近年来,生物催化被誉为一项绿色、可持续发展的最有希望的技术[1-2]。酶作为生物催化技术的关键核心,是一类高效的生物催化剂,其作用条件温和且具有优异的高化学、立体和区域选择性[3-4],近些年在食品加工、保鲜以及分析检测等领域中应用广泛。来自自然界的生物酶一般易溶于水,通常可以直接在水相中催化底物发生反应。然而,食品领域中的反应体系复杂,有时是非均相的,酶需要溶解在水相中催化非水相的底物,例如酶法制备甘油二酯、油脂酶法脱胶和脱酸等,由于非均相体系两相反应界面面积小,底物在两相间传质效率差等原因,导致酶催化反应效率低下[5-6]。通过乳化将非均相体系形成乳液,是常用的增加催化效率的手段,可以极大程度地增大两相界面面积,促进底物与酶之间的接触,从而提高反应效率[6]。在传统乳液中,体系的稳定性是依靠添加小分子表面活性剂,以及使用剧烈搅拌、高速剪切等高的外部机械能输入来维持,然而,表面活性剂易与反应产物之间发生可逆结合,导致在下游工艺及最终产品中难以去除,进而影响产品的纯度和生物安全性[7]。另外,表面活性剂及剧烈搅拌、高速剪切容易破坏酶的结构,导致酶活下降[8]。
Pickering 乳液被证明是一类高效的非均相催化反应体系[6,9]。与传统的乳液不同,Pickering 乳液是由固体颗粒代替小分子表面活性剂稳定的乳液,因其在两相界面的不可逆吸附,并且颗粒之间能够形成均匀的“致密膜”,故使Pickering 乳液具有优异的体系稳定性。自Crossley 等[7]2010年在Science 上首次报道将负载钯纳米颗粒的碳纳米管-无机氧化物用于催化生物燃料升级反应以来,Pickering 乳液催化领域的研究持续升温,其两相界面面积高,底物扩散距离短,传质阻力小等易于提升催化效率的优势被逐渐挖掘。按照在体系中催化剂与颗粒乳化剂之间的位置关系,可将催化类型分为Pickering 乳液辅助催化(催化剂与颗粒乳化剂分离)和Pickering 乳液界面催化(催化剂与颗粒乳化剂整合在一起)两大类[9](图1)。也可按照催化剂的类型大致分为Pickering 化学催化和Pickering 乳液生物催化两类,其中生物催化具有反应条件温和、催化效率高、能耗低以及环境友好等特点,可应用于生物柴油制备[10-11]、催化剂设计[12]、微反应器设计[13-14]和组织工程[15]等多学科领域中。
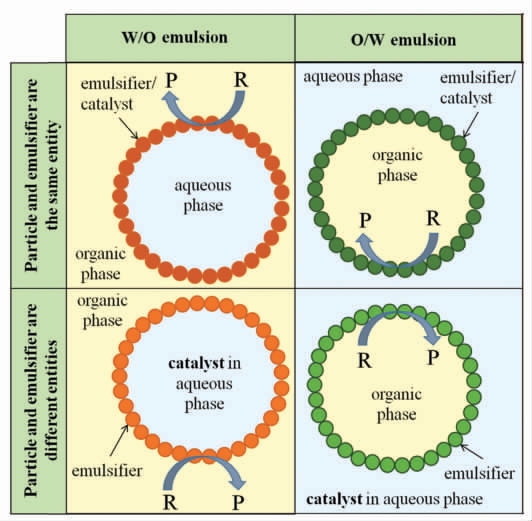
图1 Pickering 乳液催化体系分类图[9]
Fig.1 Classification of Pickering emulsion catalytic system[9]
虽然Pickering 乳液催化研究近年逐渐增多,但是大都集中于材料化学领域,近年来在食品领域中的研究逐渐涌现,Pickering 乳液催化在油脂脱酸[16]、低脂食品的风味释放[17]和脂质改性[18]中的应用被相继报道。本文结合无机、有机合成领域中Pickering 乳液生物催化反应体系的前沿研究进展,从颗粒乳化剂设计、催化反应体系及反应器工程3 个方面进行综述,并对Pickering 乳液在食品领域中的应用进行总结,以期为其催化体系在食品领域中更广泛的应用和发展提供借鉴。
1 Pickering 乳液生物催化中颗粒乳化剂的设计
近年来,可稳定Pickering 乳液生物催化体系的颗粒不断增加,颗粒的功能逐渐增多。颗粒的润湿性、表面粗糙度和形状可以被定向设计并赋予其特殊的功能特性,以满足Pickering 乳液稳定、高效催化以及方便回收利用生物催化剂的需要。
1.1 润湿性和表面形貌设计
在Pickering 乳液催化体系中,固体颗粒润湿性至关重要,具有中等润湿性的固体颗粒在连续相和分散相中有足够的浸润程度以构建稳定的乳液体系,进而为酶行使催化功能提供一个平稳的环境[19]。天然固体颗粒材料通常难以直接稳定Pickering 乳液,因此需要对颗粒进行改性处理,对于本身具有一定两亲性的材料,如氧化石墨烯、石墨氮化碳等碳质材料,其颗粒的改性主要采用酸、碱表面处理[20]。蛋白质材料的改性方法主要采用热处理、溶剂诱导或多糖形成复合物等[21-25]。对于自身不具有两亲性的材料,如二氧化硅和沸石颗粒等,其改性方法通常是表面化学接枝[6,13]。例如二氧化硅颗粒亲水性强,通常是在表面接枝长烷烃等疏水性基团,或者通过调节接枝的亲水和疏水基团比例以到达合适的两相润湿特性,进一步制备稳定的乳液[26]。
另外,Pickering 乳液体系的稳定性高低与界面膜强度大小有着直接的联系,其强度与颗粒的吸附性能相关联,而表面形貌是影响吸附强度的关键因素之一,增加固体颗粒的表面粗糙度能有效提高乳液体系的稳定性[6]。Pickering 乳液生物催化体系中所常用的疏水改性二氧化硅,改性过程中其疏水性与粗糙度同时增加,协同增强了Pickering 乳液催化体系的稳定性,为生物催化反应的顺利进行提供保障。
1.2 形状结构设计
颗粒乳化剂的设计包括外部(表面)形状和内部结构的调节。具有相同润湿性以及粗糙度的固体颗粒,当其外部形状不一时,其乳液稳定性会有所差异,这主要是因为不同形状的颗粒在乳液界面处的组装行为不一[27-28]。常见的颗粒外部形状包括球形、管状和片状等,其中管状和片状颗粒具有较高的长径比(即长轴与短轴之比),吸附在乳液界面处能够产生更大的界面面积[6,9],在提高乳液的稳定性的同时能够进一步扩大酶与底物的触及度并缩短底物扩散距离,从而提高酶促反应速率。Bao 等[29]将α-乳清蛋白(α-lac)通过地衣芽孢杆菌蛋白酶部分水解成α-lac 肽,在Ca2+离子诱导下自发组装成α-lac 纳米管,用于稳定Pickering 乳液体系并实现高效生物催化。
颗粒的内部结构设计的主要目的是建立酶载体以保护酶活性不受极端系统环境 (例如强酸/碱、有机溶剂、高温等)的影响[6]。根据颗粒对酶固定化方法的不同,主要有内表面固定和物理包埋两种策略。对于前者,无论是化学接枝还是物理吸附,主要是将其设计为介孔结构,这些介孔不仅可用于酶在颗粒内表面的固定,还可促进底物扩散,提高反应速率[30]。物理包埋是固体颗粒将酶分子包裹起来,因颗粒外壳具有足够的密度,而能够保护酶不直接暴露在有机相中,避免了酶活的损失[31]。这类颗粒通常被设计成胶囊形状,通过氢键、静电力等物理相互作用将酶封装到胶囊内部。He 等[32]选用外壳为疏水乙基纤维素,内核为亲水羧甲基纤维素(CMC)的纤维素胶囊作为固体颗粒。归因于亲水性CMC 所形成的富水环境,酶的活性中心结构可以充分伸展,从而使酶促反应过程中酶表现出更高的生物比活性。
1.3 智能响应型设计
通过智能响应设计,Pickering 乳液催化体系可以在特定温度[33]、CO2/N2[34-35]、磁场[10,36]和电场/电化学[15]等条件变化下发生定向变化,以高效、便捷、灵活地实现酶的回收再利用。
1.3.1 温度 在温度响应型设计中,聚合物通常作为改性剂接枝到固体颗粒表面以获得温度响应性能力,反应后通过改变体系温度使Pickering 乳液失稳,以实现固体颗粒和酶的便捷回收。这种温度响应是由于具有热响应性的聚合物的临界溶液温度(LCST)较低,一旦体系温度高于该值,聚合物的溶解度通常会降低,从而导致乳液的快速破乳[37-38]。此外,在温度响应设计中,不同于无机催化,生物酶的最适温度与失活温度也必须考虑其中。Wang 等[33]基于食品级的淀粉颗粒提出了一种通过调节其表面接枝的改性基团的取代度来精确调节开关温度的策略,以满足不同酶对于最适催化反应温度要求(图3a)。
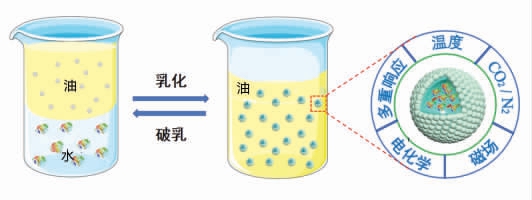
图2 各种环境响应型Pickering 乳液生物催化体系的示意图(包括温度、CO2/N2、磁场、电化学以及多重刺激响应方法)
Fig.2 Schematic drawings of various environmentally responsive Pickering emulsion biocatalytic systems(including temperature,CO2/N2,magnetic field,electrochemistry and multiple stimulus response methods)
1.3.2 CO2/N2 固体颗粒的CO2/N2 响应型设计是指向Pickering 乳液体系鼓入CO2/N2 后,颗粒乳化剂表面的某些基团会定向发生质子化/去质子化,从而改变固体颗粒表面的润湿性,导致乳液发生破乳或重新乳化[37-38]。在该策略中,CO2/N2 响应过程是一个非累积过程,即体系中不会出现盐效应或产物化学物质来抑制乳液稳定性和反应,使得体系的循环稳定性增强。此外,CO2 和N2 都是价格低廉、环境友好的气体[37-38]。Yu 等[34]将具有CO2/N2 响应性的基团N,N-二甲基十二烷基胺用于二氧化硅粒子表面的疏水化修饰,在稳定Pickering乳液的同时能够响应CO2/N2 变化,实现乳液的重新乳化/破乳。除了传统的无机颗粒外,食品级颗粒也被设计成能够响应CO2/N2 变化的乳化剂,Xi等[35]报道了一种使用纯络蛋白酸钠稳定的Pickering 乳液生物催化体系,通过交替鼓入CO2 和N2,实现乳液体系的定向破乳与重新乳化(图3b)。
1.3.3 磁场 颗粒的磁场响应性是根据添加磁场控制响应性材料的行为,以调节乳液状态,从而实现酶的分离与回收。Fe3O4/Fe2O3 等磁性/顺磁性材料通常经过修饰后被设计用于磁场响应和稳定乳液。Liu 等[10]利用微乳液聚合法:一种表面胺化磁性纳米复合材料(Fe3O4@PS-NH2)用于稳定乳液的同时,能够响应磁场变化,回收的载酶颗粒在循环5 次后仍具有显著的催化活性。另外,Yang 等[36]合成了一种Fe2O3 基-磁性中空碳纳米颗粒 (MHMCS)用于稳定Pickering 乳液生物催化体系,在15个刺激响应循环后,酶的催化活性未出现明显下降。
1.3.4 电场/电化学 电场/电化学响应是在外加电场电位变化的影响下,颗粒表面的被接枝的特殊基团的氧化/还原状态会随之发生可逆转变。清华大学化学系袁金颖团队合成了一种具有电化学响应的微凝胶颗粒,并将其应用于稳定Pickering乳液生物催化体系[15]。该微凝胶是由8 臂聚(乙二醇)/二茂铁在食品级环糊精表面功能化的修饰物(8APEG-CD/8APEG-Fc)所构建的微凝胶颗粒(图3D)。利用Fc 的氧化-还原反应,微凝胶和相应的Pickering 乳液的形成和变形可以被外加电位可逆刺激,具体表现为Fc 在+0.80 V 的电位下被氧化,原本均匀吸附在液滴表面的微凝胶会分散成为10 nm 左右直径的小颗粒,随后颗粒从界面脱离解吸使乳液破乳;当外加电场电位降到+0.20 V后,Fc 被还原,微小颗粒会重新聚集成原来大小的微凝胶,乳化后均匀致密地吸附在液滴表面以重新形成乳液。

图3 各种智能响应型代表性食品级固体颗粒(除Fe3O4 粒子)的设计及在对应环境中的刺激响应性行为[34-36,15,39]
Fig.3 Design of various intelligent-responsive representative food-grade solid particles (except Fe3O4 particles)and their stimulus-responsive behavior in the corresponding environment[34-36,15,39]
1.3.5 多重刺激 与单一响应型刺激系统相比,在固体颗粒上同时赋予多种刺激响应型功能,能够进一步促进酶的分离以及提高其可重复利用性[37-38]。目前在生物催化研究方面尚处于起步阶段,相关报道并不多见。Zhu 等[39]合成了一种具有pH 和温度双重刺激响应性的基团【聚(n-异丙基丙烯酰胺)】,将其接枝到食品级壳聚糖(CS)粒子表面,用于稳定Pickering 乳液生物催化体系(图3E)。在pH<6.8,温度<32 ℃条件下,乳液保持稳定,有利于酶促反应的进行。之后,将温度提高到32℃以上,可破乳并分离脂肪酶。当温度降低时,乳化液再次形成并用于下一个循环。这一双重响应型设计稳定的乳液体系具有良好的可循环性,脂肪酶催化活性在6 次循环后仍保持75%。
2 Pickering 乳液生物催化反应类型
Pickering 乳液催化可分为PIC 和PAC 两类,根据酶和颗粒稳定剂的整体性加以区分,在PAC中,酶大多被分散在乳液的水相,从而能够有效减少载体的使用以及对酶的复杂修饰[6]。在PIC 中,酶被颗粒乳化剂所固载,在稳定乳液的同时使得酶能够直接从界面上与外相中的底物接触,大幅提升了酶的使用效率和催化效率[19]。两种催化反应类型各有优势,可根据具体反应条件适当选择。
2.1 PAC
PAC 体系是将酶在乳液水相中分散,通过底物/产物在两相间的扩散实现高效催化,最大程度减少了传统固定化过程对酶结构和活性的影响,亦可称之为新型酶“固定化”技术[8]。除了能够避免传统酶催化应用中使用载体时对酶的复杂修饰外[40],当体系破乳后,酶可以随着两相分离而分离,实现了可逆的酶固定化处理,这无疑有利于在分子水平上研究酶的催化性能,并且为固定化材料的经济循环利用提供了前提条件[8]。Wang 等[16]制备了O/W 型Pickering 乳液生物催化体系用于脱酸反应,对比传统两相体系,催化效率提升了近7 倍。
通过对乳液自身特性进行调节,能够进一步提升PAC 的催化效率。在乳液中,随着液滴直径的减小,其整体比表面积会大大增加,有利于促进底物与酶之间的充分接触,提高传质扩散效率,从而大幅提高酶促反应效率。目前已报道的PAC 体系中,乳液直径大多在几十到几百微米,很少有微米级别以下的报道。为从液滴角度提高酶促反应效率,Ngai 等[41]报道一种仅由疏水固体或介孔二氧化硅纳米颗粒稳定的亚微米级别的W/O 型Pickering 乳液生物催化体系,以1-己醇与己酸的酯化为模型反应,酶在该体系中的生物比活性是微米级Pickering 乳液中的2.8 倍,验证了这一策略的高效性。此外,通过增大内相的体积分数,也能有效增加反应界面面积,从而提升体系的酶促反应效率。以O/W 型乳液为例,当增大内相体积分数时,可形成高界面相的Pickering 乳液(HIPPE)[42-43],其反应界面面积较常规乳液有所提升[44]。
2.2 PIC
Pickering 乳液生物界面催化在近几年发展十分迅速,该体系可以使酶在两相界面上与底物充分接触以大幅提高酶的有效利用效率。Weng 等[45]以负载脂肪酶的壳聚糖纳米颗粒制备的Pickering乳液用于橄榄油的水解,仅15 min 内,底物的转化率就达到72.8%。值得注意的是,对于这一反应,Liu 等[46]将其作为界面面积和界面酶浓度的函数进行研究,发现在酶浓度恒定的情况下,界面面积的增加也会导致界面酶浓度的降低,从而使反应速率降低。因这两种竞争效应,故导致界面面积的变化并未对反应速率产生显著的影响。
基于Pickering 乳液的生物催化体系还能直接使用两种不相容的反应底物作为油水两相,形成无溶剂体系。由于Pickering 乳液界面生物催化体系可以大幅扩大反应底物在不相容液-液两相间的接触面积以及改善其传质扩散过程,从而能够有效解决传统无溶剂体系中的酶促反应效率低下的难题[19]。Guan 等[17]报道了一个基于Pickering乳液界面生物催化的无溶剂体系,作者直接以植物甾醇和亚麻酸两种反应底物分别作为油相和水相,使用介孔碳纳米管(MCS)作为脂肪酶载体并稳定O/W 型Pickering 乳液,该无溶剂Pickering乳液界面生物催化体系在产物合成过程中绿色环保,能够很好地应用于食品领域中功能性脂类的制备。
除了用于催化单一反应外,Pickering 乳液界面生物催化还能够很好地适用于酶的级联反应,通过反应混合物的部分相转移行为,能够有效促进底物转化的同时,简化底物的纯化步骤。值得注意的是,PIC 中固定化酶有时能够同时催化两种不同类型的反应类型,进一步减少反应体系中酶的用量。例如Yang 等[36]在高酸值油的高价值产品利用中,所制备的固定化脂肪酶(AYS@MHMCS)能够用于催化高酸值油的水解反应,生成游离脂肪酸(FFA),并进一步催化FFA 与植物甾醇之间的酯化反应。
PIC 体系还能应用到有气体参与的反应中。Zhang 等[47]将碳酸酐酶包埋在制备的咪唑酯框架(ZIF)中,稳定Pickering 乳液的同时催化CO2 的矿化反应。通过Pickering 乳液的引入(加速CO2从气相扩散到乳液的速率)和MOFs 结构调整(提升颗粒对CO2 分子的捕获能力),促进了酶催化体系的内、外扩散,提高了酶法转化CO2 的效率。这一研究提供了一个高效和持续利用二氧化碳的新方法,丰富了气相参与Pickering 乳液生物催化反应体系的研究。
3 Pickering 乳液生物催化中反应器工程的进展
目前在Pickering 乳液生物催化中仍多以间歇反应体系为主,该体系中难以避免地存在一些不足:1) 间歇体系需要设置额外的步骤来进行产物分离、回收;2)外部机械搅拌可能会导致酶结构被破坏并失活;3) 产物浓度因素可能限制了生物转化效率[6,9,19]。将Pickering 乳液装载于流动反应器中以构建流动催化体系,具有解决上述问题的潜力。
Zhang 等[48]以正辛烷作为流动相通入装满W/O 型Pickering 乳液,在2 000 h 内流动相流速和Pickering 乳液的液滴形态均保持稳定 (图4)。Meng 等[49]制备的离子液体(IL)基Pickering 乳液在连续反应100 h 后,体系的催化效率无明显衰减。Chen 等[50]制备的流动Pickering 乳液在过去2个月后仍具有良好的耐久性。相比于间歇Pickering 乳液催化体系,流动条件下还能进一步提升反应速率和选择性。Chen[50]等对比研究了间歇体系与流动体系对香茅醛环化反应的催化表现,发现流动体系下催化效率是间歇体系的1.9 倍,目标产物选择性也从间歇体系的34.8%提高到64%。这一流动Pickering 乳液体系同样在酶催化中表现出优异的催化效率,例如Zhang 等[48]以酶的手性催化为模型反应,经对比研究,流动体系下的酶促反应效率较间歇体系提高了10 倍。究其原因,主要是基于流动条件下,流动相促进产物分子从催化剂的液-液界面释放,并迅速从反应体系中去除,改变了反应平衡,从而促进了反应的进行[48,50]。
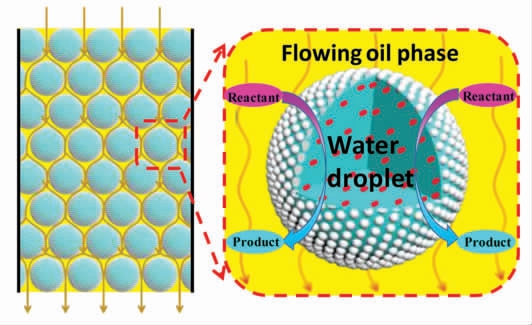
图4 连续流动的W/O 型Pickering 乳液生物催化策略示意图[49]
Fig.4 Continuous flow of W/O Pickering emulsion biocatalysis strategy map[49]
常用流动式反应器的研究通常是在玻璃柱内进行,德国柏林应用科技大学Drews 团队对此进行了创新 该研究将脂肪酶限制在乳液水相液滴中,用于催化对苯基乙醇与丁酸乙烯酯的跨酯酰化反应(图5)。以恒定的通量(即恒定的停留时间)连续进行两次生物催化,底物和产物浓度恒定且可重复,30 h 后酶的生物活性并未出现明显降低,成功开发出了连续搅拌式反应器[51]。
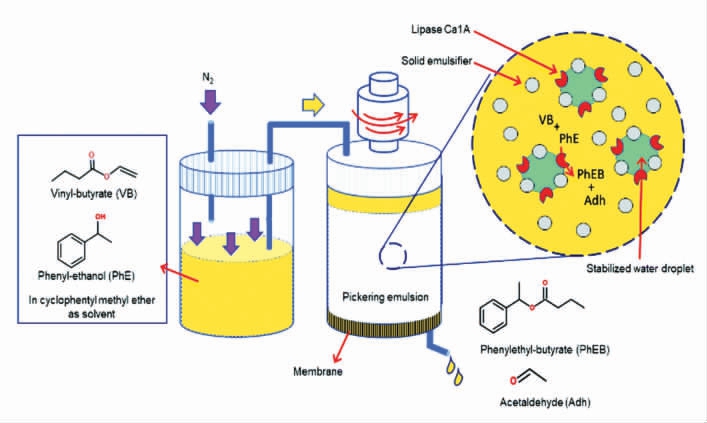
图5 在连续搅拌罐式反应器中,间隔时间生成的流动Pickering 乳液的酶酯交换[6]
Fig.5 Transesterification of flow Pickering emulsion generated at intervals in a continuous stirred tank reactor[6]
4 Pickering 乳液生物催化在食品领域中的应用发展
Pickering 乳液催化的研究主要集中于材料科学领域,然而,近年来在食品领域亦开始涌现,如在高酸值油的脱酸及深加工应用[10,36],低脂食品的风味释放[17]和脂质改性[18,30]等应用领域均有所报道。
4.1 高酸值油的脱酸及深加工应用
高酸值油是食用植物油加工和储存不当造成的。然而,目前高酸值油再利用的几种主要加工方法,如化学酯化、碱精炼和物理蒸馏均容易造成能量损耗大、营养成分流失严重等问题,使循环可利用性过低[52]。而酶法脱酸有着作用条件温和、绿色环保以及产品易于分离等优势。Wang 等[16]在传统酶法改性基础上构建了一种Pickering 乳液生物催化体系用于米糠油的脱酸,通过分析产物组成及含量发现Pickering 乳液生物催化体系相较于传统单项酶法体系效率更高,在相同脱酸量下所需的催化反应时间由41 h 降至6 h。Yang 等[36]利用Pickering 乳液生物催化体系将高酸值油通过酶解生成游离脂肪酸和甘油,其中甘油作为水溶性物质能自发扩散到水相中,而油溶性脂肪酸则继续留在油相中与植物甾醇发生酯化反应生成植物甾醇酯(图6)。由于Pickering 乳液提升了脂肪酶的界面活化性能,该体系的催化效率是单相酶反应体系的30 倍,同时甾醇酯产率是单相体系的3 倍。

图6 使用Pickering 乳液界面酶催化体系制备植物甾醇酯产品[36]
Fig.6 Preparation of plant sterol esters using Pickering emulsion interface enzymatic catalytic system[36]
4.2 低脂食品的风味释放
低脂食品符合当代消费者对于健康饮食的追求,然而低脂食品中游离脂肪酸(FFA)含量低,食品风味释放不完全,降低了消费者的购买欲,例如低脂奶酪的风味较全脂或半脂奶酪要差[53]。添加外源性修饰脂肪酶能有效水解低脂奶酪中的脂肪,产生更多的FFA,从而提高风味释放水平。Li等[17]将Pickering 乳液策略结合其中,构建了Pickering 乳液界面生物催化体系,以进一步促进外源性脂肪酶对低脂奶酪中有限脂肪的水解效率,所构建的Pickering 乳液界面酶体系能有效提高脂肪酶的催化效率,其生成的FFA 含量是正常低脂奶酪的两倍(图7)。

图7 4 种新鲜奶酪的光学照片、CLSM 图像、化学成分含量及分解乳脂后的游离脂肪酸总含量(* 表示P <0.05)[17]
Fig.7 Optical photos of four different fresh cheese,CLSM images,chemical composition,content and decomposition after the cream of free fatty acid content (*means P <0.05) [17]
4.3 脂质改性
酶法脂质改性技术已成为食品领域的研究热点,油酯、植物甾醇酯和脂肪替代品酯等脂质经修饰改性后,被广泛应用于各种食品及食品添加剂中[54-56]。将引入Pickering 乳液体系引入脂质改性反应体系,能够有效提高其中酶与底物之间的可及性,改善底物传质效率。Dong 等[18]通过将红色念珠菌脂肪酶AYS 固定在具有良好生物相容性的两亲性介孔碳球上,在稳定O/W 型Pickering 乳液的同时,催化植物甾醇的酯化和酯交换反应,该体系表现出较高的催化效率【6.8 mmol/(g·h)】及转化率(95%)。另外Sun 等[30]将南极假丝酵母脂肪酶(CRL) 固定在中空介孔二氧化硅纳米微球上,用于催化β-谷甾醇与硫辛酸酯化反应。对比游离酶体系,所构建的Pickering 乳液生物催化体系效率提升了9.1 倍。
5 结论与展望
Pickering 乳液作为一类高效的生物催化反应体系,其巨大的两相界面面积以及优异的体系稳定性,有望解决非均相食品催化体系中酶与底物触及度低、产物难以分离以及酶的可重复利度低等问题。本文首先概述固体颗粒设计中表面润湿性、粗糙度和形状结构几个因素在设计具有优异稳定乳液能力的颗粒乳化剂的重要性,以及赋予这些颗粒特殊的对外界环境变化具有可逆响应的能力,从而用于高效的酶分离与重复利用;其次总结基于两种反应体系——PAC 和PIC 的研究进展及各自的优、劣势;随后基于已有连续流动式Pickering 乳液反应策略的报道,拓展分析Pickering 乳液生物催化在实际工业化生产中的应用前景;最后归纳Pickering 乳液生物催化在高酸值油的脱酸及深加工应用、低脂食品的风味释放和脂质改性等食品领域的应用研究。
食品领域中Pickering 乳液目前仍处于初期阶段,亟待从以下4 个方面展开深入的研究:1)颗粒乳化剂与酶的组装关系、颗粒乳化剂与底物/产物之间在油水界面的行为仍需进一步阐明;2)多重刺激性响应方式在食品级颗粒中的设计和应用有待进一步探索;3)食品级PIC 和PAC 催化反应体系中的界面催化增益机制需在分子层面深入挖掘;4)连续搅拌式Pickering 乳液催化反应器在实际工业应用领域前景巨大,需尽快创制配套反应体系和设备,满足工业化需求。食品领域研究者需借鉴无机或有机合成领域中的Pickering 乳液催化的前沿研究,深度交叉融合,建立食品级Pickering 乳液催化反应体系,并用于真实食品工业非均相催化场景,提升食品加工生产效率和产品质量,减少废弃物排放并降低环境污染,促进食品工业高质量、可持续发展。
[1]LOLLO Y,HEIJDE M,SCHEBESTA P,et al.Biotechnology for clean industrial products and pro cesses:Towards industrial sustainability[J].New Biotechnology,2018,40:5-10.
[2]王文霄.精细化学品合成催化技术的应用与发展建议[J].化工管理,2022,20(20):65-68.WANG W X.Application and development suggestions of catalytic technology for fine chemical synthesis[J].Chemical Engineering Management,2022,20(20):65-68.
[3]CHASSAING B,KOREN O,GOODRICH J K,et al.Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome[J].Nature,2015,519(7541):92-96.
[4]WU Y,XU W Q,JIAO L,et al.Nanobiocatalysis:a materials science road to biocatalysis[J].Chemical Society Reviews,2022,51(16):6948-6964.
[5]BILAL M,IQBAL HAFIZ M N.State-of-the-art strategies and applied perspectives of enzyme biocatalysis in food sector-current status and future trends[J].Critical Reviews in Food Science and Nutrition,2020,60(12):2052-2066.
[6]CHANG F Q,VIS C M,CIPTONUGROHO W,et al.Recent developments in catalysis with Pickering emulsions[J].Green Chemistry,2021,23(7):2575-2594.
[7]STEVEN C,JIMMY F,MIN S,et al.Solid nanoparticles that catalyze biofuel upgrade reactions at the water/oil interface[J].Science,2010,327(5961):68-72.
[8]WU C Z,BAI S,ANSORGE-SCHUMACHER M B,et al.Nanoparticle cages for enzyme catalysis in organic media [J].Advanced Materials,2011,23(47):5694-5699.
[9]ROFRIGUEZ A M,BINLS B P.Catalysis in Pickering emulsions [J].Soft Matter,2020,16 (45):10221-10243.
[10]LIU X B,MAO Y H,YU S Y,et al.An efficient and recyclable Pickering magnetic interface biocatalyst:application in biodiesel production[J].Green Chemistry,2021,23(2):966-972.
[11]WANG L H,LIU X L,JIANG Y J,et al.Silica nanoflowers-stabilized Pickering emulsion as a robust biocatalysis platform for enzymatic production of biodiesel[J].Catalysts,2019,9(12):1026.
[12]WANG S,SCANDURRA L,HÜBNER R,et al.Tailored particle catalysts for multistep one -pot chemoenzymatic cascade in Pickering emulsions[J].2023,15(1):e202201229.
[13]ZHANG M,ETTELAIE R,DONG L L,et al.Pickering emulsion droplet -based biomimetic microreactors for continuous flow cascade reactions[J].Nature Communications,2022,13(1):475-475.
[14]LEI J Q,QI L,LUO Z G,et al.Pickering emulsion-based microreactors for size-selective interfacial enzymatic catalysis [J].Frontiers in Bioengineering and Biotechnology,2020,8:950-950.
[15]PENG L,FENG A C,LIU S Y,et al.Electrochemical stimulated pickering emulsion for recycle of enzyme in biocatalysis[J].ACS Applied Materials &Interfaces,2016,12(43):29203-29207.
[16]WANG T,CHEN K R,LI Z Y,et al.Construction of an enzyme-Pickering emulsion catalytic system and its application in the interfacial catalytic reaction of rice bran oil deacidification[J].LWTFood Science and Technology,2021,150:111921.
[17]GUAN T,LIU B,WANG R,et al.The enhanced fatty acids flavor release for low-fat cheeses by carrier immobilized lipases on O/W Pickering emulsions[J].Food Hydrocolloids,2021,116:106651.
[18]DONG Z,LIU Z S,SHI J,et al.Carbon nanoparticle-stabilized Pickering emulsion as a sustainable and high-performance interfacial catalysis platform for enzymatic esterification/ transesterification[J].ACS Sustainable Chemistry & Engineering,2019,7(8):7619-7629.
[19]NI L,YU C,WEI Q B,et al.Pickering emulsion catalysis:interfacial chemistry,catalyst design,challenges,and perspectives[J].Angewandte Chemie International Edition,2022,134(30):202115885.
[20]WAN W B,LI L,ZHAO Z B,et al.Ultrafast fabrication of covalently cross-linked multifunctional graphene oxide monoliths [J].Advanced Functional Materials,2014,24(31):4915-4921.
[21]CHEN L J,AO F,GE X M,et al.Food-grade Pickering emulsions:Preparation,stabilization and applications[J].Molecules,2020,25(14):3202.
[22]JIAO B,SHI A M,WANG Q,et al.High-internal-phase pickering emulsions stabilized solely by peanut protein-isolate microgel particles with multiple potential applications[J].Angewandte Chemie International Edition,2018,57(30):9274-9278.
[23]LI S,JIAO B,MENG S,et al.Edible mayonnaise-like Pickering emulsion stabilized by pea protein isolate microgels [J].Food Chemistry,2022,376:131866-131866.
[24]LI S,JIAO B,FAISAL S,et al.50/50 oil/water emulsion stabilized by pea protein isolate microgel particles/xanthan gum complexes and co-emulsifiers[J].Food Hydrocolloids,2023,134:108078.
[25]焦博.花生蛋白-多糖Pickering 乳液的制备及稳定机理研究[D].北京:中国农业科学院,2018.JIAO B.Preparation and stability mechanism of peanut protein -polysaccharide Pickering emulsion[D].Beijing:Chinese Academy of Agricultural Sciences,2018.
[26]SHAHNAWAZ N,SHERAZI T A,LI R Q,et al.Pickering emulsions for the polymerization of ε -caprolactone in continuous flow process[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2022,642:128715.
[27]LI W,JIAO B,LI S,et al.Recent advances on Pickering emulsions stabilized by diverse edible particles:Stability mechanism and applications[J].Frontiers in Nutrition,2022,9:864943.
[28]焦博,石爱民,刘红芝,等.基于食品级固体颗粒稳定的Pickering 乳液研究进展[J].食品科学,2018,39(5):296-303.JIAO B O,SHI A M,LIU H Z,et al.Research progress of Pickering emulsion based on stabilization of food grade solid particles[J].Food Science,2018,39(5):296-303.
[29]BAO C,LIU B,LI B,et al.Enhanced transport of shape and rigidity-tuned α-lactalbumin nanotubes across intestinal mucus and cellular barriers[J].Nano Letters,2020,20(2):1352-1361.
[30]SUN T,DONG Z,WANG J,et al.Ultrasound-assisted interfacial immobilization of lipase on hollow mesoporous silica spheres in a Pickering emulsion system:A hyperactive and sustainable biocatalys[J].ACS Sustainable Chemistry & Engineering,2020,8(46):17280-17290.
[31]WANG Y X,TAO H T,WANG K L,et al.Nanocapsules formed by interactions between chondroitin sulfate and egg white protein for encapsulating hydrophilic ingredients[J].Green Chemistry,2021,23(19):7566-7575.
[32]HE X,BINKS B P,HU J G,et al.Lipase-immobilized cellulosic capsules with water absorbency for enhanced Pickering interfacial biocatalysis[J].Langmuir,2021,37(2):810-819.
[33]WANG C,CHI H,ZHANG F,et al.Temperatureresponsive Pickering high internal phase emulsions for recyclable efficient interfacial biocatalysis [J].Chemical Science,2022,13(30):8766-8772.
[34]YU S J,ZHANG D Y,JIANG J Z,et al.Biphasic biocatalysis using a CO2-switchable Pickering emulsion[J].Green Chemistry,2019,21(15):4062-4068.
[35]XI Y K,LIU B,Wang S X,et al.CO2-responsive Pickering emulsions stabilized by soft protein particles for interfacial biocatalysis[J].Chemical Science,2022,13(10):2884-2890.
[36]YANG T,ZHANG Y F,WANG J,et al.Magnetic switchable Pickering interfacial biocatalysis:One-pot cascade synthesis of phytosterol esters from highacid value oil[J].ACS Sustainable Chemistry & Engineering,2021,9(36):12070-12078.
[37]GE X H,MO L J,YU A H,et al.Stimuli-responsive emulsions:Recent advances and potential applications[J].Chinese Journal of Chemical Engineering,2022,41:193-209.
[38]TANG J T,QUINLAN P J,TAM K C.Stimuli-responsive Pickering emulsions:recent advances and potential applications[J].Soft Matter,2015,11(18):3512-3529.
[39]WANG Y X,ZHU L Y,ZHANG H M,et al.Formulation of pH and temperature dual-responsive Pickering emulsion stabilized by chitosan-based microgel for recyclable biocatalysis [J].Carbohydrate Polymers,2020,241:116373.
[40]路雪纯,辛嘉英,张帅,等.脂肪酶固定化及其在食品领域中应用的研究进展[J].食品领域科技,2021,42(17):423-431.LU X C,XIN J Y,ZHANG S,et al.Research progress in immobilization of lipase and its application in food field[J].Science and Technology of Food Industry,2021,42(17):423-431.
[41]NGAI T,JIANG H,LI Y X,et al.Submicron inverse Pickering emulsions for highly efficient and recyclable enzymatic catalysis[J].Chemistry-An Asian Journal,2018,13(22):3533-3539.
[42]SHI A M,FENG X,WANG Q,et al.Pickering and high internal phase Pickering emulsions stabilized by protein-based particles:A review of synthesis,application and prospective[J].Food Hydrocolloids,2020,109:106117.
[43]RODRIGUEZ A M,BINKS B P.High internal phase Pickering emulsions[J].Current Opinion in Colloid & Interface Science,2022,57:101556.
[44]WANG M,WANG M J,ZHANG S M,et al.Pickering gel emulsion stabilized by enzyme immobilized polymeric nanoparticles:a robust and recyclable biocatalyst system for biphasic catalysis [J].Reaction Chemistry & Engineering,2019,4 (8):1459-1465.
[45]WENG M M,XIA C M,XU S,et al.Lipase/chitosan nanoparticle-stabilized Pickering emulsion for enzyme catalysis[J].Colloid and Polymer Science,2022,300(1):41-50.
[46]LIU L,JIANGC L L,XIE X M,et al.Amphiphilic carbonaceous microsphere-stabilized oil-inwater pickering emulsions and their applications in enzyme catalysis [J].ChemPlusChem,2016,81(7):629-636.
[47]ZHANG B Y,SHI J F,ZHAO Y,et al.Pickering interfacial biocatalysis with enhanced diffusion processes for CO2 mineralization[J].Chinese Journal of Catalysis,2022,43(4):1184-1191.
[48]ZHANG M,WEI L J,CHEN H A,et al.Compartmentalized droplets for continuous flow liquidliquid interface catalysis[J].Journal of the American Chemical Society,2016,138(32):10173-328.
[49]MENG Z X,ZHANG M,YANG H Q.Pickering emulsion droplets hosting ionic liquid catalysts for continuous -flow cyanosilylation reaction [J].Green Chemistry,2019,21(3):627-633.
[50]CHEN H,ZOU H B,HAO Y J,et al.Flow Pickering emulsion interfaces enhance catalysis efficiency and selectivity for cyclization of citronellal[J].Chem-SusChem,2017,10(9):1989-1995.
[51]HEYSE A,PLIKAT C,ANSORGE-SCHUMACHER M B,et al.Continuous two-phase biocatalysis using water-in-oil Pickering emulsions in a membrane reactor:Evaluation of different nanoparticles[J].Catalysis Today,2019,331:60-67.
[52]FENG K L,HUANG Z H,PENG B,et al.Immobilization of Aspergillus niger lipaseonto a novel macroporous acrylic resin:Stable and recyclable biocatalysis for deacidification of high -acid soy sauce residue oil[J].Bioresource Technology,2020,298:122553.
[53]VAN M O,TEJEDA D G,KRISTENSEN M N,et al.Aroma formation during cheese ripening is best resembled by Lactococcus lactis retentostat cultures[J].Microbial Cell Factories,2018,17(1):1-8.
[54]BORNSCHEUER U T.Enzymes in lipid modification[J].Annual Review of Food Science and Technology,2018,9(1):85-103.
[55]ZHANG H Y,SECUNDO F,SUN J A,et al.Advances in enzyme biocatalysis for the preparation of functional lipids[J].Biotechnology Advances,2022,61:10803.
[56]郑富良,杨斌,黄济勇,等.酶法改性樟树籽仁油制备含ω-3 多不饱和脂肪酸结构脂质及其理化性质与抗氧化活性[J].中国油脂,2020,45(12):76-83.ZHENG F L,YANG B,HUANG J Y,et al.Preparation of ω-3 polyunsaturated fatty acid structure lipids by enzymatic modification of camphor seed kernel oil and their physicochemical properties and antioxidant activities[J].China Oil and Fats,2018,45(12):76-83.