随着电子时代的到来,我国目前用眼健康问题非常严峻,截至2021年12月,我国手机网民人数达10.32 亿,老年黄斑变性病、白内障、视疲劳等眼疾越来越普遍。叶黄素(Lutein)是一种天然的亲脂性类胡萝卜素,具有优异的抗氧化性能,是黄斑区的重要组成部分,可抑制年龄相关性黄斑变性,预防眼睛避免紫外线伤害,避免晶状体氧化,减少白内障疾病风险等[1-2]。然而,叶黄素是由9 个共轭双键构成的长链萜类化合物,水溶性低、稳定性差[3],在体内易聚集、降解、结晶析出,抑制其与体内脂肪酸、胆汁酸盐等自组装形成混合胶束,降低了叶黄素在人体中的生物可给率[4],这也是制约叶黄素在医药和功能食品领域应用的技术瓶颈。叶黄素生物可给率是指食物基质中叶黄素在消化过程中被转运至混合胶束中,能被小肠上皮细胞吸收的比例。提高小肠中叶黄素混合胶束的形成,是改善其生物可给率的关键[5]。大量研究表明,制备合适的脂质运载体系可以有效改善叶黄素缓释效果,进而提高其生物可及性[6]。
纳米结构脂质载体(Nanostructured lipid carriers,NLCs)作为新一代基于脂质的纳米粒子,对脂溶性活性成分具有突出的缓释效果,可显著改善活性成分的生物可给率,已成为近几年脂溶性活性成分运载体系研究领域的热点[7]。据报道,类胡萝卜素主要通过小肠吸收,包封类胡萝卜素的NLCs 进入肠相小肠后,胆汁酸盐快速吸附在油/水界面上进行界面取代,紧接着脂肪酶会吸附在油/水界面,对脂滴进行催化水解产生游离脂肪酸(FFAs)、甘油一酯(MAGs)等物质,同时类胡萝卜素从脂滴中释放出来,并与FFAs、MAGs、胆汁酸盐形成混合胶束,进而被小肠吸收[7]。胰脂肪酶是典型的界面酶,可在油/水界面催化脂滴发生水解。因此,胆汁酸盐的界面取代作用对脂肪酶催化水解反应具有显著影响,同时,界面性质又影响胆汁酸盐的界面取代特性[8]。表面活性剂是制备NLCs 必不可少的组分,它可有效降低油/水界面张力,促进NLCs 体系的稳定。另外,表面活性剂的性质也影响NLCs 体系在体内的消化特性[9]。不同类型的表面活性剂会表现出不同的乳化特性和界面活性,而界面活性又受表面活性剂的类型、结构、浓度及其与脂滴间的相互作用等因素的影响[10]。例如,Infantes-GarciaGarcia 等[11]报道不同界面构成对O/W 型乳液中脂滴水解过程的影响,结果表明,大豆分离蛋白和柑橘果胶稳定的乳液对脂肪酶的水解效果具有显著性差异。Torcello-Gómez等[12]发现如果脂质载体的界面是由高活性或高稳定性的表面活性剂覆盖,那么其油/水界面会阻碍胆盐和脂肪酶取代界面上的表面活性剂,然后,阻碍脂肪酶吸附到脂质液滴上。
近几年,国内外针对脂质递送体系的研究热点主要聚焦于通过界面层精细结构的设计,达到调控其消化特性和稳定性的目的。仅由小分子表面活性剂构成的单一界面可能因为界面层比较薄弱,极易发生胆汁酸盐和胰脂肪酶的界面取代作用,载体中的脂滴容易被胰脂肪酶迅速水解。研究发现,通过生物大分子多糖或蛋白质对单一界面层进行修饰,可增加界面层厚度和致密度,提高其界面阻隔性能,抑制胆汁酸盐、Ca2+以及胰脂肪酶在界面的扩散,调节脂质载体中活性成分的释放特性[13]。本文将乳清分离蛋白和小分子表面活性剂吐温80 复配,构建单界面、双界面以及复合界面的叶黄素纳米结构脂质载体(Lutein-NLCs),研究3 种界面结构对Lutein-NLCs 包封率、粒径、叶黄素生物可及性、界面吸附特性等理化性质的影响,并探讨其贮藏稳定性。
1 材料与方法
1.1 材料与试剂
叶黄素(纯度>80%)、山嵛酸甘油酯、亚麻籽油、吐温80 (Tween 80)、乳清分离蛋白(Whey protein isolate,WPI),上海源叶生物科技有限公司。
正己烷、甲醇、丙酮、盐酸、氯化钾等分析纯化学试剂,国药集团化学试剂有限公司;胰脂肪酶、胃蛋白酶,南京奥多福尼生物科技有限公司;猪胆汁酸盐,北京奥博星生物技术有限责任公司;乙腈、异丙醇(色谱纯),上海麦克林生化科技有限公司。
1.2 仪器与设备
NICOMP Z3000 纳米粒度电位仪,美国PSS粒度仪公司;Elx-800 酶标仪,美国Bio-Tek 公司;GI20 体外模拟消化系统,澳大利亚国家仪器公司;1200 高效液相色谱仪,美国安捷伦科技有限公司;BS224S 电子分析天平,北京赛多利斯科学仪器公司;JEM-2100 透射电子显微镜,日本电子株式会社;FE20 实验室pH 计,上海梅特勒-托利多仪器有限公司;MD200 氮气吹扫仪,杭州奥盛仪器有限公司;HT-HP 界面流变仪,法国泰克利斯界面技术有限公司;85-2A 数显测速恒温磁力搅拌器,常州金坛华伟仪器厂;LM20 微射流纳米均质机,美国微射流均质机有限公司;TG16-WS台式高速离心机,湖南湘仪离心机仪器有限公司;DNP-9052BS-Ⅲ电热恒温培养箱,上海新苗医疗器械制造有限公司。
1.3 试验方法
1.3.1 Lutein-NLCs 的制备 参考程喆等[14]的方法,采用高压动态微射流法制备Lutein-NLCs 并做适当修改:将嵛酸甘油酯和亚麻籽油以质量比30∶70 的比例混合,在80 ℃水浴温度下加热熔化,待油脂完全熔化后,缓慢加入叶黄素(在油相中质量分数为2%),用磁力搅拌迅速搅拌使其充分溶解于油相中。将提前预热到80 ℃的表面活性剂水溶液 (质量分数1%) 迅速加入混合油相中,在12 000 r/min 条件下搅拌10 min 制备预乳液,采用高压微射流对预乳液进行高压均质,均质压力为1.4×108 Pa,循环4 次后,将样品置于4 ℃条件下迅速冷却,得到Lutein-NLCs。其中,体系中油相质量分数为5%,表面活性剂水溶液(水相)质量分数为95%。以Tween 80 为表面活性剂,制备单界面Lutein-NLCs。以Tween 80 和WPI 的等量混合溶液制备复合界面Lutein-NLCs。在单界面Lutein-NLCs 的基础上,加入等量的WPI 水相,磁力搅拌(1 000 r/min,1 h)后得到双界面Lutein-NLCs。对照组普通纳米乳液的制备:称取一定量叶黄素(在油相中质量分数为2%)溶解于亚麻籽油中形成均匀油相,将质量分数为5%油相和95%的1%Tween 80 水溶液混合,在12 000 r/min 条件下搅拌10 min 形成预乳液,用高压微射流均质(1.4×108 Pa,4 循环)得到普通纳米乳液。制备的普通纳米乳液(对照组)用于对比分析Lutein-NLCs 的叶黄素生物可给率。
1.3.2 粒径和zeta-电位分析 在模拟体外消化过程中,分别取初始乳液(Initial)、胃(Stomach)、肠(Small Intestine)消化结束时的消化液测定粒径和zeta-电位。测定前需用10 mmol/L 磷酸盐缓冲液(pH 7.0)稀释10 倍,用于粒径测定。稀释1 000倍后用于zeta-电位测定。
1.3.3 包封率和有效载量的测定 叶黄素含量的检测参照本团队所建立的HPLC 方法[15]。C30 色谱柱(4.6 mm×250 mm,5 μm),柱温25 ℃;流动相:A相为甲醇-MTBE-水(体积比70∶25 ∶5),B 相为甲醇-MTBE-水(体积比10∶85∶5)梯度洗脱,流速为0.6 mL/min。检测器为二极管阵列检测器,检测波长为450 nm。
总叶黄素提取和含量检测参考Hejri 等[16]的方法并稍微调整。称取1 g Lutein-NLCs 产品于10 mL 离心管中,加入6 mL 丙酮超声破乳,然后将混合物3 000 r/min 离心5 min,收集有机相(上层),N2 吹干,用一定量的甲醇复溶,经0.45 μm 有机滤器过滤,采用HPLC 方法检测叶黄素含量。
游离叶黄素提取和含量检测参考Liu 等[17]的方法并稍微调整。称取1 g Lutein-NLCs 产品,添加3 mL 正己烷,漩涡涡旋混匀,3 000 r/min 离心5 min,收集有机相(上层)。重复上述步骤3 次,合并3 次收集的有机相,用N2 吹干,加入甲醇复溶,经0.45 μm 有机滤器过滤,采用HPLC 方法检测叶黄素的含量。包封率和有效载量分别按公式(1)和公式(2)计算:
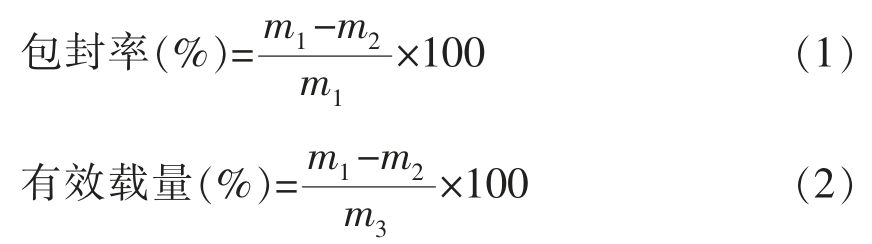
式中:m1——叶黄素总量,g;m2——游离叶黄素含量,g;m3——油脂总量,g。
1.3.4 生物可给率的测定 体外消化参考Gorusupudi 等[18]的方法并稍做调整。胃消化试验:称取5 g Lutein-NLCs、普通纳米乳液和单一叶黄素于消化管中,加10 mL 模拟胃液(3.5 mmol/L KH2PO4、10 mmol/L CaCl2·2H2O、3.6 mmol/L Mg Cl2·6H2O、6 mmol/L KCl、120 mmol/L NaCl),用0.1 mol/L HCl 调节pH 值至2.00±0.05,添加3.2 mg/mL 胃蛋白酶,设置反应温度37 ℃,转速120 r/min,在体外消化仪中消化1 h。
肠消化试验:移出消化管,用0.1 mol/L NaOH调节pH 值为7.0±0.05,添加20 mL 胰脂肪酶-胆汁酸盐消化液 (28 mg/mL 胆汁酸盐,30 mg/mL 胰脂肪酶,用0.1 mol/L NaHCO3 配制),置于体外消化仪中继续消化4 h。消化结束后,将待测消化液立即在80°C 条件下加热1 min 使酶失活,随后在冰水浴中冷却至室温[19]。
取5 mL 待测消化液于4 °C、10 000 r/min 条件下离心1 h,得到胶束相。转移出胶束相,添加5 mL 混合提取液 (V 正己烷∶V 乙醇∶V 丙酮∶甲苯=10∶6∶7∶7),涡旋摇匀,自然静置分层,添加3 mL 10%硫酸钠溶液和5 mL 正己烷,自然静置10 min 后吸取上层有机层,重复添加5 mL 正己烷,提取至下层为无色或近乎为无色,最后合并所有上清液,N2 吹干后添加甲醇复溶,经0.45 μm 有机滤膜过滤后,HPLC 方法检测叶黄素的含量。生物可给率按公式(3)计算。
式中:m1——消化过程中胶束中叶黄素的含量,g;m2——初始乳液中叶黄素的含量,g。
1.3.5 叶黄素释放程度率的测定 在模拟肠消化过程中,当消化时间达到设定值(7.5,15,30,45,60,90,120,180 min 和240 min)后,吸取1 mL 消化液样品,测定消化液中叶黄素含量。根据公式(4)计算叶黄素释放率。
式中,Rt——消化时间t 时的叶黄素释放率,%;m——消化t 时间后消化液中叶黄素的含量,g;M——初始Lutein-NLCs 中叶黄素的含量,g。
1.3.6 微观形态 通过透射电子显微镜观察Lutein-NLCs 的微观形态。将Lutein-NLCs 用PBS稀释10 倍,取2 μL 的稀释样品滴加到涂有碳层的铜网上,30 s 后用滤纸吸去过量的样品,然后用1%磷钨酸负染90 s 移除,在200 kV 条件下,通过透射电子显微镜观察样品的微观形态。
1.3.7 界面张力的测定 乳化剂和胆汁酸盐在油/水界面的分步吸附参考姚晓琳等[10]的方法。对于单界面Lutein-NLCs 体系,向玻璃样品池中加入26 mL Tween 80 水溶液,以恒定速率搅拌,待乳化剂在油/水界面吸附平衡(21 600 s)后加入2 mL 胆汁酸盐溶液 (Tween 80 的最终质量分数为0.025%、胆汁酸盐最终质量浓度为5.6 mg/mL)。对于复合界面Lutein-NLCs 体系,乳化剂为Tween 80 和WPI 混合溶液,采用与单界面体系相同的吸附方式。对于双界面Lutein-NLCs 体系,向玻璃样品池中加入23 mL Tween 80 溶液,以恒定速率搅拌,待Tween 80 在油/水界面吸附达到平衡(10 800 s) 后加入3 mL WPI 溶液,待吸附平衡(21 600 s)后加入2 mL 胆汁酸盐溶液(Tween 80、WPI 的最终质量分数分别为0.014%,0.108%)。
采用界面流变仪,通过测定界面张力和弹性模量随时间的变化规律,来衡量不同乳化剂在油/水界面的吸附特性。将亚麻籽油装入带U 型针头的注射器中,乳化剂水溶液装入玻璃样品池中,通过电脑控制注射器在样品池中打出油滴,油滴的体积和表面积分别为5 mL 和14 mm2。采用拉普拉斯方程计算油/水界面的界面张力。
1.3.8 贮藏稳定性的测定 采用加速贮藏法研究Lutein-NLCs 的贮藏稳定性。将Lutein-NLCs 样品和叶黄素对照组(质量分数为2% 油溶体系)置于恒温培养箱中,在45 ℃下避光贮藏14 d,期间每隔1 d 监测样品的粒径、电位和保留率的变化。叶黄素保留率按公式(5)计算。
式中:m1——贮藏后体系中叶黄素含量,g;m2——初始体系中叶黄素含量,g。
1.4 数据分析
所有试验均重复3 次,结果均以平均值±标准差表示。用Origin 2019 软件制图,用SPSS 26.0软件对数据进行Duncan's 多重比较的显著性分析。
2 结果与分析
2.1 界面结构对Lutein-NLCs 的包封率和有效载量的影响
界面结构对Lutein-NLCs 的包封率和有效载量的影响见表1。3 种界面结构Lutein-NLCs 之间的包封率存在显著差异 (P <0.05),其中双界面Lutein-NLCs 的包封率为97.78%,显著高于复合界面和单界面Lutein-NLCs(P <0.05),而单界面Lutein-NLCs 的包封率最低,为96.37%。复合界面和双界面Lutein-NLCs 的有效载量均显著高于单界面(P <0.05),其中复合界面Lutein-NLCs 的有效载量最高,为1.30%。
表1 不同界面结构Lutein-NLCs 的包封率和有效载量
Table 1 Encapsulation efficiency and effective loading content of Lutein-NLCs with different interfacial structures

注:不同小写字母表示显著性差异(P<0.05)。
?指标单界面复合界面双界面包封率/%96.37±0.01a97.13±0.04b97.78±0.18c有效载量/%0.637±0.002a1.299±0.013c1.091±0.004b
2.2 界面结构对Lutein-NLCs 的粒径和电位的影响
不同界面结构Lutein-NLCs 的粒径、PDI 和zeta-电位的变化见表2。双界面Lutein-NLCs 的粒径最大,为180.86 nm,显著高于复合界面Lutein-NLCs(P <0.05),而单界面Lutein-NLCs 的粒径最小,为127.60 nm。3 种界面结构Lutein-NLCs 的PDI 呈现与其粒径相同的变化规律,PDI 值均小于0.3。单界面Lutein-NLCs 的zeta-电位较低,为-14.37 mV,复合界面和双界面Lutein-NLCs 的zeta-电位绝对值虽没有显著差异(P >0.05),但两者均显著高于单界面(P <0.05),这表明复合界面和双界面Lutein-NLCs 中存在的WPI 对叶黄素纳米结构脂质载体的zeta-电位影响显著。对双界面Lutein-NLCs 来说,其所带的电荷情况主要由最外层的WPI 决定[20]。WPI 的等电点约为5,在中性pH 值下具有很强的负电荷[21],因此,复合界面和双界面的zeta-电位绝对值较高。Tween 80 作为一种非离子表面活性剂,一般不带电。单界面Lutein-NLCs 的电负性是由Tween 80 在中性环境中吸附水中的氢氧根离子或Lutein-NLCs 中存在游离脂肪酸杂质引起的[22],因此其zeta-电位绝对值较低。
表2 不同界面结构Lutein-NLCs 的粒径、PDI 和zeta-电位
Table 2 The particle size,PDI and zeta-potential of Lutein-NLCs with different interfacial structures

注:不同小写字母表示显著性差异(P<0.05)。
样品粒径/nmPDIzeta-电位/mV单界面127.60±0.29a0.23±0.01a-14.37±1.60b复合界面165.72±5.79b0.27±0.01b-19.64±1.79a双界面180.86±3.28c0.29±0.01c-23.57±1.89a
2.3 不同界面结构Lutein-NLCs 的微观形态
采用透射电子显微镜观察不同界面结构Lutein-NLCs 的微观形态,如图1所示,3 种界面结构Lutein-NLCs 均为外表光滑的球体,它们的粒径呈现单界面<复合界面<双界面的规律,并且其粒径均小于200 nm,这与纳米粒度电位仪测得的粒径结果(表2)基本一致。
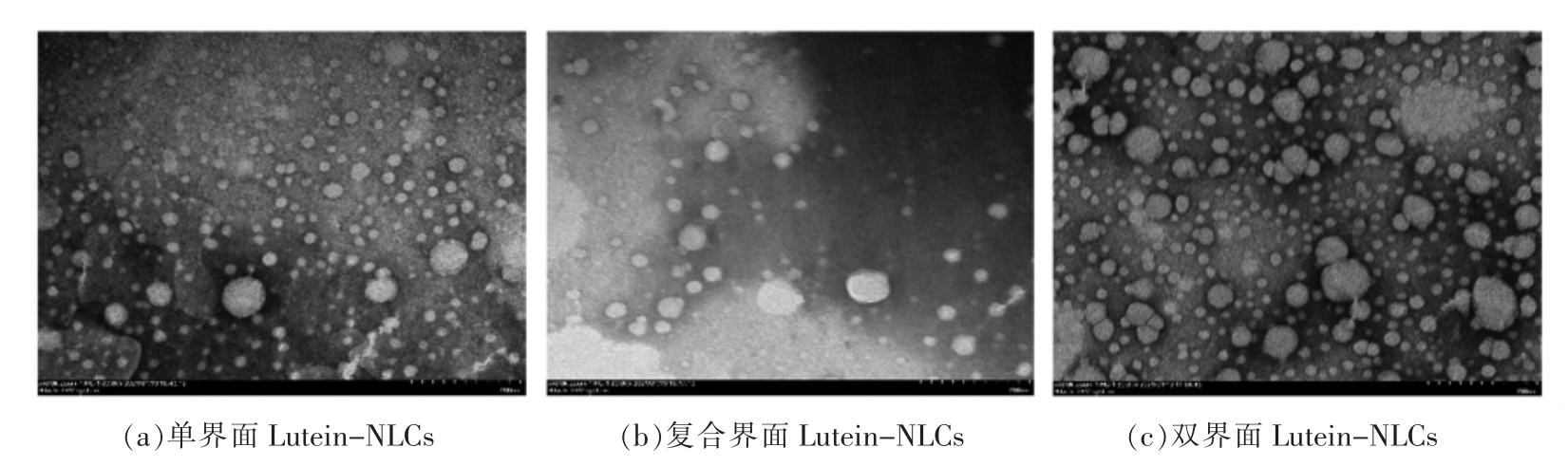
图1 不同界面结构Lutein-NLCs 的透射电镜图(所有图像均放大40 倍)
Fig.1 Transmission electron micrographs (magnificashion of 40) of Lutein-NLCs with different interfacial structures
2.4 界面结构对油/水界面张力的影响
界面结构对油/水界面张力的影响如图2所示。复合界面Lutein-NLCs 的初始界面张力最大,为19.74 mN/m,而单界面和双界面Lutein-NLCs的初始界面张力相近,约为10 mN/m。随着表面活性剂吸附于油滴表面,单界面和双界面Lutein-NLCs 的界面张力迅速下降,之后逐渐达到平衡,而复合界面的界面张力下降得较为缓慢。对于双界面Lutein-NLCs,加入WPI 后其界面张力进一步下降,最终复合界面和双界面的界面张力相近,而两者的界面张力明显低于单界面。这是由于在初始阶段,3 种界面结构Lutein-NLCs 中表面活性剂组成不同:双界面中的表面活性剂只有Tween 80,与单界面一致;而复合界面中的表面活性剂是Tween 80 和WPI 的混合物。其中,Tween 80 的分子量较低且疏水尾部仅由一个油酸碳链组成[23],因此它在油/水界面上的吸附速度快,导致单界面和双界面的初始界面张力低且下降快;而与Tween 80 相比,WPI 作为一种大分子蛋白质,扩散速度较慢,导致降低界面张力的效率较低[24],这也解释了复合界面的初始界面张力大,之后下降缓慢的现象。

图2 界面结构对油/水界面张力的影响
Fig.2 Effect of interfacial structures on interfacial tension of oil-water interface
注:(1)为双界面的第2 次加样;(2)为胆汁酸盐加样。
添加胆汁酸盐后,单界面和复合界面Lutein-NLCs 的界面张力快速下降,然而,随着时间的推移,其界面张力又恢复到添加胆汁酸盐前的水平,双界面的界面张力逐渐降低,平衡时的界面张力接近于复合界面,两者的界面张力值均低于单界面,表明单界面和复合界面Lutein-NLCs 的抗胆汁酸盐取代能力相近且强于双界面。研究表明,在小肠消化过程中,胆汁酸盐在油/水界面的取代作用对载体界面特性的影响最显著[10]。与单界面和复合界面相比,双界面的界面张力显著下降,表明其抗胆汁酸盐取代能力较弱,在消化过程中胆汁酸盐容易吸附在双界面Lutein-NLCs 上发生界面取代作用,有利于脂肪酶吸附并发生水解反应。添加胆汁酸盐后,单界面和复合界面Lutein-NLCs的界面张力变化可能是加样过程油滴晃动引起的界面张力变化。
2.5 界面结构对Lutein-NLCs 中叶黄素生物可给率的影响
探究了不同界面结构Lutein-NLCs 中叶黄素的生物可给率情况,并与单一叶黄素、常规纳米乳液进行比较,结果见图3。3 种界面结构Lutein-NLCs 的叶黄素生物可给率显著高于叶黄素和普通纳米乳液 (P <0.05)。不同界面结构Lutein-NLCs 中叶黄素的生物可给率差异显著(P <0.05),其中,单界面Lutein-NLCs 的叶黄素生物可给率最高,为63.10%;复合界面Lutein-NLCs 的叶黄素生物可给率最低,为31.85%。与单界面Lutein-NLCs 相比,复合界面和双界面Lutein-NLCs 中叶黄素生物可给率均降低,这可能是因为双界面和复合界面Lutein-NLCs 中的WPI 是大分子蛋白,形成更厚的界面层,阻碍胆汁酸盐和胰脂肪酶到达油/水界面来催化水解Lutein-NLCs[25]。
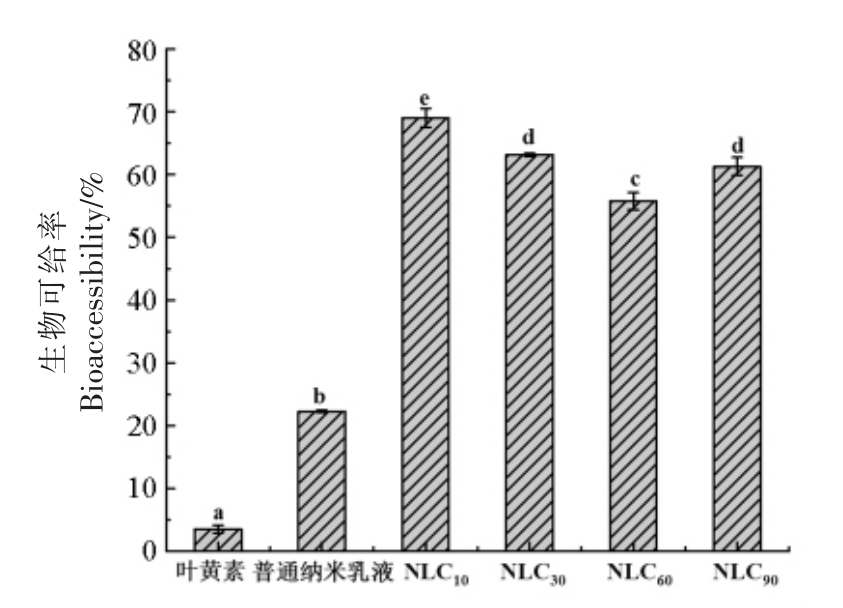
图3 不同界面结构Lutein-NLCs 的生物可给率
Fig.3 Bioaccessibility of Lutein-NLCs with different interfacial structures
2.6 界面结构对Lutein-NLCs 中叶黄素释放动力学的影响
探讨Lutein-NLCs 界面结构对叶黄素释放特性的影响,结果如图4所示。模拟消化过程中,3种界面结构Lutein-NLCs 的叶黄素释放率呈单界面>双界面>复合界面的规律。在消化30 min 内,3种界面结构Lutein-NLCs 的叶黄素释放率快速增加后趋于平缓。消化结束后单界面、复合界面和双界面Lutein-NLCs 的叶黄素释放率分别为73.74%,45.75%和52.35%。叶黄素释放速率均显著低于普通纳米乳液(P <0.05),表明Lutein-NLCs 具有较好的缓释效果,并且复合界面和双界面Lutein-NLCs 的叶黄素释放速率均显著低于单界面Lutein-NLCs(P <0.05),说明对Lutein-NLCs 进行界面修饰可有效控制叶黄素的释放。这是因为与复合界面Lutein-NLC 相比,双界面Lutein-NLCs的抗胆汁酸盐取代能力较差(图2所示),使得其油/水界面的表面活性剂易被胆汁酸盐置换,促进脂肪酶吸附在油/水界面上发挥酶解作用,进而导致双界面Lutein-NLCs 具有较高的叶黄素释放率和生物可给率。
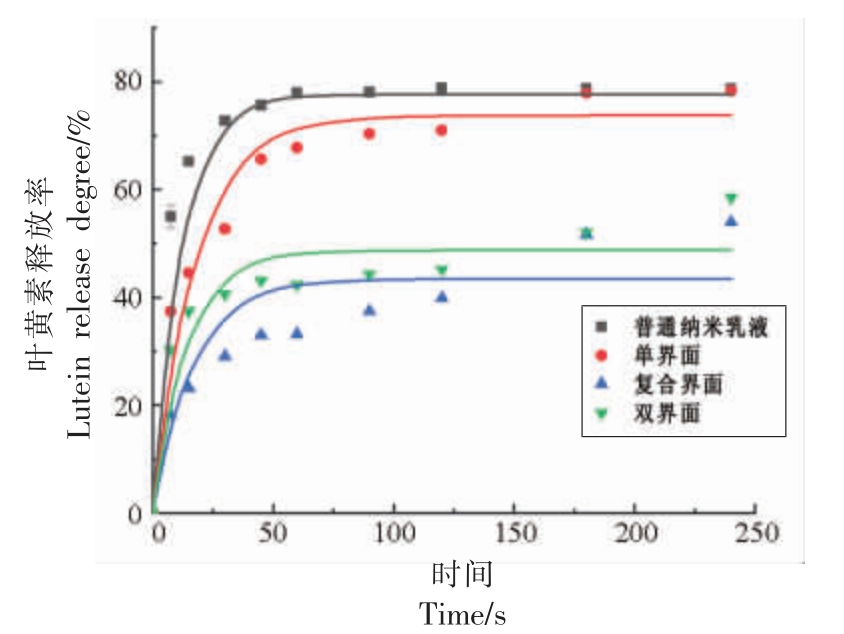
图4 不同界面结构Lutein-NLCs 在消化过程中叶黄素释放率的变化
Fig.4 The changes of lutein release degree of Lutein-NLCs with different interfacial structures during digestion
2.7 不同界面结构Lutein-NLCs 贮藏稳定性分析
2.7.1 粒径和电位的变化 图5a 为不同界面结构Lutein-NLCs 在贮藏期间粒径的变化情况。经14 d 加速贮藏后,复合界面和双界面Lutein-NLCs的粒径显著增加(P <0.05),其中复合界面Lutein-NLCs 的粒径增加0.97 倍,而双界面Lutein-NLCs的粒径增加1.37 倍,这表明复合界面和双界面结构的Lutein-NLCs 发生液滴聚集现象。与复合界面和双界面Lutein-NLCs 相比,单界面Lutein-NLCs 的粒径在贮藏过程中的变化最小,由127.60 nm 增至141.20 nm,仅增加了0.11 倍,粒径稳定性较好。NLC30、NLC90 和单界面Lutein-NLCs 的粒径仅发生微小的变化,粒径稳定性较好,而NLC10、复合界面Lutein-NLCs 和双界面Lutein-NLCs 的粒径明显增大,颗粒发生聚集。一般来说,电荷数少,颗粒间的静电斥力小,容易发生聚集,而Tween 80 具有空间位阻,能够提供空间稳定性[26]。由Tween 80 稳定的单界面Lutein-NLCs 在贮藏过程中保持较好的粒径稳定性。
探究了贮藏时间对不同界面结构Lutein-NLCs zeta-电位的影响,如图5b 所示。经过14 d加速贮藏后,3 种界面结构的Lutein-NLCs 的zeta-电位值发生了不同的变化:单界面和双界面Lutein-NLCs 的zeta-电位绝对值变小,而复合界面Lutein-NLCs 的zeta-电位绝对值变大。贮藏结束后,复合界面Lutein-NLCs 的电负性最大,其zeta-电位为-23.92 mV。
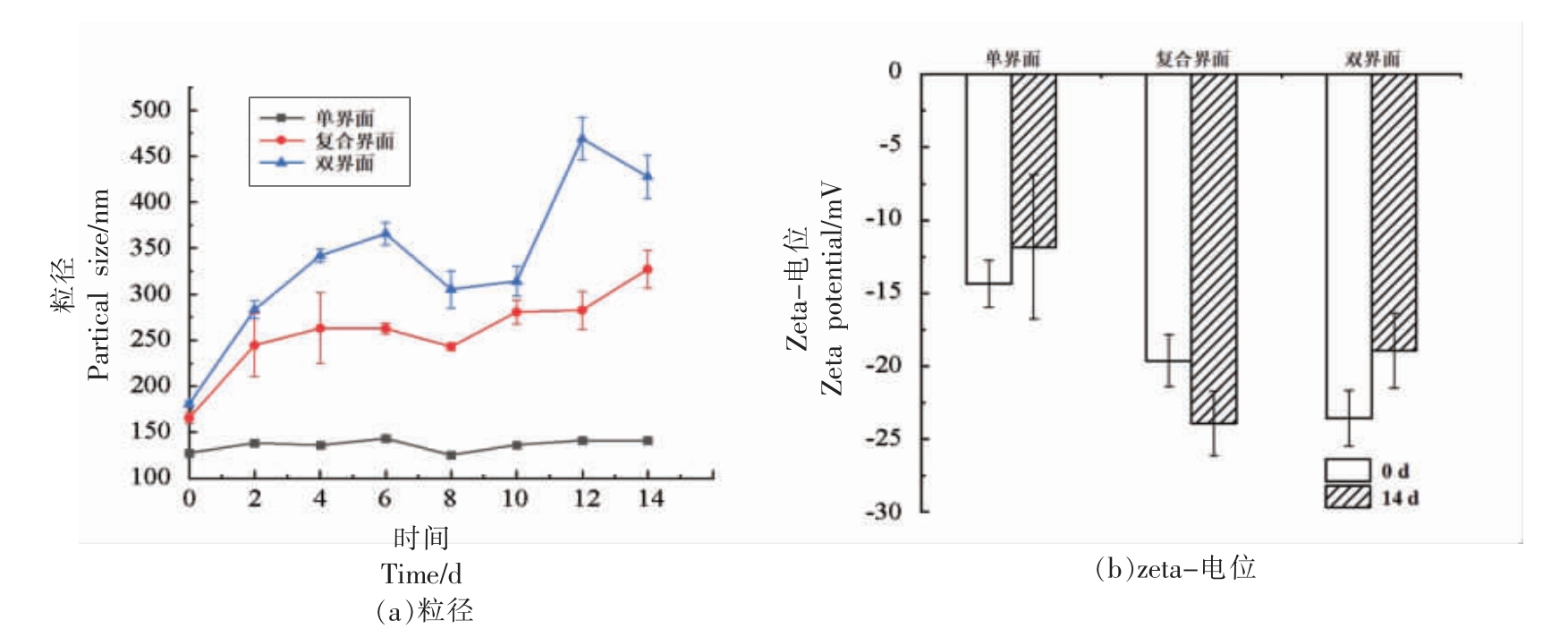
图5 贮藏过程中不同界面结构Lutein-NLCs 粒径(a)和zeta-电位(b)的变化
Fig.5 Changes in particle size and zeta potential of Lutein-NLCs with different interfacial structures during storage
2.7.2 不同界面结构Lutein-NLCs 在贮藏期间叶黄素保留率的变化 贮藏期间叶黄素保留率的变化如图6所示。随着时间的推移,3 种界面结构Lutein-NLCs 保留率均不断降低,表明叶黄素发生降解。3 种界面结构Lutein-NLCs 的叶黄素保留率始终高于叶黄素对照组,其提高了叶黄素的稳定性。贮藏14 d 后,单界面、复合界面和双界面Lutein-NLCs 的叶黄素保留率分别为29.94%,50.65%和23.33%,是叶黄素对照组的7.13,12.06倍和5.56 倍。与庞慧丽等[27]的研究相比,Lutein-NLCs(复合界面)的叶黄素保留率提高了4.07 倍,表明Lutein-NLCs 可有效提高叶黄素的贮藏稳定性。
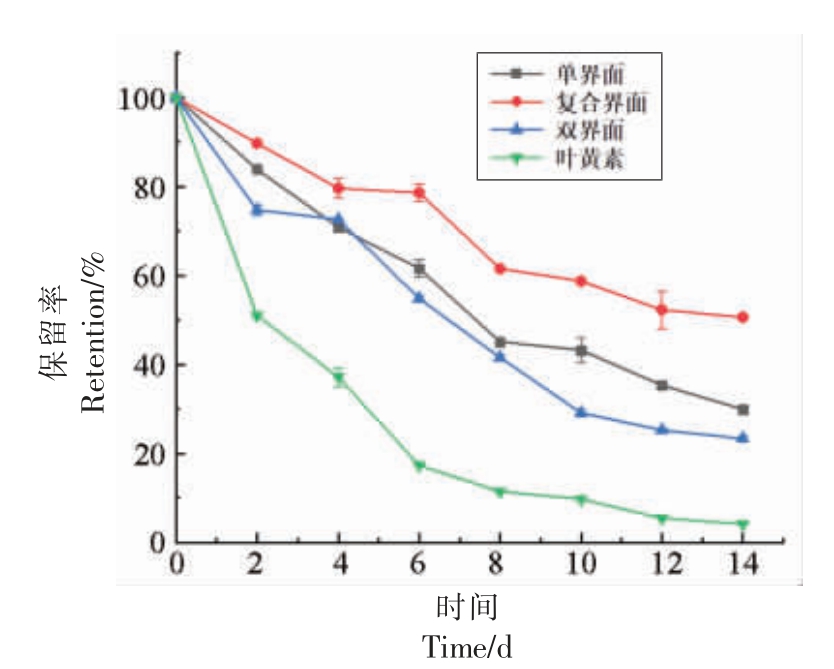
图6 贮藏过程中不同界面结构Lutein-NLCs 中叶黄素保留率的变化
Fig.6 The changes in lutein retention of Lutein-NLCs with different interfacial structures during storage
3 结论
通过小分子表面活性剂Tween 80 与天然生物大分子WPI 构建复合界面、双界面及单界面的3 种界面结构的Lutein-NLCs。运用体外模拟消化模型和界面流变技术,评估界面结构对Lutein-NLCs 体系中叶黄素释放和生物可及性的影响。与普通纳米乳液相比,3 种界面结构的Lutein-NLCs均显著提高了叶黄素的生物可给率,具有较好的缓释效果;同时,也提高了叶黄素的稳定性。其中复合界面Lutein-NLCs 的叶黄素保留率最高,为50.65%,是叶黄素对照组的12.06 倍。
[1]吕亚男,顾青,李东丽,等.叶黄素对转化生长因子-β2 诱导的视网膜色素上皮细胞上皮-间质转化的影响[J].上海交通大学学报 (医学版),2019,39(6):571-577.LÜ Y N,GU Q,LI D L,et al.Effects of lutein on transforming growth factor-β2 induced epithelialmesenchymal transition in ARPE-19 cells[J].Journal of Shanghai Jiao Tong University (Medical Science),2019,39(6):571-577.
[2]焦岩,李大婧,刘春泉,肖亚冬.叶黄素纳米脂质体的制备工艺优化及其氧化稳定性[J].食品科学,2017,38(18):259-265.JIAO Y,LI D J,LIU C Q,et al.Lutein nanoliposomes:optimization of preparation conditions and oxidative stability[J].Food Science,2017,38(18):259-265.
[3]ABDEL-AAL E M,HUMAYOUN A,KHALID Z,et al.Dietary sources of lutein and zeaxanthin carotenoids and their role in eye health[J].Nutrients,2013,5:1169-1185.
[4]MAPELLI-BRAHM P,MARIELLE M,CHARLES D,et al.Comparison of the bioavailability and intestinal absorption sites of phytoene,phytofluene,lycopene and β-carotene[J].Food Chemistry,2019,300(1):25232.
[5]BECERRA M O,CONTRERS L M,LO M H,et al.Lutein as a functional food ingredient:Stability and bioavailability[J].J Functional Food,2020,66:103771.
[6]ROSTAMABADI H,FALSAFI S R,JAFARI S M.Nanoencapsulation of carotenoids within lipid-based nanocarriers[J].Journal of Controlled Release,2019,298:38-67.
[7]DAN N.Compound release from nanostructured lipid carriers (NLCs)[J].Journal of Food Engineering,2016,171:37-43.
[8]HOLMBERG K.Interactions between surfactants and hydrolytic enzymes[J].Colloids and Surfaces B:Biointerfaces,2018,168:169-177.
[9]BERTON-CARABIN Claire,SCHRO?N K.Towards new food emulsions:designing the interface and beyond[J].Current Opinion in Food Science,2019,27(6):74-81.
[10]姚晓琳,聂珂,陈玉,等.复合界面对食品乳液中脂肪消化的影响[J].食品科学,2018,39(2):1-7.YAO X L,NIE K,CHEN Y,et al.Effect of complex interface on lipid digestion in food emulsion[J].Food Science,2018,39(2):1-7.
[11]INFANTES-GARCIA M R,VERKEMPINCK S H E,GONZALEZ-FUENTES P G,et al.Lipolysis products formation during in vitro gastric digestion is affected by the emulsion interfacial composition[J].Food Hydrocolloids,2021,110:106163.
[12]TORCELLO-GÓMEZ A,MALDONADO-VALDERRAMA J,MARTÍN -RODRÍGUEZ A,et al.Physicochemical properties and digestibility of emulsified lipids in simulated intestinal fluids:influence of interfacial characteristics[J].Soft Matter,2011,7(13):6167-6177.
[13]CHU B S,RICH G T,RIDOUT M J,et al.Modulating pancreatic lipase activity with galactolipids:Effects of emulsion interfacial composition[J].Langmuir,2009,25(16):9352-9360.
[14]程喆,潘思轶.柚皮苷纳米乳液递送体系的消化特性[J].食品科学,2020,40(20):7-13.CHENG Z,PAN S Y.Digestion characteristics of naringin -loaded nanoemulsion delivery systems [J].Food Science,2020,41(20):7-13.
[15]SONG J F,YANG Q M,HUANG W Y,et al.Optimization of trans lutein from pumpkin (Cucurbita moschata) peel by ultrasound-assisted extraction[J].Food and Bioproducts Processing,2018,107:104-112.
[16]HEJRI A,KHOSRAVI A,GHARANJIG K,et al.Optimisation of the formulation of β-carotene loaded nanostructured lipid carriers prepared by solvent diffusion method[J].Food Chemistry,2013,141(1):117-123.
[17]LIU C H,WU C T.Optimization of nanostructured lipid carriers for lutein delivery[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2010,353(2):149-156.
[18]M.SC A G,M.SC B V.Wheat germ oil:A potential facilitator to improve lutein bioavailability in mice[J].Nutrition,2013,29(5):790-795.
[19]JIN F,HUANG M G,CHAI Z,et al.The influence of oil composition on the transformation,bioaccessibility,and intestinal absorption of curcumin in nanostructured lipid carriers[J].Food & Function,2020,11(6):5223-5239.
[20]SHENG B L,LI L,ZHANG X,et al.Physicochemical properties and chemical stability of β -carotene bilayer emulsion coated with bovine serum albumin and arabic gum compared to monolayer emulsions[J].Molecules,2018,23(2):495.
[21]ZHANG R J,ZHANG Z P,ZOU L Q,et al.Enhancement of carotenoid bioaccessibility from carrots using excipient emulsions:influence of particle size of digestible lipid droplets[J].Food & Function,2016,7(1):93-103.
[22]WEIGEL F,WEISS J,DECKER E A,et al.Lutein-enriched emulsion-based delivery systems:Influence of emulsifiers and antioxidants on physical and chemical stability[J].Food Chemistry,2018,242:395-403.
[23]GOMES A,COSTA A L R,LOPES C R.Impact of oil type and WPI/Tween 80 ratio at the oil-water interface:Adsorption,interfacial rheology and emulsion features[J].Colloids and Surfaces B:Biointerfaces,2018,164:272-280.
[24]GRIGORIEV D O,DERKATCH S,KR?GEL J,et al.Relationship between structure and rheological properties of mixed BSA/Tween 80 adsorption layers at the air/water interface[J].Food Hydrocolloids,2007,21(5):823-830.
[25]LEE S J,CHOI S J,LI Y,et al.Protein-stabilized nanoemulsions and emulsions:Comparison of physicochemical stability,lipid oxidation,and lipase digestibility[J].Journal of Agricultural and Food Chemistry,2011,59(1):415-427.
[26]BEHBAHANI E S,GHAEDI M,ABBASPOUR M,et al.Curcumin loaded nanostructured lipid carriers:In vitro digestion and release studies[J].Polyhedron,2019,164:113-122.
[27]庞慧丽,李大婧,刘春泉.叶黄素在有机溶剂中的稳定性[J].食品科学,2013,34(23):15-19.PANG H L,LI D J,LIU C Q.Stability of lutein in organic solvents[J].Food Science,2013,34(23):15-19.