副溶血弧菌 (Vibrio parahaemolyticus,VP)是广泛分布于海洋环境中的嗜盐革兰氏阴性杆状或曲线形细菌[1],是全球海鲜消费引起的食源性疾病暴发的主要原因之一[2]。VP 感染的症状包括腹泻、腹部绞痛、呕吐和发烧,严重时可发展为败血症,甚至导致患者死亡[3]。高感染率归因于高频率的海鲜饮食以及食用未煮熟海鲜,VP 感染在亚洲出现的频率很高,尤其是在中国、日本和韩国[4-5]。另外,抗生素广泛用于治疗由VP 引起的感染,增加了抗生素抗性菌株的发生率[6],因此人们在积极寻找预防VP 感染的新策略。
天然植物提取物是帮助克服耐多药细菌感染的一种选择。长期以来,精油一直被认为是对哺乳动物毒性较低的环保抗微生物物质[7]。柠檬草精油(LG-EO)被证明具有防腐、抑菌、抗氧化的能力[8],可能与其含有柠檬醛、月桂烯、香叶醇等活性成分有关[9]。LG-EO 被证明可有效抑制鲍曼不动杆菌、金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌等细菌的生长[10]。本文研究LG-EO 对3 株副溶血性弧菌的抑菌活性及其机制,包括细胞壁完整性、细胞膜通透性、形态特征、膜电位和呼吸链脱氢酶等能量代谢途径及细胞内DNA 含量和结构等方面,为这种植物源抑菌剂在水产品的保鲜和杀菌的应用提供参考。
1 材料与方法
1.1 菌株、试剂及仪器、设备
副溶血弧菌ATCC 17802(VP17802),上海菌种保藏中心。副溶血弧菌WT(VPWT)分离于市售水产品,保存于本实验室。副溶血弧菌HZ(VPHZ),杭州市医院临床分离株。
主要试剂:柠檬草精油(LG-EO),江西吉安中香天然植物精油有限公司;二甲基亚砜(DMSO)、罗丹明123、红四氮唑 (TTC),麦克林生物技术有限公司;ATP 酶和AKP 测定试剂盒,南京建成生物工程公司;全基因组细菌DNA 提取试剂盒,南京诺唯赞生物科技有限公司。
主要仪器、设备:FE38-Standard 台式电导率仪,上海右一仪器有限公司;JS-680D 全自动凝胶成像分析仪,上海培清科技有限公司;VICTOR X 酶标仪,美国 Perkin Elmer 公司;Nano Pro 2010/2020 超微量紫外-可见分光光度计,北京鼎昊源科技有限公司;HitachiH-7650 型透射电子显微镜,日立公司;SIGMA3-30K 冷冻高速离心机,美国Sigma 公司。
1.2 LG-EO 对副溶血性弧菌的最小抑菌浓度(MIC)测定
副溶血性弧菌在含3% NaCl 的TSB (下同)中培养过夜,稀释成105~106 CFU/mL 菌液待用。将LG-EO 溶于DMSO 中配成10 mg/mL 的溶液,用二倍稀释法使LG-EO 质量浓度分别为2 000,1 000,500,250,125,62.5,31.25 μg/mL,以加同等量DMSO 为对照组。将上述处理组和对照组于37℃培养24 h 后测定OD600nm。与菌液初始吸光度值比较没有明显变化且肉眼观察不到活菌的最小LG-EO 浓度作为MIC。
1.3 时间-杀灭分析
参考Elexson 等[11]的方法并稍加修改,用80,120,160,200,240,280 μg/mL 的LG-EO 分别处理VP 17802、VP WT、VP HZ 菌株0,10,20 min,不加LG-EO 的组别为对照组,于硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(TCBS)平板上进行菌落计数。
1.4 LG-EO 对副溶血性弧菌细胞壁和细胞膜的影响
1.4.1 碱性磷酸酶(AKP)活性的测定 取指数期的过夜培养物,5 000×g 离心10 min 收集沉淀,洗涤,重悬于0.01 mol/L 磷酸盐(PBS)缓冲液(pH 7.4)中,使菌液浓度约为1×107 CFU/mL。分别加入120,240 μg/mL LG-EO,以不加LG-EO 的为对照组。将菌液37 ℃孵育不同时间,5 000 g 离心10 min,得上清液。按照AKP 试剂盒说明书,用酶标仪测定上清液的OD520nm。已知AKP 分解磷酸苯二钠产生酚和游离磷酸钠,以100 mL 菌液与基质作用15 min 产生1 mg 酚为1 金氏单位(King unit)。
1.4.2 蛋白质泄漏量和上清液电导率的测定 按AKP 的处理方法得到处理组和对照组的细菌上清液,通过0.22 μm 膜过滤,用超微量紫外-可见分光光度计测定蛋白质浓度。同样,收集各组上清液后稀释20 倍测定电导率[12]。
1.4.3 透射电镜观察细胞 分别将培养至对数生长期的菌体转接于含120 μg/mL 和240 μg/mL LG-EO 的TSB 中,使菌体浓度约1×107 CFU/mL,对照组不添加LG-EO。培养2 h 后,离心收集菌体,用PBS(0.01 mol/L,pH 7.2) 洗涤 3 次,经戊二醛-锇酸双重固定,梯度脱水、包埋、超薄切片、染色后,用透射电子显微镜(TEM)观察拍照。
1.5 LG-EO 对副溶血性弧菌能量代谢的影响
1.5.1 膜电位的测定 参考Liu 等[13]的方法,取过夜培养的菌液于TSB 培养基中,细菌浓度约1×107 CFU/mL。加入LG-EO,使其终质量浓度分别为120,240 μg/mL,对照组不添加LG-EO,培养2 h。将罗丹明123 加入PBS (0.01 mol/L,pH 7.4)中,得到1 mg/mL 储备溶液。菌液用PBS 洗涤3 次,加入罗丹明123 储备液,使其终质量浓度为2 μg/mL。黑暗中孵育30 min,用PBS 洗涤样品并重悬。然后,分别在480 nm 和530 nm 的激发波长和发射波长下测量罗丹明123 荧光,测得数据为平均荧光强度(Mean fluorescence intensity,MFI)。
1.5.2 呼吸链脱氢酶活力的测定 在细菌生长至对数期末期时,将1 mL VP 菌液加入无菌管试中,然后,加入2 mL 0.05 mol/L Tris-HCl 缓冲液(pH=8.6),2 mL 0.1 mol/L 葡萄糖溶液和2 mL 1 mg/mL TTC(红四氮唑)溶液。混合后,加入LGEO(120,240 μg/mL),对照组不加精油。37 ℃培养2 h,向每管加入两滴浓硫酸停止反应。然后,加入5 mL 正丁基乙醇,振摇,取上层有机相,4 000×g离心10 min,以正丁基乙醇为参照,测定波长490 nm 处的光密度。
1.5.3 ATP 酶活力的测定 取过夜培养的菌液于TSB 培养基中,使细菌浓度约为1×107 CFU/mL。加入一定量LG-EO,使其终质量浓度为120,240 μg/mL,对照组不添加LG-EO,37 ℃培养2 h,收集菌体,PBS 溶液洗涤重悬,冰浴、间歇式超声破碎5 min,离心,取上清液,测OD660nm。ATP 酶活力用U/mg prot 表示,定义为每小时每毫克蛋白分解ATP产生1 μmol 无机磷的量。
1.6 LG-EO 对副溶血性弧菌DNA 的影响
1.6.1 基因组DNA 的凝胶电泳分析 取对数生长期的培养物,经离心得到菌体沉淀,用无菌PBS清洗3 次,重悬于TSB 培养基中。处理组分别加入120,240 μg/mL LG-EO,对照组不添加LGEO,37 ℃孵育2 h。处理结束后取5 mL 菌悬液于4°C 下10 000 r/min 冷冻离心1 min,获得菌体沉淀,根据细菌基因组DNA 提取试剂盒方法抽提DNA。将各组样品分别取5 μL,与2 μL 6×上样缓冲液混匀,即上样样品液,1%琼脂糖凝胶电泳观察。
1.6.2 柠檬醛与副溶血性弧菌DNA 作用的紫外吸收光谱 将两株VP 对照组的DNA(0,5 μL)与柠檬醛(120 μg/mL)混合,补充缓冲液至1.5 mL。将制备好的反应体系置37 ℃恒温培养箱中孵育20 min。用紫外分光光度计测量190~380 nm 处的吸收光谱[14]。
1.7 数据处理与分析
每个处理均设3 个重复组,采用Origin 8.5进行数据分析并作图,应用SPSS 20.0 的ANOVA进行方差分析,P<0.05 表示具有显著性差异。
2 结果
2.1 LG-EO 对副溶血性弧菌的MIC
LG-EO 对不同副溶血性弧菌菌株MIC 范围为80~120 μg/mL,说明LG-EO 对副溶血弧菌有较好的抑菌活性。其中,VP17802 对LG-EO 最敏感,MIC 为80 μg/mL;其次是水产品分离株WT,MIC 为100 μg/mL;临床菌株HZ 具有最强的抗性,MIC 为120 μg/mL。
2.2 时间-杀伤分析
评价0~20 min 内LG-EO 对3 株副溶血性弧菌的杀灭效果,结果见表1。对照组菌液质量浓度达到7 lg(CFU/mL),随着LG-EO 浓度的增加,杀灭效果逐渐增强。VP 17802 对LG-EO 最为敏感,80 μg/mL LG-EO 作用20 min,菌液浓度降低1.48 lg(CFU/mL),而VP WT 和VP HZ 分别下降0.58 lg(CFU/mL)和0.59 lg(CFU/mL)。120 μg/mL LG-EO 处理20 min,VP 17802 的活菌数下降3.40 lg(CFU/mL),VP WT 和VP HZ 分别降了2.94lg(CFU/mL)和2.24 lg(CFU/mL)。当200 μg/mL LG-EO 作用20 min,在3 株VP 中均未检测到活菌。而LG-EO 质量浓度达到280 μg/mL,加入培养基中,能立即杀灭副溶血性弧菌。时间-杀伤试验表明,LG-EO 在短时间内可有效灭活副溶血性弧菌,表现出较强的抑菌活性。
表1 LG-EO 对副溶血性弧菌的时间-杀灭试验
Table 1 Time-kill assay against VP by LG-EO concentrations
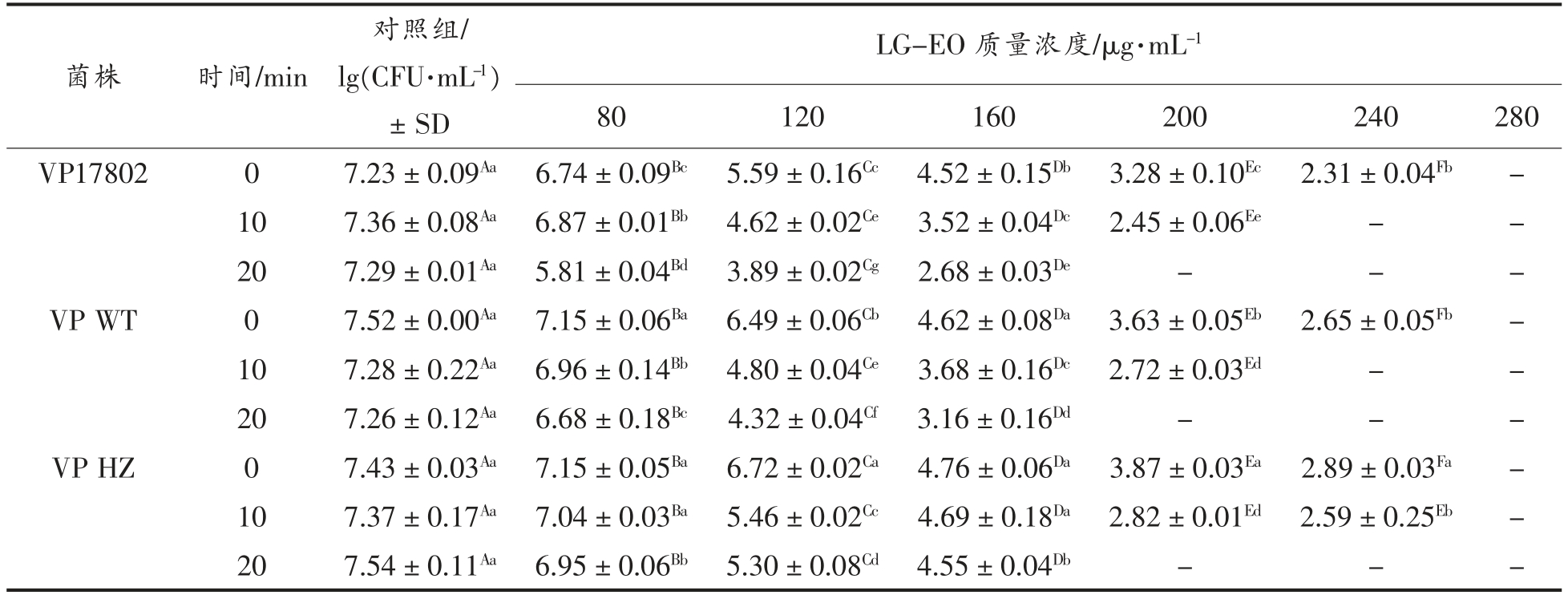
注:-:未检出;SD= 标准偏差;同一行中的不同大写字母(A、B、C 等)表示有显著性差异,同一列中的不同小写字母(a、b、c 等)表示有显著性差异(P<0.05)。
对照组/lg(CFU·mL-1)± SD LG-EO 质量浓度/μg·mL-1 80120160200240280 VP1780207.23±0.09Aa 6.74±0.09Bc 5.59±0.16Cc 4.52±0.15Db 3.28±0.10Ec 2.31±0.04Fb-107.36±0.08Aa 6.87±0.01Bb 4.62±0.02Ce 3.52±0.04Dc 2.45±0.06Ee--207.29±0.01Aa 5.81±0.04Bd 3.89±0.02Cg 2.68±0.03De---VP WT07.52±0.00Aa 7.15±0.06Ba 6.49±0.06Cb 4.62±0.08Da 3.63±0.05Eb 2.65±0.05Fb-107.28±0.22Aa 6.96±0.14Bb 4.80±0.04Ce 3.68±0.16Dc 2.72±0.03Ed--207.26±0.12Aa 6.68±0.18Bc 4.32±0.04Cf 3.16±0.16Dd---VP HZ07.43±0.03Aa 7.15±0.05Ba 6.72±0.02Ca 4.76±0.06Da 3.87±0.03Ea 2.89±0.03Fa-107.37±0.17Aa 7.04±0.03Ba 5.46±0.02Cc 4.69±0.18Da 2.82±0.01Ed 2.59±0.25Eb-207.54±0.11Aa 6.95±0.06Bb 5.30±0.08Cd 4.55±0.04Db---菌株时间/min
2.3 LG-EO 对副溶血性弧菌细胞结构的影响
2.3.1 细胞壁完整性 碱性磷酸酶(AKP)通常只存在于细胞内,位于细胞膜和细胞壁之间,不向细胞外分泌,只有当细胞壁受损时,才能在细胞外检测到它的活性。AKP 活性可作为评价细胞壁通透性的指标[15]。如图1所示,对照组上清液中AKP 活性在2 h 内略有升高,而经LG-EO 处理后,上清液中AKP 活性随LG-EO 浓度及孵育时间的增加显著提高(P<0.05)。VP 17802 和VP HZ 经240 μg/mL LG-EO 处理2 h,AKP 活性分别达到0.85 King unit/100 mL 和0.58 King unit/100 mL。这表明LG-EO 通过破坏VP 细胞壁,将细胞中的AKP快速释放到培养基中,这与Cao 等[16]和Diao 等[17]的研究结果一致。

图1 LG-EO 处理后副溶血性弧菌上清液中AKP 的活性
Fig.1 Activity of AKP in the culture media of V.parahaemolyticus after LG-EO treatment
2.3.2 细胞膜通透性 当细菌细胞膜受损时,细胞的各种组分如蛋白质、核酸、离子将从细胞中释放出来。蛋白质作为细菌细胞内的重要生物大分子,在培养基中其含量增加被视为细胞膜损伤的重要标志[18]。细菌上清液中蛋白质浓度的变化如图2a 和2b 所示。对照组在孵育过程中细胞外蛋白浓度基本无变化。然而,与120 μg/mL LG-EO共孵育1h 后,VP 17802 和VP WT 上清液中的蛋白质质量浓度分别达97 μg/mL 和94 μg/mL,2 h后泄漏量分别为234 μg/mL 和182 μg/mL,表明此时细胞膜的通透性显著增加(P<0.05)。
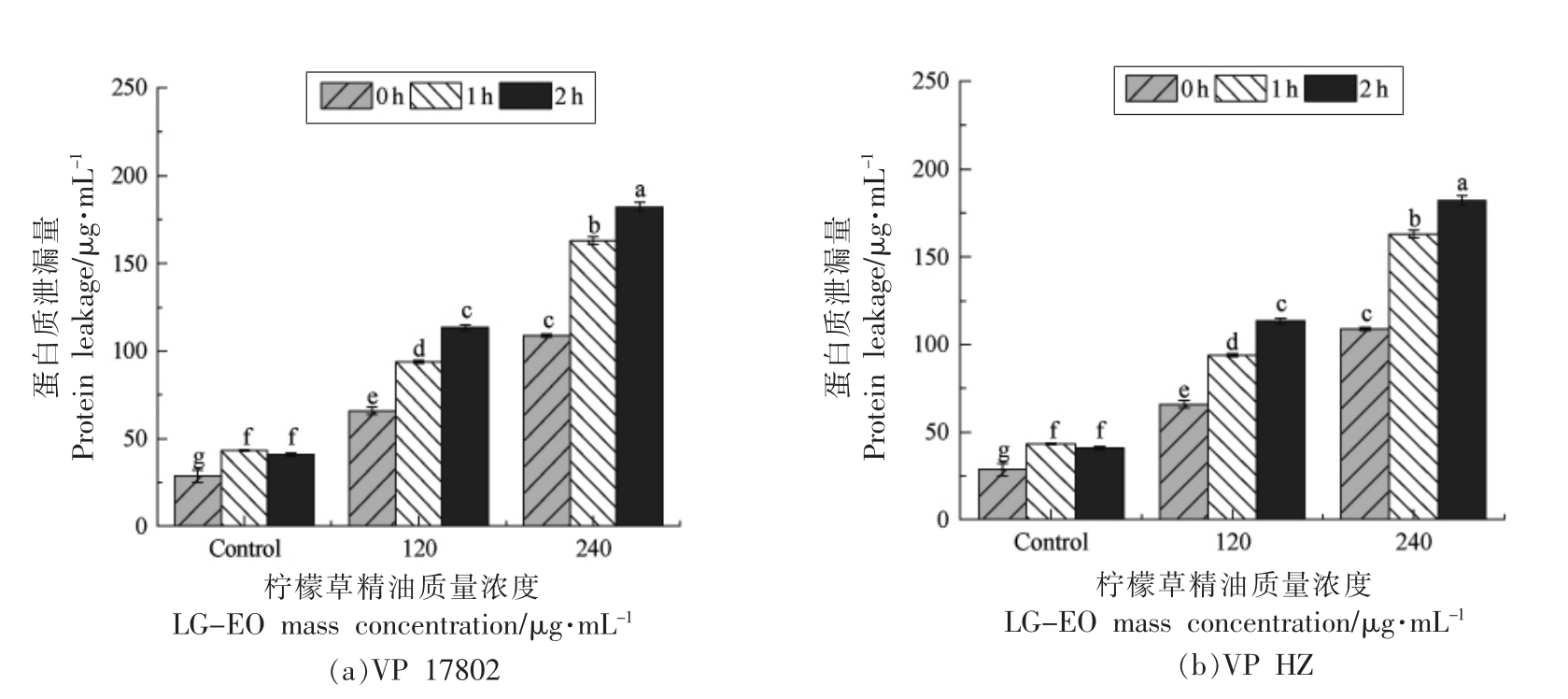
图2 LG-EO 处理后副溶血性弧菌蛋白质泄漏量
Fig.2 Protein leakage from V.parahaemolyticus treated with LG-EO
细菌细胞膜完整性被破坏,渗透性增加,细胞中的Na+,K+泄漏,导致上清液的电导率变大。如图3a 和3b 所示,在孵育期间,对照组中VP 17802和VP WT 电导率没有显著变化,处理组中随LGEO 的浓度和处理时间的延长,两株VP 的电导率都明显增大,增幅VP 17802 稍高于VP HZ。如在120 μg/mL LG-EO 处理2 h,两株菌上清液的电导率分别增加12.6%和6.96%,而240 μg/mL LGEO 处理同样时间,上清液电导率分别增加了16.6%和7.87%,说明经LG-EO 处理后VP 细胞膜受到破坏,大量的电解质流出。
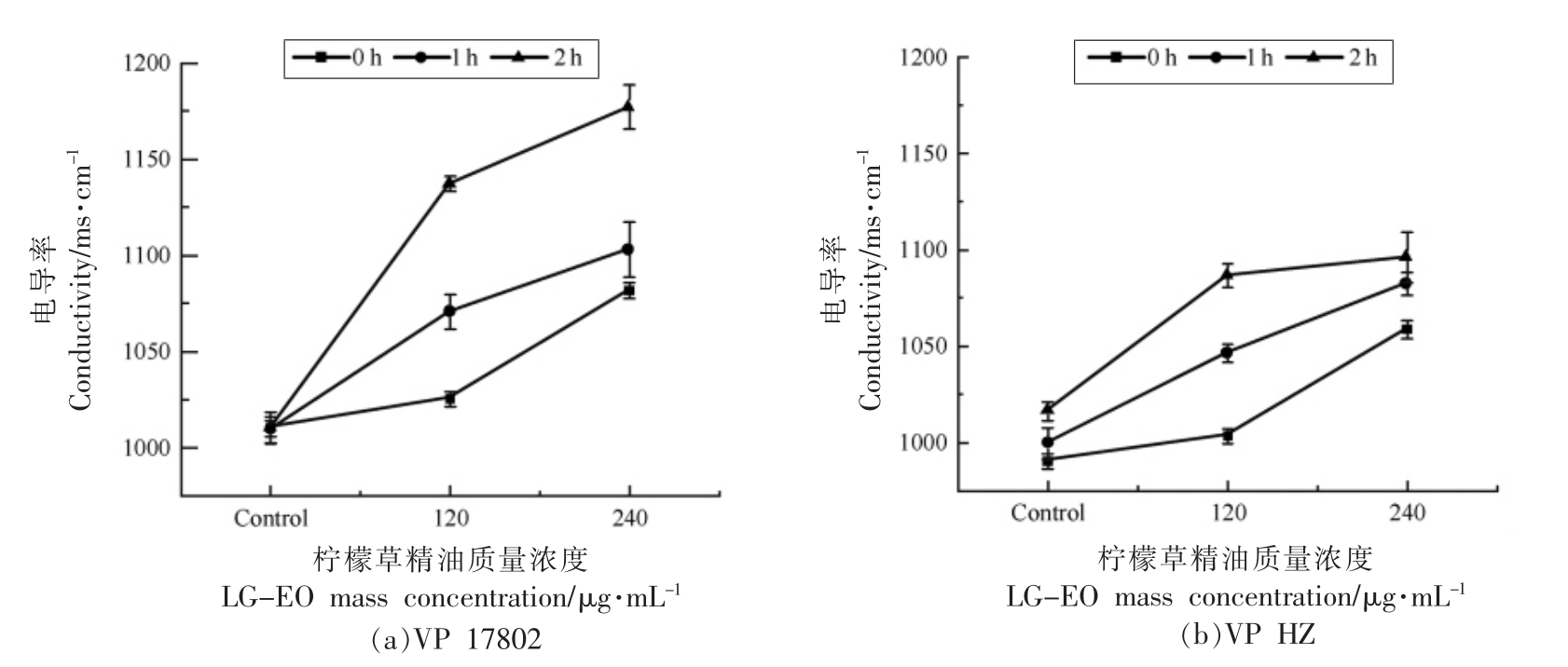
图3 LG-EO 处理后副溶血性弧菌的电导率
Fig.3 Conductivity of V.parahaemolyticus treated with LG-EO
2.3.3 TEM 观察细胞 由图4A 和4D 可看出,对照组菌体结构完整,表面光滑,胞浆分布均匀。经120 μg/mL LG-EO 处理,细胞形态发生改变,在受损的细胞上有一些明亮的孔洞和间隙,同时细胞壁和细胞膜被破坏,细胞内容物严重流失(图4B和4E),细胞膜边界变得模糊,且细胞形态受损程度随LG-EO 浓度的增加而增加。240 μg/mL LGEO 处理后胞质大量减少,使颜色变浅,部分细胞膜溶解,出现严重空泡化(图4C 和4F)。

图4 LG-EO 处理VP 17802 2 h 后的TEM 图像
Fig.4 TEM images of VP 17802 treated with LG-EO for 2 h
注:图中A~C.分别为×20 000 的对照组、120 μg/mL 和240 μg/mL LG-EO 处理组;E~F.分别为×40 000 的对照组、120 μg/mL 和240 μg/mL LG-EO 处理组。
2.4 膜电位和能量代谢相关酶活力的测定结果
2.4.1 膜电位 膜电位(MP)是由生物细胞膜内、外的电位差引起的,对于质子动力势的产生至关重要[13]。细胞产生ATP 维持正常的能量代谢,而维持膜电位的稳定是先决条件。MP 改变是细胞早期损伤的重要标志。罗丹明123 是一种亲脂性阳离子染料,通过跨膜电势进入细胞基质,其荧光强度反映膜电位的变化。如图5a 所示,未处理菌株VP 17802 和VP HZ 的荧光强度在2 h 内分别达到734.7 AU 和660.4 AU,而用120 μg/mL LG-EO处理2 h 后,两菌株的MP 分别下降52.7%和24.2%,用240 μg/mL LG-EO 处理后两菌株的膜电位(MP)则分别下降66.6%和40.1%。结果表明,LG-EO 可引起细菌细胞膜去极化,荧光强度减少证明了这一点。LG-EO 可在短时间内破坏VP 的稳态,大量的膜电位丢失,导致细胞能量耗尽,继而影响细胞的一系列生理活动,最终导致细胞死亡[19]。
2.4.2 呼吸链脱氢酶 呼吸链为细胞活动提供重要能量,对于细菌,呼吸链是主要存在于细胞质膜中的电子系统,将电子从NADH 或FADH2 转移至氧,同时产生CO2 和ATP。可以通过红四氮唑(TTC)进入细胞之后被还原的程度来间接反映呼吸链脱氢酶的活性大小,其还原产物为红色的三苯甲臜。细菌呼吸链的失活,意味着氧化磷酸化和细菌产能途径被抑制,导致细菌缺乏生长能量而死亡。如图5b 所示,对照组中的VP 17802 和VP HZ 在孵育2 h 后OD490nm 分别达0.132 和0.142,表明细胞进行正常的呼吸作用。然而,在LG-EO处理的细菌中,呼吸链的脱氢酶活性受到显著抑制(P <0.05),且抑制程度是浓度依赖性的。当向培养基中加入240 μg/mL LG-EO 时,2 h 后两株VP 的OD490nm 分别为0.032 和0.065,与对照组相比分别下降了75.6%和73.3%(P <0.05)。

图5 LG-EO 对副溶血性弧菌膜电位(a)和呼吸链脱氢酶(b)的影响
Fig.5 Effects of LG-EO on membrane potential (a) and respiratory chain dehydrogenase activity (b)of V.parahaemolyticus
2.4.3 ATP 酶 ATP 是一种高能磷酸化合物,是生物体内最直接的能量来源。细胞内ATP 的活性与物质代谢及能量释放、储存和利用有关。当细胞受损或凋亡时,ATP 含量迅速下降[20]。据图6a 和6b,ATPase 活性在LG-EO 处理后均显著降低(P<0.05),120 μg/mL 和240 μg/mL LG-EO 处理效果相似,240 μg/mL LG-EO 处理VP 17802 2 h,Na+/K +-ATPase 和Ca2 +/Mg2 +-ATPase 活性分别由4.83,4.09 U/mg prot 下降到0.54,0.39 U/mg prot,各下降了88.8%和90.5%;VP HZ 两种ATP 酶活性则分别从4.31,3.56 U/mg prot 降至1.07,0.87 U/mg prot,各下降了75.2%和75.6%。
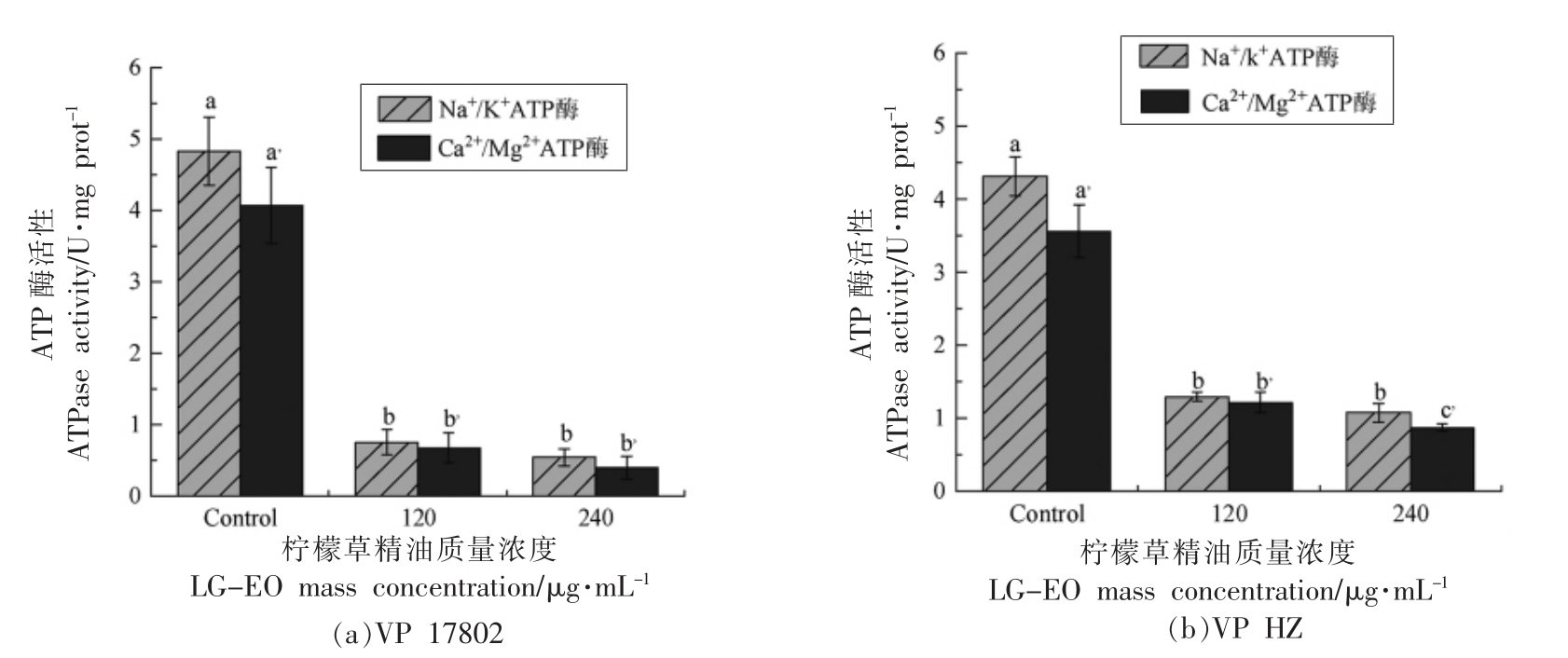
图6 LG-EO 对副溶血性弧菌ATP 酶活性的影响
Fig.6 Effects of LG-EO on ATPase activity of V.parahaemolyticus
2.5 DNA 含量和结构
LG-EO 处理后VP 基因组DNA 琼脂糖凝胶电泳如图7a 所示,经不同浓度的LG-EO 处理2 h 后,VP 17802 和VP HZ 基因组DNA 核酸条带明显变暗,特别是240 μg/mL LG-EO 处理的,几乎使大于10 000 bp 的核酸条带消失。表明LGEO 作用下,VP 的DNA 含量显著下降,可能的原因是细胞膜通透性增大,使DNA 泄漏至细胞外,或者DNA 的合成途径被抑制,导致处理组的基因组DNA 含量明显低于对照组。
LG-EO 成分复杂,主要成分为柠檬醛[9]。通过紫外吸收光谱探究柠檬醛与副溶血性弧菌DNA的相互作用。有研究表明,化合物与DNA 相互作用后,若出现红移 (Red-shift) 和减色效应(Hypochromic effect),则表明化合物与DNA 之间有嵌入结合作用;若出现蓝移(Blue-shift)和增色效应(Hyperchromic effect),表明两者之间是静电作用[21]。分别取5μL VP 17802 和VP HZ 的DNA与柠檬醛作用,如图7b 所示,均出现一定程度的红移和减色现象,柠檬醛的最大吸收峰在244 nm处,而加入副溶血性弧菌DNA 的柠檬醛吸收峰红移到242 nm 处,减色幅度VP 17802>VPHZ,在最大吸收峰处的吸光度分别下降了9.9%和6.6%。说明柠檬醛嵌入VP 的DNA 中与其相互作用,导致DNA 结构发生变化,进而影响VP 一系列的生理活动。
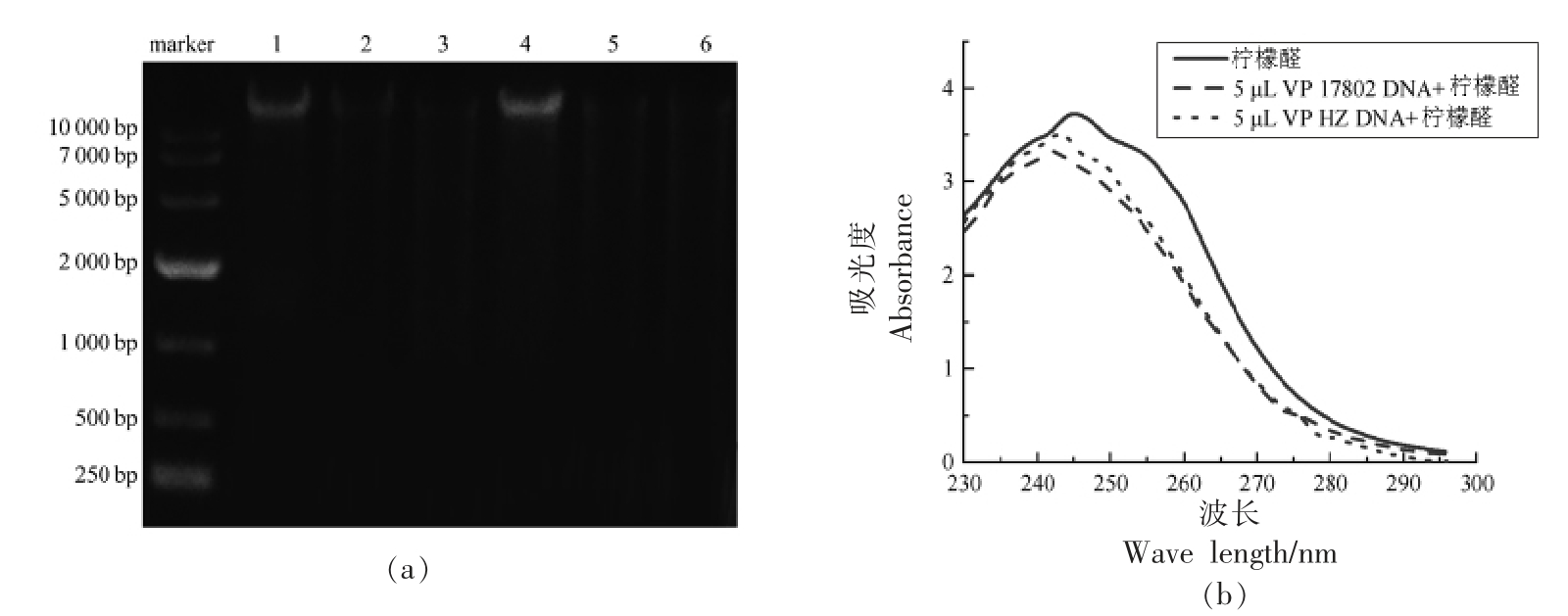
图7 LG-EO 处理对副溶血性弧菌DNA 含量和结构的影响
Fig.7 Effects of LG-EO treatment on the DNA content and structure of V.parahaemolyticus
注:a.1、2、3 泳道分别为VP 17802 对照组,120 μg/mL LG-EO 处理组,240 μg/mL LG-EO 处理组;4、5、6 泳道分别是VP HZ 对照组,120 μg/mL LG-EO 处理组,240 μg/mL LG-EO 处理组。
3 讨论
3.1 精油对副溶血性弧菌的抑杀活性
精油(EOs)是美国食品和药物管理局公认的天然安全产品[22],其对食源性病原体具有抗菌作用,有望成为化学消毒剂的天然抗菌替代品。本文探究LG-EO 对不同来源的VP 的抑菌活性,结果显示:VP 17802 菌株最为敏感,LG-EO 对其MIC仅为80 μg/mL,其次是来源于水产品的VP WT和临床的VP HZ,MIC 分别为100 μg/mL 和120 μg/mL。Ashrafudoulla 等[23]报道丁香酚对VP 的8株环境分离株和2 株临床分离株的MIC 分别为0.15%和1%(体积分数),相同浓度的丁香酚处理导致临床分离株更多的细胞灭活和核酸蛋白泄漏。不同环境压力和分离来源会影响菌株对抑菌物质的敏感性。另外,不同的VP 分离株所含毒力基因也有差异,流行病学研究表明,大多数临床分离株含有tdh 和trh 基因,而环境分离株很少携带毒力基因[24]。含有较多毒力基因可能会提高菌株对环境压力和抑菌物质的适应性。VP HZ 作为临床分离株,其较高MIC 可能与携带多个毒力基因有关。
时间-杀伤试验结果显示,VP 17802 在MIC浓度下处理20 min 即可使活菌数量下降1 lg(CFU/mL),而超过240 μg/mL 的LG-EO 处理3株VP 10 min,无活菌可检出,表明LG-EO 对VP有很强的抑杀活性。Mizan 等[25]报道丁香油、百里香油和大蒜油对VP 的MIC 分别为0.06%~0.07%,0.02%和0.09%,4MIC 丁香油、百里香油处理VP 10 min,4MIC 大蒜油处理VP 20 min 即可完全灭活细胞,与本文的研究结果类似。同样,丁香酚3MIC(0.3%)处理VP 5 min 也无活菌可检出[23]。这些研究说明不同种类的精油(EOs)对副溶血性弧菌都有较好的抑制效果,可成为控制这种致病性弧菌的有效方式。
3.2 LG-EO 破坏细菌细胞壁膜完整性
经LG-EO 处理后,VP 胞外的AKP 活性、蛋白质泄露量及电导率均高于对照组,说明VP 的细胞壁和细胞膜在LG-EO 作用下完整性严重受损,导致细胞膜通透性增高,细胞内容物流出。用TEM 观察到LG-EO 使VP 细胞膜破损、溶解,大量内容物流出,显示内部空化现象。维持离子稳态对于保障细胞的能量状态是非常重要的,因为它对能量相关的过程,如溶质运输、代谢控制、膨压和运动的活动具有重要意义[26]。郭都等[27]通过测定LIVE/DEADR试剂盒中所含的两种染料 (SYTO 9和PI)与细胞膜完整及不完整菌体核酸结合后所产生的特异性荧光,来分析反式肉桂醛对VP 细胞膜完整性的影响,结果发现2MIC(100 μg/mL)的反式肉桂醛使VP 细胞膜损伤比例达到29.9%(P<0.01),VP 菌体呈现轻度皱缩且中心凹陷和不同程度的干瘪皱缩。Cao 等[28]发现柠檬醛以MIC(125 μg/mL)处理副溶血性弧菌10 h 后,培养基中的葡萄糖和戊二醛含量分别增加32.74%和2.68倍,扫描电镜显示细胞明显变形,并随柠檬醛浓度的增加,细胞完整性丧失,甚至破裂。Zhang 等[29]用肉桂精油处理金黄色葡萄球菌和大肠杆菌时,发现大肠杆菌出现细胞壁膜分离、溶解,细胞质内容物泄漏、极化和细胞畸变的现象。可见,LG-EO能破坏细胞壁膜,使其通透性提高,重要生物大分子和离子泄漏出细胞,进而影响一系列生理活动。
3.3 LG-EO 扰乱细菌能量代谢
细胞在静息状态下存在于细胞膜两侧的电位差称为膜电位(MP),正常的膜电位对细胞存活和必需营养物质的运输是必不可少的[30]。通过测定膜电位可以判定LG-EO 导致副溶血性弧菌细胞膜去极化,从而引起细胞代谢活性异常和细菌死亡。郭俸钰等[31]观察到芳樟醇(5 mL/L)使大肠杆菌膜电位下降近85%。Lu 等[32]使用特异性荧光染料DiBAC4 (3) 来跟踪百里香酚对阪崎肠杆菌膜电位的影响,发现百里香酚浓度从MIC(1.25 mg/mL)增加到2MIC,荧光强度相应增强(P≤0.01),出现去极化现象。这种现象主要是由于pH 值的改变和离子运动引起的,特别是K+或K+与其它几种离子的扩散,导致膜内外离子浓度差异更大,膜电位更负[33]。同样,用芳樟醇处理铜绿假单胞菌和黑胡椒精油处理大肠杆菌也观察到类似的结果[13,34]。LG-EO 还导致VP 细胞内呼吸链脱氢酶和ATPase 的活性降低(P<0.05),提示LG-EO 可以破坏VP 的呼吸链,使细菌因缺乏能量而死亡。而ATP作为最直接的通用能量,其ATP 酶活性的降低可能导致ATP 从病原体流出,并阻碍呼吸代谢[35]。Na+/K+-ATP 酶在Na+和K+的跨膜转运以及维持细胞膜的通透性中起着至关重要的作用[36],其活性的快速降低可能导致细胞膜内、外H+梯度的差异,从而改变细胞膜的通透性。Ca2+-ATP 酶可以催化质膜内侧ATP 的水解,这对于释放能量和维持细胞内低浓度的游离Ca2+具有重要意义[37]。Han等[38]报道单增李斯特菌的两种ATP 酶活性在柠檬烯作用下24 h 内持续下降,并且ATP 的浓度也显著下降(P<0.05)。以上结果说明LG-EO 作为一种抑菌剂,使VP 细胞膜通透性增加,大量细胞内容物包括蛋白质和电解质外渗出细胞,降低产生能量相关酶活性,生理代谢活动受到重要的影响,细胞生长和繁殖所需的能量和关键物质无法及时合成,最终导致细胞死亡。
3.4 LG-EO 作用于细菌DNA
LG-EO 也影响副溶血性弧菌的基因组DNA。在LG-EO 的作用下基因组DNA 的琼脂糖凝胶电泳条带变暗甚至消失,表明LG-EO 的存在导致VP 无法正常合成生长繁殖所需的DNA。此外,副溶血弧菌的DNA 还可与LG-EO 主要成分柠檬醛发生作用,柠檬醛嵌合进VP 的DNA,导致紫外吸收光谱的红移和减色。由此推断,柠檬醛可与VP的DNA 相互作用导致其结构的改变,从而阻碍DNA 的合成和相关的多种生理活动。山苍子精油抑制金黄色葡萄球菌和大肠杆菌也有相似的DNA 改变现象[39-40]。
LG-EO 以来源广泛、价格低廉,不易产生耐药性的优势已在食品加工、医药等行业中应用。利用LG-EO 或柠檬醛制成食品保鲜剂,或与其它环境友好的抑菌剂协同应用于食品保鲜中具有良好前景。
4 结论
LG-EO 对副溶血性弧菌有较好的抑菌活性,在高于MIC 的处理下短时间内即可有效灭活VP。LG-EO 作用于细胞壁和细胞膜,导致细胞膜的渗透性增加,细胞内容物流出,降低了细胞膜电位,生理代谢功能紊乱,影响一系列关键胞内酶活性,干扰VP 细胞的正常功能。同时,细胞内重要的生命大分子DNA 也大量流失,与柠檬醛发生相互作用,导致细胞无法生长繁殖。本研究为LG-EO 作为天然抑菌物质控制食品中的副溶血性弧菌提供了理论依据。
[1]LETCHUMANAN V,CHAN K G,LEE L H.Vibrio parahaemolyticus:a review on the pathogenesis,prevalence,and advance molecular identification techniques[J].Frontiers in Microbiology,2014,5(11):705.
[2]BROBERG C A,CALDER T J,ORTH K.Vibrio parahaemolyticus cell biology and pathogenicity determinants[J].Microbes and Infection,2011,13(12):992-1001.
[3]LOPATEK M,WIECZOREK K,OSEK J.Prevalence and antimicrobial resistance of Vibrio parahaemolyticus isolated from raw shellfish in Poland[J].Journal of Food Protection,2015,78 (5):1029-1033.
[4]HAN N,MIZAN M F R,JAHID I K,et al.Biofilm formation by Vibrio parahaemolyticus on food and food contact surfaces increases with rise in temperature[J].Food Control,2016,70(1):161-166.
[5]NDRAHA N,HSIAO H I.Influence of climatic factors on the temporal occurrence and distribution of total and pathogenic Vibrio parahaemolyticus in oyster culture environments in Taiwan[J].Food Microbiology,2021,98(9):103765.
[6]YANG Y,XIE J F,LI H,et al.Prevalence,antibiotic susceptibility and diversity of Vibrio parahaemolyticus isolates in seafood from South China[J].Front Microbiol,2017,8(12):2566.
[7]ISMAN M B.Plant essential oils for pest and disease management[J].Crop Protection,2000,19(8/9/10):603-608.
[8]郭长江,韦京豫,杨继军,等.66 种蔬菜、水果抗氧化活性的比较研究[J].营养学报,2003,25(2):203-207.GUO C J,WEI J Y,YANG J J,et al.Comparative study of antioxidant activities of 66 vegetables and fruits[J].Acta Nutrimenta Sinica,2003,25(2):203-207.
[9]许泽文,李环通,王绮潼,等.柠檬草精油成分分析、抑菌性及对巨峰葡萄保鲜研究[J].食品研究与开发,2020,41(1):51-59.XU Z W,LI H T,WANG Q T,et al.Analysis of volatile components,antibacterial activity and perseveration on kyoho grapes of lemongrass essential oil[J].Food Research and Development,2020,41(1):51-59.
[10]ADUKWU E C,BOWLES M,EDWARDS V,et al.Antimicrobial activity,cytotoxicity and chemical analysis of lemongrass essential oil (Cymbopogon flexuosus) and pure citral[J].Applied Microbiol Biotechnol,2016,100(22):9619-9627.
[11]ELEXSON N,SON R,RUKAYADI Y,et al.Biosafety of Vibrio parahaemolyticus biofilm from seafood using herbs and spices[J].Journal of Life Medicine,2013,1(10):71-82.
[12]艾启俊,于庆华,张红星,等.鹿蹄草素对金黄色葡萄球菌的抑制作用及其机理研究[J].中国食品学报,2007,7(2):33-37.AI Q J,YU Q H,ZHANG H X,et al.Studies on bacteriostatic action and antimicrobial mechanism of Pyrolin against Staphylococcus aureus[J].Journal of Chinese Institute of Food Science and Technology,2007,7(2):33-37.
[13]LIU X,CAI J X,CHEN H M,et al.Antibacterial activity and mechanism of linalool against Pseudomonas aeruginosa[J].Microbial Pathogenesis,2020,141(4):103980.
[14]CUI H Y,ZHANG C H,LI C Z,et al.Antibacterial mechanism of oregano essential oil[J].Industrial Crops and Products,2019,139(11):111498.
[15]KANG S M,KONG F H,SHI X Y,et al.Antibacterial activity and mechanism of lactobionic acid against Pseudomonas fluorescens and Methicillin-resistant Staphylococcus aureus and its application on whole milk[J].Food Control,2020,108(2):106876.
[16]CAO J R,FU H J,GAO L H,et al.Antibacterial activity and mechanism of lactobionic acid against Staphylococcus aureus[J].Folia Microbiologica,2019,64(6):899-906.
[17]DIAO M M,QI D P,XU M M,et al.Antibacterial activity and mechanism of monolauroyl-galactosyl glycerol against Bacillus cereus[J].Food Control,2018,85(1):339-344.
[18]CUI H Y,ZHANG C H,LI C Z,et al.Antimicrobial mechanism of clove oil on Listeria monocytogenes[J].Food Control,2018,94(1):140-146.
[19]RAMZAN R,STANIEK K,KADENBACH B,et al.Mitochondrial respiration and membrane potential are regulated by the allosteric ATP-inhibition of cytochrome c oxidase[J].Biochimica et Biophysica Acta(BBA)-Bioenergetics,2010,1797(9):1672-1680.
[20]PATEL A,MALINOVSKA L,SAHA S,et al.ATP as a biological hydrotrope[J].Science,2017,356(6339):753-756.
[21]WANG H T,ZOU D,XIE K P,et al.Antibacterial mechanism of fraxetin against Staphylococcus aureus[J].Mol Med Rep,2014,10(5):2341-2345.
[22]DE JESUS I C,SANTOS FRAZÃO G G,BLANK A F,et al.Myrcia ovata Cambessedes essential oils:A proposal for a novel natural antimicrobial against foodborne bacteria[J].Microbial Pathogenesis,2016,99(10):142-147.
[23]ASHRAFUDOULLA M,MIZAN M,HA J W,et al.Antibacterial and antibiofilm mechanism of eugenol against antibiotic resistance Vibrio parahaemolyticus[J].Food Microbiology,2020,91(10):103500.
[24]LI L Z,MENG H M,GU D,et al.Molecular mechanisms of Vibrio parahaemolyticus pathogenesis[J].Microbiological Research,2019,222(5):43-51.
[25]MIZAN M F R,ASHRAFUDOULLA M,HOSSAIN M I,et al.Effect of essential oils on pathogenic and biofilm-forming Vibrio parahaemolyticus strains[J].Biofouling,2020,36(4):467-478.
[26]COX S D,MANN C M,MARKHAM J L,et al.Determining the antimicrobial actions of tea tree oil[J].Molecules,2001,6(2):87-91.
[27]郭都,张文婷,郝旭昇,等.反式肉桂醛对副溶血性弧菌的抑制作用[J].食品与生物技术学报,2020,39(1):14-23.GUO D,ZHANG W T,HAO X S,et al.Antimicrobial activity of trans-cinnamaldehyde against Vibrio parahaemolyticus[J].Journal of Food Science and Biotechnology,2009,39(1):14-23.
[28]CAO J J,LIU H,WANG Y,et al.Antimicrobial and antivirulence efficacies of citral against food borne pathogen Vibrio parahaemolyticus RIMD2210633[J].Food Control,2021,120(1):107507.
[29]ZHANG Y B,LIU X Y,WANG Y F,et al.Antibacterial activity and mechanism of cinnamon essential oil against Escherichia coli and Staphylococcus aureus[J].Food Control,2016,59(1):282-289.
[30]YUN D G,LEE D G.Silymarin exerts antifungal effects via membrane-targeted mode of action by increasing permeability and inducing oxidative stress[J].Biochimica et Biophysica Acta (BBA)-Biomembranes,2017,1859(3):467-474.
[31]郭俸钰,陈文学,陈海明,等.芳樟醇对大肠杆菌的抑菌作用机制[J].现代食品科技,2020,36(4):113-118.GUO F Y,CHEN W X,CHEN H M,et al.Antibacterial mechanism of linalool against Escherichia coli[J].Modern Food Science and Technology,2020,36(4):113-118.
[32]TIAN L,WANG X Y,LIU R J,et al.Antibacterial mechanism of thymol against Enterobacter sakazakii[J].Food Control,2021,123(5):107716.
[33]SILVERMAN J A,PERLMUTTER N G,SHAPIRO H M.Correlation of daptomycin bactericidal activity and membrane depolarization in Staphylococcus aureus[J].Antimicrobial Agents and Chemotherapy,2003,47(8):2538-2544.
[34]ZHANG J,YE K P,ZHANG X,et al.Antibacterial activity and mechanism of action of black pepper essential oil on meat-borne Escherichia coli[J].Front Microbiol,2016,7(1):2094.
[35]SUN X H,ZHOU T T,WEI C H,et al.Antibacterial effect and mechanism of anthocyanin rich Chinese wild blueberry extract on various foodborne pathogens[J].Food Control,2018,94(1):151-156.
[36]LEBRUN P,MALAISSE W J,HERCHUELZ A.Na+--K+ pump activity and the glucose-stimulated Ca2+-sensitive K+ permeability in the pancreatic Bcell[J].The Journal of Membrane Biology,1983,74(1):67-73.
[37]LIN L,GU Y L,LI C Z,et al.Antibacterial mechanism of ε -poly-lysine against Listeria monocytogenes and its application on cheese[J].Food Control,2018,91(1):76-84.
[38]HAN Y J,SUN Z C,CHEN W X.Antimicrobial susceptibility and antibacterial mechanism of limonene against Listeria monocytogenes[J].Molecules,2019,25(1):33.
[39]DAI J M,LI C Z,CUI H Y,et al.Unraveling the anti-bacterial mechanism of Litsea cubeba essential oil against E.coli O157:H7 and its application in vegetable juices[J].International Journal of Food Microbiol,2021,338(1):108989.
[40]HU W,LI C Z,DAI J M,et al.Antibacterial activity and mechanism of Litsea cubeba essential oil against methicillin -resistant Staphylococcus aureus(MRSA)[J].Industrial Crops and Products,2019,130(4):34-41.