桃果易受机械损伤,储运性差,市场上常以加工食品出售,例如:桃汁、桃子罐头、果酒、果脯[1]。桃加工食品在生产过程中会产生大量的桃仁副产物,若能高效开发利用,将其变废为宝,不仅保护环境,而且可以减少生物质资源的浪费。桃仁(Semen persicae)含脂肪油类、蛋白质和氨基酸、苷类、矿物质、纤维素等药用和营养成分[2],常与红花(Carthami flos)配伍作为活血化瘀常用药,具有悠久的临床应用历史[3-4]。
苦杏仁苷是桃仁的主要药用成分[5],广泛存在于桃子等核果的种子中,含量高达6%[6-7]。多年来,苦杏仁苷除了具有中医学所说的止咳平喘的功效外,还具有抗纤维化[8],辅助抗癌[9],抗动脉粥样硬化[10-11],抗心肌肥厚[12],降血脂[13]、降血糖[14]和抗凝血[15]作用等生理功效。将桃仁中的苦杏仁苷进行分离提纯,对其抗凝血、降血脂、降血糖等生理功能进行探究,明确其构效关系,并开发相应功能产品,将具有较好的应用前景。
本文采用冷冻干燥、热风干燥、微波干燥分别对‘北京14 号’白桃桃仁进行干燥处理,以乙醇体积分数、超声温度、超声时间为单因素参数,研究桃仁苦杏仁苷提取工艺,并做响应面法设计试验,明确桃仁中苦杏仁苷的最佳提取工艺参数。同时对其抗凝血、降血脂和降血糖活性进行体外研究,为桃仁的综合开发利用提供参考。
1 材料与方法
1.1 材料与试剂
‘北京14 号’白桃新鲜桃仁,浙江丰岛食品股份有限公司;苦杏仁苷标准品,Sigma;乙醇、石油醚(沸程60~90 ℃),上海凌峰化学试剂有限公司;色谱级甲醇,TEDIA;α-淀粉酶,麦克林;α-葡萄糖苷酶、牛磺酸胆酸盐、甘氨酸胆酸盐,上海源叶;胰脂肪酶、对硝基苯基-β-D-吡喃半乳糖苷(pNPG)、月桂酸4-硝基苯酯,阿拉丁。
1.2 仪器与设备
DGG-9070A 立式电热恒温鼓风干燥箱,上海森信公司;Free Zone 冻干机,美国Labconco 公司;Waters e2695 分析型高效液相色谱仪,美国Waters 公司;KQ-5200DE 超声清洗器,昆曲市超声仪器有限公司;UV-9000 紫外分光光度计,上海元析仪器;Spark 10M 多功能酶标仪,瑞士TECAN公司;全自动凝血分析仪UP1500,上海太阳生物技术有限公司。
1.3 试验方法
1.3.1 绘制苦杏仁苷标准曲线 准确称取苦杏仁苷标准品用甲醇配制成不同质量浓度标准溶液,通过高效液相色谱法测定不同质量浓度标准溶液的相应峰面积绘制标准曲线[16]。色谱柱:Eclipse XDB-C18 柱(4.6 mm×250 mm,5 μm);流动相:以甲醇∶水(2∶8),等度洗脱30 min;检测波长:217 nm;流速:1.0 mL/min;柱温:30 ℃;进样量20 μL。苦杏仁苷标准曲线:Y=9206.9X+75703(R2=0.9998),式中,X——苦杏仁苷标准品的质量浓度(μg/mL);Y——峰面积。
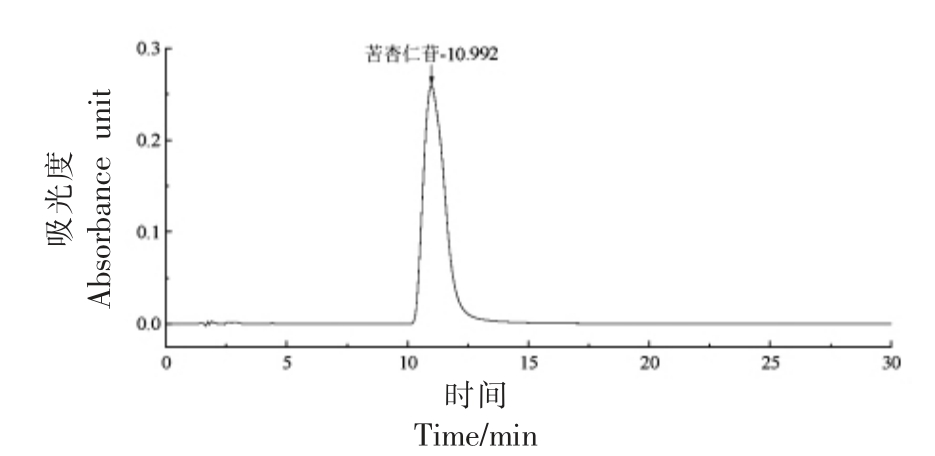
图1 苦杏仁苷高效液相图谱
Fig.1 HPLC chromatogram of amygdalin
1.3.2 桃仁干燥及苦杏仁苷提取工艺 将白桃桃仁洗净后,立即采用以下3 种干燥方式将桃仁进行干燥。
1)冷冻干燥 将桃仁置于干燥托盘,于-80℃预冻后,放入冻干机中,0.01 kPa,-80 ℃干燥48 h。
2)热风干燥 将桃仁置于50 ℃热风干燥箱,烘至完全干燥。
3)微波干燥 将桃仁置于微波炉中,间歇干燥10 min 至完全干燥。
将干燥后的桃仁研磨成粉末过筛,样品与石油醚料液比(g/mL)为1∶5,重复2 次石油醚脱脂,真空过滤,滤渣于通风橱中将石油醚挥干,固定桃仁与乙醇液料比(g/mL)为1∶14,之后进行超声提取,真空抽滤,滤液即苦杏仁苷提取液。
苦杏仁苷提取率计算公式:

将滤液通过旋转蒸发仪浓缩,将浓缩液进行冷冻干燥得到苦杏仁苷粉末,纯度为51%。干燥器保存,使用时用生理盐水溶解,配制成所需浓度溶液。
1.3.3 单因素实验 超声提取采用设置不同乙醇体积分数(60%,70%,80%,90%,100%)、提取温度(50,60,70,80,90 ℃)、提取时间(10,20,30,40,50,60 min),通过改变工艺参数,考察乙醇体积分数、提取温度、提取时间对苦杏苷得率的影响。
1.3.4 Box-Behnken 试验设计 选定一种干燥方式,在单因素实验的基础上建立3 因素模型,以苦杏仁苷提取率为响应值,基于Box-Behnken 试验设计原理,设计响应面优化试验,试验后对响应面结果进行分析[17]。
1.3.5 体外抗凝血 参照王辰龙等[18]的方法,取小鼠血浆1.80 mL,加入200 μL 白桃桃仁苦杏仁苷溶液,以生理盐水作为空白对照。37 ℃温育2 min 后,加入促凝血酶原,温育2 min 后加入20 mmol/L CaCl2 0.1 mL 混匀,使用全自动凝血分析仪测定活化部分凝血酶时间(APTT)、凝血酶原时间(PT)、凝血酶时间(TT)和纤维蛋白原(FIB)含量。
1.3.6 体外降血脂
1.3.6.1 胰脂肪酶抑制率 胰脂肪酶用缓冲液溶解配制成0.25 mg/mL 胰脂肪酶溶液,称取月桂酸4-硝基苯酯溶解于乙醇,用缓冲液稀释得到10 mmol/mL 的底物溶液。参照王远等[19]的反应体系,37 ℃温育20 min 后,用酶标仪在405 nm 波长下测定吸光度。胰脂肪酶的抑制率按公式(2)计算:
式中,A——对照试验组的吸光值;a——对照空白组的吸光值;B——样品试验组的吸光值;b——样品空白组的吸光值。
1.3.6.2 胆酸盐结合率 参照芦宇等[20]的方法,分别移取3 mL 苦杏仁苷溶液2 份于100 mL 三角瓶中,模拟胃消化1 h,用0.1 mol/L 的NaOH 溶液调节pH 值至6.3,模拟肠道消化1 h。取其中1 份样品于三角瓶中加入4 mL 0.3 mmol/L 甘氨酸胆酸钠(牛磺酸胆酸盐)。在37 ℃下继续振荡1 h,离心取上清液,用比色法测定387 nm 波长处吸光度。按公式(3)计算:
式中,A0——空白对照试验组的吸光值;A1——样品试验组的吸光值。
1.3.7 体外降血糖活性分析
1.3.7.1 α-淀粉酶抑制活性 根据严尚隆等[21]的方法测定。移取不同浓度的苦杏仁苷溶液250 μL至试管,加入0.25 μL 1%α-淀粉酶溶液。37 ℃水浴10 min 后,加入0.5 mL 1%淀粉溶液。继续水浴20 min,再加入1 mL DNS 溶液煮沸5 min 后,定容至10 mL。冷却至室温,在540 nm 波长处测定吸光值,抑制活性按公式(4)计算:
式中,A1——α-淀粉酶溶液+样品+淀粉溶液+DNS 溶液的吸光值;A2——水+样品+淀粉溶液+DNS 溶液;A3——α-淀粉酶溶液+生理盐水+淀粉溶液+DNS 溶液的吸光值;A4——水+水+淀粉溶液+DNS 溶液的吸光值。
1.3.7.2 α-葡萄糖苷酶抑制活性 参考蔡思学等[22]的方法测定。200 μL 苦杏仁苷溶液中加入200 μL α-葡萄糖苷酶溶液。37 ℃水浴15 min,再加入200 μL pNPG 溶液。继续37 ℃水浴25 min,加入5 mL Na2CO3 溶液终止反应。冷却至室温,在405 nm 波长处测得吸光值A1。将酶液替换为水,测得A2。样品溶液换成水,作空白对照A0。抑制活性按公式(5)计算:
1.3.8 生物信息学分析 α-淀粉酶、α-葡萄糖苷酶和胰脂肪酶的晶体结构来自PDB 数据库(PDB ID:3VM7、3W38、1GPF)。在PubChem 上下载小分子苦杏仁苷的结构(PubChem CID:656516)。参照齐燕娇等[23]的方法进行分子对接,选取能量最小的构象结果做进一步分析。
1.4 数据处理
使用Origin 2018 软件作图,所有数据用SPSS 24 软件进行统计处理,并采用ANAVO 检验进行显著性分析(P<0.05 表示差异显著),多重比较采用LSD-t 检验。
2 结果与分析
2.1 单因素优化苦杏仁苷提取工艺
由图2a 可知,苦杏仁苷提取率随乙醇体积分数的增加呈先上升后下降的趋势,乙醇体积分数大于70%后,对苦杏仁苷提取率影响不大,微波干燥和热风干燥的桃仁在80%乙醇下提取,苦杏仁苷得率最高,而冷冻干燥的苦杏仁苷提取率在90%乙醇提取下最高。由图2b 可知,提取温度对苦杏仁苷提取率的影响与不同乙醇体积分数提取相类似,呈先上升后下降的趋势,70~80 ℃为最佳提取温度范围。由图2c 可知,超声时间大于30 min 后,提取率无明显变化,20~40 min 的超声处理已经基本将苦杏仁苷提取完全。综合单因素实验结果,微波干燥后的桃仁苦杏仁苷提取率明显优于热风干燥和冷冻干燥。
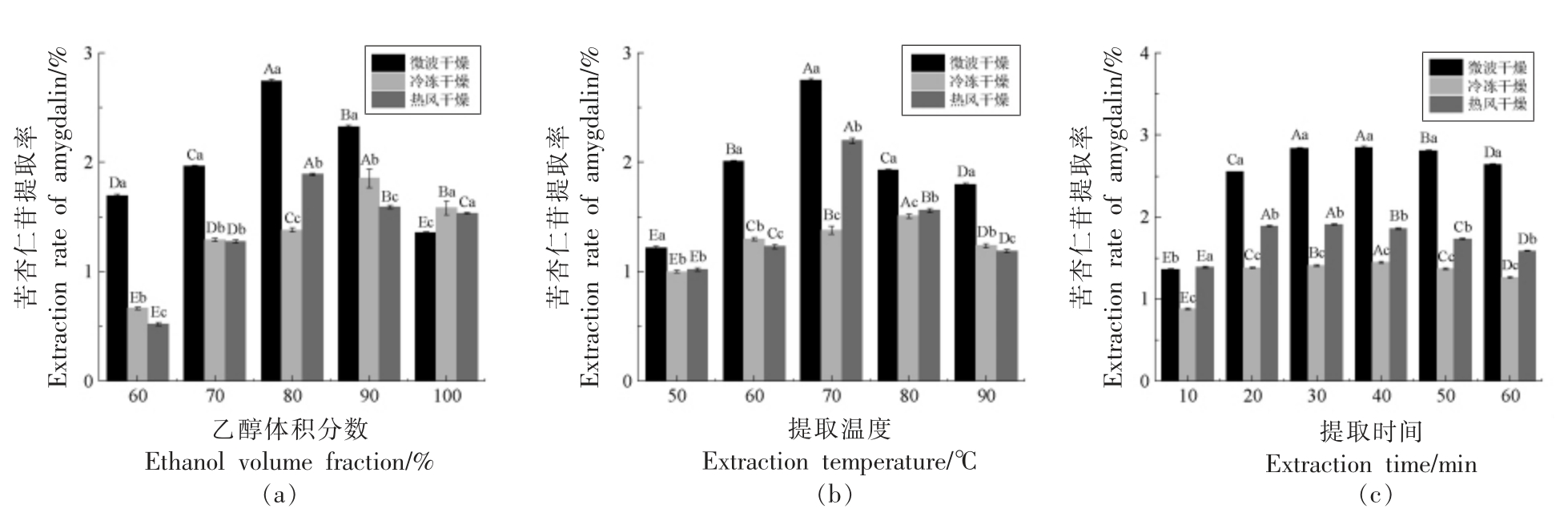
图2 不同因素对桃仁苦杏仁苷提取率的影响
Fig.2 Effects of different factors on the extraction rate of amygdalin from peach kernel
注:不同小写字母表示同一提取工艺不同干燥方式不同组别差异显著(P<0.05),不同大写字母表示同一干燥方式不同提取工艺相同组别差异显著(P<0.05)。
2.2 响应面优化苦杏仁苷提取工艺
结合单因素试验结果选定微波干燥方式干燥桃仁,并采用响应面法对桃仁中苦杏仁苷的提取工艺进行优化,得出桃仁苦杏仁苷提取响应面试验结果。利用Design Expert 软件进行分析,得到苦杏仁苷提取率(Y)对乙醇体积分数(A)、提取温度(B)、提取时间(C)的二次多项回归方程为:Y=3.672+0.055A-0.18375B-0.06375C+0.0125AB-0.1875AC-0.105BC-1.6735A2-0.711B2-0.011C2,试验所选用模型P<0.0001,决定系数R2=0.9987>0.8,失拟不显著(P=0.768003>0.05),说明方程的拟合情况较好。由表2 可知,A 和C 的一次项系数的P 值小于0.05,B 的P 值小于0.001,说明A 和C 对响应值影响显著,B 极显著。各因素与响应值之间不是简单的线性关系,且各因素存在交互作用。
表1 Box-Behnken 试验设计及结果
Table 1 Results of Box-Behnken design tests
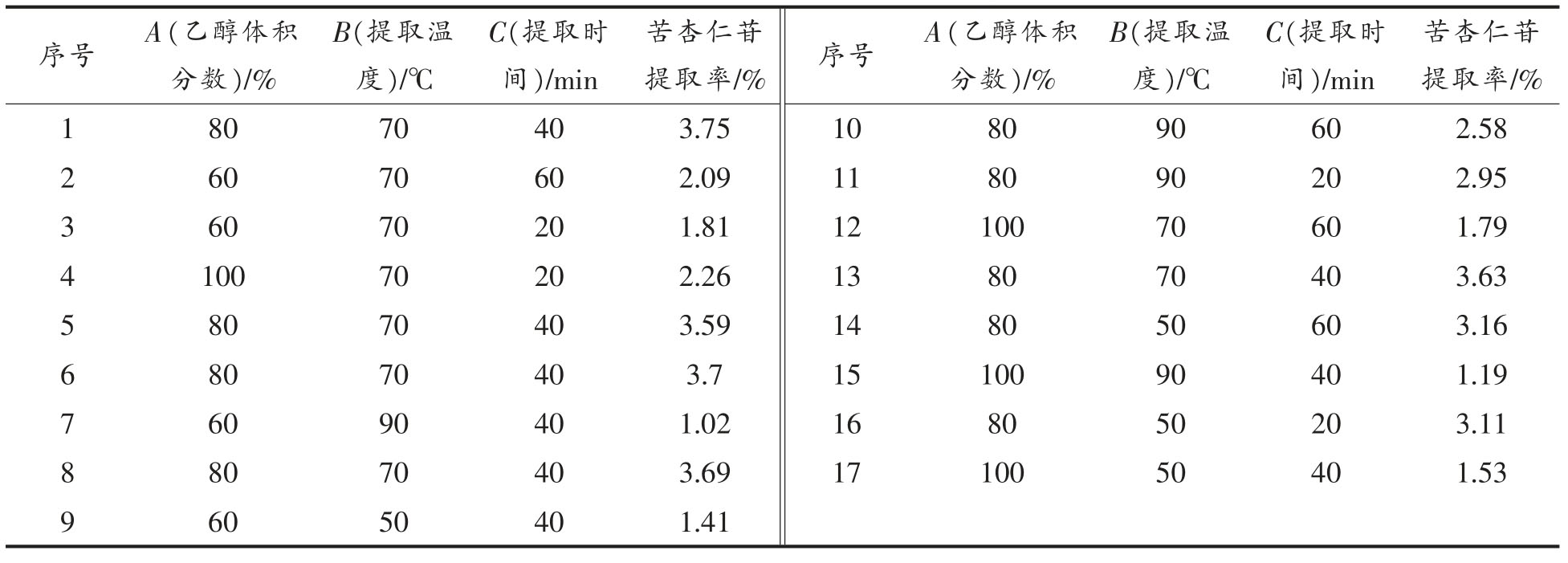
表2 回归方差分析结果
Table 2 Analysis of variance for the fitted regression model
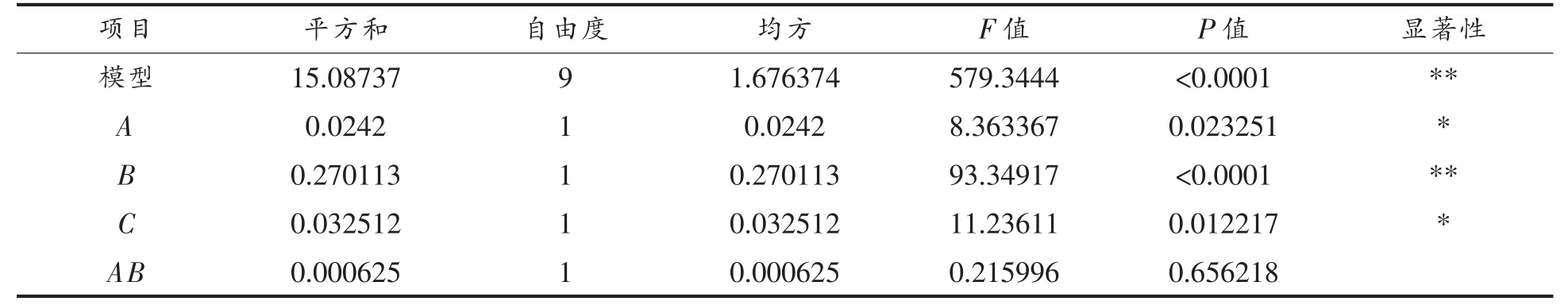
(续表2)
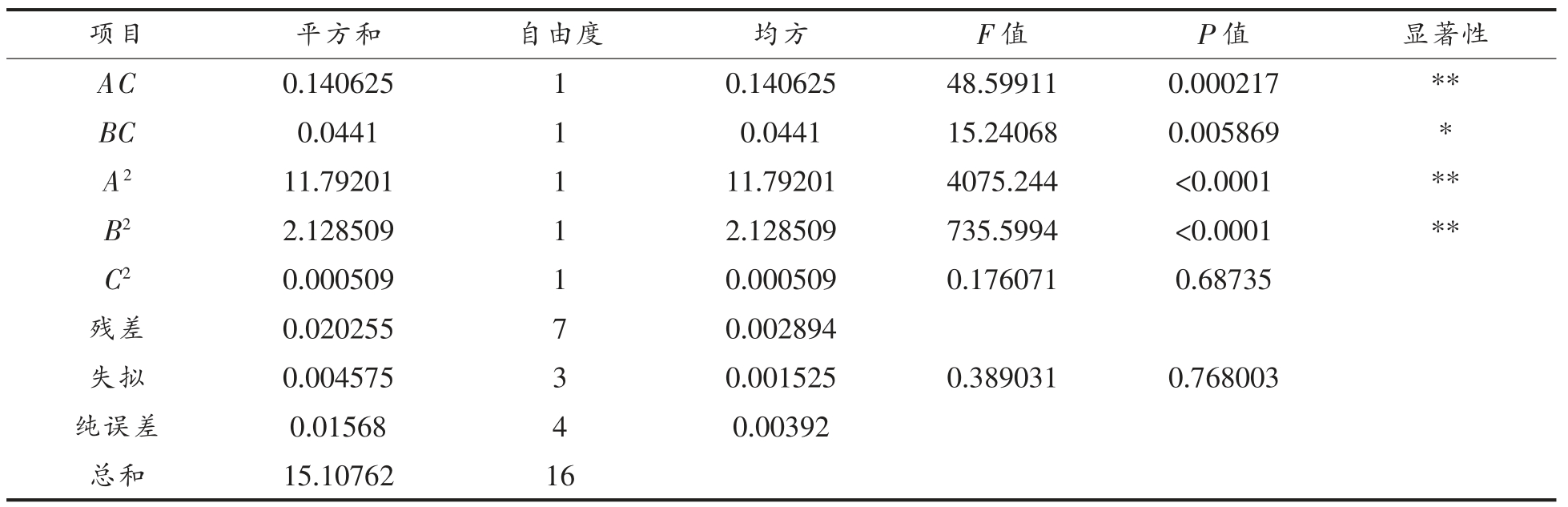
注:*.差异显著(P<0.05);**.差异极显著(P<0.01)。回归系数R2=0.9987,R2Adj=0.9969。
根据回归方程获得的响应面和等高线图,能直观反映各因素之间交互作用的强弱[24]。如图3所示,因素A 和C,因素B 和C 之间的响应面图的曲面较陡,等高线图趋于椭圆,交互作用明显。因素A 和B 的响应面图曲面较平,等高线图趋于圆形,交互作用较小。乙醇体积分数对应的曲面较陡,说明其对苦杏仁苷提取率的影响最为显著。采用响应面优化获得的工艺条件(乙醇体积分数81.43%,提取温度68.91 ℃,提取时间20.00 min)提取白桃桃仁中的苦杏仁苷,进行验证性试验,重复3 次,得到实际苦杏仁苷提取率为(3.61±0.05)%,与预测提取率3.74%无显著性差异,证明该方程具有准确性和实用性[25]。
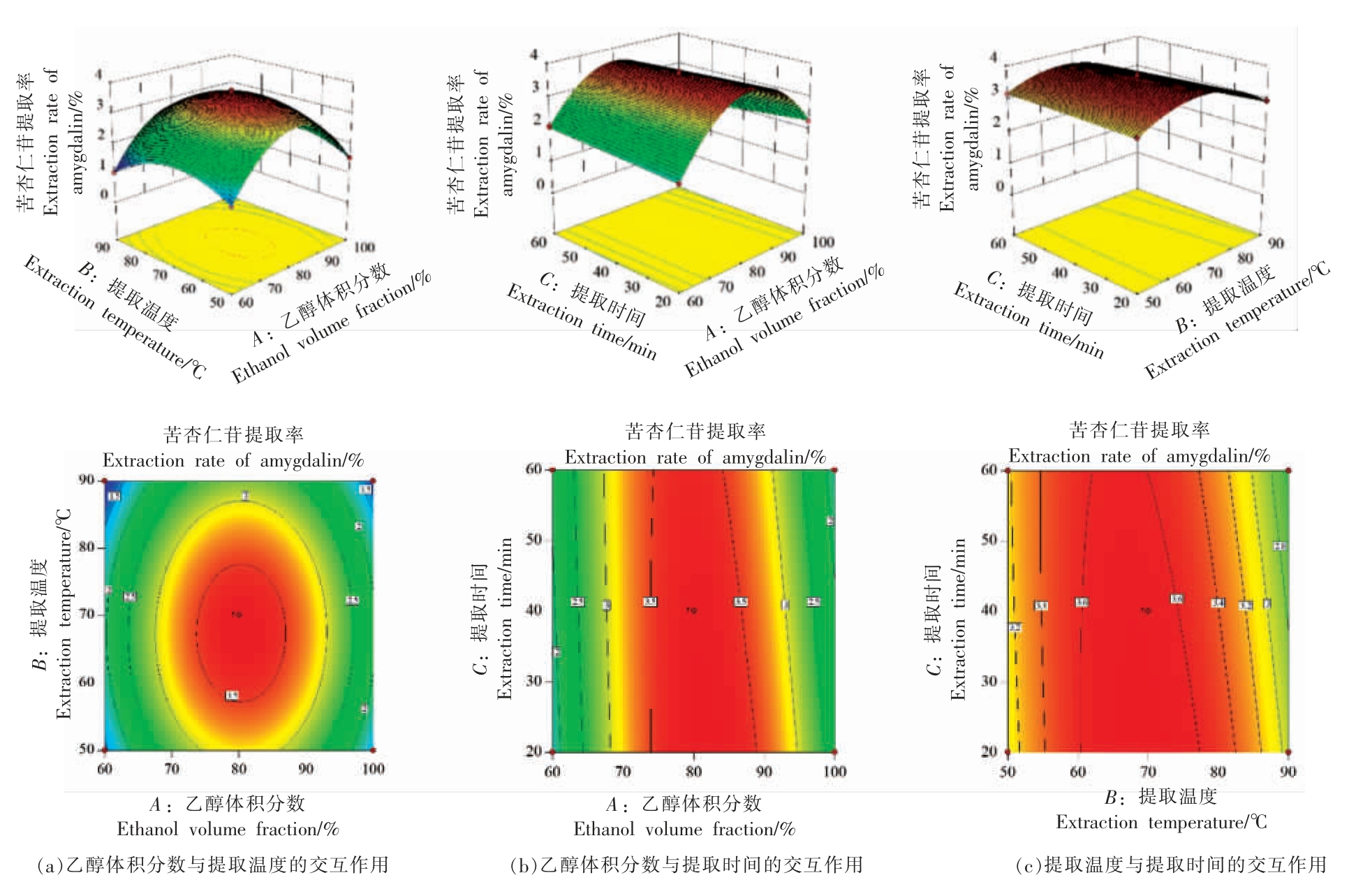
图3 各两因素交互作用对苦杏仁苷提取率的影响
Fig.3 Effect of two interactions on the extraction rate of amygdalin
2.3 桃仁苦杏仁苷体外抗凝血活性
药物主要通过对凝血途径的激活和抑制来影响机体的凝血系统,凝血4 项的变化可以反应机体凝血系统的病理变化[26],即活化部分凝血酶时间(APTT)、凝血酶时间(TT)、凝血酶原时间(PT)和纤维蛋白原含量(FIB)。由表3 可知,苦杏仁苷对APTT、PT、TT 和FIB 的影响与其浓度存在一定关系。与空白对照相比,苦杏仁苷质量浓度在15~100 mg/mL 时,可显著延长APTT。除50 mg/mL 外,苦杏仁苷可延长TT。苦杏仁苷可降低PT,且随质量浓度变化呈先上升后下降的趋势。在质量浓度低于25 mg/mL 和大于100 mg/mL 时,可降低小鼠血浆的FIB 的含量。Liu 等[27]发现苦杏仁苷可显著延长APTT,降低FIB 含量,具有一定程度的活血化瘀作用。苦杏仁可能通过延长APTT 和TT 使内源性凝血途径和共同凝血途径被激活。FIB 含量的降低,说明苦杏仁苷可能通过抑制纤维蛋白原转化为纤维蛋白,发挥抗凝血的作用。
表3 苦杏仁苷对体外凝血功能的影响(![]() ,n=3)
,n=3)
Table 3 Effects of amygdalin on blood coagulation in vitro(![]() ,n=3)
,n=3)
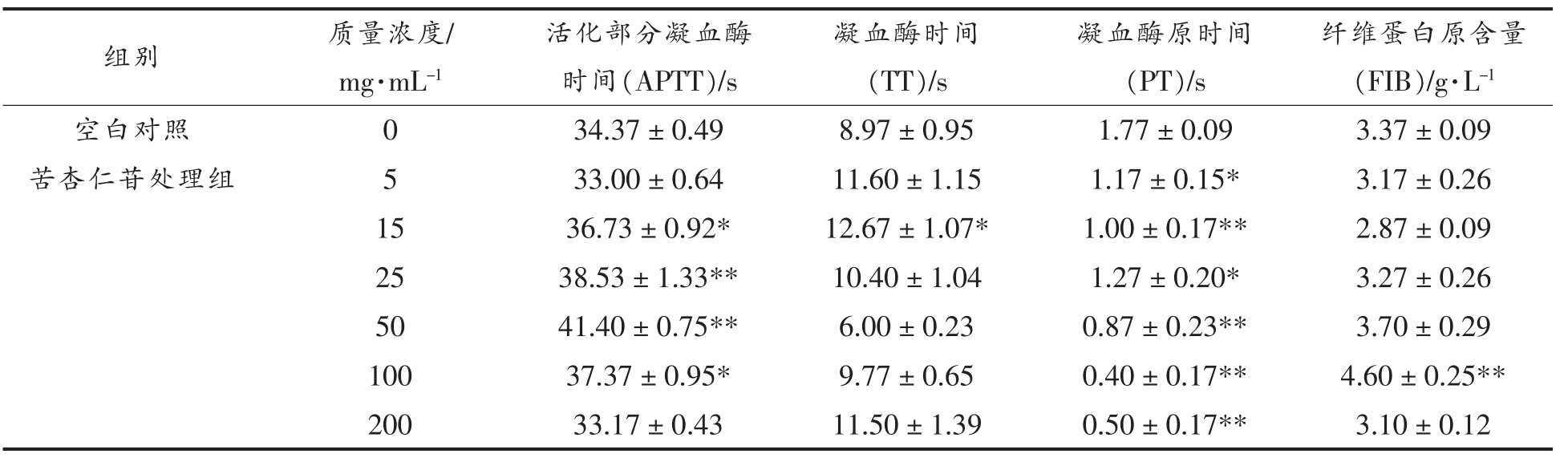
注:与空白对照组相比,*.差异显著(P<0.05),**.差异极显著(P<0.01)。
2.4 桃仁苦杏仁苷体外降血脂活性
胰脂肪酶可水解肠腔中50%~70%的脂肪,已报道的研究将胰脂肪酶抑制率作为降血脂的重要指标[28]。肝脏中胆固醇可以转化为胆汁酸,与胆汁酸的结合可降低胆固醇量,有降血脂的效果[29]。由图4a 可知,在0~50 mg/mL 质量浓度范围内,桃仁中苦杏仁苷对胰脂肪酶抑制率,随着质量浓度的增大而增加,表现出较好的线性关系,在低剂量时,苦杏仁苷表现出对胰脂肪酶活性较强的抑制作用,在质量浓度为100 mg/mL 时,桃仁苦杏仁苷对胰脂肪酶抑制率可达(87.67±2.89)%。由图4b可知,苦杏仁苷提取物对两种胆酸盐有一定的结合能力,在试验条件下,苦杏仁苷与牛磺酸胆酸盐、甘氨酸胆酸盐的结合量随质量浓度的增加而增加,且更易与甘氨酸胆酸钠结合。综合图4 结果表明,苦杏仁苷具有一定的胰脂肪酶抑制能力,且能结合牛磺酸胆酸盐和甘氨酸胆酸盐,可能具有体外降血脂的潜力。张玲等[13]的研究表明欧李仁中提取的苦杏仁苷对胰脂肪酶活性有较好的抑制作用,且其与牛磺胆酸钠、甘氨胆酸钠及脱氧胆酸钠均能结合,具有一定的体外降脂作用,与本文的研究结果相类似。
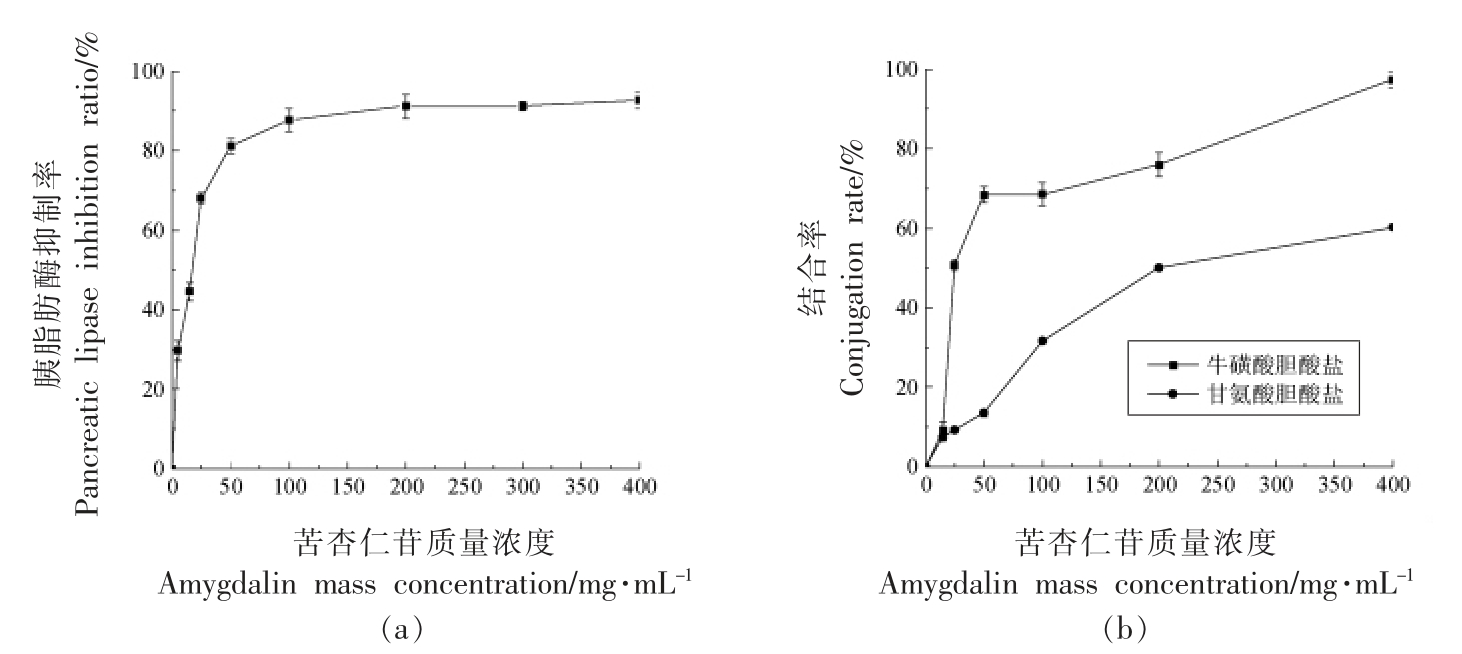
图4 苦杏仁苷对胰脂肪酶和胆酸盐结合的影响
Fig.4 Effects of amygdalin on pancreatic lipase activity and cholate binding
2.5 体外降血糖
如图5a 所示,桃仁中苦杏仁苷对α-淀粉酶的抑制作用随剂量的上升而加强,在用量为0~200 mg/mL 时,苦杏仁苷与α-淀粉酶抑制率呈较好的线性关系,在此质量浓度范围内,苦杏仁苷对α-淀粉酶的抑制率最高达到75.42%,当质量浓度大于200 mg/mL 时,其对α-淀粉酶的抑制作用没有明显增强。α-葡萄糖苷酶对苦杏仁苷较为敏感,当质量浓度为0~25 mg/mL 时,苦杏仁苷对α-葡萄糖苷酶抑制活性快速上升,当质量浓度大于50 mg/mL,苦杏仁苷对α-葡萄糖苷酶的抑制作用趋于稳定。以上结果表明,桃仁中苦杏仁苷对α-淀粉酶和α-葡萄糖苷酶活性均有较好的抑制作用,表现出一定的体外降血糖作用。李瑞玲[14]发现欧李仁中提取的苦杏仁苷质量浓度为100 mg/mL时,对α-淀粉酶的抑制率达到最大,为87.4%,表明其具有体外降血糖作用,并通过动物实验发现,苦杏仁苷提取物可以明显改善正常小鼠和糖尿病小鼠的糖耐量、体质量及脏器指数,降低糖尿病小鼠的血糖值。
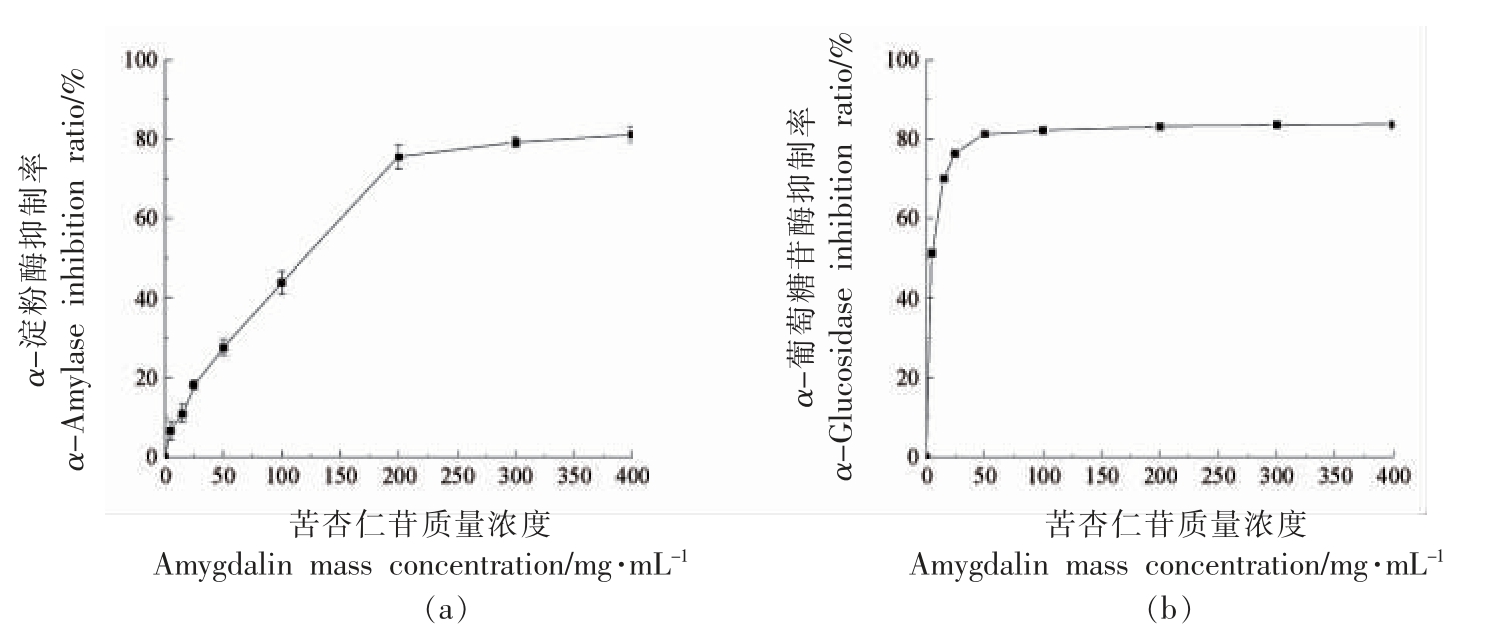
图5 苦杏仁苷对α-淀粉酶(a)和α-葡萄糖苷酶(b)的抑制率
Fig.5 Inhibitory rate of amygdalin on α-amylase(a)and α-glucosidase(b)activities
2.6 生物信息学分析
将桃仁苦杏仁苷与α-淀粉酶、α-葡萄糖苷酶和胰脂肪酶进行分子对接分析,进一步研究其相互作用结合位点。从图6 可以看出,苦杏仁苷与α-淀粉酶、α-葡萄糖苷酶和胰脂肪酶结合位点处的氨基酸大多是极性氨基酸,它们的相互作用主要以氢键为主,图中以黄色虚线表示。图6a 显示苦杏仁苷与α-淀粉酶结合位点处的氨基酸是CYS51、GLN353、SER355、ALA365,氢键主要由谷氨酰胺GLN353、丝氨酸SER355 与苦杏仁苷组成。其它相关研究也表明谷氨酰胺Glu 为α-淀粉酶的关键活性位点[30],据此可推断α-淀粉酶对苦杏仁苷具有较强的亲和力,苦杏仁苷通过与谷氨酰胺Glu 结合,改变α-淀粉酶催化口袋构象,从而降低其催化活性。图6b 显示苦杏仁苷与α-葡萄糖苷酶结合位点处的氨基酸是MET801、ARG447、ARG536、LYS560、GLN533,氢键主要由谷氨酰胺GLN533、精氨酸ARG536、赖氨酸LYS560 与苦杏仁苷作用形成。苦杏仁苷对α-葡萄糖苷酶有抑制作用,其原因可能是苦杏仁苷与葡萄糖结构较为相似,作为底物竞争性抑制剂与α-葡萄糖苷酶的活性中心结合,使酶对葡萄糖的催化活性降低[20]。图6c 显示苦杏仁苷与胰脂肪酶结合位点处的氨基酸是ASP184、GLU179、SER21、TYR181,氢键主要由谷氨酰胺GLN179 与苦杏仁苷组成。苦杏仁苷与胰脂肪酶的结合处周围分布有多个α 螺旋结构,有序的二级结构数量与酶分子周围的高度氢键结构相关,能增强酶分子的结构刚性。苦杏仁苷的结合可能会减少其α 螺旋,从而降低胰脂肪酶的稳定性,影响其催化能力[31]。
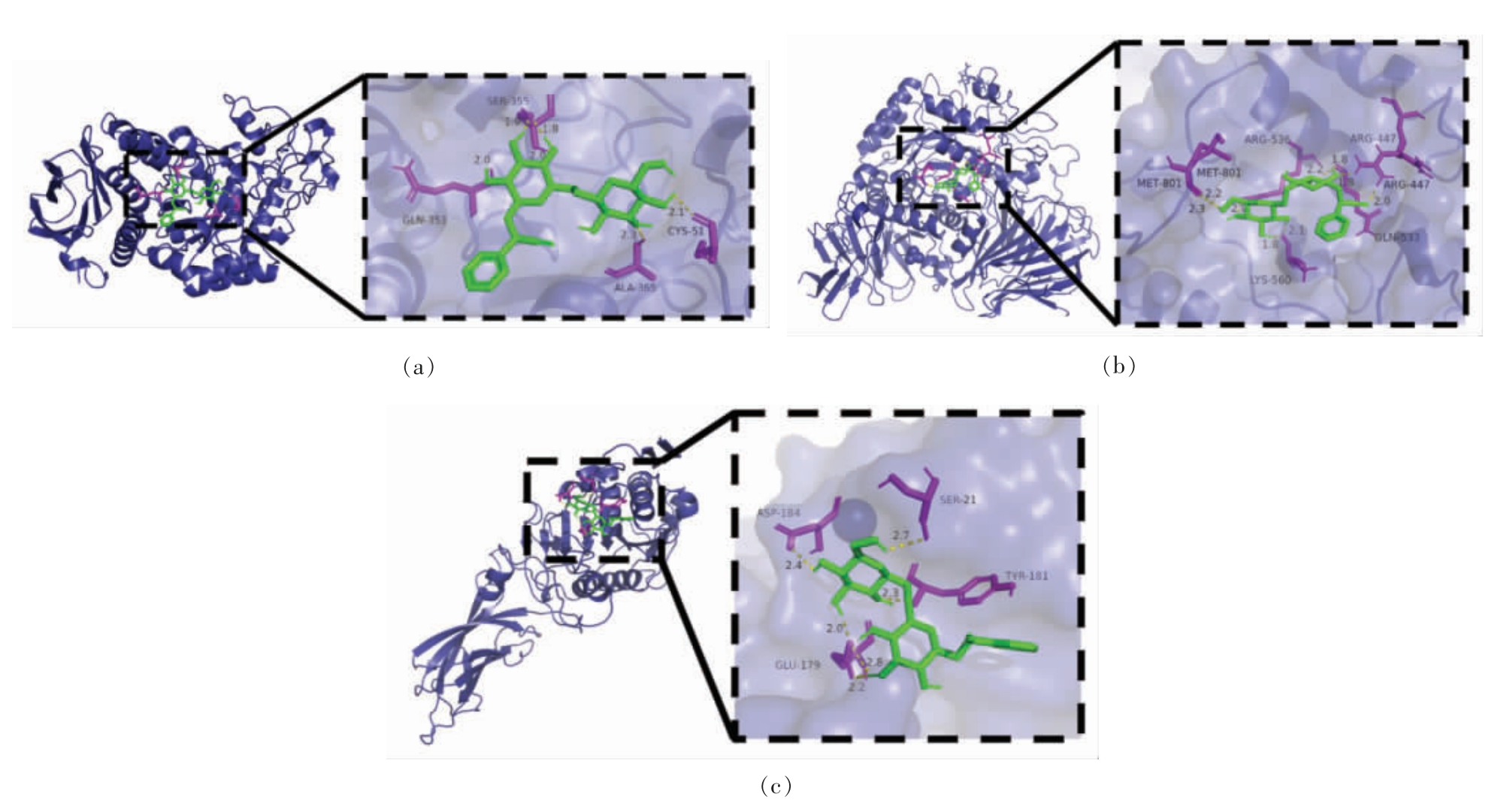
图6 苦杏仁苷与α-淀粉酶(a)、α-葡萄糖苷酶(b)、胰脂肪酶(c)的分子对接
Fig.6 Molecular docking of amygdalin with α-amylase(a),α-glucosidase(b)and pancreatic lipase(c)
注:图中黄色虚线表示氢键。
3 结论
本研究通过分析不同干燥方式下乙醇体积分数、提取温度和超声时间对桃仁苦杏仁苷提取率的影响,在选定微波干燥的基础上应用响应面法优化研究获得桃仁中苦杏仁苷的最佳提取工艺条件为:乙醇体积分数81.43%,提取温度68.91 ℃,提取时间20.00 min,在此条件下,模型预测提取率可达3.74%。桃仁苦杏仁苷的生物活性研究表明,苦杏仁苷可以延长ABTT 和TT,降低FIB 含量,抑制α-淀粉酶、α-葡萄糖苷酶以及胰脂肪酶的催化活性,此外苦杏仁苷还能结合牛磺酸胆酸盐和甘氨酸胆酸盐,结果表明苦杏仁苷具有一定的体外抗凝血、降血脂和降血糖作用。本研究为超声辅助法提取白桃中桃仁苦杏仁苷工艺提供了数据支撑,并对其生物活性及相关机理进行了初步探索,将废弃生物质资源进行合理、多层次的利用,保护了生态环境,对提高桃产业附加值提供了新思路。
[1] 吕健,毕金峰,赵晓燕,等.国内外桃加工技术研究进展[J].食品与机械,2012,28(1):268-271,274.LÜ J,BI J F,ZHAO X Y,et al.Research progress on peach processing technology[J].Food &Machinery,2012,28(1):268-271,274.
[2] JASWAL V,PALANIVELU J,DR R C.Effects of the gut microbiota on amygdalin and its use as an anti-cancer therapy:Substantial review on the key components involved in altering dose efficacy and toxicity[J].Biochemistry and Biophysics Reports,2018,14(C):125-132.
[3] OYENIRAN O H,ADEMILUYI A O,OBOH G.African mistletoe(Tapinanthus bangwensis Lor.)infestation improves the phenolic constituents,antioxidative and antidiabetic effects of almond(Terminalia catappa Linn.)host leaf in sucrose-rich diet-induced diabetic -like phenotypes in fruit fly(Drosophila melanogaster Meigen)[J].Food Frontiers,2021,2:77-90.
[4] 许筱凰,李婷,王一涛,等.桃仁的研究进展[J].中草药,2015,46(17):2649-2655.XU X F,LI T,WANG Y T,et al.Research progress in Persicae Semen[J].Chinese Traditional and Herbal Drugs,2015,46(17):2649-2655.
[5] HE X Y,WU L J,WANG W X,et al.Amygdalin-A pharmacological and toxicological review [J].Journal of Ethnopharmacology,2020,254:112717.
[6] BARCELOUX D G.Cyanogenic foods(Cassava,Fruit Kernels,and Cycad Seeds)[J].Disease-a-Month,2009,55(6):336-352.
[7] KAJINOA A,BAIB W,YOSHIMURAC N,TAKAYANAGI M.Identification of peach and apricot kernels for traditional Chinese medicines using near-infrared spectroscopy[J].Vibrational Spectroscopy,2021,113:103202.
[8] ZHANG X Q,HU J G,ZHOU Y Z,et al.Amygdalin improves microcirculatory disturbance and attenuates pancreatic fibrosis by regulating the expression of endothelin-1 and calcitonin gene-related peptide in rats[J].Journal of the Chinese Medical Association,2018,81(5):437-443.
[9] 吕建珍,邓家刚.苦杏仁苷的药理作用研究进展[J].现代药物与临床,2012,27(5):530-535.LÜ J Z,DENG J G.Research progress in pharmacological effects of amygdalin[J].Drugs &Clinic,2012,27(5):530-535.
[10] DENG J G,LI C Y,WANG H L,et al.Amygdalin mediates relieved atherosclerosis in apolipoprotein E deficient mice through the induction of regulatory T cells[J].Biochemical and Biophysical Research Communications,2011,411(3):523-529.
[11] DENG J G,WANG H L,LIU Y D,et al.Antiatherosclerotic effects mediated by the combination of probucol and amygdalin in apolipoprotein e -knockout mice fed with a high fat diet[J].Journal of Animal &Veterinary Advances,2012,11(1):20-25.
[12] 陈莹.苦杏仁苷对异丙肾上腺素所致大鼠心肌肥厚的作用研究[D].吉林:延边大学,2014.CHEN Y.Effect of amygdalin on the action of myocardial hypertrophy induced by isoproterenol in rats[D].Jilin:Yanbian University,2014.
[13] 张玲,丁卫英,高芬,等.欧李仁苦杏仁苷与胆酸盐的结合及对胰脂肪酶的抑制作用[J].贵州农业科学,2018,46(9):136-138.ZHANG L,DING W Y,GAO F,et al.Conjugation rate of amygdalin extract from cerasus humilis combined with three cholates and inhibition effect of the amygdalin extract on pancrelipase[J].Guizhou Agricultural Sciences,2018,46(9):136-138.
[14] 李瑞玲.欧李仁苦杏仁苷的提取及生物活性研究[D].呼和浩特:内蒙古大学,2019.LI R L.Extraction and biological activity of amygdalin from prunus humilis[D].Hohhot:Inner Mongolia University,2019.
[15] 金松今,张红英,朴惠顺,等.桃仁乙醇提取物对小鼠出血时间和凝血时间的影响[J].延边大学医学学报,2010,33(2):98-99.JIN S J,ZHANG H Y,PIAO H S,et al.Effects of ethanol extract of the Semen persicae for bleeding time and coagulation time in mice[J].Journal of Medical Science Yanbian University,2010,33(2):98-99.
[16] 张鑫,李瑞玲,孙学茹,等.超声波辅助提取欧李仁中苦杏仁苷的工艺优化[J].食品与机械,2018,34(10):163-168.ZHANG X,LI R L,SUN X R,et al.Optimization of ultrasonic-assisted extraction of amygdalin from prunus humilis seed[J].Food &Machinery,2018,34(10):163-168.
[17] 钱浩杰,郜海燕,穆宏磊,等.水酶法提取山核桃油脂工艺研究[J].核农学报,2017,31(7):1365-1373.QIAN H J,GAO H Y,MU H L,et al.Study on the extraction technology of walnut oil by aqueous enzymatic method[J].Journal of Nuclear Agricultural Sciences,2017,31(7):1365-1373.
[18] 王辰龙,张子奇,王曼,等.黑木耳多糖的提取分离及体外抗凝血作用研究[J].食品工业科技,2013,34(9):238-241.WANG C L,ZHANG Z Q,WANG M,et al.Study on extraction,isolation and in vitro anitcoagulation of polysaccharides from Auricularia auricular[J].Science and Technology of Food Industry,2013,34(9):238-241.
[19] 王远,郑雯,蔡珺珺,等.辣木叶黄酮结构分析及其对胰脂肪酶的抑制作用[J].食品科学,2018,39(2):31-37.WANG Y,ZHENG W,CAI J J,et al.Structural analysis and anti -pancreatic lipase activity of flavonoids from Moringa oleifera Lam.leaves[J].Food Science,2018,39(2):31-37.
[20] 芦宇,吕长鑫,焦天慧,等.聚酰胺纯化红树莓籽黄酮及其结合胆酸盐能力评价[J].中国食品学报,2019,19(10):172-178.LU Y,LÜ C X,JIAO T H,et al.Ability of bile salt-binding of red raspberry seed flavonoids purifuication by polyamide[J].Journal of Chinese Institute of Food Science and Technology,2019,19(10):172-178.
[21] 严尚隆,潘创,杨贤庆,等.长松藻多糖降解、结构表征及降血糖活性测定[J].食品与发酵工业,2021,47(18):119-126.YAN S L,PAN C,YANG X Q,et al.Degradation,structural characterization and hypoglycemic activity of polysaccharides from Codium cylindricum[J].Food and Fermentation Industries,2021,47(18):119-126.
[22] 蔡思学,户晶晶,孙乐常,等.2 种抗氧化剂对α-葡萄糖苷酶的抑制作用[J].中国食品学报,2021,21(4):39-45.CAI S X,HU J J,SUN L C,et al.Inhibitory effect of two antioxidants on α-glucosidase[J].Journal of Chinese Institute of Food Science and Technology,2021,21(4):39-45.
[23] 齐燕姣,陆会宁,金能智,等.α-葡萄糖苷酶与米格列醇相互作用及其进化关系[J].生物信息学,2015,13(3):141-149.QI Y J,LU H N,JIN N Z,et al.Interaction and evolutional analysis of α-glucosidases and Miglitol[J].Chinese Journal of Bioinformatics,2015,13(3):141-149.
[24] 柳萌,郜海燕,房祥军,等.不同成熟度杨梅酚酸的超声-微波协同优化提取及其抗氧化性对比[J].食品科学,2021,42(3):112-120.LIU M,GAO H Y,FANG X J,et al.Optimization of ultrasonic-microwave assisted extraction of phenolic acids from Chinese bayberries(Morella rubra Sieb.Et zucc)of different maturities and a comparative study of their antioxidant activities[J].Food Science,2021,42(3):112-120.
[25] 尚凡贞,刘瑞玲,吴伟杰,等.无糖益生菌猕猴桃脯工艺优化及其营养风味分析[J].食品工业科技,2021,42(19):226-237.SHANG F Z,LIU R L,WU W J,et al.Process optimization of sugar -free probiotic preserved kiwifruit and analysis of nutritional flavor[J].Science and Technology of Food Industry,2021,42(19):226-237.
[26] 宋艳丽,郭继倩,郭庆丰,等.可皆霉素的制备及抗凝血作用研究[J].西北药学杂志,2020,35(4):481-484.SONG Y L,GUO J Q,GUO Q F,et al.Study on the preparation and anticoagulant effect of cochliodinol[J].Northwest Pharmaceutical Journal,2020,35(4):481-484.
[27] LIU L,DUAN J A,TANG Y P,et al.Taoren-Honghua herb pair and its main components promoting blood circulation through influencing on hemorheology,plasma coagulation,and platelet aggregation[J].Journal of Ethnopharmacology,2012,139(2):381-387.
[28] TISS M,SOUIY Z,ABDELJELIL N B,et al.Fermented soy milk prepared using kefir grains prevents and ameliorates obesity,type 2 diabetes,hyperlipidemia and liver-kidney toxicities in HFFD-rats[J].Journal of Functional Foods,2020,67:103869.
[29] 杨青松,陈小玲,高路,等.水溶性红雪茶多糖体外结合胆酸盐能力的分析[J].中国食品添加剂,2017,9:49-54.YANG Q S,CHEN X L,GAO L,et al.Analysis of bile salt-binding ability of water-soluble polysaccharide from Lethariella spp.in vitro[J].Chinese Food Additives,2017,9:49-54.
[30] CAO J W,ZHANG Y,HAN L,et al.Number of galloyl moieties and molecular flexibility are both important in alpha-amylase inhibition by galloylbased polyphenols[J].Food &Function,2020,11(5):3838-3850.
[31] 王诗卉,刘云.茶叶儿茶素抑制剂对胰脂肪酶构效关系的影响[J].食品科学,2013,34(9):104-107.WANG S H,LIU Y.Effect of(-)-Epigallocatechin-3-gallate as an inhibitor on the structure-activity relationship of pancreatic lipase[J].Food Science,2013,34(9):104-107.