沙棘(Hippophae Rhamnoides L.,Sea buckthorn)为胡颓子科沙属落叶性灌木或乔木,又名酸醋柳、黑刺、沙枣等。作为一种药食同源植物,沙棘具有极高的营养和药用价值,如健脾消食、止咳化痰、活血化瘀、消炎杀菌、免疫调节、促进组织再生等[1-3]。中国是沙棘资源最丰富的国家,拥有世界上95%以上的沙棘分布面积[2]。沙棘中含有沙棘黄酮、维生素类、多糖、有机酸、酚酸、油脂、生物碱、微量元素、蛋白质和氨基酸等多种生物活性物质[4],其中沙棘黄酮具有多种重要的药理活性,例如抗氧化、抗炎、抗肿瘤、抗真菌,保护心血管,缓解糖尿病损害,增强免疫力,抑制胆固醇的新生合成,进而改善肥胖和高脂血症等[5-7]。沙棘黄酮中主要是异鼠李素、槲皮素、山奈酚、杨梅素等糖苷元组成的黄酮醇亚类,黄酮醇的组成和含量与沙棘果的成熟度、产地、亚种有关[4]。通过比较研究不同地区和成熟度的沙棘果实中总黄酮和单一黄酮含量差异,能够为沙棘果的开发利用提供一定的参考依据。
本试验采用超声辅助法提取沙棘果实中的沙棘总黄酮,因为相比传统的溶剂回流法,超声辅助提取法是利用强烈空化和机械振动作用,破坏目标化合物与样品基质间的相互作用,增强溶剂与样品间的相互作用,具有节约溶剂,缩短提取时间,高效环保的优点[8]。韩丹丹等[9]对比研究了超声提取和回流提取清见蜜柑果皮中多甲氧基黄酮提取率,结果发现超声提取省时、高效,更适合工业化提取。本试验采用响应面法优化提取工艺,旨在提高沙棘黄酮的提取率。周璇等[10]采用超声辅助法结合响应面优化提取女贞子中的总黄酮,含量最高为47.4 mg/g。本试验采用高效液相色谱(High-performance liquid chromatography,HPLC)技术检测3 种沙棘果实中4 种黄酮苷元的含量与分布,并分别对其1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl,DPPH)自由基清除率、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除率和还原能力进行比较研究,旨在为沙棘果中黄酮类化合物生物活性的研究提供数据支持,为其综合开发利用提供依据。
1 材料与方法
1.1 材料与试剂
新疆塔城地区自产的大果沙棘(Sea buckthorn)购自新疆一七〇兵团有机沙棘生态基地,其中,成熟(橙黄色)标记为沙棘A,过熟(红色)标记为沙棘B(图1),-20 ℃保存备用;新疆阿克苏地区自产的野生沙棘,标记为沙棘C(图1),4 ℃保存备用。

图1 3 种新疆沙棘果实
Fig.1 Three kinds of sea buckthorn fruits
芦丁标准品,上海索莱宝生物科技公司;槲皮素、山奈酚,合肥博美生物科技有限公司;杨梅素、异鼠李素,成都普瑞法科技开发有限公司;DPPH,美国Sigma 公司;ABTS,上海易恩化学技术有限公司;乙腈、甲酸均为国产色谱级;硝酸铝九水合物、亚硝酸钠、氢氧化钠、无水乙醇、石油醚、甲醇、过硫酸钾、铁氰化钾均为国产分析纯级。
1.2 仪器与设备
PB17 破壁机,中山市金正生活电器有限公司;超声波清洗器,上海方需科技有限公司;UV-1200 紫外可见分光光度计,上海美谱达仪器有限公司;R210D 型旋转蒸发仪,杭州大卫科教仪器有限公司;Allegra X-30R 高速冷冻离心机,美国Beckman Coulter 公司;SCIENTZ-30ND 冷冻干燥机,宁波新芝生物科技股份有限公司;FA1004 电子天平,上海舜宇恒平科学仪器有限公司;LC 1100 高效液相色谱系统,美国安捷伦公司。
1.3 试验方法
1.3.1 沙棘果前处理 取适量冷冻储存的鲜果沙棘A、沙棘B 去杂后进行冷冻干燥,粉碎并过60目筛。沙棘C 低温烘干后粉碎过60 目筛。称取1 g 沙棘果粉加入80 mL 石油醚,浸泡1 h,70 ℃水浴回流1.5 h,抽滤,向滤渣中加入60 mL 石油醚回流1 h,抽滤,回收滤渣,充分挥发石油醚后,留待提取用。
1.3.2 沙棘黄酮提取 准确称取适量脱脂后的沙棘A 果粉置于100 mL 锥形瓶中,按一定的料液比、乙醇浓度、提取时间、功率超声提取总黄酮,重复提取3 次,将提取液室温离心(8 000 r/min,10 min),合并上清液于容量瓶中定容,摇匀得到沙棘黄酮提取液。将提取液旋蒸浓缩至无醇味后置于-20 ℃冰箱保存,冷冻干燥得到沙棘黄酮粗提物(The total flavonoids extract,TFE)。
1.3.3 总黄酮含量测定
1.3.3.1 芦丁标准曲线绘制 采用亚硝酸钠-硝酸铝法。精密称取芦丁对照品20 mg,用60%乙醇配成0.2 mg/mL 的对照品溶液。精密量取对照品溶液l,2,3,4,5,6 mL,分别置于25 mL 量瓶中,各加30%乙醇稀释至6 mL,加5%亚硝酸钠溶液1 mL,混匀,静置6 min,再加10%硝酸铝溶液1 mL,摇匀,静置6 min,加1 mol/L 氢氧化钠试液10 mL,加30%乙醇至刻度,摇匀,静置15 min,以相应试剂为空白对照,在510 nm 波长处测定吸光度。以吸光度为纵坐标,浓度为横坐标,得到芦丁标准曲线为:y=12.27x-0.01033,R2=0.9997,表明标准品芦丁在0.008~0.048 mg/mL 质量浓度范围内线性良好。
1.3.3.2 沙棘黄酮提取率测定 准确吸取3 mL提取液于25 mL 的容量瓶中,根据1.3.3.1 节的操作步骤,测定提取液在510 nm 波长处的吸光值,根据标准曲线计算得到总黄酮浓度,根据公式(1)计算沙棘总黄酮提取率。
式中,C——沙棘果粉总黄酮质量浓度(mg/mL);N——稀释倍数;V——提取液总体积(mL);M——样品的质量(g)。
1.3.4 单因素实验 分别考察料液比(1∶10,1∶20,1∶30,1∶40,1∶50,g/mL),乙醇体积分数(50%,60%,70%,80%,90%),超声时间(20,30,40,50,60,70 min),超声功率(100,150,210,290,300 W)对沙棘总黄酮提取率的影响。前期通过预试验确定了脱脂的必要性和超声温度为50 ℃最佳。刘锡建等[11]对比发现脱脂后沙棘黄酮的提取效果更佳。田建华等[12]亦研究发现沙棘黄酮的最佳提取温度为50 ℃。在研究单因素变量的影响时,其它各因素固定的条件为:乙醇体积分数60%,料液比1∶20,超声功率270 W,超声50 min,提取3 次,每个试验重复3 次。
1.3.5 Box-Behnken 试验设计 根据单因素实验结果,应用Box-Behnken Design 进行响应面优化试验(3 因素3 水平),因素与水平设计表见表1。
表1 Box-Behnken 试验因素水平设计
Table 1 Level of independent variables used for Box-Behnken design

1.3.6 沙棘黄酮提取液抗氧化能力的测定
1.3.6.1 DPPH 自由基清除能力测定 参考Brand-Williams 等[13]的方法并进行修改。准确称取7.8 mg DPPH,加无水乙醇溶解得到0.2 mmol/L DPPH 工作液。将2 mL 梯度浓度的样品溶液与2 mL DPPH 工作液混合,以同等浓度的抗坏血酸做阳性对照,以无水乙醇做空白对照,室温下避光静置30 min,于517 nm 波长处检测其吸光度。DPPH清除率按照公式(2)计算:
式中,A白——未加抗氧化剂时DPPH 的吸光度值;A样——加入样品后DPPH 的吸光度值。
1.3.6.2 ABTS 自由基清除能力测定 参考Jo等[14]和沙玉欢等[15]的方法并加以修改,称取192.03 mg 的ABTS 溶于50 mL 去离子水中制得7 mmol/L 的ABTS 溶液;称取66.2284 mg K2S2O8 溶于100 mL 去离子水中制得2.45 mmol/L 的K2S2O8 溶液,取等量上述配制好的溶液,混合均匀,室温下避光放置12~16 h,得到ABTS 母液。用无水乙醇按照约1∶46 的体积比将ABTS 母液稀释直至其在734 nm 波长处的吸光度为0.7±0.02,得到ABTS 工作液。取300 μL 梯度浓度样品溶液与4 mL ABTS工作液混合,室温下静置6 min,在734 nm 波长处检测其吸光度值,以同等浓度的抗坏血酸做阳性对照,以ABTS 工作液和去离子水的混合液为空白组。ABTS 清除率按照公式(3)计算:
式中,A白——未加抗氧化剂时ABTS 的吸光度值;A样——加入样品后ABTS 的吸光度值。
1.3.6.3 还原能力测定 参考柳萌等[16]和李欣等[17]的方法,采用高铁盐-铁氰化钾比色法测定样品的还原能力。取1 mL 样品溶液于离心管中,加入2.5 mL 0.2 mol/L 磷酸缓冲液(pH 6.6)和2.5 mL K3Fe(CN)6 溶液(质量分数1%),混匀后50 ℃保温20 min。随后加入质量分数10%三氯乙酸溶液2.5 mL,混合后4 ℃3 000 r/min 离心10 min。取上清液2.5 mL,加入2.5 mL 去离子水和0.5 mL质量分数0.1% FeCl3 溶液,混匀后静置10 min,在700 nm 波长处测定吸光度,以其吸光度表征样品还原能力,以0.05 mg/mL 抗坏血酸为阳性对照。
1.3.7 黄酮各组分含量测定
1.3.7.1 色谱条件 采用安捷伦Poroshell 120 C18,反相色谱柱(3.0 mm×150 mm,2.7 μm),柱温30 ℃,流动相A 相为0.1%甲酸溶液,B 相为色谱级乙腈溶液,进样量为10 μL,流速为0.4 mL/min,检测波长为370 nm,洗脱程序为初始比例A 相为90%,B 相为10%,梯度变化至A 相60%,B 相40%,保持5 min,洗脱时间为40 min。
1.3.7.2 溶液配制 黄酮苷元对照品溶液配制:称取芦丁、槲皮素、异鼠李素、山奈酚、杨梅素标准品适量置于容量瓶中,用甲醇定容至刻度,得到对照品溶液,过0.22 μm 滤膜即得。
供试品溶液配制:称取TFE 50 mg 于圆底烧瓶中,加入甲醇与质量分数为25%的HCl 溶液(体积比为4∶1)50 mL,85 ℃加热回流1 h,放冷至室温后过滤,滤液转移至50 mL 容量瓶中,用甲醇定容至刻度,摇匀,过0.22 μm 滤膜即得。
1.4 数据处理与分析
采用GraphPad Prism 8.0 软件作图和统计分析。试验均设置3 个重复,结果以“平均值±标准差”的形式表示。采用单因素方差分析和双因素有重复试验方差分析来确定多组数据间差异的显著性,以P<0.05 表示差异显著。
2 结果与分析
2.1 单因素实验结果
如图2a 所示,当乙醇体积分数在50%~60%范围内时,总黄酮的提取率随乙醇体积分数的增大而增加,当乙醇体积分数为60%时,总黄酮的提取率达到最大值2.76%,当乙醇体积分数继续增大时,总黄酮的提取率开始逐渐降低。其原因可能是黄酮苷易溶于有机溶剂,乙醇体积分数增大会使得溶剂有效地向细胞内渗透,使得提取率增大。当乙醇体积分数大于60%时,可能会使得沙棘果中其它醇溶性杂质、色素等溶出[18],进而使得总黄酮提取率降低。
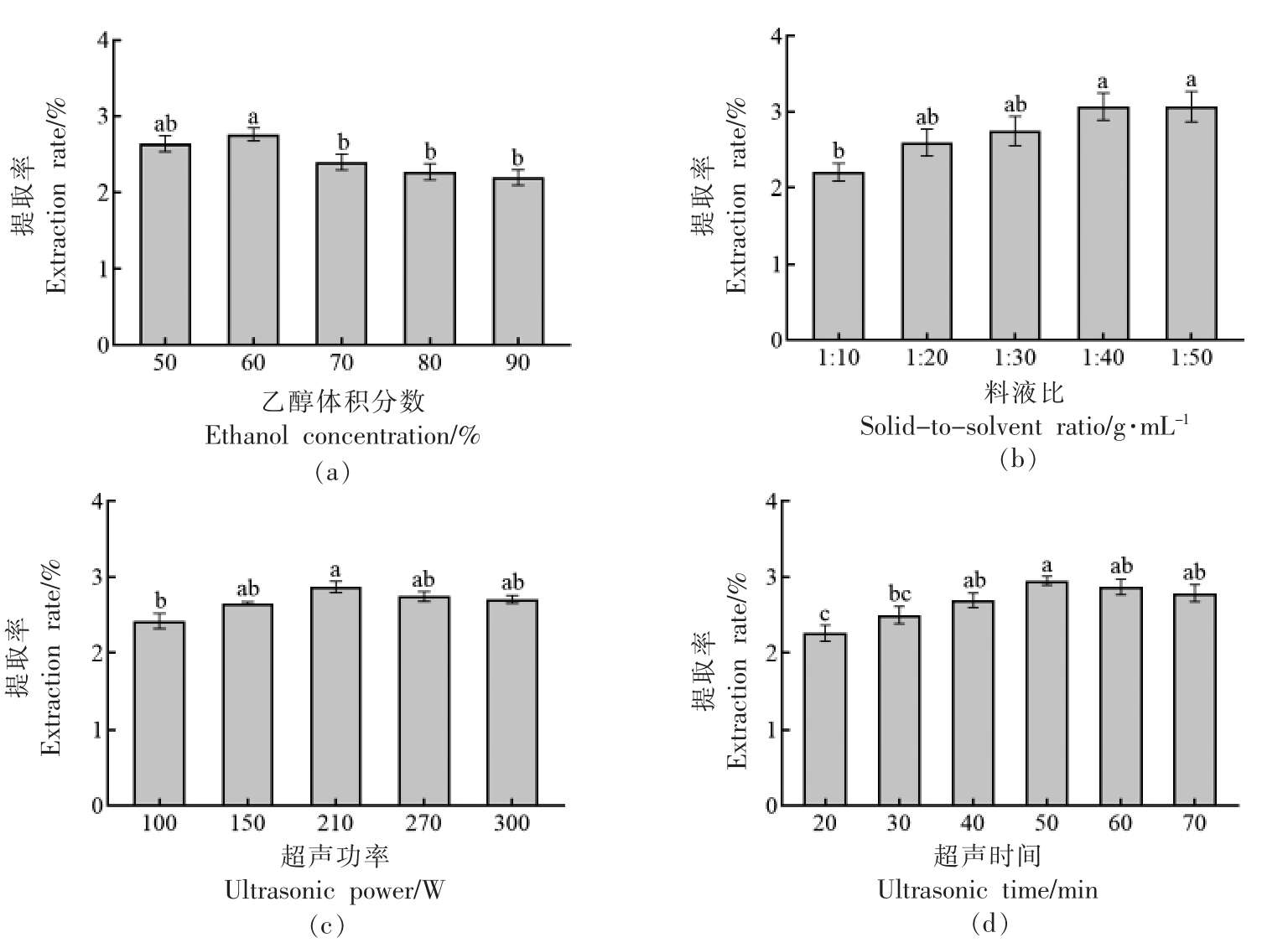
图2 不同提取条件对沙棘黄酮提取率的影响
Fig.2 Effects of different extraction conditions on the extraction rate of sea buckthorn flavonoids
注:不同小写字母表示差异显著(P<0.05),下同。

图3 各因素交互作用对黄酮提取率的响应面图与等高线图
Fig.3 Response surface plots and contour plots of the interaction of various factors on the extraction rate of flavonoids
如图2b 所示,总黄酮提取率与料液比呈正相关,料液比为1∶40 时,总黄酮提取率达到最大值为3.07%,当料液比大于1∶40 后,总黄酮提取率的增长逐渐平缓。可能是因为料液比增大使得物料能够与溶剂充分接触,同时两者之间的浓度差亦是提取过程中的推动力,推动力越大,提取率越高。然而,当料液比继续增大时,可能有大量杂质溶出,降低了超声的工作效率,使得提取率的增长非常平缓[19]。同时过高的料液比会造成提取溶剂的浪费,也会给后续浓缩冻干工艺增加难度。
如图2c 所示,总黄酮提取率随超声功率的增大先升高后降低,在210 W 时提取率最大为2.87%。这可能是因为超声波的空化效应和机械效应能够破坏物料的细胞膜与细胞壁,使得总黄酮更容易溶出。然而,超声功率过大会导致提取温度过高,进而可能会使得溶出的总黄酮被分解破坏,提取率降低[8]。
如图2d 所示,随超声时间的延长,总黄酮提取率整体呈升高的趋势,超声时间为50 min 时,总黄酮提取率最高为2.95%。猜测是因为50 min时大部分黄酮类物质已溶出,继续延长超声时间会使其它杂质溶出或黄酮部分分解[20],降低提取率,而且从经济效应来说,应在保证提取率的前提下,尽可能缩短提取时间,故选择50 min 作为超声时间较合适。
2.2 响应面试验结果
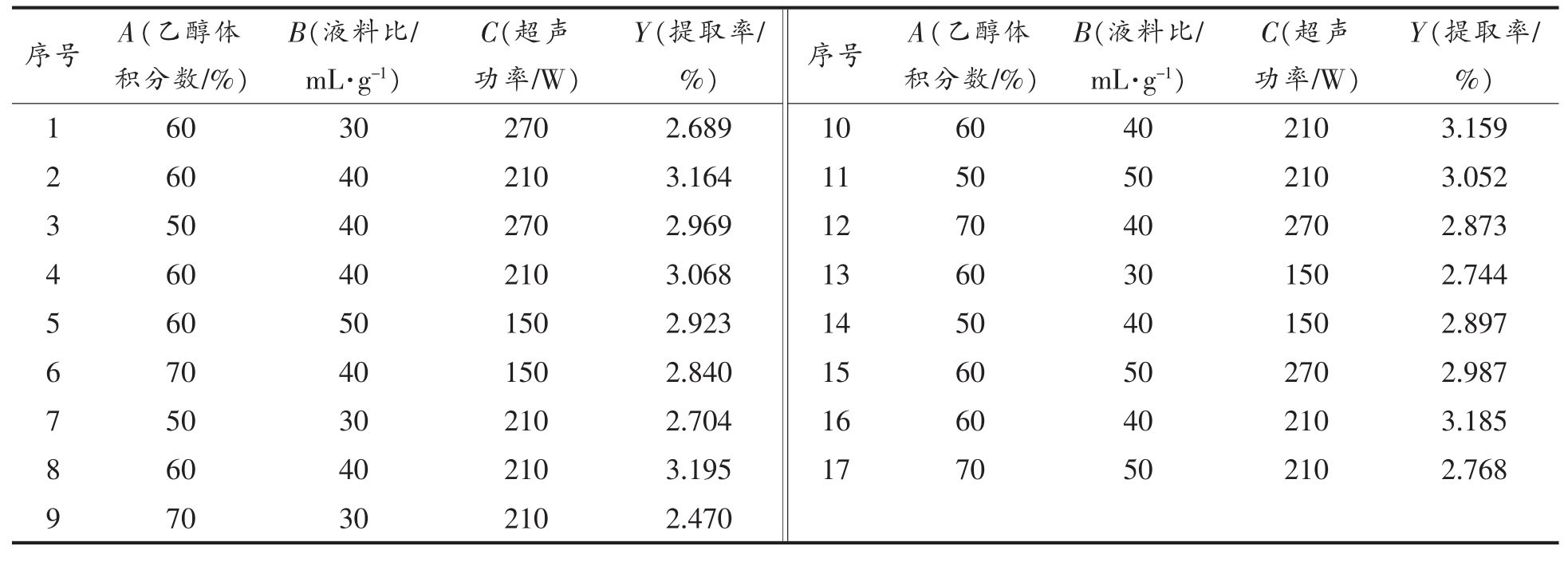
2.2.1 Box-Behnken 试验设计结果 根据单因素实验结果,并结合Box-Behnken 的试验设计原理,以乙醇体积分数(A)、液料比(B)、超声功率(C)为自变量,提取率(Y)为响应值,采用Design-Expert 8.0.6 软件设计三因素三水平的试验如表2 所示。并对试验结果进行分析,得到总黄酮提取率对自变量A、B、C 的回归方程:Y=3.16-0.084A+0.14B-0.013AB-0.00975AC+0.030BC-0.18A2-0.24B2-0.089C2。
表2 Box-Behnken 试验设计与结果
Table 2 Box-Behnken design with experimental results
根据方差分析结果可知,模型的P 值为0.0004,P<0.01 表明该模型回归极显著,在选定的因素范围内具有统计学意义;失拟误差P>0.05 不显著,表明模型与试验数据拟合程度良好,同时模型的决定系数R2=0.9604,说明试验值与理论模型有96.04%是相符的,模型的CV%为2.13%,说明其置信度是较高。由表3 可知,模型一次项A、B和二次项A2、B2、C2 对提取率的影响极显著,通过P 值分析,各因素的主效应关系为:液料比>乙醇体积分数>超声功率。
表3 回归方差分析结果
Table 3 Analysis of variance for the fitted regression model
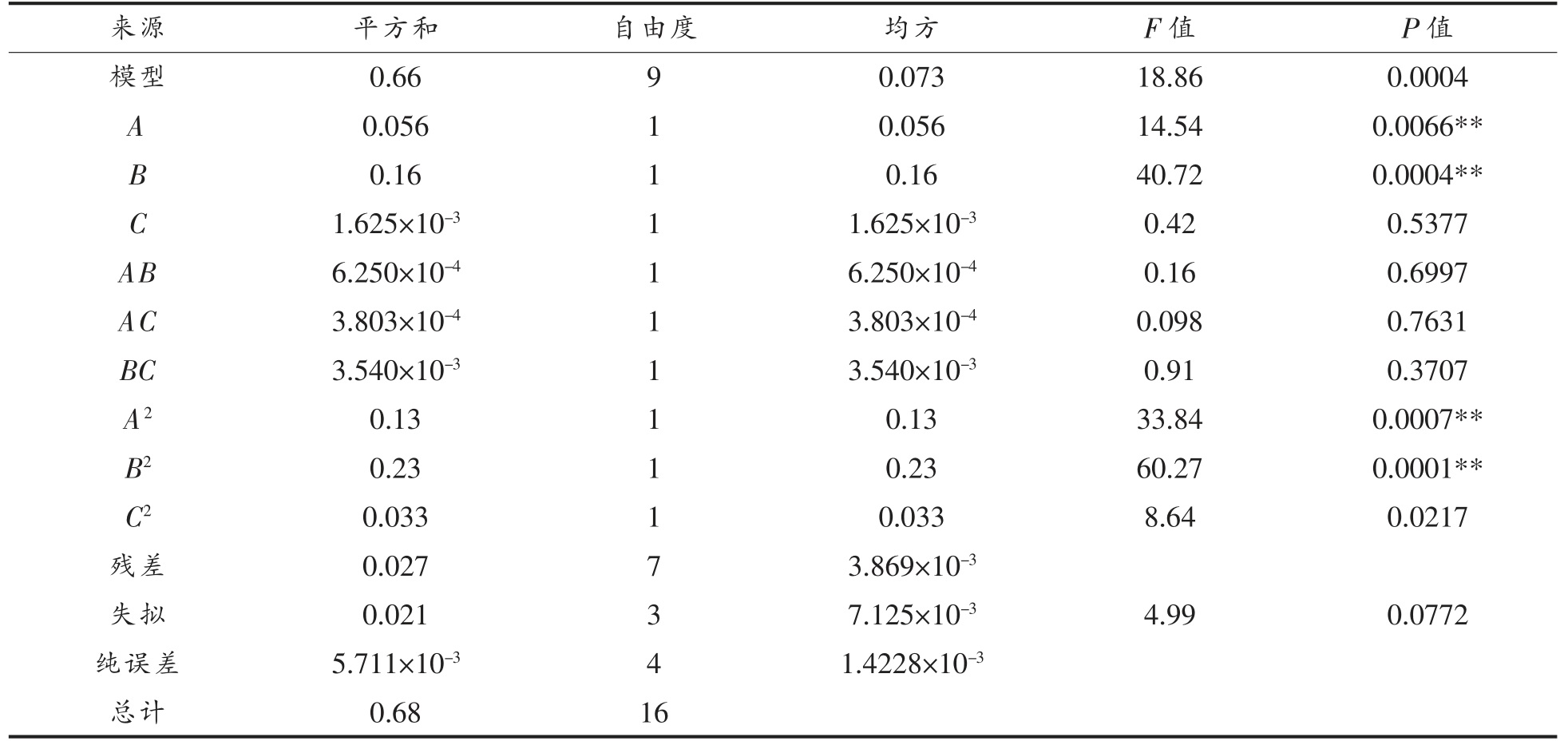
注:R2=0.9622;*.表示P<0.05,差异显著;**.表示P<0.01,差异极显著。
2.2.2 响应面分析 根据回归方程得到的响应面图和等高线图能够直观看到各因素间的交互作用,其中响应面图的陡峭程度和等高线图接近椭圆形的程度都能够反映各因素对响应值的影响程度[21]。如图b1、c1 所示,乙醇体积分数与超声功率、液料比与超声功率之前的等高线图趋向椭圆形,交互作用显著。比较3 组响应面图可知,乙醇体积分数和液料比的曲线相比于超声功率更加陡峭,这说明乙醇体积分数和液料比对总黄酮的提取率影响作用显著,当超声功率不变时,总黄酮提取率随乙醇体积分数增加,液料比增大,呈现先上升后下降的趋势。
2.2.3 验证试验 通过模型预测沙棘总黄酮提取的最佳工艺条件为:A=57.47,B=43,C=219,即超声功率为219 W,液料比为43∶1,乙醇体积分数为57.5%,此时预测最大总黄酮提取率Y =3.194%。考虑到实际操作情况,对上述预测的最佳工艺条件进行修正,即超声功率210 W,液料比45∶1,乙醇体积分数55%,在此条件下,做3 次平行试验,结果测得总黄酮提取率为3.241%±0.13%,与理论预测值无显著性差异,说明以上模型对沙棘总黄酮提取的工艺优化具有实际可行性。
采用优化后的工艺条件提取沙棘B、沙棘C的总黄酮,结果测得沙棘B 的总黄酮提取率为1.856%±0.01%,沙棘C 的总黄酮提取率为3.795%±0.23%,对比可知总黄酮提取率:沙棘C>沙棘A>沙棘B。
2.3 HPLC 法检测沙棘黄酮中各组分含量
采用HPLC 法检测3 种沙棘果实中提取的总黄酮水解后各主要黄酮苷元的含量,结果如表4所示。异鼠李素在3 种沙棘果实中含量都为最高,其次是槲皮素,说明异鼠李素与槲皮素是3 种沙棘果实中主要的黄酮苷元,而杨梅素在3 种沙棘果实中含量都较低。对比可知,3 种沙棘果实中山奈酚的含量差异显著,沙棘C>沙棘A>沙棘B,且沙棘A、沙棘C 中槲皮素的含量显著高于沙棘B,猜测与沙棘B 的成熟度有关,过熟的沙棘果中山奈酚和槲皮素含量较低。沙棘B 中异鼠李素含量显著高于沙棘C,而沙棘C 中杨梅素含量显著高于沙棘A 和沙棘B,猜测与产地有关,即相比于阿克苏地区,塔城地区的沙棘果实中异鼠李素含量较高,而杨梅素含量极低。
表4 不同沙棘果实总黄酮中各苷元的含量
Table 4 Contents of aglycones in total flavonoids of different sea buckthorn fruits
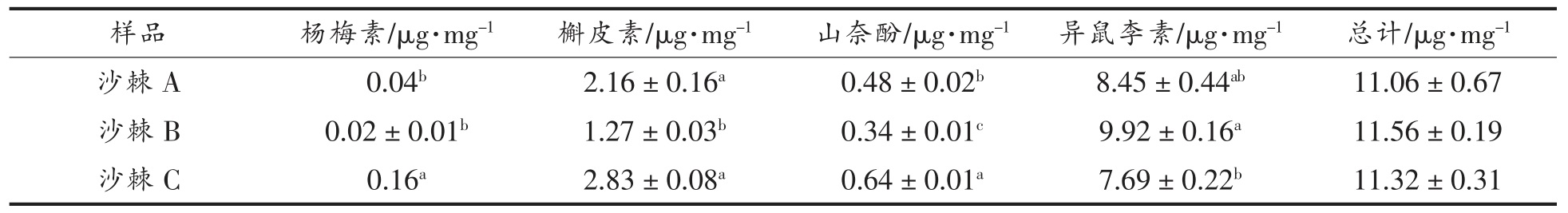
注:同列不同肩标小写字母表示差异显著(P<0.05)。
由表4 可知,3 种沙棘总黄酮苷元含量:沙棘B(11.56 μg/mg)>沙棘C(11.32 μg/mg)>沙棘A(11.06 μg/mg),三者之间并没有显著差异,然而与化学方法测定的沙棘提取液中总黄酮的含量有明显差异,可能是因为化学法检测的是黄酮苷和苷元的总量,使得结果偏高,亦或是提取液中有其它物质存在影响了化学法的准确性。
2.4 沙棘黄酮提取物的体外抗氧化能力比较
DPPH 自由基清除试验、ABTS 自由基清除试验以及还原能力测定都是常用于表征物质抗氧化能力的体外试验[22]。如图4a 所示,与抗坏血酸相比,沙棘C 的DPPH 自由基清除率明显较高,样品质量浓度为0.01 mg/mL 时,其DPPH 自由基清除率显著高于抗坏血酸。同时随着样品质量浓度的增大,沙棘A、沙棘B 的DPPH 自由基清除率亦逐渐增大,然而均低于抗坏血酸与沙棘C。当样品质量浓度为0.04 mg/mL 时,DPPH 自由基清除率:沙棘C(95.28%)>抗坏血酸(94.95%)>沙棘B(87.47%)>沙棘A(86.11%)。

图4 不同沙棘果实总黄酮提取物的体外抗氧化能力
Fig.4 Antioxidant capacity of total flavonoids from different sea buckthorn fruits in vitro
注:与抗坏血酸相比,*.表示P<0.05,差异显著;
**.表示P<0.01,差异极显著。
如图4b 所示,样品质量浓度为0.01 mg/mL时,沙棘A、沙棘C 的ABTS 自由基清除率显著高于抗坏血酸。随着样品质量浓度的增大,沙棘A、沙棘C 的ABTS 自由基清除率逐渐升高,且始终高于抗坏血酸;沙棘B 的ABTS 自由基清除率也呈上升趋势,而低于抗坏血酸,在样品质量浓度为0.04,0.05 mg/mL 时,沙棘B 的自由基清除率显著低于抗坏血酸。当样品质量浓度为0.04 mg/mL 时,ABTS 自由基清除率:沙棘C(92.50%)>沙棘A(81.33%)>抗坏血酸(74.12%)>沙棘B(54.52%)。
物质的还原能力越强,其抗氧化性越强,如图4c 所示,沙棘A、沙棘C 的还原能力与同等质量浓度的抗坏血酸相当,其吸光度值分别为0.510 和0.551,而沙棘B 的吸光度值(0.488)显著低于抗坏血酸(0.556),说明沙棘B 的还原能力较沙棘A 和沙棘C 弱。综合图4a~4c 与表4 可知,3 种沙棘黄酮的抗氧化能力可能与各黄酮苷元的含量相关。
2.5 沙棘黄酮苷元含量与抗氧化能力的相关性分析结果
为深入了解沙棘黄酮苷元含量与其抗氧化能力的关系,对沙棘各黄酮苷元和总量与DPPH 自由基清除率、ABTS 自由基清除率、还原能力进行Pearson 相关性分析,结果如表5 所示。沙棘黄酮苷元总含量与DPPH 自由基清除率呈显著正相关,相关系数为0.834(P=0.039),与还原能力亦呈显著正相关,相关系数为0.819(P=0.046)。
表5 沙棘黄酮苷元含量与抗氧化能力相关性
Table 5 Correlation coefficients between the content of sea buckthorn flavonoid aglycone and antioxidant capacity

注:*.表示P<0.05;**.表示P<0.01。
3 讨论
本研究发现超声提取工艺参数对沙棘总黄酮得率具有一定影响,故采用3 因素3 水平的Box-Behnken 响应面法优化沙棘A 总黄酮提取工艺参数,结果表示:超声功率为210 W,料液比为1∶45,乙醇体积分数为55%时,沙棘A 总黄酮提取率最高为3.241%,在此条件下,沙棘B 总黄酮提取率为1.856%,沙棘C 的总黄酮提取率为3.795%,对比可知总黄酮提取率:沙棘C>沙棘A>沙棘B。由此可推断新疆阿克苏地区的沙棘果实总黄酮含量略高于塔城地区,而在塔城地区,成熟度较高的沙棘果总黄酮含量较低。田建华等[12]采用果胶酶协同超声波法提取山西沙棘果渣中的总黄酮,提取率最高达8.91 mg/g。樊旭等[23]采用超声辅助法提取吉林省蛟河市自培育的沙棘果实总黄酮,提取率最高为2.665%。汪成等[24]通过对比发现10 个不同产地沙棘果中总黄酮含量差异显著,其中新疆青河产的沙棘果中总黄酮含量最高为65.953 mg/g。可推测生长地域对沙棘中总黄酮的提取率有较大影响。白生文等[25]利用超声波辅助提取河西走廊沙棘果渣、果皮渣、籽粕中总黄酮,三者的提取率分别为2.55%,0.651%,1.901%。王苗苗等[26]采用回流法提取新疆自产的大果沙棘和中亚沙棘中的总黄酮,大果沙棘中黄酮含量为7.02 mg/g,中亚沙棘中黄酮含量为9.56 mg/g。由此可见,沙棘中总黄酮的含量变化还与存在部位、品种等有密切的关系。本研究通过对不同地域、不同成熟度的沙棘果实中总黄酮提取率进行对比,为新疆沙棘果实的开发利用提供理论支持。
本试验测定结果发现新疆阿克苏地区与塔城地区的沙棘总黄酮苷元的组成与含量都没有显著差异,含量较高的黄酮苷元均为异鼠李素、槲皮素、山奈酚,杨梅素含量均较低,而单一黄酮苷元含量之间有显著差异。对比阿克苏地区,塔城地区沙棘B 中异鼠李素含量较高(11.56 μg/mg),杨梅素含量较低(0.02 μg/mg)。汪成等[24]检测了10 批不同地区沙棘果中单一黄酮和总黄酮的含量,发现不同产地的沙棘果中槲皮素、异鼠李素含量有显著差异,且槲皮素、异鼠李素的含量与总黄酮含量不具有一致性。由此可知,单一黄酮苷元含量与总黄酮含量之间无一致性。本研究的含量测定结果还表明,不同成熟度的沙棘果中单一黄酮苷元的含量有明显差异,成熟度更高的沙棘B 中槲皮素、山奈酚含量都较低,而关于成熟度差异对沙棘果中单一黄酮苷元含量影响的研究较少。明确不同地区、不同成熟度的沙棘果中总黄酮含量与组成、单一黄酮苷元含量差异,不仅能够弹性调整沙棘果实的收获时间,减少贮藏费用,还有助于对沙棘活性成分的进一步挖掘及评价[27],为之后开发具有明确营养功能的沙棘系列保健食品奠定基础。
体外抗氧化结果表明,3 种沙棘果实总黄酮提取液都具有一定的抗氧化活性,且存在剂量-效应关系,焦岩等[28]也发现大果沙棘黄酮的纯度与其抗氧化活性存在量效关系。然而由于成熟度和生长地区的差异,导致3 种沙棘果实所含抗氧化活性物质的含量有所不同,抗氧化能力存在显著差异。阿克苏地区的沙棘C 总黄酮提取液的DPPH 自由基清除率、ABTS 自由基清除率、还原能力均较强,猜测可能与其杨梅素、山奈酚含量较高有关。本研究通过对沙棘黄酮苷元含量与抗氧化活性之间的相关性进行研究发现,沙棘总黄酮苷元含量与DPPH 自由基清除率、还原能力均呈显著正相关(P<0.05)。Guo 等[29]研究发现细胞外抗氧化活性与沙棘提取物中的总酚和黄酮类化合物密切相关,而细胞抗氧化活性以及对HepG2 细胞的抗增殖作用与总酚酸和黄酮苷元显著相关。由此可知,沙棘中含有除黄酮外其它重要的抗氧化成分,如维生素C、类胡萝卜素和酚类化合物等。![]() 等[27]证实了成熟度差异是导 致沙棘浆果中维生素C 和β-胡萝卜素含量高的重要因素,进而使得晚熟品种的沙棘浆果的抗氧化活性更高。Rop 等[30]也发现沙棘果实中多酚和总黄酮的含量与抗氧化能力之间存在很强的相关性。而本试验中3 种沙棘果实的抗氧化活性与维生素C、类胡萝卜素和多酚的具体关系可做进一步研究。本研究明确了3 种沙棘黄酮的抗氧化能力,为沙棘产品的开发利用提供了数据支持。
等[27]证实了成熟度差异是导 致沙棘浆果中维生素C 和β-胡萝卜素含量高的重要因素,进而使得晚熟品种的沙棘浆果的抗氧化活性更高。Rop 等[30]也发现沙棘果实中多酚和总黄酮的含量与抗氧化能力之间存在很强的相关性。而本试验中3 种沙棘果实的抗氧化活性与维生素C、类胡萝卜素和多酚的具体关系可做进一步研究。本研究明确了3 种沙棘黄酮的抗氧化能力,为沙棘产品的开发利用提供了数据支持。
[1] 张东,邬国栋.沙棘黄酮的化学成分及药理作用研究进展[J].中国药房,2019,30(9):1292-1296.ZHANG D,WU G D.Research progress on chemical composition and pharmacological effects of sea buckthorn flavonoids[J].China Pharmacy,2019,30(9):1292-1296.
[2] 周浩楠,胡娜,董琦,等.沙棘化学成分及药理作用的研究进展[J].华西药学杂志,2020,35(2):211-217.ZHOU H N,HU N,DONG Q,et al.Research progress on the chemical composition and pharmacological action of Hippophae rhamnoides [J].West China Journal of Pharmaceutical Sciences,2020,35(2):211-217.
[3] SURYAKUMAR G,GUPTA A.Medicinal and therapeutic potential of Sea buckthorn(Hippophae rhamnoides L.)[J].Journal of Ethnopharmacology,2011,138(2):268-278.
[4] CIESAROVÁ Z,MURKOVIC M,CEJPEK K,et al.Why is sea buckthorn(Hippophae rhamnoides L.)so exceptional? A review[J].Food Research International(Ottawa,Ont.),2020,133:109170.
[5] ULLAH A,MUNIR S,BADSHAH S L,et al.Important flavonoids and their role as a therapeutic agent[J].Molecules(Basel,Switzerland),2020,25(22):E5243.
[6] LIU S,XIAO P,KUANG Y,et al.Flavonoids from sea buckthorn:A review on phytochemistry,pharmacokinetics and role in metabolic diseases[J].Journal of Food Biochemistry,2021,45(5):e13724.
[7] XIAO P,LIU S,KUANG Y,et al.Network pharmacology analysis and experimental validation to explore the mechanism of sea buckthorn flavonoids on hyperlipidemia[J].Journal of Ethnopharmacology,2021,264:113380.
[8] CHAVES J O,DE SOUZA M C,DA SILVA L C,et al.Extraction of flavonoids from natural sources using modern techniques[J].Frontiers in Chemistry,2020,8:507887.
[9] 韩丹丹,毕金峰,谢宏,等.清见蜜柑果皮中多甲氧基黄酮的提取分离[J].中国食品学报,2018,18(6):191-199.HAN D D,BI J F,XIE H,et al.Extraction and separation of polymethoxyflavones in Kiyomi tango peels[J].Journal of Chinese Institute of Food Science and Technology,2018,18(6):191-199.
[10] 周旋,许明祥,蔡文卓,等.女贞子总黄酮超声辅助提取工艺及体外抗氧化活性研究[J].食品与机械,2019,35(3):182-188.ZHOU X,XU M X,CAI W Z,et al.Ultrasonicassisted extraction and antioxidant activity of total flavonoids from Ligustrum lucidum Ait by response surface methodology[J].Food &Mechinery,2019,35(3):182-188.
[11] 刘锡建,王艳辉,李平,等.沙棘果渣中总黄酮提取的研究[J].北京化工大学学报(自然科学版),2004(1):18-21.LIU X J,WANG Y H,LI P,et al.Extraction of total flavones from marc of Sea buckthorn[J].Journal of Beijing University of Chemical Technology(Natural Science Edition),2004(1):18-21.
[12] 田建华,张春媛,魏璐.沙棘果渣总黄酮提取工艺优化及抗氧化活性研究[J].天然产物研究与开发,2021,33(1):65-72.TIAN J H,ZHANG C Y,WEI L,et al.Study on the extraction technology and antioxidant activity of total flavonoids from the pomace of sea buckthorn[J].Natural Product Research and Development,2021,33(1):65-72.
[13] BRAND-WILLIAMS W,CUVELIER M E,BERSET C.Use of a free radical method to evaluate antioxidant activity[J].LWT -Food Science and Technology,1995,28(1):25-30.
[14] JO Y J,CHO H S,CHUN J Y.Antioxidant activity of β-cyclodextrin inclusion complexes containing trans-cinnamaldehyde by DPPH,ABTS and FRAP[J].Food Science and Biotechnology,2021,30(6):807-814.
[15] 沙玉欢,毛晓英,吴庆智,等.核桃分心木黄酮物质的组分及其抗氧化性分析[J].食品科学,2021,42(12):91-98.SHA Y H,MAO X Y,WU Q Z,et al.Flavonoid composition and antioxidant activity of Diaphragma juglandis fructus[J].Food Science,2021,42(12):91-98.
[16] 柳萌,郜海燕,房祥军,等.不同成熟度杨梅酚酸的超声-微波协同优化提取及其抗氧化性对比[J].食品科学,2021,42(3):112-120.LIU M,GAO H Y,FANG X J,et al.Optimization of ultrasonic-microwave assisted extraction of phenolic acids from Chinese Bayberries(Morella rubra Sieb.et Zucc)of different maturities and a comparative study of their antioxidant activities[J].Food Science,2021,42(3):112-120.
[17] 李欣,薛治浦,朱文学.丹参不同部位总酚酸和总黄酮含量分析及其抗氧化活性研究[J].食品科学,2011,32(3):108-111.LI X,XUE Z P,ZHU W X,et al.Antioxidant activities and contents of total flavonoids and phenols from different parts of Salvia miltiorrhiza Bunge[J].Food Science,2011,32(3):108-111.
[18] 李萌萌,焦天慧,吕长鑫,等.红树莓籽中黄酮提取工艺及抗氧化活性研究[J].中国食品学报,2017,17(2):101-109.LI M M,JIAO T H,LÜ C X,et al.Optimization of extraction technology of flavonoids from red raspberry and studies on its antioxidant activity[J].Journal of Chinese Institute of Food Science and Technology,2017,17(2):101-109.
[19] 罗磊,张冰洁,朱文学,等.响应面试验优化超声辅助提取金银花叶黄酮工艺及其抗氧化活性[J].食品科学,2016,37(6):13-19.LUO L,ZHANG B J,ZHU W X,et al.UItrasonic-assisted extraction and antioxidation of flavonoids from Lonicera japonica Thunb.leaves:Process optimization by response surface methodology and antioxidant activity evaluation[J].Food Science,2016,37(6):13-19.
[20] 赵刚,顾佳丽,励建荣.Plackett-Burman 设计及响应面法优化芹菜中总黄酮的超声提取工艺[J].中国食品学报,2017,17(8):147-155.ZHAO G,GU J L,LI J R,et al.Optimization of ultrasonic extraction conditions of total flavonoids from apium graveolens by Plackett-Burman design and response surface analysis[J].Journal of Chinese Institute of Food Science and Technology,2017,17(8):147-155.
[21] CUI Q,LIU J Z,HUANG Y Y,et al.Enhanced extraction efficiency of bioactive compounds and antioxidant activity from Hippophae rhamnoides L.byproducts using a fast and efficient extraction method[J].Separation Science and Technology,Philadelphia:Taylor &Francis Inc,2017,52(7):1160-1171.
[22] WANG X,DING G,LIU B,et al.Flavonoids and antioxidant activity of rare and endangered fern:Isoetes sinensis[J].PLoS One,2020,15(5):e0232185.
[23] 樊旭,周鸿立.响应面法优化沙棘黄酮的提取和抗氧化活性的研究[J].河南工业大学学报(自然科学版),2018,39(4):85-90.FAN X,ZHOU H L.Optimization of extraction and antioxidant activity of flavonoids from seabuckthorn by response surface methodology[J].Journal of Henan University of Technology(Natural Science Edition),2018,39(4):85-90.
[24] 汪成,王怀友,汪蔓青,等.不同产地沙棘果化学成分含量及抗氧化活性的研究[J].华西药学杂志,2020,35(5):513-517.WANG C,WANG H Y,WANG M Q,et al.Study on content of major chemical constituents and antioxidation activities of Sea buckthorn fruit[J].West China Journal of Pharmaceutical Sciences,2020,35(5):513-517.
[25] 白生文,汤超,田京,等.沙棘果渣总黄酮提取工艺及抗氧化活性分析[J].食品科学,2015,36(10):59-64.BAI S W,TANG C,TIAN J,et al.Extraction and antioxidant activity of total flavonoids from sea buckthorn pomace[J].Food Science,2015,36(10):59-64.
[26] 王苗苗,刘宗浩,张永,等.2 种新疆沙棘中黄酮、多酚及其抗氧化活性分析[J].食品工业科技,2020,41(18):51-57.WANG M M,LIU Z H,ZHANG Y,et al.Analysis of the flavonoid,polyphenol and its antioxidant activity of 2 kinds of sea buckthorn from Xinjiang[J].Science and Technology of Food Industry,2020,41(18):51-57.
[27] ![]() I,ORSAVOVÁ J,SNOPEK L,et al.Impact of phenolic compounds and vitamins C and E on antioxidant activity of sea buckthorn(Hippophaë rhamnoides L.)berries and leaves of diverse ripening times[J].Food Chemistry,2020,310:125784.
I,ORSAVOVÁ J,SNOPEK L,et al.Impact of phenolic compounds and vitamins C and E on antioxidant activity of sea buckthorn(Hippophaë rhamnoides L.)berries and leaves of diverse ripening times[J].Food Chemistry,2020,310:125784.
[28] 焦岩,常影,余世锋,等.大果沙棘果渣黄酮体外抗氧化活性[J].江苏农业科学,2014,42(9):285-287.JIAO Y,CHANG Y,YU S F,et al.In vitro antioxidant activity of large fruit sea buckthorn pomace flavonoids[J].Jiangsu Agricultural Sciences,2014,42(9):285-287.
[29] GUO R,GUO X,LI T,et al.Comparative assessment of phytochemical profiles,antioxidant and antiproliferative activities of Sea buckthorn(Hippophaë rhamnoides L.)berries[J].Food Chemistry,2017,221:997-1003.
[30] ROP O,ERCISLI S,MLCEK J,et al.Antioxidant and radical scavenging activities in fruits of 6 sea buckthorn(Hippophae rhamnoides L.)cultivars[J].Turkish Journal of Agriculture and Forestry,2014,38(2):224-232.