几丁质(Chitin),又名甲壳素,由N-乙酰-D-氨基葡萄糖通过β-1,4 糖苷键连接而成,是自然界中第二大丰富的多糖,仅次于纤维素[1],广泛存在于虾、蟹等甲壳类动物的外壳中[2]。近年来,随着海鲜消费量的增长,虾蟹壳废弃物也逐年增多,有小部分虾蟹壳废弃物被用于堆肥或者转换成其它附加值产品[3],在一定程度上为目前商品化几丁质的开发提供了来源[4],然而,受市场和技术的限制,大部分的虾蟹壳废弃物在未经处理的情况下直接堆弃在环境中,不仅严重污染环境,也极大地浪费了几丁质资源。
几丁质因具有分子质量大,结晶度高,较强的分子内和分子间氢键等特点,而使其不溶于水、稀酸、稀碱和一般的有机溶剂,并且酶促降解率低,导致其商业应用受到严重限制[5]。几丁质的降解产物——几丁寡糖,具有分子质量低,水溶性好,且易于分散和吸收等特点[6],被广泛应用于食品[7-8]、医药[9-11]和农业[12]等领域。目前,几丁寡糖主要通过几丁质酶降解而得[13-14],然而,由于该类酶不易得且价格昂贵,导致制备成本极高,产业化受限。寻找来源广,易获得且价格低廉,降解效率高的几丁质非特异性降解酶代替传统的几丁质酶[5],已成为几丁质加工行业中亟待解决的问题。
几丁质改性作为几丁质酶促降解的前处理工艺,能够有效提高几丁质的降解效率,并且操作简单,避免了化学法(如添加外源化学试剂等)引起的环境污染问题。常见且有效的改性方法包括超微粉碎[15]、蒸汽爆炸[16]、瞬时弹射蒸汽爆炸[17]、超声[18]、高压均质[19]和射线辐射[20]等物理方法,以及使用有机溶剂[21]、离子液体[22]和超临界水[23]等化学方法。据本团队之前的研究结果,超微粉碎和高压均质联合处理是一种有效的几丁质改性方法[24]。
为提高几丁质的酶促降解率,制备几丁寡糖,本研究首先选用7 种非特异性酶处理几丁质,筛选降解效率和经济效益最高的非特异性酶。应用此酶降解经不同改性预处理(超微粉碎法、高压均质法和超微粉碎-高压均质联合法)的几丁质,寻找最佳预处理方法,并优化酶降解工艺流程,分析酶解产物。
1 材料与方法
1.1 材料与试剂
几丁质,生工生物工程(上海)有限公司;胃蛋白酶(500 U/mg)、木瓜蛋白酶(20 万U/g)、α-淀粉酶(6 000 U/mg)、果胶酶(500 U/mg)、脂肪酶(100 U/mg),北京博奥拓达科技有限公司;胰蛋白酶(250 U/mg)、纤维素酶(3 U/mg)、橄榄油、N-乙酰-D-氨基葡萄糖,北京索莱宝科技有限公司;几丁寡糖(DP 1-6),青岛博智汇力生物科技有限公司;醋酸钠,ThermoFisher 公司;氢氧化钠,Alfa Aesar 公司。
1.2 仪器与设备
水浴恒温振荡器(SHA-C),常州国宇仪器制造有限公司;可见分光光度计(721G),上海仪电分析仪器有限公司;照胶仪(Tanon 4600SF),北京原平皓生物技术有限公司;高速冷冻离心机(Eppendorf AG 22331 Hamburg),德国Eppendorf 公司;离子色谱仪(ICS5000),ThermoFisher 公司;氮吹仪(UGC-24M),力辰科技有限公司。
1.3 试验方法
1.3.1 几丁质的改性处理 为了提高几丁质的降解率,本研究对商品化的几丁质,即原几丁质(Raw chitin,RC),分别进行超微粉碎(Ultra-micro grinding,UMG)、高压均质(High-pressure homogenization,HPH)和超微粉碎-高压均质(UMGHPH)联合处理。
1.3.1.1 几丁质的超微粉碎处理 分别取2 g RC装入2 个研磨腔室中,进行UMG 处理,转速1 400 r/min,时间30 min,得到超微粉碎几丁质(Ultramicro grinding chitin,UMGC)。研磨前将研磨罐、研磨球和RC 于液氮中浸泡5 min。
1.3.1.2 几丁质的高压均质处理 将RC 配制成悬浊液(30 g/L),进行HPH 处理,压力40 MPa,时间10 min,收集均质后的悬浊液,真空冷冻干燥,得到高压均质几丁质(High-pressure homogenization chitin,HPHC)。
1.3.1.3 几丁质的超微粉碎和高压均质联合处理 首先将RC 进行UMG 处理(同1.3.1.1 节),然后将得到的UMGC 配制成悬浊液(30 g/L),再对其进行HPH 处理(同1.3.1.2 节),收集均质后的悬浊液,真空冷冻干燥,得到超微粉碎-高压均质几丁质(Ultra-micro grinding-high-pressure homogenization chitin,UMG-HPHC)。
1.3.2 DNS 法测还原糖含量 参考王悦[25]的方法绘制N-乙酰-D-氨基葡萄糖(NAG)标准曲线,测定还原糖含量。N-乙酰-D-氨基葡萄糖的标准曲线(图1)的回归方程为:
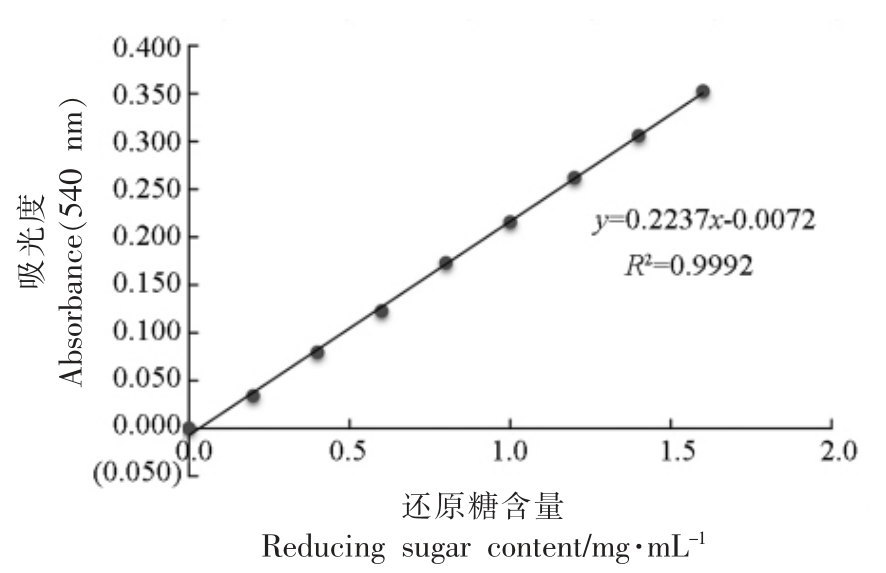
图1 NAG 的标准曲线
Fig.1 The standard curve of NAG
式中,y——吸光度(A540nm),x——N-乙酰-D-氨基葡萄糖质量浓度(mg/mL)。
待测样品中的还原糖含量:

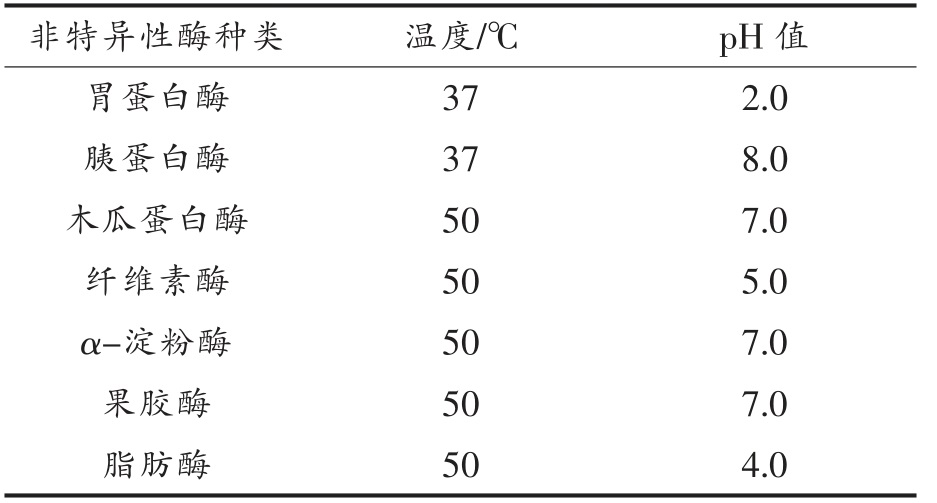
1.3.3 降解几丁质的非特异性酶制剂的筛选 以RC 为底物(50 mg/mL),分别使用商品化胃蛋白酶、胰蛋白酶、木瓜蛋白酶、纤维素酶、α-淀粉酶、果胶酶和脂肪酶于水浴摇床(180 r/min)中酶解2 h,使用DNS 法测酶解液中的还原糖产量。7 种非特异性酶的酶解条件如表1 所示。
表1 7 种非特异性酶制剂酶解几丁质的酶解条件
Table 1 Enzymatic hydrolysis conditions of chitin by 7 non-specific enzymes
1.3.4 木瓜蛋白酶对不同改性几丁质的降解效率评估 使用木瓜蛋白酶分别降解RC、UMGC、HPHC 和UMG-HPHC,参考杜敬河[5]的方法,将几丁质样品配制成底物溶液(50 mg/mL,pH 7.0)。取1 mL 底物溶液,加入1 mL 木瓜蛋白酶溶液(10 mg/mL),于水浴摇床(37 ℃,180 r/min)中反应210 min。反应结束后,煮沸20 min,12 000 r/min 离心2 min。同时设有对照组,向1 mL 底物溶液中加入1 mL 预先灭活的木瓜蛋白酶溶液,其余处理同上。最后使用DNS 法测定酶解液中的还原糖含量。
1.3.5 木瓜蛋白酶降解改性几丁质的反应条件优化
1.3.5.1 木瓜蛋白酶降解UMG-HPHC 的最适反应温度测定 将UMG-HPHC 加入磷酸氢二钠-柠檬酸缓冲溶液(0.2 mol/L,pH 7.0)中,配制成底物溶液(50 mg/mL)。取1 mL 底物溶液,加入1 mL木瓜蛋白酶溶液(10 mg/mL),于水浴摇床(180 r/min)中反应2 h,酶解反应温度分别为:40,45,50,55,60 ℃,反应结束后测定酶解液中还原糖含量。
1.3.5.2 木瓜蛋白酶降解UMG-HPHC 的最适反应pH 值测定 分别将相同质量UMG-HPHC 加入不同pH 的磷酸氢二钠-柠檬酸缓冲溶液(0.2 mol/L,pH 4.0,5.0,6.0,7.0,8.0)中,配制成底物溶液(50 mg/mL)。取1 mL 底物溶液,加入1 mL 木瓜蛋白酶溶液(10 mg/mL),于水浴摇床(50 ℃,180 r/min)中反应2 h,反应结束后测定酶解液中还原糖产量。
1.3.5.3 木瓜蛋白酶降解UMG-HPHC 的最适加酶量测定 将UMG-HPHC 加入磷酸氢二钠-柠檬酸缓冲溶液(0.2 mol/L,pH 7.0)中,配制成底物溶液(50 mg/mL)。随后配制不同质量浓度的木瓜蛋白酶溶液(5,10,15,20,25 mg/mL),取1 mL 底物溶液,分别加入1 mL 不同质量浓度的酶溶液,于水浴摇床(50 ℃,180 r/min)中反应2 h,反应结束后测定酶解液中还原糖含量。
1.3.5.4 木瓜蛋白酶降解UMG-HPHC 的最适时间测定 将UMG-HPHC 加入磷酸氢二钠-柠檬酸缓冲溶液(0.2 mol/L,pH 7.0)中,配制成底物溶液(50 mg/mL),随后加入木瓜蛋白酶溶液(10 mg/mL),将体系置于水浴摇床(50 ℃,180 r/min)中进行反应,分别于2,6,10,14,18 h 取样1 次,反应结束后测定酶解液中还原糖含量。
1.3.6 几丁质酶解产物的薄层层析分析 薄层层析是几丁寡糖分离常用的一种方法,分离效果和重现好,而且操作简单[6]。首先将UMG-HPHC 加入磷酸氢二钠-柠檬酸缓冲溶液(0.2 mol/L,pH 7.0)中,配制成底物溶液(50 mg/mL),随后加入木瓜蛋白酶溶液(10 mg/mL),将体系置于水浴摇床(50 ℃,180 r/min)中反应1 h,灭活离心后得到酶解液,参考刘靖[26]的方法进行后续操作,取酶解液5 μL 点样于硅胶板GF254 上,以正丁醇∶水∶乙酸=2∶1∶1(V/V/V)为展开剂,以0.2%茚三酮乙醇为显色剂,同时以几丁寡糖(聚合度为1~6)标准品作对照。
1.3.7 几丁质酶解产物中寡糖成分测定 将UMG-HPHC 与木瓜蛋白酶在最优条件下酶解14 h 后,经Sevage 法去除游离蛋白,冻干,得到几丁寡糖粗品,对其进行离子色谱分析,测定酶解产物中寡糖的组成比例。
1.3.7.1 标准溶液的配制 用标准品麦芽1-7 糖配制成单糖标准溶液,取各单糖标准溶液精密配制1 mg/L 标准品。
1.3.7.2 样品准备 精密称量5 mg 样品置于安瓿瓶中,加入5 mL 水,涡旋混匀,吸取100 μL 加入900 μL 去离子水,12 000 r/min 离心5 min。取上清进行离子色谱分析。
1.3.7.3 色谱方法 色谱柱:DionexCarbopacTMPA200(3 mm×150 mm);流动相:A:H2O,B:130 mmol/L NaOH,C:65 mmol/L NaOH &1025 mmol/L NaOAC;流速:0.3 mL/min;进样量:25 μL;柱温:30 ℃;检测器:电化学检测器。
1.3.8 数据处理 运用Excel 2019 进行数据处理,结果用“![]() ”表示;运用Origin 2018 绘图;使用SPSS 20.0 做差异显著性分析,P<0.05 为差异显著。所有试验均重复3 次及以上。
”表示;运用Origin 2018 绘图;使用SPSS 20.0 做差异显著性分析,P<0.05 为差异显著。所有试验均重复3 次及以上。
2 结果与分析
2.1 用于降解几丁质的非特异性酶制剂的筛选
7 种非特异性酶降解RC 的还原糖含量结果如图2 所示。
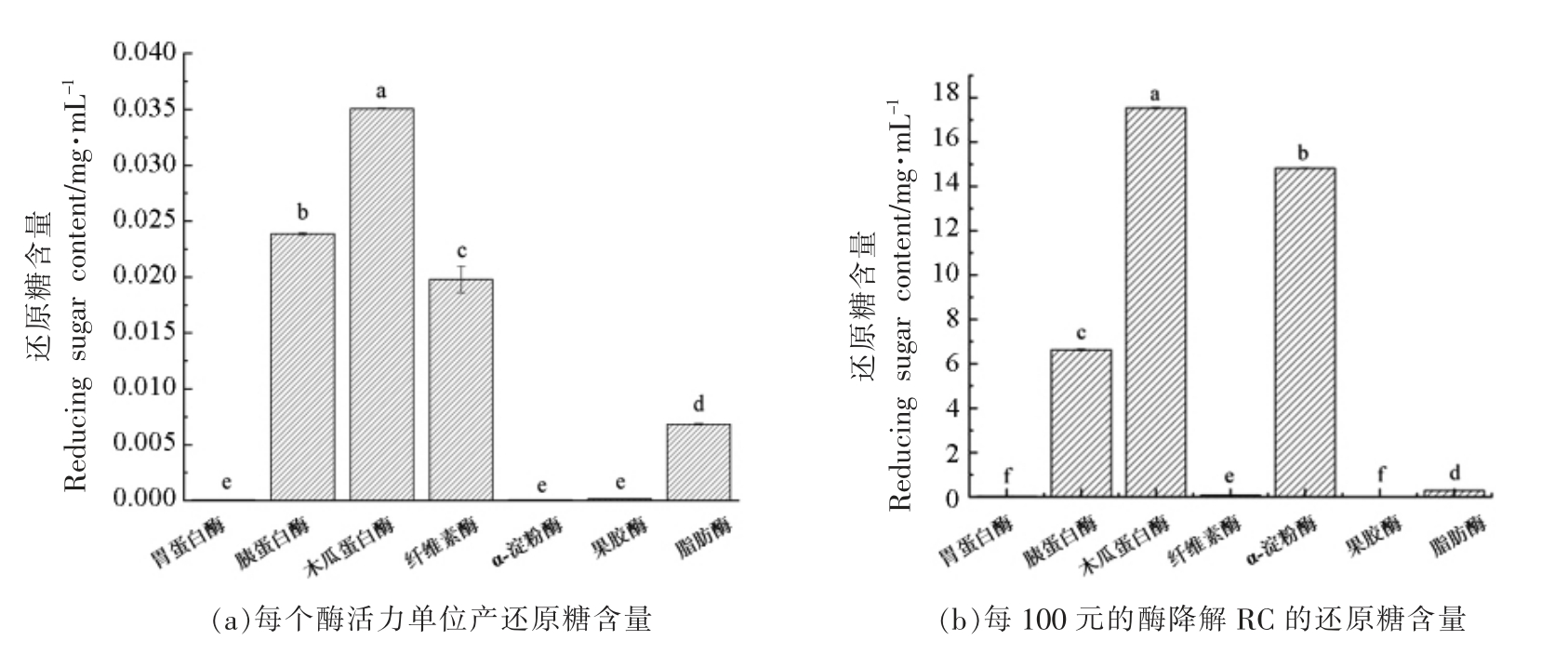
图2 不同非特异性酶降解RC 的能力
Fig.2 The ability of different non-specific enzymes to degrade RC
注:图中不同字母表示各处理间差异显著(P<0.05),下同。
图2a 为在每个酶活力单位下,7 种非特异性酶降解RC 后的还原糖含量。从图中可以看出,木瓜蛋白酶降解RC 转变成还原糖的能力最强,在每个酶活力单位下,还原糖产量达到70.16 mg/mL,说明木瓜蛋白酶具有最强的RC 降解能力;图2b 中为每100 元酶降解RC 的还原糖产量,其中每100 元的木瓜蛋白酶降解RC 的还原糖含量最高,达17.54 mg/mL。结果表明,在7 种非特异性降解酶中,木瓜蛋白酶不仅具有最高的降解RC 的能力,同时具有最高的经济效益。据报道木瓜蛋白酶主要作用于GlcNAc 和GlcN 之间的糖苷键,并优先作用于分子链较长的部分[27],这或许是其降解RC 效率较高的原因,并且该酶具有稳定性好,价格低廉等特点[27],因此选择该酶进行后续试验。
2.2 不同改性几丁质对木瓜蛋白酶降解能力的影响
首先分别对几丁质进行超微粉碎、高压均质和超微粉碎-高压均质改性处理,然后用木瓜蛋白酶分别对不同的改性几丁质(UMGC、HPHC 和UMG-HPHC)进行酶解,以未改性几丁质(RC)为对照。测定酶解后的还原糖含量,以还原糖含量作为评价指标,评价木瓜蛋白酶对不同改性几丁质的降解能力。
结果如图3 所示,木瓜蛋白酶降解4 种几丁质后的还原糖含量依次为UMG-HPHC(93.67 mg/mL)>HPHC(89.39 mg/mL)>UMGC(88.83 mg/mL)>RC(87.62 mg/mL)。其中木瓜蛋白酶降解UMGHPHC、HPHC 和UMGC 的还原糖产量比对照(RC)提高了6.05,1.77,1.21 mg/mL,结果表明,UMG 和HPH 改性处理对木瓜蛋白酶降解几丁质具有积极作用,且UMG 和HPH 联合处理组较单独改性处理组的几丁质降解率更高。
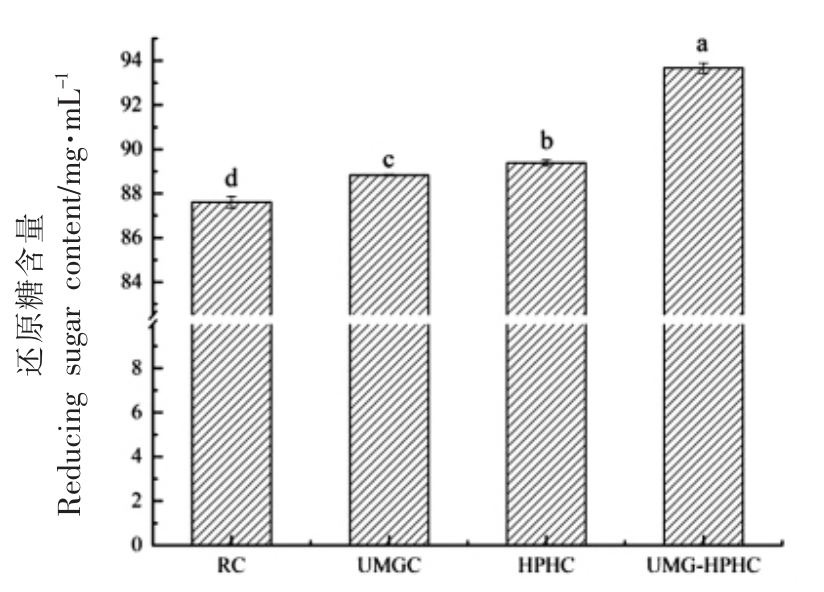
图3 木瓜蛋白酶降解不同改性几丁质的还原糖含量
Fig.3 The reduction sugar content of different pretreatment chitin degraded by papain
2.3 木瓜蛋白酶降解几丁质的反应条件优化
2.3.1 反应温度对木瓜蛋白酶降解UMG-HPHC的影响 木瓜蛋白酶对温度的变化比较敏感,在低于最适反应温度时,温度升高,反应速率增加,高于最适反应温度时,木瓜蛋白酶活性降低[27]。因此,本研究探究了不同温度下木瓜蛋白酶对UMG-HPHC 的降解能力,以酶解后的还原糖产量作为评定指标,结果如图4 所示。
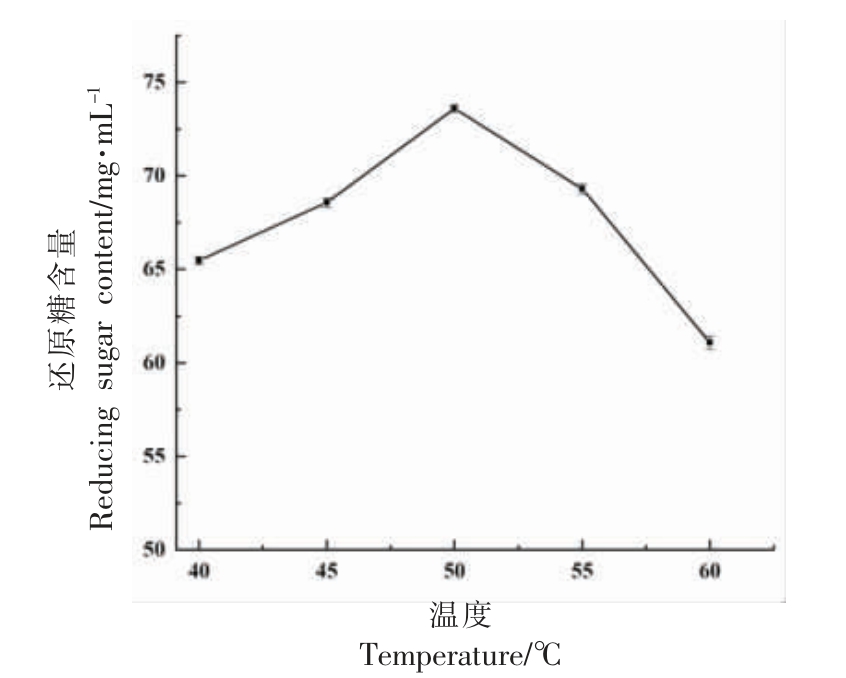
图4 不同温度下木瓜蛋白酶降解UMG-HPHC 的还原糖含量
Fig.4 Reducing sugar content of UMG-HPHC degraded by papain in different temperatures
在pH 5.0 条件下,随着温度升高,还原糖含量呈先增加后降低的趋势,当温度达到50 ℃时,还原糖的含量最高,达73.59 mg/mL。因此,木瓜蛋白酶降解UMG-HPHC 的最适温度为50 ℃。
2.3.2 反应pH 值对木瓜蛋白酶降解UMGHPHC 的影响 在不同pH 值下木瓜蛋白酶降解UMG-HPHC,测得酶解后的还原糖含量,结果如5所示。
pH 值对酶活性的影响很大,主要表现在两方面:一方面是通过影响几丁质分子上氨基的存在形式,即R-NH2 和R-NH3+,从而影响酶与底物的结合;另一方面是通过影响酶分子活性部位上有关基团的解离,导致酶和底物的结合力降低,从而降低酶反应速率[27]。因此,本研究探究了不同pH值下木瓜蛋白酶降解UMG-HPHC 的能力,以酶解后的还原糖产量作为评定指标,结果如图5所示。
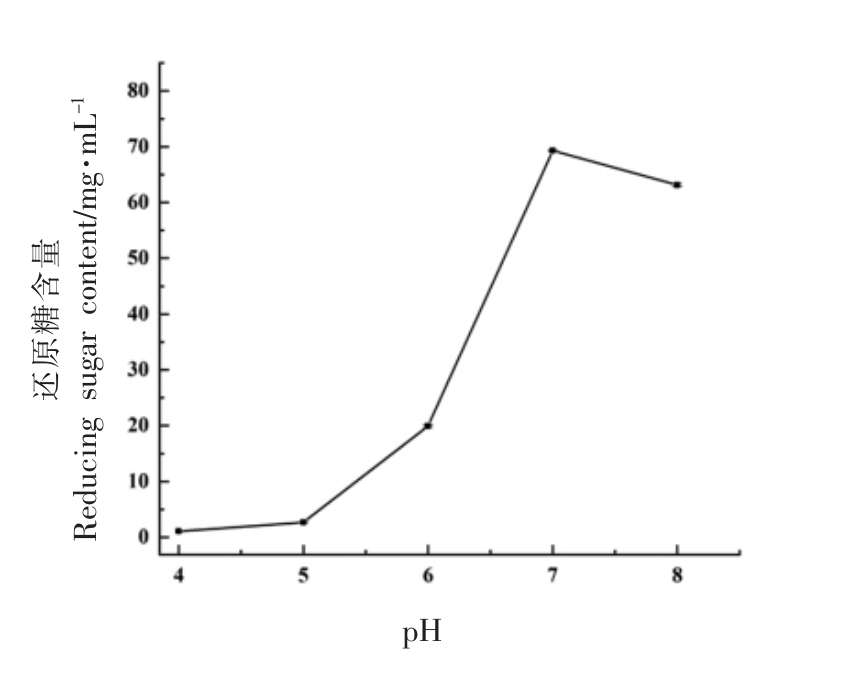
图5 不同pH 值下木瓜蛋白酶降解UMG-HPHC 的还原糖含量
Fig.5 Reducing sugar content of UMG-HPHC degraded by papain at different pH value
在pH 值在4.0~8.0 范围内,还原糖含量随着pH 值的增加呈先升高后略降低的趋势,在pH 7.0时,还原糖含量达到最大值,达68.28 mg/mL,故木瓜蛋白酶作用的最适pH 值为7.0。
2.3.3 加酶量对木瓜蛋白酶降解UMG-HPHC 的影响 在UMG-HPHC 中分别添加不同量的木瓜蛋白酶,测得酶解后的还原糖含量,结果如图6所示。
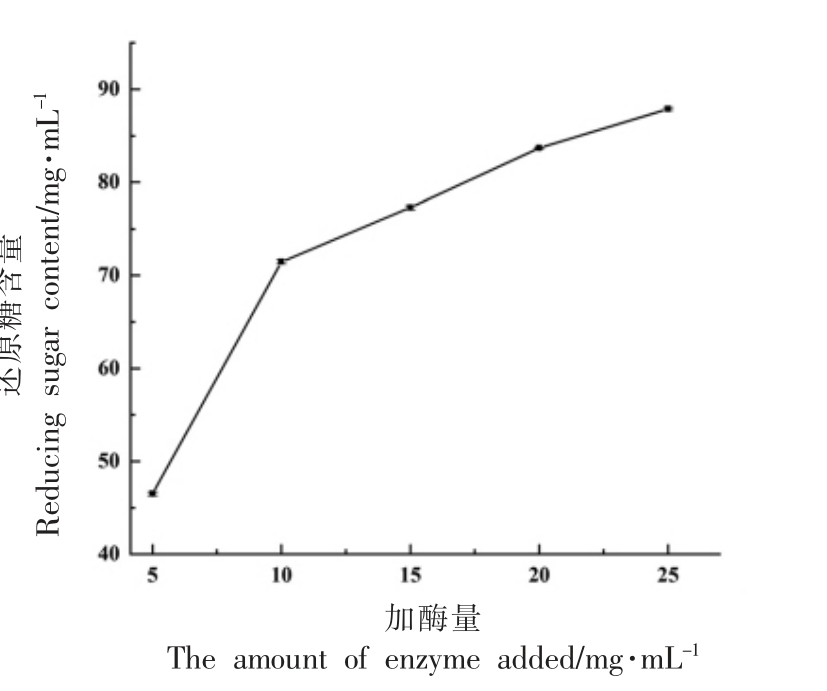
图6 不同添加量的木瓜蛋白酶降解UMG-HPHC 的还原糖含量
Fig.6 Reducing sugar content of UMG-HPHC degraded by papain with different mass concentration
在几丁质底物浓度一定时,随着木瓜蛋白酶添加量的增加,还原糖含量也逐渐增加,然而当加酶量超过10 mg/mL 之后,还原糖含量的增加速率有所降低。
2.3.4 木瓜蛋白酶降解UMG-HPHC 的反应进程 探究不同反应时间,木瓜蛋白酶对UMG-HPHC的降解能力,在不同时间取样,并测定产物中的还原糖含量,绘制酶促反应进程图,结果如图7 所示。
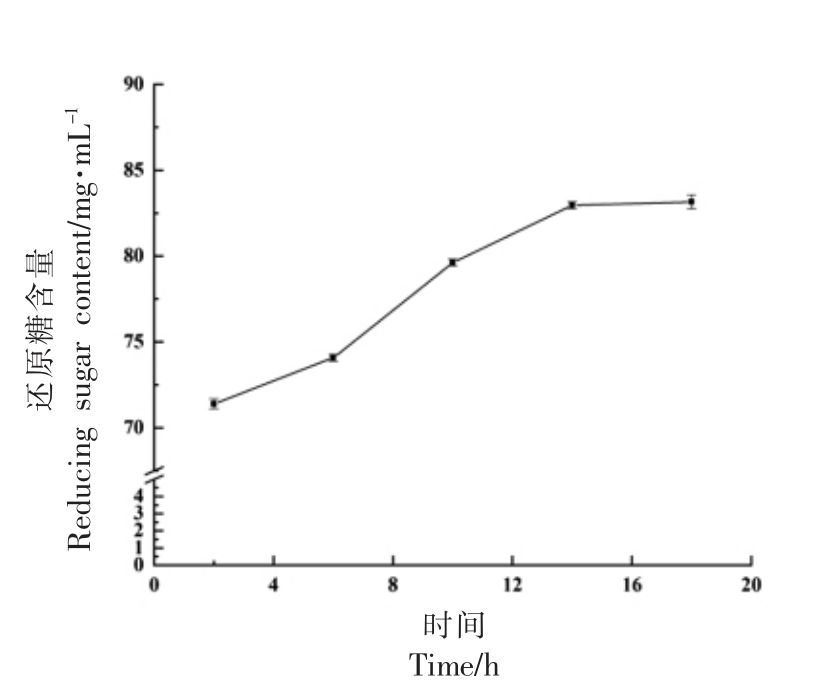
图7 木瓜蛋白酶降解UMG-HPHC 过程中的还原糖含量变化
Fig.7 The changes in reducing sugar content during papain degradation of UMG-HPHC
随着反应时间的延长,还原糖的含量不断增加,14 h 之后还原糖产量基本保持不变化,表明14 h 时木瓜蛋白酶的降解反应达到平衡。因此选择14 h 作为最佳酶解时间。
2.4 木瓜蛋白酶对UMG-HPHC 的降解产物分析
将UMG-HPHC 用木瓜蛋白酶酶解1 h,取酶解产物进行分析,结果如图8 所示。
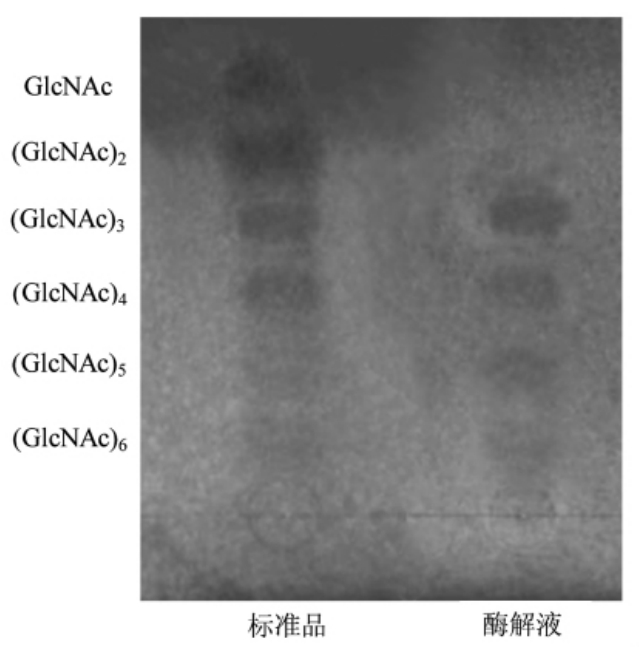
图8 木瓜蛋白酶对UMG-HPHC 的酶解产物的薄层色谱图
Fig.8 The thin-layer chromatography diagram of enzymatic hydrolysis products of UMG-HPHC by papain
通过酶解液的谱带可以直观的看出,在水解的初始阶段(反应1 h)产生了(GlcNAc)3、(Glc-NAc)4、(GlcNAc)5 和(GlcNAc)6,表明木瓜蛋白酶确实能够通过作用于UMG-HPHC 分子链中的β-1,4-糖苷键制备几丁寡糖[26]。
将酶解14 h 后的产物进行离子色谱分析,探究反应平衡后几丁寡糖的组成及比例,结果如图9 所示。该降解产物中几丁寡糖的主要成分为GlcNAc 和(GlcNAc)2,质量浓度分别为:22.26 mg/mL 和58.75 mg/mL。
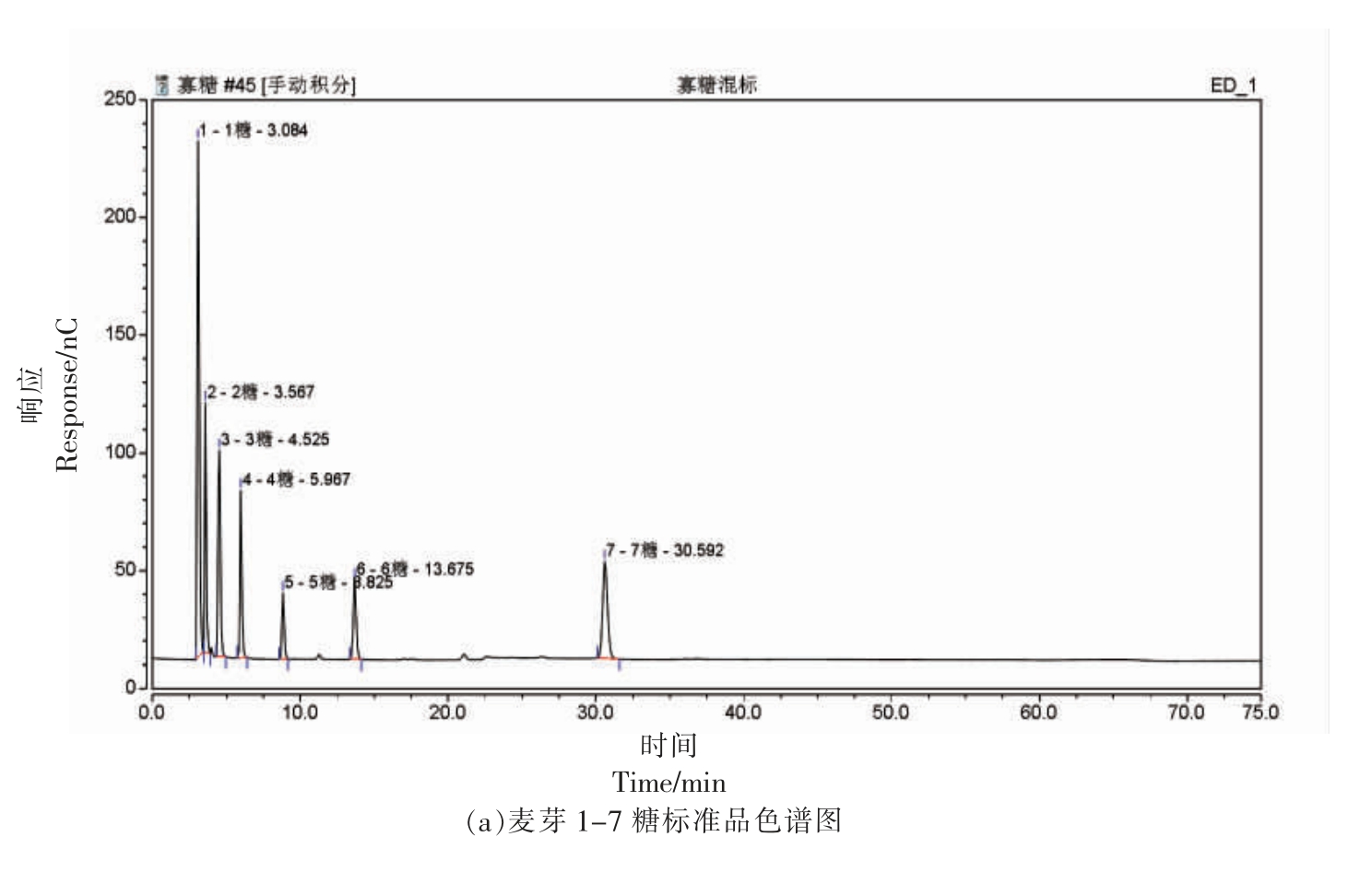
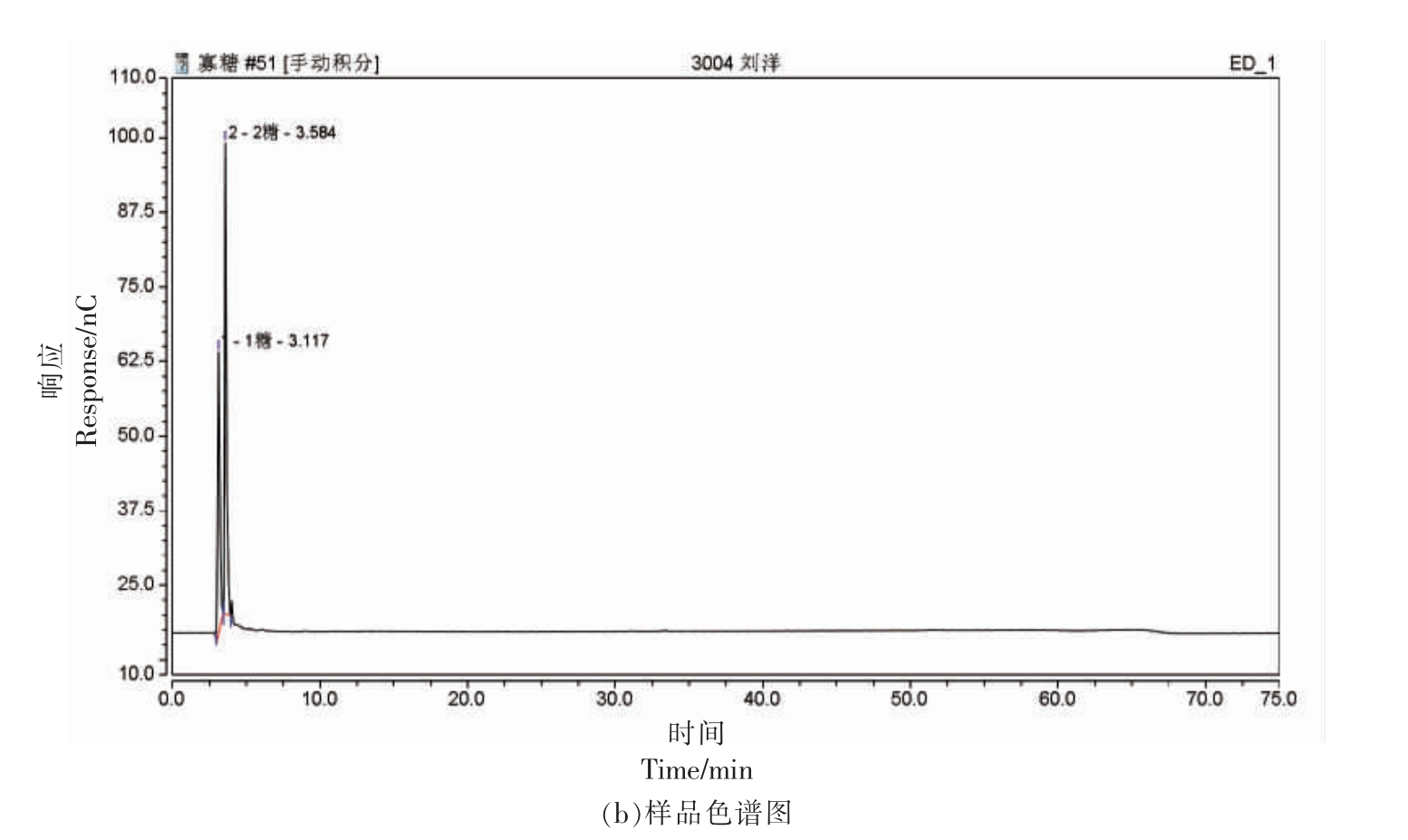
图9 酶解产物的离子色谱图
Fig.9 Ion chromatography of enzymatic hydrolysis products
有文献报道,在酶降解几丁质的进程中,随着时间的延长,所产生的几丁寡糖的聚合度逐渐降低,结合图8 和图9 可知,本研究的结果与文献[26]一致。
3 结论
本研究通过对7 种非特异性酶的筛选发现木瓜蛋白酶不仅具有最高的几丁质降解能力,而且价格低廉,是非特异性酶中最佳的选择;随后选用3 种方法预处理几丁质,并用木瓜蛋白酶对其进行降解,发现UMG-HPHC 预处理组的几丁质降解效率最高,证实UMG 和HPH 联合处理具有协同酶解的作用,改变几丁质的性能,从而提高几丁质的降解效率。研究进一步以还原糖产量为评价指标,对木瓜蛋白酶降解UMG-HPHC 的条件进行单因素优化,得到最佳的降解条件为温度50℃,pH 7.0,质量浓度10 mg/mL,时间14 h。并通过TLC 结果最终证实木瓜蛋白酶可以通过断裂β-1,4 糖苷键来制备几丁寡糖,使用离子色谱分析了酶解14 h 的产物,发现只有GlcNAc 和(Glc-NAc)2,质量浓度分别为22.26 mg/mL 和58.75 mg/mL,总之,本研究为几丁寡糖的进一步制备与应用提供了基础数据和试验方法。
[1] 张文昌.基于超微碾磨诱导的甲壳素非晶化及其应用研究[D].合肥:中国科学技术大学,2020.ZHANG W C.Amorphousization of chitin induced by superfine grinding and its application[D].Hefei:University of Science and Technology of China,2020.
[2] MOHAN K,MURALISANKAR T,JAYAKUMAR R,et al.A study on structural comparisons of αchitin extracted from marine crustacean shell waste[J].Carbohydrate Polymer Technologies and Applications,2021,2:100037.
[3] DENG J J,MAO H H,FANG W,et al.Enzymatic conversion and recovery of protein,chitin,and astaxanthin from shrimp shell waste[J].Journal of Cleaner Production,2020,271:122655.
[4] PAKIZEH M,MORADI A,GHASSEMI T.Chemical extraction and modification of chitin and chitosan from shrimp shells[J].European Polymer Journal,2021,159:110709.
[5] 杜敬河.甲壳素酶产生菌的筛选及酶法制备甲壳低聚糖的研究[D].广州:华南农业大学,2016.DU J H.Screening of chitinase producing bacteria and preparation of chitin oligosaccharides by enzymatic hydrolysis[D].Guangzhou:South China Agricultural University,2016.
[6] 武大引.甲壳低聚糖的制备及性能测定[D].青岛:青岛科技大学,2017.WU D Y.Preparation and properties of chitooligosaccharides[D].Qingdao:Qingdao University of Science and Technology,2017.
[7] 陈静文,何雪萍,王润莲,等.不同分子质量甲壳低聚糖对0~4 周黄羽肉鸡性能的影响[J].家禽科学,2020(3):9-14.CHEN J W,HE X P,WANG R L,et al.Effect of chitin oligosaccharides with different molecular weight on performance of 0 -4 weeks yellow featherbroilers[J].Poultry Science,2020(3):9-14.
[8] 魏红军.功能性低聚糖的生理功能及其在食品中的应用[J].农产品加工,2011(9):126-128.WEI H J.Physiologic functions and application in food of functional oligosaccharides[J].Academic Periodical of Farm Products Processing,2011(9):126-128.
[9] NGO D N,LEE S H,KIM M M,et al.Production of chitin oligosaccharides with different molecular weights and their antioxidant effect in RAW 264.7 cells[J].Journal of Functional Foods,2009,1(2):188-198.
[10] VO T S,NGO D H,TA Q V,et al.Protective effect of chitin oligosaccharides against lipopolysaccharide-induced inflammatory response in BV-2 microglia[J].Cellular Immunology,2012,277(1/2):14-21.
[11] SYED I A,RAZI A,MOHD S K,et al.Chitin and its derivatives:Structural properties and biomedical applications[J].International Journal of Biological Macromolecules,2020,164:526-539.
[12] 王文霞,赵小明,杜昱光,等.寡糖生物防治应用及机理研究进展[J].中国生物防治学报,2015,31(5):757-769.WANG W X,ZHAO X M,DU Y G,et al.Progress on application and mechanism of oligosaccahrides in plant biocontrol response[J].Chinese Journal of Biological Control,2015,31(5):757-769.
[13] FU X,GUO Y X,JIN Y G,et al.Bioconversion of chitin waste using a cold-adapted chitinase to produce chitin oligosaccharides[J].LWT,2020,133:109863.
[14] KUMAR A,KUMAR D,GEORGE N,et al.A process for complete biodegradation of shrimp waste by a novel marine isolate Paenibacillus sp.AD with simultaneous production of chitinase and chitin oligosaccharides[J].International Journal of Biological Macromolecules,2018,109:263-272.
[15] ZHANG W C,ZHAO Y,XU L,et al.Superfine grinding induced amorphization and increased solubility of α-chitin[J].Carbohydrate Polymers,2020,237:321-328.
[16] TAN T S,CHIN H Y,TSAI M L,et al.Structural alterations,pore generation,and deacetylation of αand β-chitin submitted to steam explosion[J].Carbohydrate Polymers,2015,122:321-328.
[17] TIAN Z Q,WANG S K,HU X F,et al.Crystalline reduction,surface area enlargement and pore generation of chitin by instant catapult steam explosion[J].Carbohydrate Polymers,2018,200:255-261.
[18] WANG Q,YAN X X,CHANG Y J,et al.Fabrication and characterization of chitin nanofibers through esterification and ultrasound treatment [J].Carbohydrate Polymers,2018,180:81-87.
[19] SALABERRIA A M,FERNANDES S C M,DIAZ R H,et al.Processing of α-chitin nanofibers by dynamic high pressure homogenization:Characterization and antifungal activity against A.niger[J].Carbohydrate Polymers,2015,116:286-291.
[20] DZIRIL M,GRIB H,LARIBI-HANCHI H,et al.Chitin oligomers and monomers production by coupling γ radiation and enzymatic hydrolysis[J].Journal of Industrial and Engineering Chemistry,2015,26:396-401.
[21] ZHOU N,YANG P F,CHEN J,et al.Effect of organic solvents treatment on structure of chitin and its enzymatic hydrolysis[J].Polymer Degradation and Stability,2021,198:109654.
[22] MA Q Y,GAO X Z,BI X Y,et al.Combination of steam explosion and ionic liquid pretreatments for efficient utilization of fungal chitin from citric acid fermentation residue [J].Biomass and Bioenergy,2021,145:105967.
[23] OSADA M,MIURA C,NAKAGAWA Y S,et al.Effect of sub-and supercritical water pretreatment on enzymatic degradation of chitin[J].Carbohydrate Polymers,2011,88(1):308-312.
[24] 刘洋,肖宇,马爱进,等.超微粉碎和高压均质联合处理对几丁质理化性质及微观结构的影响[J/OL].食品科学:1-15.(2021-10-18)[2021-10-23].http://kns.cnki.net/kcms/detail/11.2206.TS.20211015.2111.062.html.LIU Y,XIAO Y,MA A J,et al.Effect of combined treatment of ultra-micro grinding and high pressure homogenization on the physicochemical properties and microstructure of chitin[J/OL].Food Science:1-15.(2021-10-18)[2021-10-23].http://kns.cnki.net/kcms/detail/11.2206.TS.20211015.2111.062.html.
[25] 王悦.高产几丁质酶菌株的分离鉴定与酶学性质研究[D].天津:天津科技大学,2017.WANG Y.Isolation and identification of high chintinase-producing bacterium and the prooerties of its chintinase[D].Tianjin:Tianjin University of Science and Technology,2017.
[26] 刘靖.纤维素酶水解壳聚糖的特性及机理研究[D].无锡:江南大学,2006.LIU J.Study on the hydrolytic characterization and mechanism of cellulase on chitosan[D].Wuxi:Jiangnan University,2006.
[27] 蔡广志.木瓜蛋白酶与双氧水制备低分子量壳聚糖[D].长春:长春工业大学,2012.CAI G Z.Papain and hydrogen peroxide preparation of low molecular weight chitosan[D].Changchun:Changchun University of Technology,2012.