干发酵香肠具有独特的质地,典型发酵风味,且经过较长时间发酵成熟,营养成分非常丰富。它们已成为最受欢迎的发酵肉制品之一[1]。然而,风干肠含有丰富的蛋白质和游离氨基酸,在成熟期间,经脱羧酶阳性非发酵菌群作用会产生高水平的生物胺(Biogenic amines,BAs),生物胺又是致癌性N-亚硝基化合物的前体物。近年来,与致癌N-亚硝基化合物及其前体物相关的安全性问题和潜在危害已引起人们广泛的关注。目前在发酵食品中主要有3 种策略可用来抑制BAs 的形成,例如:限制胺阳性细菌的生长,减少食品中的游离氨基酸,接种胺阴性发酵剂[2]。
在肉制品发酵过程中使用发酵剂培养物有助于确保食品安全并规范最终产品的特性[3-4]。目前用于肉类发酵的发酵剂有乳酸菌(Lactic acid bacteria,LAB)和凝固酶阴性葡萄球菌(Coagulase negative staphylococcus,CNS),例如葡萄球菌属和考库里亚属,在蛋白水解、脂解和硝酸还原酶活性中发挥作用,从而提高产品的红色度和风味特征[5]。关于乳酸菌发酵剂主要使用的菌种有清酒乳杆菌、植物乳杆菌、戊糖乳杆菌、弯曲乳杆菌和戊糖片球菌[6]。发酵剂的应用,以及严格的温度和相对湿度(RH)因素,是风干肠发酵成熟过程中发生动态变化的关键驱动因素,发酵香肠行业采用此方法来提高产品的质量和安全性[7]。自发发酵过程的启动需要相对较长的时间,产品质量差异很大,限制了其可接受性和商业重要性[8]。较高的发酵温度能刺激乳酸菌的快速生长,导致pH 值迅速下降,以减少生物胺阳性菌株的生长,有利于提高风干肠的安全品质。此外,发酵过程中发生复杂的生化和物理变化,显著改变了风干肠的质地特征,如肌肉蛋白质的酸变性,增加了质地的硬度和口感[9]。据报道,接种混合发酵剂在30 ℃发酵鱼肉,也能显著抑制生物胺的积累[10]。Adab 等[11]使用3株生物胺阴性菌株——清酒乳杆菌、肉葡萄球菌、木糖葡萄球菌混合发酵骆驼肉制作干发酵香肠,将香肠于30 ℃和90%相对湿度下发酵,直到pH值达到5.3 及以下,发现能使生物胺的含量急剧减少。李秀明等[12]研究表明,发酵剂PRO-MIX5(木糖葡萄球菌+清酒乳杆菌+类植物乳杆菌)制品的菌体碎片-微生物亚硝化抑制剂(Microbial nitrification inhibitor,MNI)能有效抑制红肠和培根中N-亚硝胺的形成,且较低的MNI 添加量(0.05%)应用于红肠中就能起到抑制效果。Xiao等[13]研究戊糖乳杆菌R3 能降低MRS 肉汤中NDMA 和NDEA 两种N-亚硝胺(N-nitrosamines,NAs)的浓度,其细胞外代谢产物或细胞内提取液均不能降低两种NAs 的浓度,进一步研究发现戊糖乳杆菌R3 细胞碎片中的蛋白质是导致NAs 减少的原因。该物质是位于细胞壁上的表面层蛋白(SLPs)。因此,NDMA 和NDEA 的下降与戊糖乳杆菌R3 的SLP 相关。
目前,关于MNI 对风干肠理化性质和安全品质的研究尚未见报道。前期试验风干肠一直处于(25±2)℃的恒湿培养箱中进行12 d 发酵、风干成熟,导致其pH 值下降缓慢,对腐败微生物的控制效果不佳,进而使生物胺的含量较高。本试验对前期风干肠的工艺参数进行调整,提高发酵温度为30 ℃,降低风干成熟过程的温度(14~16 ℃)。本研究将前期优选出的能提高风干肠安全品质的PRO-MIX 发酵剂、发酵牛骨调味基料和复配抗氧化剂(FBFA)以及MNI 应用于风干肠的加工中,探讨几种方式特别是MNI 对风干肠理化性质及安全品质的影响,从而为MNI 在风干肠中的开发应用提供理论参考。
1 材料与方法
1.1 试验材料
VHI-41(木糖葡萄球菌+戊糖片球菌+植物乳杆菌)、PRO-MIX5(木糖葡萄球菌、清酒乳杆菌、类植物乳杆菌),意大利萨科公司;乙腈、二氯甲烷(均为色谱纯)、氯化钠、无水硫酸钠、高氯酸、丹磺酰氯、亚硝酸钠、亚铁氰化钾、乙酸锌、对氨基苯磺酸、盐酸萘乙二胺、盐酸、氢氧化钠、碳酸氢钠、氨水、硼酸、丁基羟基茴香醚(BHA)、乙二胺四乙酸(EDTA)(均为分析纯级),国药集团化学试剂有限公司;配制试剂所用水均为超纯水。
1.2 仪器与设备
Agilent 1200、Agilent 1260 高效液相色谱仪(配备紫外吸收检测器),美国Agilent 公司;CM-5色差仪,日本Konica Minolta 公司;STARTER3100 pH 计,美国Ohaus 公司;CLIMACELL 恒温恒湿箱,艾力特国际贸易有限公司;RE-2000A 旋转蒸发仪、LC-CCA 冷却液循环泵、SHZ-D 循环水式真空泵,上海力辰仪器科技有限公司;TA-XT plus质构仪,英国Stable Micro Systems 公司;JY69-IIN 超声波细胞破碎仪,西瓦卡精密仪器有限公司。
1.3 方法
1.3.1 FBFA 的制备 参照陈援援等[14]的方法。
1.3.2 MNI 的制备 参照李秀明等[15]的方法。
1.3.3 风干肠的制作 参照陈援援等[14]的方法。
1.3.4 试验设计方案 试验分4 组,1)CK 组:按照1.3.3 节风干肠的基础配方和工艺制作;2)MNI组:在CK 组基础上,加入肉质量0.05%的MNI;3)MNIP 组:在CK 组基础上,加入肉质量0.05%的MNI,并接入20 g/100 kg 的PRO-MIX5 商业复合菌;4)FBFAP 组:在CK 组基础上,加入FBFA,并接入20 g/100 kg 的PRO-MIX5 商业复合菌。
将灌装好的4 组肠放在30 ℃恒温恒湿培养箱中发酵,使4 组肠馅的pH 值降到5.4 左右时,立即将温度调至14~16 ℃,按照陈援援等[14]风干肠制作工艺参数进行为期20 d 的风干成熟过程。在发酵阶段的8 h 后,每隔1 h 取样测定各组样品的pH 值变化,确定发酵终点。在风干成熟的1,5,10,15,20 d 取样,测定4 组样品的pH 值、水分含量、aw、色差、TBARs 值、8 种BAs(色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺和精胺)含量的变化;对于成熟20 d 的终产品,测定9 种NAs(NDMA,NDEA,NMEA,NDPA,NPIP,NPYR,NMOR)含量和亚硝酸盐残留量。
1.3.5 指标测定
1.3.5.1 pH 值 按照GB 5009.237-2016《食品安全国家标准 食品pH 值的测定》[16]中肉及肉制品pH 值测定方法。
1.3.5.2 水分含量 按照GB 5009.3-2016 《食品安全国家标准 食品中水分的测定》[17]中的直接干燥法。
1.3.5.3 aw 用绞肉机将样品绞碎,室温(约20℃)下将肉平铺于玻璃皿上,用智能水分活度仪进行测定。
1.3.5.4 色差值 将剔除肥肉后的样品绞碎置于室温(约20 ℃)下,平衡温度2 h,均匀平铺于玻璃皿中,采用色差仪测定样品的亮度值(L*)和红度值(a*)(正值表示样品色泽偏红,负值表示样品色泽偏绿),测定前用标准白板校正色差仪。每个处理组包含3 个平行试样,结果取平均值。
1.3.5.5 TBARs 值 参照Witte 等[18]的方法,称取5 g 碎肉,加入15 mL 7.5%的三氯乙酸(TCA)混合液(含0.1%BHA,0.1%EDTA),在3 000 r/min 下匀浆30 s 过滤,取2.5 mL 滤液,加入2.5 mL 0.02 mol/L 2-硫代巴比妥酸,摇匀,沸水浴40 min,冷却至室温后,加入3 mL 的氯仿,混匀,在2 ℃,2 000×g 下离心10 min,吸取上层清液,在532 nm波长下测吸光度值。
式中,A——532 nm 波长下的吸光度值;V——样品体积,mL;M——丙二醛相对分子量,72.063;ε——摩尔吸光系数,156 000;1——光程;m——肉样质量(g)。
1.3.5.6 BAs 含量 参照Eerola 等[19]的方法。
1.3.5.7 亚硝酸盐含量 参照GB 5009.33-2016《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》[20]方法测定。
1.3.5.8 NAs 含量 样品前处理参照GB 5009.26-2016《食品安全国家标准 食品中N-亚硝胺类化合物的测定》[21]方法。
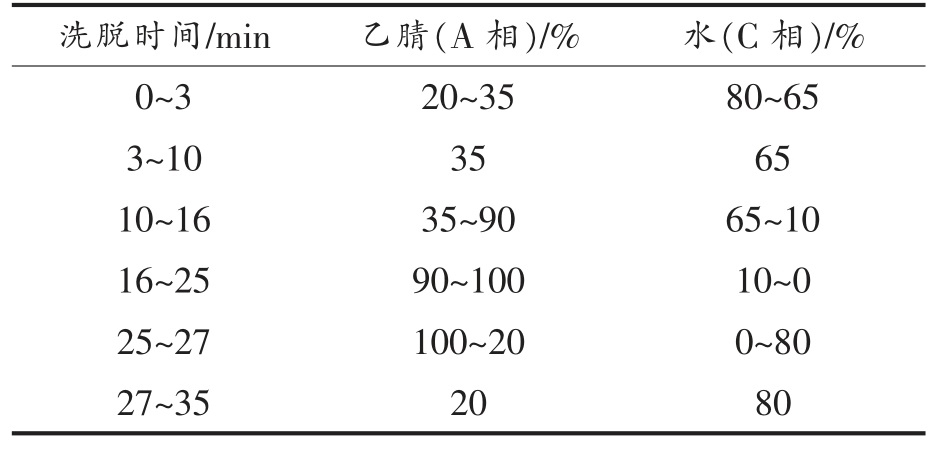
9 种N-亚硝胺的检测方法参照肖付刚等[22]的方法进行,采用安捷伦1260 高效液相色谱仪测定。色谱柱:ZORBAX SB-C18 柱,柱温25 ℃;流速1 mL/min;进样量10 μL;分析时间30 min;后运行时间10 min;紫外检测波长230 nm。流动相梯度洗脱程序见表1 所示。
表1 流动相梯度洗脱程序
Table 1 Mobile phase gradient elution procedure
1.4 数据处理
试验数据以“平均值±标准差”表示,采用SPSS 19.0 软件进行差异显著性分析;采用Origin 10.0 软件作图。
2 结果与分析
2.1 4 组样品在发酵和成熟过程中pH 值的变化
图1a 为4 组样品在发酵阶段pH 值的变化情况,由图1a 可以看出,4 组样品的肉馅体系初始pH 值在6.61~6.68 范围内,随着发酵时间的延长,4 组样品的pH 值均呈不同程度降低的趋势。MNIP 组和MNI 组的pH 值变化呈快速降低趋势,分别在发酵的12.5 h 和15 h,其pH 值降低至5.44 和5.45;而FBFAP 组和CK 组的pH 值呈缓慢降低趋势,分别在发酵的21 h 和22 h,其pH 值才分别降低至5.68 和5.64。pH 值降低至5.4 正好是肌肉蛋白质的等电点,易使肌肉蛋白质凝胶化,且能抑制大多数腐败微生物的生长繁殖[23]。由此可以看出,MNI 和PRO-MIX5 协同作用(MNIP组)可以快速降低肉馅体系的pH 值,对风干肠产品品质和安全有利。
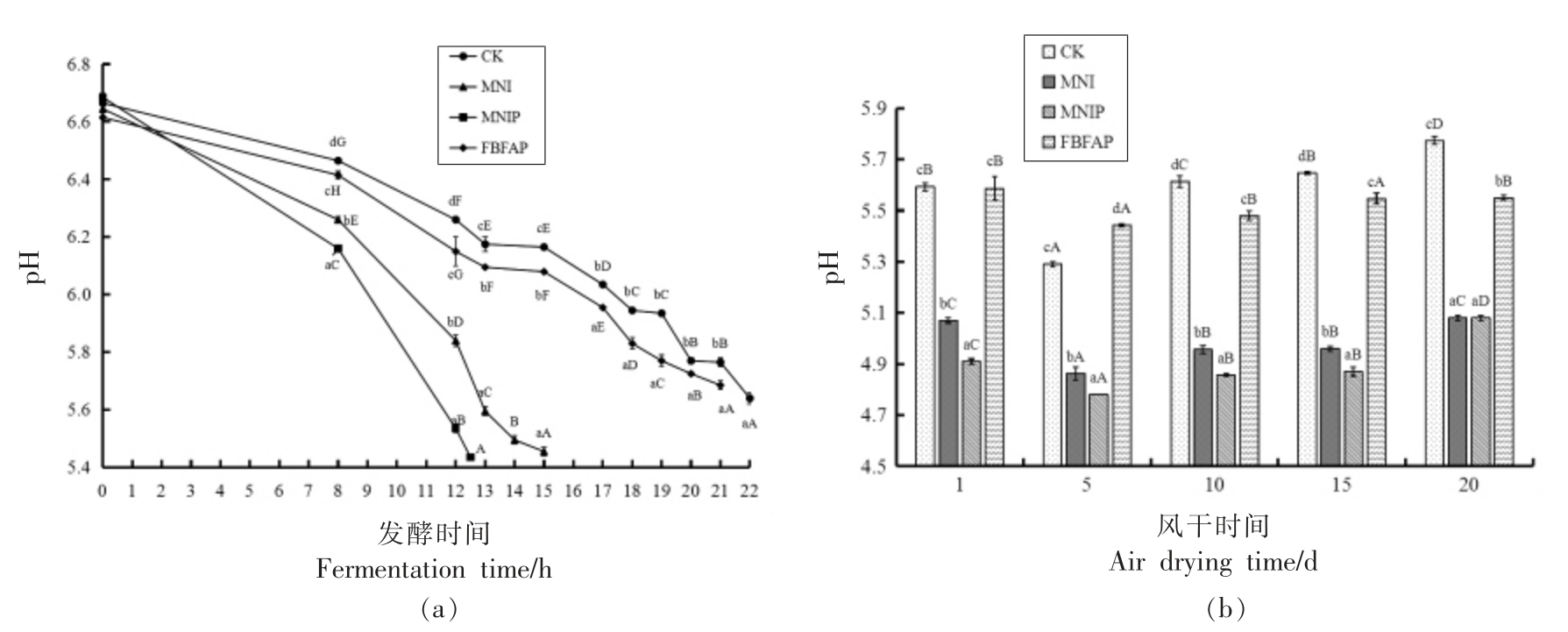
图1 4 组样品在发酵(a)和成熟过程(b)中pH 值的变化
Fig.1 Changes of pH value of 4 groups of samples during fermentation(a)and maturation(b)
注:小写字母不同,表示相同风干时间不同组间差异显著(P<0.05);大写字母不同,表示同一组不同风干时间差异显著(P<0.05)。图2~4 同,表2~3 同。
4 组样品在风干成熟过程中pH 值的动态变化如图1b 所示。由图1b 可以看出,风干第1 天,4组样品的pH 值在4.91~5.59 范围内,到风干成熟的第5 天时,均降到各组样品的极限pH 值(4.78~5.44),此时pH 值由低到高依次为:MNIP
2.2 4 组样品在风干成熟过程中水分含量和aw的变化
图2a、2b 为4 组样品在风干成熟过程中水分含量和aw 的变化情况。由图2 可以看出,4 组样品在风干成熟过程中,其水分含量和aw 均呈现缓慢降低的趋势,然而它们之间的变化规律并不一致,这种差异在于肠内部的水分迁移和风干成熟过程中表面水分的蒸发速率不同所致[26]。另外,由于MNIP 组和MNI 组分别在发酵的12.5 h 和15 h就结束发酵阶段,为了与CK 组和FBFAP 组同步进入风干成熟阶段。CK、MNI、MNIP、FBFAP 组样品在风干成熟的第1 天,水分含量分别为65.10%,69.64%,66.23%,68.53%,到风干终点时缓慢降低到24.75%,28.72%,28.91%,26.13%;aw 由初始的0.901,0.925,0.931,0.926 分别降到0.72,0.767,0.751,0.745。到风干终点时,4 组风干肠的水分含量和aw 均达到风干肠的要求范围0.87~0.75[27],能很好地抑制大多腐败微生物和致病性微生物的生长繁殖。试验发现,MNI 组和MNIP 的水分含量和aw 在风干终点时均显著高于CK 组和FBFAP组(P<0.05),在产品达到安全的前提下,相对高的水分含量有利于提高风干肠的感官品质,使风干肠不至于太硬。
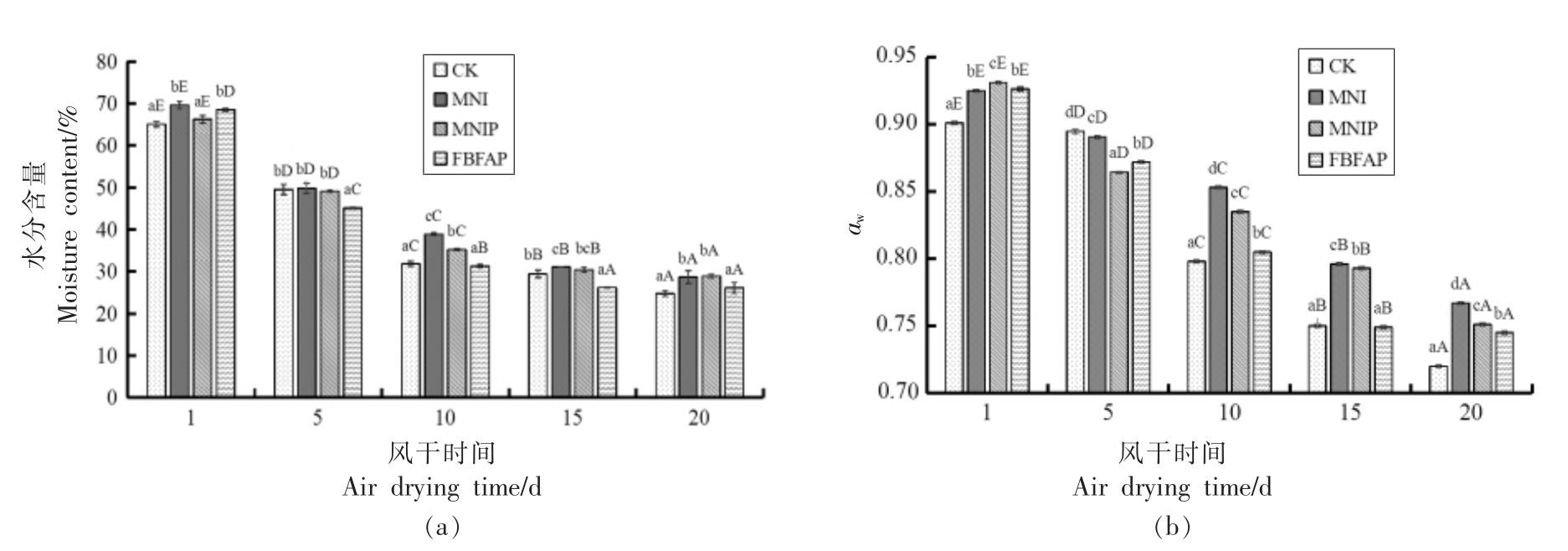
图2 4 组样品在风干成熟过程中水分含量(a)和aw(b)的变化
Fig.2 Changes of moisture content(a)and aw(b)of four groups of samples during air drying and maturation
2.3 4 组样品在风干成熟过程中色泽的变化
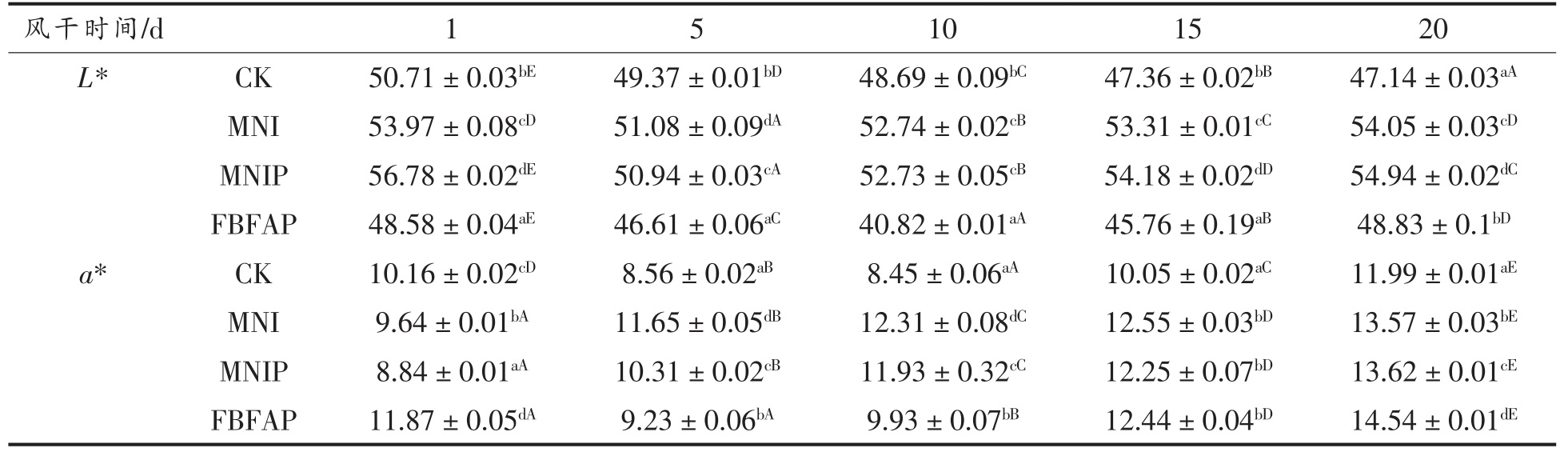
风干肠外表颜色是影响消费者购买欲的关键因素。4 组样品在风干成熟过程中色泽的变化见表2,由表2 可以看出,随着风干成熟过程的进行,各组的a*值有升高趋势,a*值升高的主要原因:一是由于乳酸菌发酵作用产酸,降低肉馅中的pH 值,促进亚硝酸盐降解和NO 的产生,从而生成更多的NO-Mb,使风干肠的a* 值增加[28];二是由于某些乳酸菌可以将高铁肌红蛋白转化为鲜红色肌红蛋白衍生物[29],如亚硝基肌红蛋白、氧合肌红蛋白等。到风干成熟第20 天时,4 组风干肠成品L*值大小关系为MNIP>MNI>FBFAP>CK,a*值大小关系为FBFAP>MNIP>MNI>CK,可以看出在肉馅中分别加入MNI、MNI+PRO-MIX5 或PROMIX5+FBFA 均能明显提高风干肠的L* 值和a*值,对风干肠的颜色有改善作用,这与李秀明等[30]研究的PRO-MIX5 商业复合菌能提高发酵红肠的a*值及陈援援等[31]研究的FBFA 能提高风干肠a*值的结果一致。PRO-MIX5 商业复合菌中含有木糖葡萄球菌,Morita 等[32]和Li 等[33]研究表明木糖葡萄球菌能产生一氧化氮合酶,转化高铁肌红蛋白(Met-Mb)为NO-Mb,进而提高风干肠的a*值。MNI 组虽未接入商业发酵剂,但该组的a*值也大于CK 组,这是因为MNI 是由PRO-MIX5 商业复合菌发酵后制备的菌体碎片,对风干肠色泽的形成也起到一定的有利作用。
表2 4 组样品在风干成熟过程中色泽的变化
Table 2 Color changes of 4 groups of samples during air drying and ripening
2.4 4 组样品在风干成熟过程中TBARs 值的变化
TBARS 含量反映了脂质过氧化物和多不饱和脂肪酸氧化过程中,形成的过氧化物的降解产物之一丙二醛的含量,被广泛用作脂质氧化程度的指标,并被认为是风干肠的重要质量指标。4 组样品在风干成熟过程中TBARs 值的变化如图3所示。风干成熟第1 天时,CK、MNI、MNIP、FBFAP的初始TBARs 值分别为0.21,0.20,0.20,0.23 mg/kg,随着风干成熟过程的进行,4 组样品的丙二醛含量在逐渐增加,此现象归因于风干肠的部分脱水和不饱和脂肪酸的氧化所致。从风干成熟的第5~20 天,CK 组的丙二醛含量始终显著高于3 个试验组(P<0.05),到风干终点时,4 组风干肠成品中丙二醛含量大小关系为CK>FBFAP>MNIP≈MNI,说明加入MNI、MNIP、FBFAP 对风干肠有较好的抗氧化效果,MNI 作为PRO-MIX5 复合乳酸菌的细胞破碎物,研究表明,存在于细菌细胞表面的肽聚糖[34]、表层蛋白[35]和胞外多糖[36]作为免疫刺激分子维持低活性氧水平。Adesulu-Dahunsi 等[37]试验表明乳酸菌产生的胞外多糖具有抗氧化的作用,Zhang 等[38]的研究结果表明,植物乳杆菌C88胞外多糖具有抗氧化作用,可能与清除活性氧和减少脂质过氧化有关。此外,一些乳酸菌能产生抵御高活性氧水平的蛋白质,包括过氧化氢酶、超氧化物歧化酶和谷胱甘肽过氧化物酶[39]。
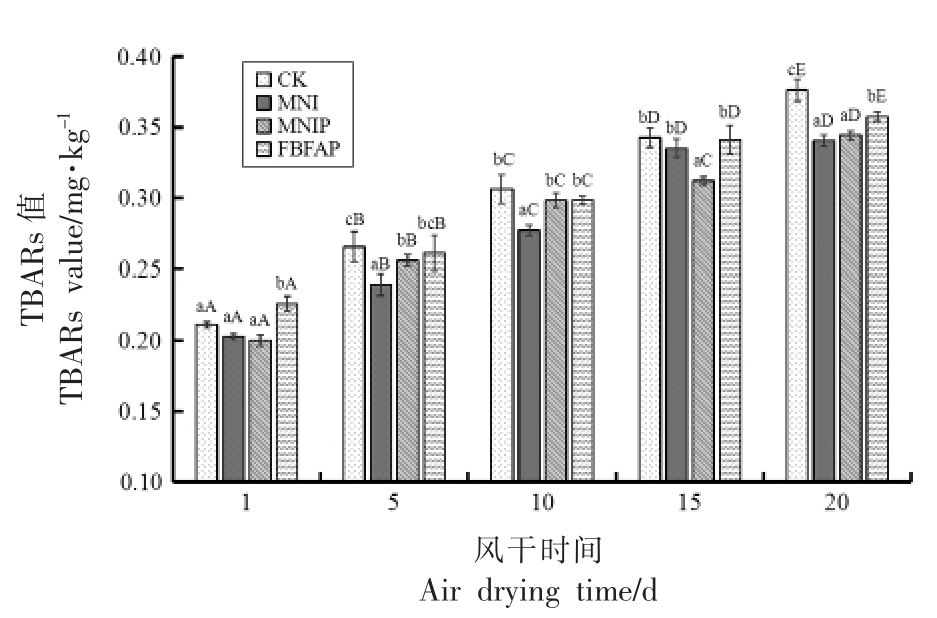
图3 4 组样品在风干成熟过程中TBARs 值的变化
Fig.3 Change of TBARs value of 4 groups of samples during air drying and maturation
2.5 4 组样品在风干成熟过程中生物胺含量的变化
BAs 是含氮的有机碱,常见的有组胺、酪胺、腐胺、尸胺、色胺、苯乙胺、亚精胺和精胺8 种。在低浓度下,BAs 对机体某些代谢和生理功能至关重要,可作为激素或神经递质,帮助调节免疫系统、肠道健康和温度[40],然而,当BAs 在体内大量积累时,它们会引起不同的毒性症状,如头痛、低血压、高血压、恶心、心悸、呼吸困难和出汗等[41]。4组样品在风干成熟过程中,8 种BAs 含量的变化见图4。

图4 4 组样品在风干成熟过程中组胺(a)、酪胺(b)、腐胺(c)、尸胺(d)、色胺(e)、苯乙胺(f)、亚精胺(g)和精胺(h)含量的变化
Fig.4 Changes of histamine(a),tyramine(b),putrescine(c),cadaverine(d),tryptamine(e),phenylethylamine(f),spermidine(g)and spermine(h)in four groups of samples during air drying and maturation
组胺和酪胺被认为是食品中毒性最大的BAs,与食品安全相关[42]。目前,大量研究者指出符合良好卫生和生产规范的组胺水平为50~100 mg/kg,酪胺为100~800 mg/kg[43]。4 组样品组胺含量在风干成熟的第1 天为5.39~16.48 mg/kg,随着风干成熟过程的进行呈不同程度的增加趋势,到成熟终点时增加到8.60~49.72 mg/kg,其大小关系为:CK(49.72 mg/kg)>FBFAP(40.97 mg/kg)>MNI(19.92 mg/kg)>MNIP(8.60 mg/kg),如图4a 所示。酪胺含量在CK、MNI、FBFAP 组中,随着风干成熟时间的延长而增加,MNIP 组在成熟的第1 天没有检出酪胺,且随着成熟时间的延长MNIP 组酪胺含量为先增加后降低的趋势。到成熟终点时,4 组风干肠酪胺含量大小关系依次为:CK(34.77 mg/kg)>FBFAP(32.14 mg/kg)>MNI(21.18 mg/kg)>MNIP(0.92 mg/kg),如图4b 所示。由此可以看出,在整个风干成熟过程中,4 组风干肠组胺和酪胺含量均低于限量规定值,充分保证了产品的安全性,其中3 组试验组风干肠组胺和酪胺的含量均显著低于CK 组(P<0.05),加入的MNI、MNIP、FB FAP 对风干肠成品组胺的抑制率分别达到59.95%,82.71%,17.60%,对酪胺的抑制率分别为39.08%,97.36%,7.56%。相比较而言,加入MNIP对风干肠成品组胺和酪胺的抑制效果最佳。这是因为MNIP 组添加有MNI 和PRO-MIX5 商业发酵剂,MNI 和发酵剂具有协同增效作用,能在30℃条件下发酵,使肉馅体系pH 值在较短时间内快速降低,通过抑制腐败微生物的生长繁殖来阻止组胺和酪胺的积累,达到提高风干肠安全品质的目的。
有报道称腐胺和尸胺可能有助于形成致癌的杂环N-亚硝胺[11],其产生与革兰氏阴性菌关系密切,主要是肠杆菌和假单胞菌的作用[44]。由图4c可知,在成熟的前15 d,4 组样品中腐胺的浓度呈现不同的增幅,3 个试验组样品中腐胺浓度均显著低于CK 组(P<0.05)。到风干成熟终点时,MNI、MNIP、FBFAP 组风干肠中腐胺浓度分别比CK 组低74.49%,87.97%,0.73%,试验说明加入的MNI、MNIP 对腐胺有较好的抑制效果,分析其原因,可能是这两组风干肠肉馅体系在发酵阶段清酒乳杆菌和木糖葡萄球菌大量繁殖,Lee 等[45]报告称清酒乳杆菌和木糖葡萄球菌可通过产生胺氧化酶降解发酵过程中形成的BAs。尸胺可以作为食品安全的卫生指标[46]。由图4d 可以看出,在风干成熟的前15 d,CK 组中尸胺从18.94 mg/kg 增加到36.76 mg/kg,3 组试验组从15.43~18.83 mg/kg 增加到18.25~33.70 mg/kg。到成熟终点时,MNIP 组没有检出尸胺,MNI 组和FBFAP 组尸胺含量分别为30.23 mg/kg 和34.94 mg/kg,明显低于CK 组(36.96 mg/kg),其抑制率分别为18.20%和5.5%。
色胺和苯乙胺是食品中常见的生物胺,它们的存在分别归因于色氨酸和苯丙氨酸在微生物脱羧酶的脱羧作用下产生[47]。图4e 是4 组样品在风干成熟过程中,色胺含量的变化情况,在成熟的第1 天,4 组样品的色胺含量在1.29~1.41 mg/kg,随着风干时间的延长,色胺呈缓慢升高的趋势,3 组试验组样品中色胺含量显著低于CK 组(P<0.05),到成熟终点时,4 组风干肠色胺含量的大小关系为:CK(2.76 mg/kg)>FBFAP(1.69 mg/kg)>MNIP(1.59 mg/kg)≈MNI(1.49 mg/kg)组,说明加入MNI、MNIP、FBFAP 有利于抑制风干肠中色胺的形成。苯乙胺在4 组风干肠成熟过程中的动态变化如图4f 所示,CK、MNI、MNIP、FBFAP 组苯乙胺在风干成熟过程中,没有规律性变化,到成熟终点时,MNI 组没有检出苯乙胺。
4 组样品风干成熟过程中亚精胺和精胺水平保持相对稳定,分别在1.45~1.82 mg/kg(图4g)和10.98~23.23 mg/kg(图4h)范围,这与Santiyanont等[48]和Kala 等[49]的研究结果一致。Bover-Cid 等[50]研究表明精胺和亚精胺可能是为某些微生物生长繁殖提供氮源,因此认为这两种BAs 或许不与微生物的活动有关,而是肉产品中本身含有的。
2.6 4 组风干肠成品的NAs 含量和亚硝酸盐残留量
4 组风干肠成品的NAs 含量和亚硝酸盐残留量见表3。由表3 可知,4 组风干肠成品中亚硝酸盐含量均比较低,最高的MNI 组中亚硝酸盐残留量只有4.34 mg/kg,远低于国家限量标准30 mg/kg,主要是亚硝酸盐在风干肠发酵和成熟过程中起着发色、抑菌、抗氧化等作用被消耗,使含量降低,这与Du 等[51]的研究结果一致,在成熟过程中,亚硝酸盐残留量很低,就能减少NAs 的生成,可有效提高产品的安全性。
表3 4 组风干肠成品的NAs 含量和亚硝酸盐残留量
Table 3 Content of NAs and nitrite residue in finished products of 4 groups of air dried sausages
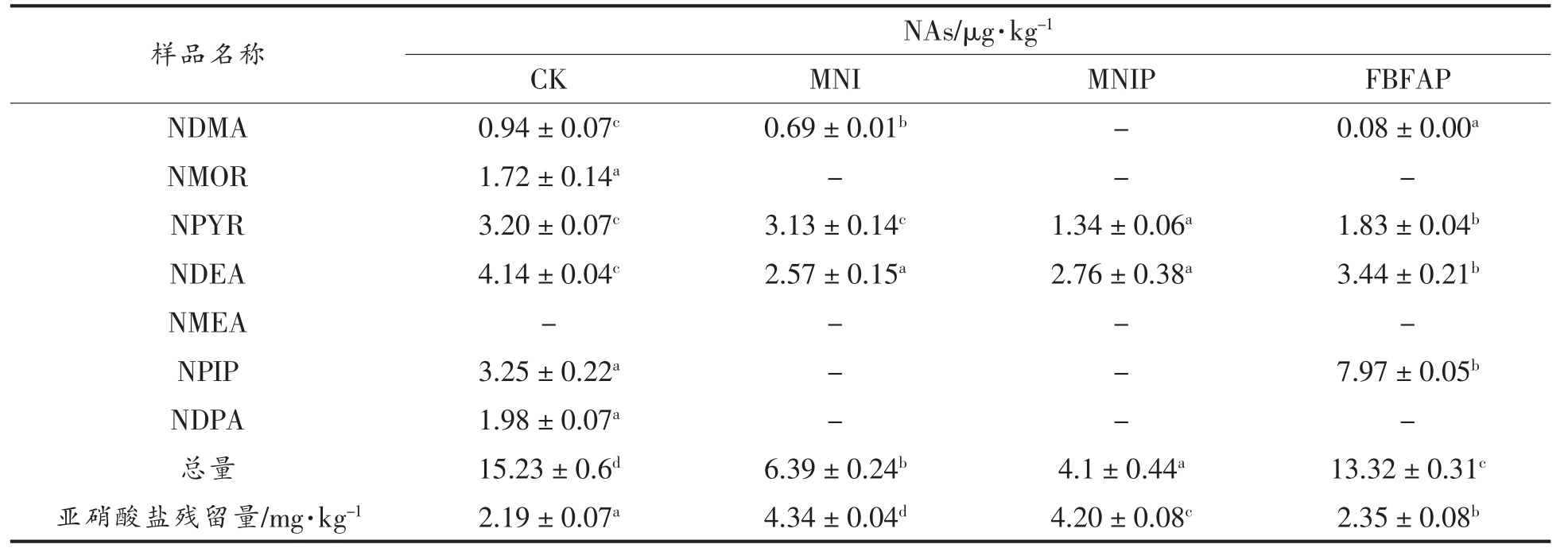
注:“-”表示未检出。
NAs 因其强致癌性和广泛存在而越来越引起人们的重视,NDMA、NDEA、NPIP 和NPYR 是食品中发现的最常见的NAs 致癌物[52],其中NDMA和NDEA 的毒性最强,被国际癌症研究机构(IARC)定义为2A 类致癌物。从表3 可以看出,4组风干肠中均未检出NMEA,CK 组检测出6 种NAs,MNI、MNIP 和FBFAP 组分别检测出3 种、2种和4 种NAs。与CK 组相比,使用MNIP 生产出的风干肠对7 种NAs 有明显的抑制效果(P<0.05),MNI 除对NPYR 的抑制效果不显著外,对其余6种NAs 均有显著的抑制作用(P<0.05)。FBFAP 组会导致NPIP 含量的增加,然而对其余6 种NAs均有显著的抑制效果(P<0.05)。4 组风干肠NAs总量大小关系为:CK(15.32)>FBFAP(13.32)>MNI(6.39)>MNIP(4.10)。试验表明,加入MNI、MNIP、FBFAP 能显著降低风干肠中NAs 总量,这与李秀明等[15]和刘璐璐等[53]研究加入0.05%的MNI 能显著抑制红肠和培根中NAs 总量的研究结果一致。其中MNIP 和MNI 组对NAs 的抑制效果最好,这是因为加入的MNI 含有细胞壁细胞膜碎片、细胞器和包涵体等物质,可作为群体感应的信号分子,能调控风干肠肉馅中的微生物群体,加速对NAs的抑制或者分泌代谢物降解NAs。PRO-MIX5 含有清酒乳杆菌和类植物乳杆菌,Nowak 等[54]研究表明乳杆菌(短乳酸杆菌0945、干酪乳杆菌114001)细胞内提取物中发生的酶促反应可能参与NAs 的消除。肖亚庆[55]研究表明戊糖乳杆菌R3降解NDMA 和NDEA 的原因是通过代谢作用,且进一步研究发现位于该菌株细胞壁最外层的蛋白可能本身是NAs 的降解酶或者为NAs 降解酶提供附着位点。Grill 等[56]报道在磷酸盐缓冲液中具有酶活性的长双歧杆菌bb536 胞内提取物,可以在体外代谢NDMA、NPIP 和NPYR,此外研究还表明菌株细胞壁上的表面蛋白是NAs 减少的原因。然而,关于MNI 可以抑制NAs 形成的机理、菌体表面蛋白质的特性和还原反应的分子证据等还需要进一步深入研究。
3 结论
在接种含PRO-MIX 的情况下加入MNI 有利于风干肠肉馅在较短的时间内pH 值降到5.4,且在整个成熟阶段含有MNI 的两组风干肠的pH 值始终维持在较低水平5.08,这有利于提高风干肠的安全品质。到风干终点时,MNI 组和MNIP 组水分含量和aw 在一般风干肠要求的范围内,而高于CK 和FBFA 组,有利于获得较好的感官品质;与CK 组相比,加入MNI、MNIP 和FBFAP 能显著提高的风干肠成品的L* 和a*,降低TBARs 值,有明显的发色和抗氧化作用。MNI 组除对亚精胺没有抑制作用以外,对其余的7 种生物胺均有明显的抑制效果,MNIP 组对色胺、腐胺、尸胺、组胺和酪胺有较好的抑制作用。FBFAP 组对色胺、尸胺、组胺和酪胺有抑制作用。4 组风干肠亚硝酸钠含量远低于国家限量标准,MNI、MNIP 和FBFAP 组能有效的抑制风干肠的NAs 形成,对NAs 的抑制率分别为58.04%,73.08%和13.14%。MNIP 组的抑制效果最好,说明MNI 和PRO-MIX 发酵剂协同作用对风干肠NAs 的形成有显著的抑制作用。综上所述,加入MNIP 能很好的提高风干肠的理化性质和安全品质。
[1] WANG X,ZHANG Y,REN H,et al.Comparison of bacterial diversity profiles and microbial safety assessment of salami,Chinese dry-cured sausage and Chinese smoked -cured sausage by high -throughput sequencing[J].LWT,2018,90:108-115.
[2] RUSSO P,CAPOZZI V,SPANO G,et al.Metabolites of microbial origin with an impact on health:Ochratoxin A and biogenic amines[J].Frontiers in Microbiology,2016,7:482.
[3] BAKA A M,PAPAVERGOU E J,PRAGALAKI T,et al.Effect of selected autochthonous starter cultures on processing and quality characteristics of Greek fermented sausages[J].LWT-Food Science and Technology,2011,44(1):54-61.
[4] BONOMO M G,RICCIARDI A,SALZANO G.Influence of autochthonous starter cultures on microbial dynamics and chemical-physical features of traditional fermented sausages of Basilicata region[J].World Journal of Microbiology and Biotechnology,2011,27(1):137-146.
[5] BEDIA M,MÉNDEZ L,BAÑÓN S.Evaluation of different starter cultures(Staphylococci plus Lactic Acid Bacteria)in semi-ripened Salami stuffed in swine gut[J].Meat Science,2011,87(4):381-386.
[6] TALON R,LEROY S,LEBERT I.Microbial ecosystems of traditional fermented meat products:The importance of indigenous starters[J].Meat Science,2007,77(1):55-62.
[7] BASSI D,PUGLISI E,COCCONCELLI P S.Comparing natural and selected starter cultures in meat and cheese fermentations[J].Current Opinion in Food Science,2015,2:118-122.
[8] TWIDDY D R,CROSS S J,COOKE R D.Parameters involved in the production of lactic acid preserved fish‐starchy substrate combinations[J].International Journal of Food Science &Technology,1987,22(2):115-121.
[9] YIN L J,JIANG S T.Pediococcus pentosaceus L and S utilization in fermentation and storage of mackerel sausage[J].Journal of Food Science,2001,66(5):742-746.
[10] HU Y,XIA W,LIU X.Changes in biogenic amines in fermented silver carp sausages inoculated with mixed starter cultures [J].Food Chemistry,2007,104(1):188-195.
[11] EI ADAB S,WADDA W B,TEKIKI A,et al.Effect of mixed starter cultures on biogenic amine formation during the ripening of tunisian dry fermented camel meat sausage[J].Italian Journal of Food Science,2020,32(2):321-336.
[12] 李秀明,刘静静,闫利娟,等.乳酸菌抑制N-亚硝胺形成的机理探究及应用效果[J].食品科学,2020,41(2):141-147.LI X M,LIU J J,YAN L J,et al.Inhibition mechanism and application of lactic acid bacteria on N-nitrosamine formation[J].Food Science,2020,41(2):141-147.
[13] XIAO Y,LI P,XU M,et al.Decrease of N-nitrosodimethylamine and N -nitrosodiethylamine by Lactobacillus pentosus R3 is associated with surfacelayer proteins[J].Annals of Microbiology,2018,68(1):27-34.
[14] 陈援援,符慧靖,罗巧枝,等.微生物亚硝化抑制剂对风干肠发酵成熟期间微生物菌落变化的影响及其感官评价分析[J].现代食品科技,2022,38(7):79-89.CHEN Y Y,FU H J,LUO Q Z,et al.Effects of microbial nitrosation inhibitors on the changes of microbial colony during the fermentation and maturation of air dried sausage and sensory evaluation analysis[J].Modern Food Science and Technology,2022,38(7):79-89.
[15] 李秀明,常娅妮,吴晨燕,等.微生物亚硝化抑制剂对红肠品质的影响[J].肉类研究,2019,33(2):13-18.LI X M,CHANG Y N,WU C Y,et al.Effects of microbial nitrification inhibitors on the quality of red sausage[J].Meat Research,2019,33(2):13-18.
[16] 中华人民共和国国家卫生和计划生育委员会.食品安全国家标准 食品pH 值的测定:GB 5009.237-2016[S].北京:中国标准出版社,2016:1-4.National Health and Family Planning Commission of the People's Republic of China.National standard for food safety.Determination of pH value of food:GB 5009.237 -2016 [S].Beijing:China Standards Press,2016:1-4.
[17] 中华人民共和国国家卫生和计划生育委员会.食品安全国家标准 食品中水分的测定:GB 5009.3-2016[S].北京:中国标准出版社,2016:1-2.National Health and Family Planning Commission of the People's Republic of China.National food safety standard.Determination of moisture in food:GB 5009.3-2016[S].Beijing:China Standards Press,2016:1-2.
[18] WITTE V C,KRAUSE G F,BAILEY M E.A new extraction method for determining 2 -thiobarbituric acid values of pork and beef during storage[J].Journal of Food Science,1970,35(5):582-585.
[19] EEROLA S,HINKKANEN R,LINDFORS E,et al.Liquid chromatographic determination of biogenic amines in dry sausages[J].Journal-AOAC International,1993,76(3):575.
[20] 中华人民共和国国家卫生和计划生育委员会.食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定:GB 5009.33-2016[S].北京:中国标准出版社,2016:2-8.National Health and Family Planning Commission of the People's Republic of China.National food safety standard.Determination of nitrite and nitrate in foods:GB 5009.33-2016[S].Beijing:China Standards Press,2016:2-8.
[21] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.食品安全国家标准 食品中N-亚硝胺类化合物的测定:GB 5009.26-2016[S].北京:中国标准出版社,2016:1-9.National Health and Family Planning Commission of the People's Republic of China,State Food and Drug Administration.National Food Safety Standard.Determination of N-nitrosamines in foods:GB 5009.26-2016[S].Beijing:China Standards Press,2016:1-9.
[22 肖付刚,赵钧馨,孙军涛,等.HPLC 同时检测肉制品中9 种亚硝胺[J].食品科技,2018,43(10):352-356.XIAO F G,ZHAO J X,SUN J T,et al.Screening for 9 nitrosamines in meat products sold in the market by HPLC[J].Food Science and Technology,2018,43(10):352-356.
[23] 龙强,聂乾忠,刘成国.发酵香肠研究进展及展望[J].食品科学,2017,38(13):291-298.LONG Q,NIE G Z,LIU C G.Fermented sausage:Recent progress and prospects[J].Food Science,2017,38(13):291-298.
[24] SLEYTR U B,SCHUSTER B,EGELSEER E M,et al.S-layers:Principles and applications[J].FEMS Microbiology Reviews,2014,38(5):823-864.
[25] GONZÁLEZ-FERNÁNDEZ C,SANTOS E M,Rovira J,et al.The effect of sugar concentration and starter culture on instrumental and sensory textural properties of chorizo-Spanish dry-cured sausage[J].Meat Science,2006,74(3):467-475.
[26] LORENZO J M,FRANCO D.Fat effect on physicochemical,microbial and textural changes through the manufactured of dry-cured foal sausage lipolysis,proteolysis and sensory properties[J].Meat Science,2012,92(4):704-714.
[27] HU Y,ZHANG L,ZHANG H,et al.Physicochemical properties and flavour profile of fermented dry sausages with a reduction of sodium chloride[J].LWT,2020,124:109061.
[28] LUO Z,GASASIRA V,HUANG Y,et al.Effect of Lactobacillus salivarius,H strain isolated from Chinese dry-cured ham on the color stability of fresh pork[J].Food Science &Human Wellness,2013,2(3/4):139-145.
[29] LI Y W,XUE J L,XIAO H Y,et al.Conversion of metmyoglobin to bright red myoglobin derivatives by lactic acid bacteria[J/OL].DEStech Transactions on Environment,Energy and Earth Sciences,2016:434-438.[2021-10-18] https://www.researchgate.net/publication/326756380.
[30] 李秀明,周伟,鲍佳彤,等.不同乳酸菌发酵剂对发酵红肠品质的影响[J].肉类研究,2019,33(7):7-13.LI X M,ZHOU W,BAO J T,et al.Effects of different starter cultures of lactic acid bacteria on the quality of fermented red sausage[J].Meat Research,2019,33(7):7-13.
[31] 陈援援,马凯华,李璐,等.外源抑制物对风干肠风干过程中理化性质及安全品质的影响[J].肉类研究,2020,34(6):14-20.CHEN Y Y,MA K H,LI L,et al.Effects of exogenous inhibitors on physicochemical properties and safety of air-dried sausage during processing[J].Meat Research,2020,34(6):14-20.
[32] MORITA H,SAKATA R,NAGATA Y.Nitric oxide complex of iron(II)myoglobin converted from metmyoglobin by Staphylococcus xylosus[J].Journal of Food Science,1998,63(2):352-355.
[33] LI P,KONG B,CHEN Q,et al.Formation and identification of nitrosylmyoglobin by Staphylococcus xylosus in raw meat batters:A potential solution for nitrite substitution in meat products[J].Meat Science,2013,93(1):67-72.
[34] LEBEER S,VANDERLEYDEN J,DE KEERSMAECKER S C J.Host interactions of probiotic bacterial surface molecules:Comparison with commensals and pathogens[J].Nature Reviews Microbiology,2010,8(3):171-184.
[35] KONSTANTINOV S R,SMIDT H,DE VOS W M,et al.S layer protein A of Lactobacillus acidophilus NCFM regulates immature dendritic cell and T cell functions[J].Proceedings of the National Academy of Sciences,2008,105(49):19474-19479.
[36] KIM Y,OH S,YUN H S,et al.Cell‐bound exopolysaccharide from probiotic bacteria induces autophagic cell death of tumour cells[J].Letters in Applied Microbiology,2010,51(2):123-130.
[37] ADESULU-DAHUNSI A T,SANNI A I,JEYARAM K.Production,characterization and in vitro antioxidant activities of exopolysaccharide from Weissella cibaria GA44[J].LWT,2018,87:432-442.
[38] ZHANG L,LIU C,LI D,et al.Antioxidant activity of an exopolysaccharide isolated from Lactobacillus plantarum C88[J].International Journal of Biological Macromolecules,2013,54:270-275.
[39] NAKAGAWA H,MIYAZAKI T.Beneficial effects of antioxidative lactic acid bacteria[J].AIMS Microbiology,2017,3(1):1.
[40] SUN Q,LV M,HU A,et al.Seasonal variation in the occurrence and removal of pharmaceuticals and personal care products in a wastewater treatment plant in Xiamen,China[J].Journal of Hazardous Materials,2014,277:69-75.
[41] LEE S,YOO M,SHIN D.The identification and quantification of biogenic amines in Korean turbid rice wine,Makgeolli by HPLC with mass spectrometry detection[J].LWT-Food Science and Technology,2015,62(1):350-356.
[42] ZHANG Q,LIN S,NIE X.Reduction of biogenic amine accumulation in silver carp sausage by an amine-negative Lactobacillus plantarum[J].Food Control,2013,32(2):496-500.
[43] LI C,ZHAO Y,WANG Y,et al.Microbial community changes induced by Pediococcus pentosaceus improve the physicochemical properties and safety in fermented tilapia sausage[J].Food Research International,2021,147:110476.
[44] SUN Q,CHEN Q,LI F,et al.Biogenic amine inhibition and quality protection of Harbin dry sausages by inoculation with Staphylococcus xylosus and Lactobacillus plantarum[J].Food Control,2016,68:358-366.
[45] LEE Y C,KUNG H F,HUANG C Y,et al.Reduction of histamine and biogenic amines during salted fish fermentation by Bacillus polymyxa as a starter culture[J].Journal of Food and Drug Analysis,2016,24(1):157-163.
[46] CHANG M,CHANG H C.Development of a screening method for biogenic amine producing Bacillus spp[J].International Journal of Food Microbiology,2012,153(3):269-274.
[47] LADERO V,LINARES D M,PÉREZ M,et al.Biogenic amines in dairy products[J/OL].Microbial Toxins in Dairy Products,2017:94-131.[2021-10-18] https://doi.org/10.1002/9781118823095.ch4.
[48] SLANTIYANONT P,CHANTARASAKHA K,TEPKASIKUL P,et al.Dynamics of biogenic amines and bacterial communities in a Thai fermented pork product Nham[J].Food Research International,2019,119:110-118.
[49] KALAC P,KRAUSOVÁ P.A review of dietary polyamines:Formation,implications for growth and health and occurrence in foods[J].Food Chemistry,2005,90(1/2):219-230.
[50] BOVER-CID S,IZQUIERDO-PULIDO M,VIDALCAROU M C.Changes in biogenic amine and polyamine contents in slightly fermented sausages manufactured with and without sugar[J].Meat Science,2001,57(2):215-221.
[51] DU S,CHENG H,MA J K,et al.Effect of starter culture on microbiological,physiochemical and nutrition quality of Xiangxi sausage[J].Journal of Food Science and Technology,2019,56(2):811-823.
[52] SALLAN S,KABAN G,![]() et al.Nitrosamine formation in a semi -dry fermented sausage:Effects of nitrite,ascorbate and starter culture and role of cooking[J].Meat Science,2020,159:107917.
et al.Nitrosamine formation in a semi -dry fermented sausage:Effects of nitrite,ascorbate and starter culture and role of cooking[J].Meat Science,2020,159:107917.
[53] 刘璐璐,李秀明,陈援援,等.微生物亚硝化抑制剂对新型培根品质的影响[J].肉类研究,2021,35(2):1-8.LIU L L,LI X M,CHEN Y Y,et al.Effects of microbial nitrosation inhibitors on the quality of new bacon[J].Meat Research,2021,35(2):1-8.
[54] NOWAK A,KUBERSKI S,LIBUDZISZ Z.Probiotic lactic acid bacteria detoxify N-nitrosodimethylamine[J].Food Additives &Contaminants:Part A,2014,31(10):1678-1687.
[55] 肖亚庆.戊糖乳杆菌降N-亚硝胺及其在香肠发酵中的应用研究[D].合肥:合肥工业大学,2018.XIAO Y Q.Decrease of N-nitrosamines by Lactobacillus pentosus R3 and its utilization in sausage fermentation[D].Hefei:Hefei University of Technology,2018.
[56] GRILL J P,CROCIANI J,BALLONGUE J.Effect of Bifidobacteria on nitrites and nitrosamines[J].Let ters in Applied Microbiology,1995,20(5):328-330.