随着果酒行业的兴起和消费者购买习惯的转变,果酒被越来越多的人饮用,包括葡萄酒[1-2]、苹果酒、樱桃酒、桃酒、火龙果酒[3-7]、猕猴桃酒[8-9]等。猕猴桃是我国近10 年一直保持较高增长速度的水果之一,其产量和面积均居世界首位[10],其常见的加工产品猕猴桃果酒,在市场的认可度和附加值较高[11]。有机酸是影响猕猴桃酒质量的一个非常重要的因素[12],其特有的酸味和口感是果酒的主要呈味物质,适量的酸度可以很好地平衡甜味和苦味,过高的有机酸会导致酸味过重,且常伴随酒体粗糙失光、浑浊等不良现象[13-14]。例如,海沃德猕猴桃汁中柠檬酸含量9.19 g/L,占总酸含量的67.7%,苹果酸含量3.66 g/L,酒石酸含量1.63 g/L[15],酸含量过高。分析猕猴桃酒中有机酸成分,并通过有效的技术使猕猴桃酒中有机酸含量适宜尤为重要。
目前,猕猴桃酒降酸的方法主要有化学降酸、物理降酸和生物降酸。其中,化学试剂降酸法的降酸剂及其用量是关键,不适用于猕猴桃酒降酸[16],且不利于满足消费者追求天然、无化学添加的新消费需求。物理降酸成本高昂,应用并不普遍,仅在少数酿酒业发达且能源充足的国家使用。利用生物降酸是现代果酒降酸研究的发展方向[17]。酿造过程中常用乳酸菌进行苹果酸-乳酸发酵,以达到降酸目的,然而,主要针对苹果酸较高的酒体,且乳酸菌在低pH 值、高乙醇环境下生长和发酵缓慢,加之商业乳酸菌剂成本高[18-19],制约了乳酸菌的广泛应用。筛选具有降解柠檬酸、良好发酵性能的酵母菌株是果酒生产中的技术难题。
近年来,研究发现一些非酿酒酵母具有良好的降酸效果,比如卢思言等[20]从蓝靛果果实中筛选出1 株可降解多种有机酸的二孢接合酵母。白玉峰等[21]从赤霞珠葡萄自然发酵汁中分离出具有苹果酸降解能力的酵母,然而,不同酵母菌株降解酸的能力差异显著。陆生伊萨酵母可降解苹果酸和柠檬酸[22],东方伊萨酵母可有效降解柠檬酸[23]。然而,非酿酒酵母在酿造过程中多数存在发酵速率缓慢,对低氧环境耐受性较低等缺点[24-27]。有研究表明,微氧环境可以提高混合发酵葡萄酒的品质和芳香性物质含量,降低乙醇含量,延长非酿酒酵母在混合发酵中的存活时间等,并且通氧会对葡萄酒有机酸代谢存在影响。微通氧会降低非酿酒酵母纯种发酵乳酸和乙酸的含量[28-31],而对东方伊萨酵母柠檬酸代谢的影响还有待研究。
目前,生物降酸是现代果酒绿色酿造的重要发展方向,关于微氧环境对东方伊萨酵母降酸菌株发酵特性以及有机酸代谢的影响研究较少。本研究以实验室保藏菌株为材料,筛选降酸酵母菌株,探究其生物学特性和发酵性能,设置不同氧气环境优化猕猴桃酒酿造工艺,以期获得高效降解柠檬酸的菌株及发酵猕猴桃果酒的最佳酿造工艺,旨在为猕猴桃果酒产业降酸的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料 本研究所用菌株(表1)全部保藏于西北农林科技大学葡萄酒学院酿酒微生物种质资源研究中心,猕猴桃(海沃德)产于陕西眉县猕猴桃基地。
表1 试验筛选菌株
Table 1 Screening strains of experiment

(续表1)

1.1.2 试验试剂 酵母浸粉、蛋白胨、酸水解酪蛋白,北京奥博星生物技术有限责任公司;葡萄糖,天津市科密欧化学试剂有限公司;氢氧化钠、无水乙醇、无水氯化钙,四川西陇科学有限公司;无水柠檬酸,上海阿拉丁生化科技股份有限公司;琼脂粉、无氨基酵母氮源(YNB)、L-精氨酸、L-脯氨酸、色氨酸,北京索莱宝科技有限公司;麦角甾醇,上海源叶生物科技有限公司;吐温-80,天津市天力化学试剂有限公司;肌醇,北京博奥拓达科技有限公司。
1.1.3 试验仪器与设备 恒温培养箱,上海精宏实验设备有限公司;高压蒸汽灭菌锅,日本Tomy公司;Gen5 酶标仪,美国Biotek;高效液相色谱仪(HPLC),日本岛津公司;pH 计,德国sartorius 赛多利斯;PCR 仪,BioRAD 公司。
1.3 试验方法
1.3.1 菌株26S rDNA D1/D2 分子鉴定
1.3.1.1 酵母DNA 提取 用YPD 液体培养基培养酵母2~3 d,取菌液1 mL 于1.5 mL 离心管中。加入200 μL 裂解液A(4 mL TritonX-100,20 mL 10%SDS,4 mL 5 mol/L NaCl,400 μL 0.5 mol/L EDTA,2 mL 1 mol/L Tris-HCl(pH 8.0)定容至200 mL),剧烈摇匀;加入酚-氯仿-异乙醇(25∶24∶1,V∶V∶V)B 200 μL,剧烈摇匀;加入TE 缓冲液C 200 μL,轻微摇匀;12 000 r/min 离心7 min。小心取上清至新的1.5 mL 离心管中,加入无水乙醇1 mL,-20 ℃冰箱冰冻10 min。12 000 r/min 离心2 min,倒掉上清液留沉淀,加入70%乙醇500 μL 悬浮沉淀,12 000 r/min 离心1 min。倒掉上清,干燥,加入20 μL TE 缓冲液。用紫外分光光度计对DNA 浓度和纯度进行检测,以ddH2O 作为对照。
1.3.1.2 基因扩增 通用引物NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和 NL4(5' -GGTCCGTGTTTCAAGACGG-3')进行26S r RNA D1/D2 区的PCR 扩增。PCR 反应体系(25 μL):引物NL1 和NL4 各1 μL,Premix 酶10 μL,1~200 ng/μL 模版DNA 1 μL,ddH2O 补足至25 μL。PCR循环为:预变性95 ℃5 min,变性94 ℃1 min,退火52 ℃1 min,延伸72 ℃1.5 min;循环36 次;72℃补充延伸15 min。扩增产物进行琼脂糖凝胶电泳。PCR 扩增液送至上海生工生物工程技术服务有限公司进行测序,测序得到的菌株DNA 序列经BLAST 软件比对。
将冻存于甘油管中的17 株伊萨属酵母菌株划线于YPD 固体培养基进行纯化培养,在28 ℃下培养48 h 后,挑取单个菌落与YPD 液体培养基,在28 ℃,180 r/min 下培养24 h 制备菌悬液。将制备好的菌悬液以5×105 cells/mL 接种量接种于装有5 mL 柠檬酸培养基的试管中,于28 ℃,150 r/min 条件下培养6 d,每组3 个平行。总酸测定参照GB/T 15038-2006 葡萄酒、果酒通用分析方法[32]测定,采用NaOH 滴定法测定总酸含量(以柠檬酸计)。根据培养前、后总酸质量浓度差计算总酸降解率,酿酒酵母CECA 作为对照菌株。根据菌株总酸降解率的结果,筛选出具有最佳柠檬酸降解率的菌株。
式中,c1——培养前柠檬酸质量浓度(g/L);c2——培养后柠檬酸质量浓度(g/L)。
1.3.2 菌株生物学特性表征 挑取YPD 固体培养基上纯化后的单菌落接种于YPD 培养基中,在30 ℃,180 r/min 下培养24 h 后作为菌悬液使用。
将菌悬液以1×106 cells/mL 分别接种于初始糖质量浓度为100,150,200,250 g/L;酒精体积分数为6%,9%,12%,14%;柠檬酸含量为10,20,30,50,70 g/L 的YPD 培养基中,10,15,20,25 ℃,150 r/min 条件下培养,测定发酵液在600 nm 波长下的吸光值,每组重复2 次。
1.3.3 菌株发酵性能研究 将GS1-1 和对照菌株酿酒酵母(CECA)菌株接种于葡萄模拟汁中,具体配方参照Spiropoulos 等[33]修改。分别于25 ℃,150 r/min 和静置条件下发酵,分析试验菌株的发酵性能,每组重复3 次。每隔24 h 取样监测600 nm 波长下的吸光值和还原糖含量,分析试验菌株的发酵性能及降酸能力。
1.3.4 猕猴桃果酒发酵
1.3.4.1 发酵工艺 将新鲜猕猴桃果实去皮、打浆、榨汁,添加SO2,加入果胶酶(0.02 mL/kg),调整糖度至170 g/L,分装于1 L 的玻璃发酵罐,每个瓶装500 mL 发酵液。按体积分数10%的接种量接入酵母菌种子液,分别在20 ℃下通氧(1.5 L/min,24 h)后静置发酵和不通氧静置条件下进行酒精发酵。期间每隔24 h 测定还原糖含量,发酵结束后,测定酒度、挥发酸、残糖和有机酸等理化指标。
1.3.4.2 理化指标测定 pH、总酸、挥发酸测定:采用pH 计测定pH;参照GB/T 15038-2006 葡萄酒、果酒通用分析方法[32]测定总酸和挥发酸。
残糖测定:利用DNS 法[34]测定残糖。
有机酸测定:采用高效液相离子排阻色谱法[35]测定发酵过程中及发酵结束后有机酸含量。色谱柱:HPX-87H 氢离子柱(300 mm×7.8 mm);色谱条件:流动相:0.01 mol/L H2SO4(HPLC 等级水溶液);流速:0.6 mL/min;柱温:60 ℃室温;检测波长:210 nm;进样量:5 μL。
1.3.4.3 感官分析 参照尹荐等[36]的方法,品尝小组由10 名葡萄酒专业的学生(5 男,5 女)组成,感官分析前对品尝小组进行标准香气物质闻香培训,感官分析试验采用随机区组设计,要求品评员用标准香气特征中的3~4 个特征词汇来描述葡萄酒的香气特征,并用“五点标度法”量化(1 为弱;2为较弱;3 为中等;4 为较强;5 为强)。香气特征的量化强度值(MF,%)为该特征词汇的使用频率(F,%)和强度平均值(I,%)的几何平均数,用如公式(2)计算:
1.4 数据处理
采用SPSS 22.0 进行统计分析,利用最小显著差异法(Least-Significant Difference,LSD)进行差异显著性检验,P<0.01 表示差异极显著,P<0.05表示差异显著。使用Origin 2019b 32Bit 软件作图。
2 结果与分析
2.1 菌株鉴定结果
试验筛选菌株鉴定结果如表1 所示,其中非酿酒酵母均为东方伊萨酵母属(分离自宁夏、新疆、甘肃、陕西),均保藏于来自西北农林科技大学葡萄酒学院。
将供试菌株于柠檬酸培养基(2%柠檬酸)中筛选,结果如图1 所示,所有非酿酒酵母菌株的柠檬酸降解能力均显著高于酿酒酵母(P<0.05),其中菌株GS1-1 具有最高的柠檬酸降解率,其降解率为65.65%。
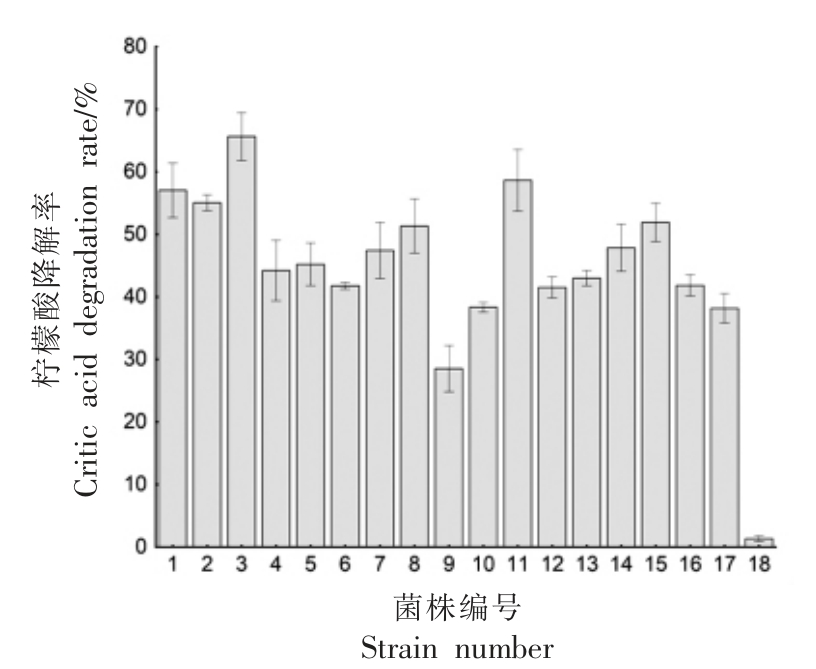
图1 不同菌株的柠檬酸降解率
Fig.1 Citric acid degradation rate of different strains
2.2 菌株生物学特性
筛选菌株生长情况如图2 所示,将筛选所得的菌株GS1-1 和对照菌株酿酒酵母CECA,按照同一接种量接种于不同培养条件下,通过监测其生物量探究其生物特性。糖是酵母发酵的底物,是转化为酒精的主要来源,也为酵母提供能源物质[37]。通常猕猴桃果酒在发酵中由于果实含糖量较低需要调整糖度,研究结果表明初始糖度在20%~24%之间,生长效果较佳[38]。菌株在不同糖含量培养基中的生长情况如图2a 所示,随着糖含量的升高,菌株GS1-1 与CECA 的生长量都呈现先升高后降低的趋势,对照菌株生长量始终高于GS1-1,较高的糖含量会抑制两菌株的生长,研究发现,GS1-1 在糖含量变化过程中生长情况良好,过高的糖浓度并没有对其造成代谢压力。
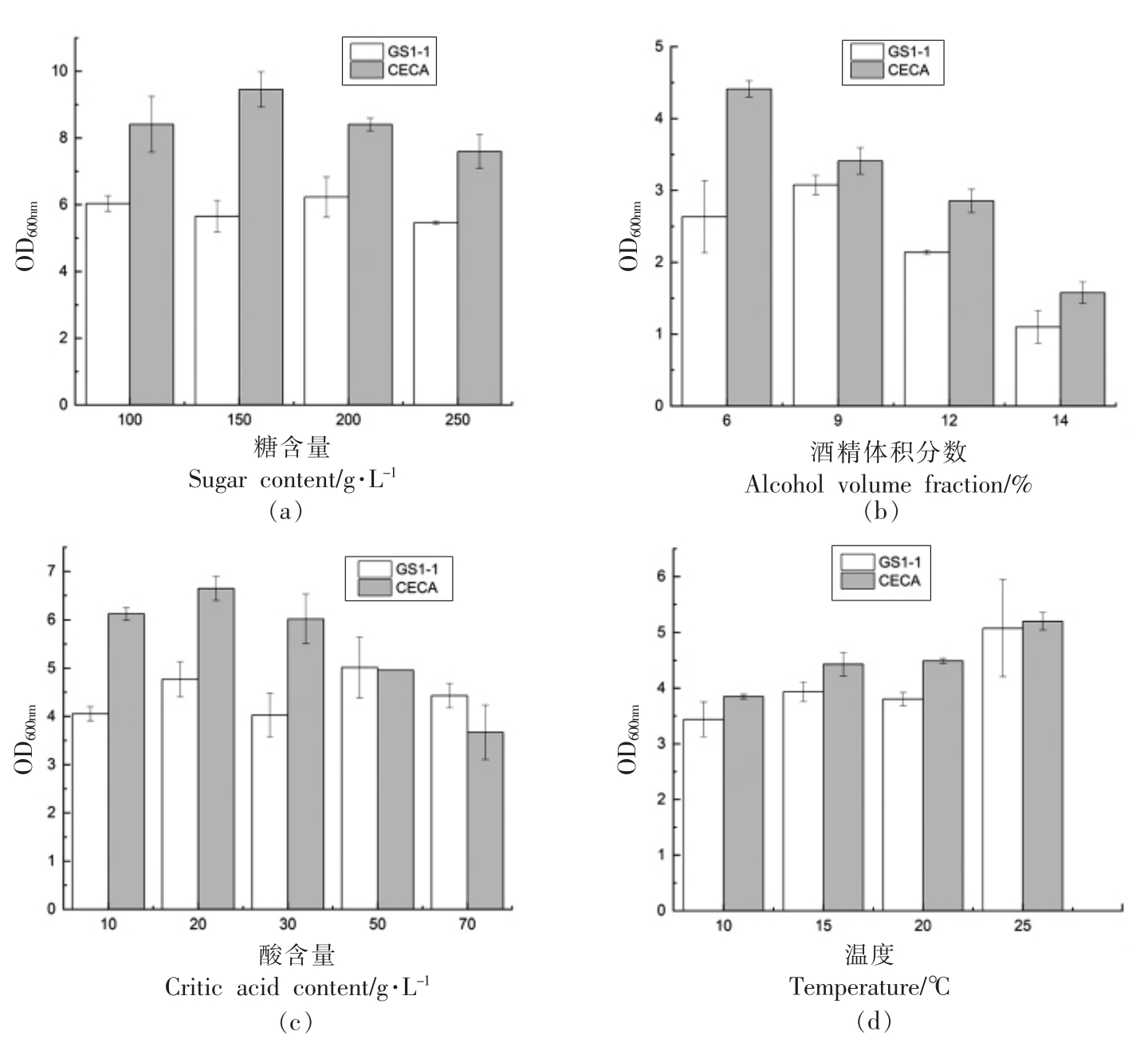
图2 不同糖含量(a)、酒精体积分数(b)、酸含量(c)和温度(d)下菌株的生物量
Fig.2 Biomass of strains in different sugar content(a),alcohol volume fraction(b),acid content(c)and temperature(d)
在果酒发酵过程中,酵母的酒精耐受性是果酒生产的重要特性,发酵过程产生的酒精达到一定程度会抑制酵母生长甚至致死[39-40],导致发酵不能完成。菌株在不同酒精含量培养基中的生长情况如图2b 所示,随着酒精体积分数的升高,CECA的生物量呈降低趋势,而GS1-1 生物量在酒精体积分数为9%时最高,在酒精体积分数大于9%时对生长量有明显的抑制作用。
猕猴桃果实富含有机酸,其中柠檬酸含量占有机酸含量的50%以上,因此酸胁迫在猕猴桃酒发酵过程中尤为重要。本文以酿酒酵母菌株CECA 为对照,探究了非酿酒酵母菌株GS1-1 在不同酸含量培养基中的生长情况,如图2c 所示。两菌株生物量均随柠檬酸含量升高整体呈先升高后降低的趋势,最终GS1-1 生物量显著高于CECA对照(P<0.05)。在酸胁迫下,微生物会形成一种抵御胁迫机制,酵母通过信号分子和信号传导途径进行基因的表达和代谢调整[41]。因此,在相同酸环境下,GS1-1 相较于对照菌株CECA 具有较强的信号传导途径或更佳的抵御机制。
菌株在不同温度下的生长情况如图2d 所示,随着温度升高,两菌株间的生物量差异减小,均在25 ℃达到最大值,张晓萍等[42]发现发酵温度是影响发酵时间和果酒风味的重要因素,发酵温度过高和过低均受到一定水平的抑制,在21 ℃时猕猴桃酒风味等感官评定达到最佳,与GS1-1 发酵适宜温度相近。结果表明,筛选所得高效降酸菌株具有多重环境耐受性,能够满足果酒发酵所需的条件。
2.3 菌株发酵性能
氧分子(O2)是酒精发酵过程中必不可少的营养因子,因为酵母细胞需要氧气才能产生固醇和不饱和脂肪酸,从而显著影响酵母发酵能力和活力[43]。氧气的另一个有益作用,是其可以改变葡萄酒的化学和香气成分。为验证筛选菌株在不同氧环境下的发酵性能,以1×106 cells/mL 接种量将其接种于模拟葡萄汁Triple M 中,以商业化的酿酒酵母CECA 作为对照菌株,在25 ℃下,150 r/min和静置条件下恒温发酵。如图3a、3b 所示,筛选菌株GS1-1 在摇瓶和静置条件下均可完成发酵,摇瓶条件下,发酵速率与CECA 相近,生物量始终高于CECA。而静置条件下,发酵速率慢于对照组,生物量始终显著低于对照菌株(P<0.01)。结果表明,在不同氧气环境下,酵母生长能力和发酵速率有明显差异,微氧可以提高发酵速率。在蒋凯[31]将微通氧引入葡萄糖高浓度乙醇发酵研究中,发现微通氧通过增加酵母细胞总量来提高酿酒酵母的细胞浓度和发酵活力,从而能够缩短发酵时间,提高发酵速率,虽与本试验所采用的发酵培养基不同,但均证明微通氧可以提高发酵速率。
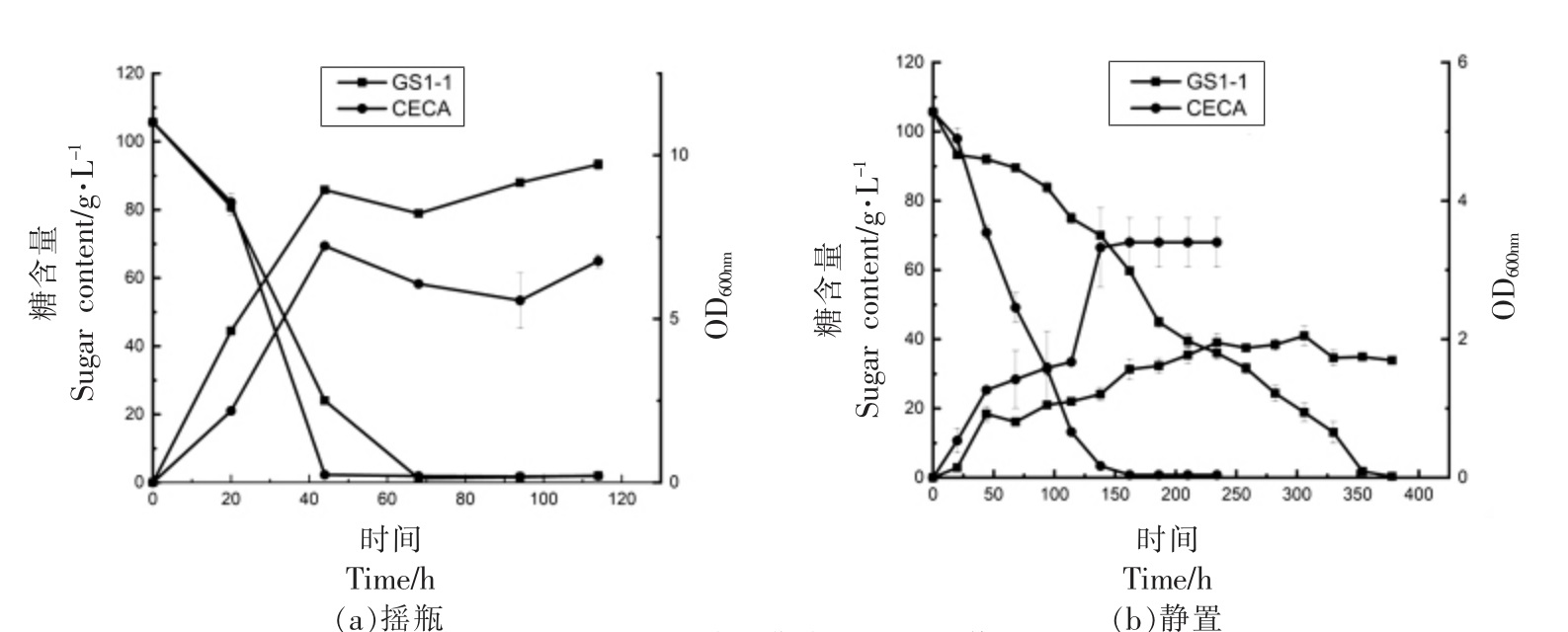
图3 菌株GS1-1、CECA 在不同氧气条件下的发酵曲线和生长曲线
Fig.3 Fermentation and growth curves of strains GS1-1 and CECA in different oxygen conditions
注:从0开始处曲线为OD600nm 值。
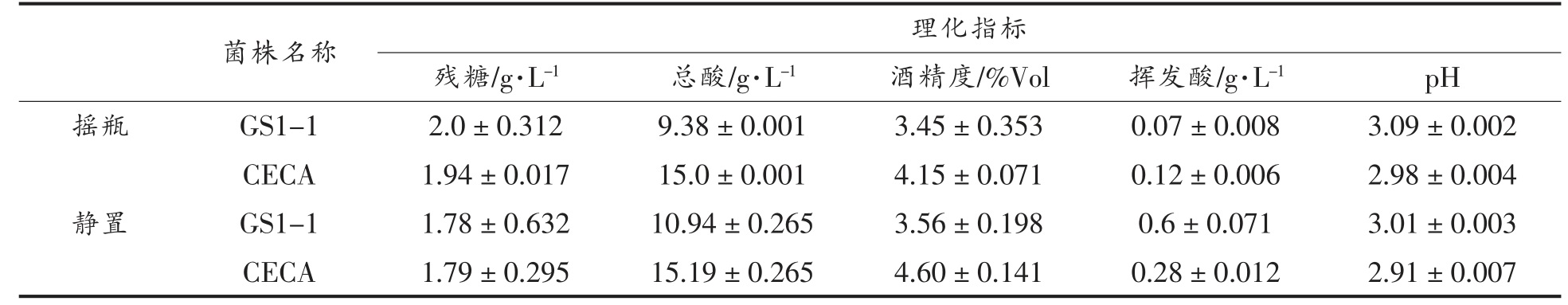
菌株GS1-1 和CECA 在不同氧气环境下发酵模拟葡萄汁的各理化指标结果如表2 所示,模拟葡萄汁初始总酸(以柠檬酸计)为12.374 g/L,残糖至2 g/L 以下视为发酵结束。在不同氧气环境下两菌株均可完成发酵,挥发酸含量在0.07~0.28 g/L 之间,符合国标GB/T 15038-206,属于较低水平。其中,菌株GS1-1 在两种环境下均可降解柠檬酸,在有氧环境下菌株GS1-1 柠檬酸降解率为24.2%,高于静置条件下发酵(11.6%),二者酸含量差异极显著(P<0.01),而CECA 的总酸不降反增,pH 值与酸含量变化一致。
表2 不同氧气环境下两菌株发酵的各项理化指标
Table 2 Various physical and chemical indexes of fermentation of two strains in different oxygen environment
2.4 猕猴桃果酒发酵
在模拟葡萄汁发酵试验中,发现摇瓶发酵时,菌株发酵速率显著高于静置发酵,且酸利用率更高,挥发酸含量较低。因此在果酒发酵中,设置不同氧气环境,探究不同氧气环境下菌株的降酸效果。两菌株在不同氧气环境下的猕猴桃果汁中的发酵曲线如图4 所示,其中,GS1-1 静、GS1-1 1d分别代表静置发酵和以1.5 L/min 流量通氧1 d 后静置发酵的试验组。非酿酒酵母菌株GS1-1 在不同氧气环境下发酵速率虽然较酿酒酵母缓慢,但能够独立完成酒精发酵,可以作为实际生产的优选菌株。由图4 可知,通氧后发酵速率均明显提高,与刘光鹏等[27]和Yan 等[29]研究酵母在通不通氧情况下的发酵速率变化情况一致,刘光鹏等[27]以高浓度木薯粉浆液化滤液为原料,研究微通氧浓醪酒精发酵过程,发现在浓醪酒精发酵过程中,微通氧能够提高酵母细胞活性,进而提高发酵效率。本研究进一步表明微通氧可以提高酵母活性,进而提高发酵速率。
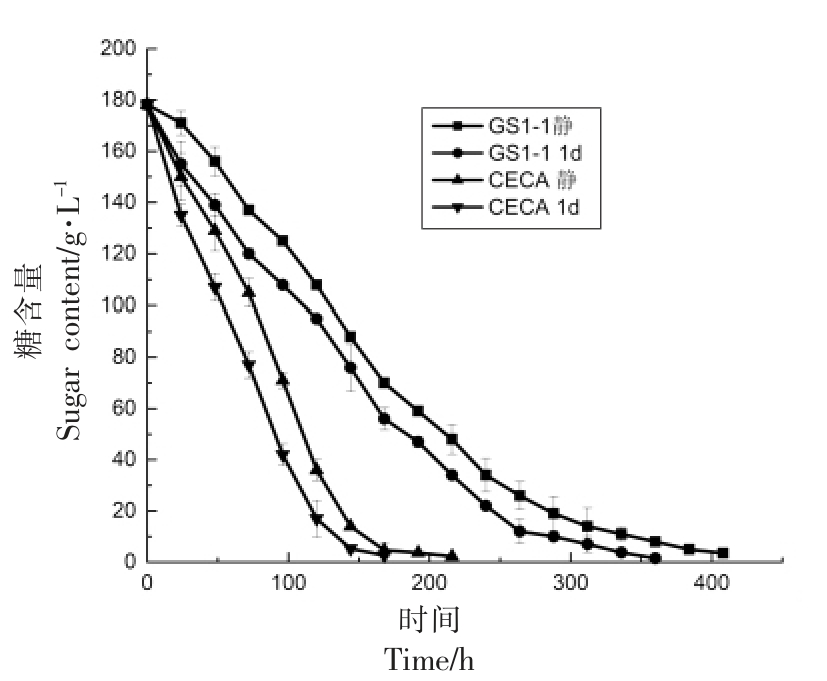
图4 不同氧气环境下猕猴桃酒菌株发酵曲线
Fig.4 Fermentation curves of kiwi fruit wine with strains in different oxygen environments
菌株在不同氧气条件下,发酵猕猴桃酒的理化指标如表3 所示,猕猴桃酒初始总酸为15.84 g/L,柠檬酸含量为9.23 g/L,残糖至4 g/L 以下视为发酵结束。在不同氧气环境下,两菌株均可完成发酵,挥发酸含量在0.23~0.71 g/L 之间,本研究发现非酿酒酵母发酵组前期通氧所得猕猴桃酒挥发酸(以乙酸计)高于静置发酵组,而对照酿酒酵母发酵组前期通氧所得猕猴桃酒挥发酸相比静置组略升高。Jolly 等[44]研究表明发酵期间通氧通常会增加酒体挥发酸的含量,然而各菌株之间存在差异。本研究所用东方伊萨菌株GS1-1 在微通氧条件下会降低挥发酸含量,是后续研究的良好材料。发酵结束后,菌株CECA 对照组总酸和柠檬酸含量略有减少,通氧1 d 试验组中CECA 所得猕猴桃酒的总酸含量为14.96 g/L,柠檬酸含量为8.14 g/L,总酸降解率为5.56%,柠檬酸降解率为11.8%;不通氧(静置)试验组中CECA 所得猕猴桃酒的总酸含量为15.21 g/L,柠檬酸含量为8.37 g/L,总酸降解率为3.98%,柠檬酸降解率为9.32%。菌株GS1-1 试验组的总酸和柠檬酸含量较CECA 均有显著差异(P<0.01),通氧1 d 的试验组中GS1-1所得猕猴桃酒的总酸含量为13.41 g/L,柠檬酸含量为7.12 g/L,总酸降解率为15.34%,柠檬酸降解率为22.9%;不通氧(静置)试验组总酸含量为14.01 g/L,柠檬酸含量为7.59 g/L,总酸降解率为11.56%,柠檬酸降解率为17.77%。
表3 菌株在不同氧气环境下猕猴桃酒发酵的理化指标
Table 3 Physicochemical indexes of kiwi wine fermentation by strains in different oxygen environments
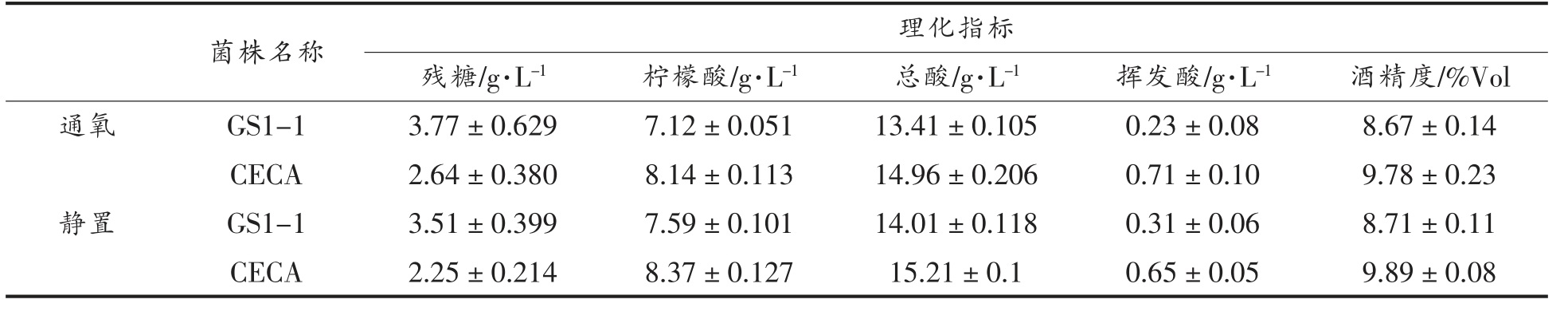
图5 是感官分析得出的供试酒样中5 种典型的香气特征。其中,酿酒酵母处理酒样中温带酸果类强于非酿酒酵母处理酒样,不通氧处理酒样中温带酸果类香气强于微通氧处理。与对照相比,东方伊萨酵母菌株GS1-1 微通氧处理显著(P<0.05)降低了温带酸果类香气,提升了柑橘、热带水果和花香特征。
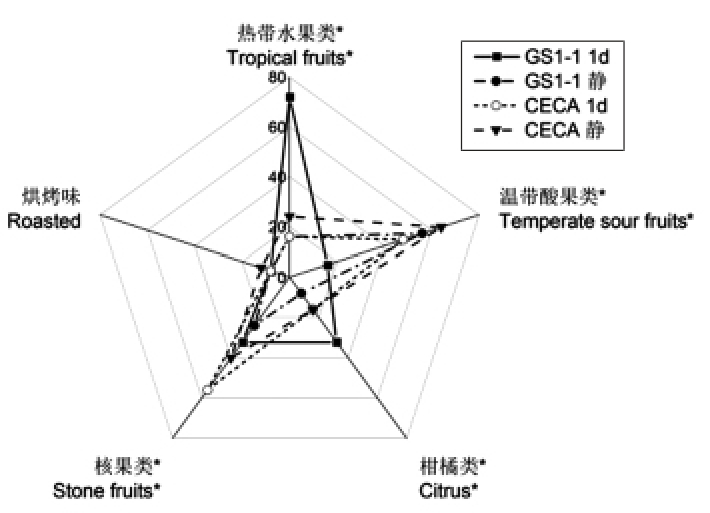
图5 供试酒样香气特征的感官量化分析结果
Fig.5 Sensory quantitative analysis results of the aroma characteristics of the wine samples tested
注:*.表示处理间差异性显著(P<0.05)。
由此可知,通氧可以显著提高菌株有机酸降解率,从而降低果酒中的酸含量,调节果酒风味和口感。目前,通氧对葡萄酒酿造影响的研究主要围绕发酵初期通氧使酵母进行己糖的呼吸作用,减少实际发酵中消耗的糖,进而生产低乙醇含量的葡萄酒,或是在混合发酵中延长非酿酒酵母的存活时间以提高发酵过程中非酿酒酵母的发酵优势[45-49]。少有研究通氧对于降低果酒有机酸含量的影响,本研究通过对比通不通氧条件下菌株的降酸效果,发现通氧可将非酿酒酵母菌株GS1-1 的总酸降解率提高至24.6%。果酒中的有机酸作为主要的呈味物质,对感官质量尤为重要,通过筛选降酸酵母菌株,优化降酸条件,获得最佳降酸菌株和条件,获得口感更佳的果酒对果酒产业意义重大。
3 结论
本研究以柠檬酸为唯一外加碳源的培养基筛选得到具有柠檬酸降解能力的菌株GS1-1,其具有65%的柠檬酸降解率。经鉴定,该菌株属于东方伊萨酵母属。通过对菌株GS1-1 的生物学特性和发酵性能研究表明,该菌株与酿酒酵母菌株具有相近的生长能力,能够独立完成发酵。在有氧环境下能更高效地完成发酵,且具有更高的酸降解率。将菌株GS1-1 用于猕猴桃果酒发酵,以商业化的酿酒酵母菌株CECA 为对照。在相同发酵条件下,菌株CECA 基本不具有降酸能力,而GS1-1 在不通氧的条件下,柠檬酸降解率为17.77%,通氧条件下柠檬酸降解率为22.9%。该菌株具有良好的生长能力和发酵性能,在猕猴桃果酒产业中具有应用潜力。本研究结果表明筛选具有独立发酵能力和发酵品质的非酿酒酵母菌株,优化工艺条件以提高发酵菌株降酸率,对于猕猴桃酒产业有重大意义。
[1] MARTINEZ-GARCIA R,MAURICIO J C,GARCIA-MARTINEZ T,et al.Towards a better understanding of the evolution of odour-active compounds and the aroma perception of sparkling wines during ageing[J].Food Chemistry,2021,357:129784.
[2] ORTIZ-TOVAR G,MINEBOIS R,BARRIO E,et al.Aroma production and fermentation performance of S.cerevisiae x S-kudriavzevii natural hybrids under cold oenological conditions[J].International Journal of Food Microbiology,2019,297:51-59.
[3] LEE J H,KANG T H,UM B H,et al.Evaluation of physicochemical properties and fermenting qualities of apple wines added with medicinal herbs[J].Food Science and Biotechnology,2013,22(4):1039-1046.
[4] XIAO Z B,ZHANG N,NIU Y W,et al.Multivariate classification of cherry wines based on headspace solid phase microextraction and gas chromatography-mass spectrometry of volatile compounds[J].International Journal of Food Properties,2015,18(6):1272-1287.
[5] 何松,任建军,牛东泽,等.阳山水蜜桃非酿酒酵母的筛选、发酵特性及产香气性能的研究[J].食品科技,2021,46(1):1-7.HE S,REN J J,NIU D Z,et al.Study on screening,fermentation characteristics and aroma production performance of Yangshan peach non-Saccharomyces yeast[J].Food Technology,2021,46(1):1-7.
[6] LIU Q Y,WENG P F,WU Z F.Quality and aroma characteristics of honey peach wines as influenced by different maturity[J].International Journal of Food Properties,2020,23(1):445-458.
[7] YU Z H,LI J Q,HE S C,et al.Winemaking characteristics of red-fleshed dragon fruit from three locations in Guizhou Province,China[J].Food Science &Nutrition,2021,9(5):2508-2516.
[8] LIU D,XU J N,CAO Y F,et al.Effect of glutathione-enriched inactive dry yeast on color,phenolic compounds,and antioxidant activity of kiwi wine[J].Journal of Food Processing and Preservation,2020,44(3):1-10.
[9] QI Y M,LIU M M,YANG K,et al.Effect of skin maceration treatment on aroma profiles of kiwi wines elaborated with Actinidia deliciosa "Xuxiang" and A.chinensis "Hortl6A"[J].Journal of AOAC International,2019,102(2):683-685.
[10] 李丽琼,王永平,陈大明,等.我国猕猴桃产业新型经营模式分析与探讨[J].安徽农业科学,2020,48(19):245-247.LI L Q,WANG Y P,CHEN D M,et al.Analysis and discussion on the new operation model of kiwi fruit industry in my country[J].Anhui Agricultural Sciences,2020,48(19):245-247.
[11] 张琛,郗笃隽,刘辉,等.我国猕猴桃果酒酿造工艺及其品质评价研究进展[J].中国酿造,2020,39(10):26-29.ZHANG C,XI D J,LIU H,et al.Research progress on the brewing technology and quality evaluation of kiwi fruit wine in my country[J].China Brewing,2020,39(10):26-29.
[12] LIU N,QIN Y,SONG Y Y,et al.Aroma composition and sensory quality of cabernet Sauvignon wines fermented by indigenous Saccharomyces cerevisiae strains in the eastern base of the Helan mountain,China[J].International Journal of Food Properties,2016,19(11):2417-2431.
[13] 文连奎,赵薇,张微,等.果酒降酸技术研究进展[J].食品科学,2010,31(11):325-328.WEN L K,ZHAO W,ZHANG W,et al.Research progress on the technology of reducing acidity in fruit wine[J].Food Science,2010,31(11):325-328.
[14] 舒学香,周文,隋明.猕猴桃果酒发酵专用酵母的筛选[J].江苏调味副食品,2018(2):9-10,20.SHU X X,ZHOU W,SUI M.Screening of special yeast for kiwi fruit wine fermentation [J].Jiangsu Seasoning and Non-staple Food,2018(2):9-10,20.
[15] 郝雅兰.猕猴桃干酒降酸技术研究[D].杨凌:西北农林科技大学,2014.HAO Y L.Research on acidity reduction technology of kiwi dry wine[D].Yangling:Northwest A&F University,2014.
[16] 王华,李维新.猕猴桃干酒的降酸研究[J].食品科学,2000,21(9):29-31.WANG H,LI W X.Research on decreasing acidity of kiwi dry wine[J].Food Science,2000,21(9):29-31.
[17] 张春晖,夏双梅,莫海珍.微生物降酸技术在葡萄酒酿造中的应用[J].酿酒科技,2000(2):56-58,60.ZHANG C H,XIA S M,MO H Z.Application of microbial acid reduction technology in winemaking[J].Brewing Technology,2000(2):56-58,60.
[18] SUMBY K M,GRBIN P R,JIRANEK V.Implications of new research and technologies for malolactic fermentation in wine[J].Applied Microbiology and Biotechnology,2014,98(19):8111-8132.
[19] DI MARTINO C,TESTA B,LETIZIA F,et al.Effect of exogenous proline on the ethanolic tolerance and malolactic performance of Oenococcus oeni[J].Journal of Food Science and Technology -Mysore,2020,57(11):3973-3979.
[20] 卢思言,曾祥玉,王鑫源,等.蓝靛果中可降解有机酸的酵母菌株筛选及鉴定[J].食品工业科技,2021,42(20):126-133.LU S Y,ZENG X Y,WANG X Y,et al.Screening and identification of yeast strains capable of degrading organic acids in Lonicera edulis[J].Food Industry Technology,2021,42(20):126-133.
[21] 白玉峰,张文霞,田亚楠,等.宁夏贺兰山东麓降L-苹果酸葡萄酒酵母的筛选[J].中国酿造,2021,40(1):49-54.BAI Y F,ZHANG W X,TIAN Y N,et al.Screening of L-malic acid wine yeast at the eastern foot of Helan Mountain in Ningxia[J].China Brewing,2021,40(1):49-54.
[22] 文连奎,王立芳,王贵珍.陆生伊萨酵母降解L-苹果酸和柠檬酸的研究[J].食品科学,2011,32(7):220-223.WEN L K,WANG L F,WANG G Z.Study on the degradation of L-malic acid and citric acid by Issatchenkia terricola[J].Food Science,2011,32(7):220-223.
[23] 郝爱玲,冯莉,秦义,等.降解柠檬酸酵母菌的筛选及其发酵性能研究[J].中国食品学报,2018,18(11):72-80.HAO A L,FENG L,QIN Y,et al.Screening of citric acid degrading yeast and its fermentation performance[J].Journal of Chinese Institute of Food Science and Technology,2018,18(11):72-80.
[24] VISSER W,SCHEFFERS W A,BATENBURG -VAN DER VEGTE W H,et al.Oxygen requirements of yeasts[J].Applied and Environmental Microbiology,1990,56(12):3785-3792.
[25] BLATEYRON L,SABLAYROLLES J M.Stuck and slow fermentations in enology:Statistical study of causes and effectiveness of combined additions of oxygen and diammonium phosphate [J].Journal of Bioscience and Bioengineering,2001,91(2):184-189.
[26] ROSENFELD E,BEAUVOIT B,BLONDIN B,et al.Oxygen consumption by anaerobic Saccharomyces cerevisiae under enological conditions:Effect on fermentation kinetics[J].Applied and Environmental Microbiology,2003,69(1):113-121.
[27] 刘光鹏,王娟,伍时华,等.连续微通氧浓醪乙醇发酵研究[J].食品与生物技术学报,2017,36(6):649-656.LIU G P,WANG J,WU S H,et al.Study on ehanol fermentation of continuous micro-oxygen concentrated mash[J].Journal of Food and Biotechnology,2017,36(6):649-656.
[28] CONTRERAS A,HIDALGO C,SCHMIDT S,et al.The application of non-Saccharomyces yeast in fermentations with limited aeration as a strategy for the production of wine with reduced alcohol content[J].International Journal of Food Microbiology,2015,205:7-15.
[29] YAN G,ZHANG B,JOSEPH L,et al.Effects of initial oxygenation on chemical and aromatic composition of wine in mixed starters of Hanseniaspora vineae and Saccharomyces cerevisiae[J].Food Microbiology,2020,90:103460.
[30] APLIN J J,EDWARDS C G.Impacts of non-Saccharomyces species and aeration on sequential inoculation with Saccharomyces cerevisiae to produce lower alcohol Merlot wines from Washington state[J].Journal of the Science of Food and Agriculture,2021,101(4):1715-1719.
[31] 蒋凯.酿酒酵母GGSF16 微通氧5L 罐高浓度乙醇发酵研究[D].广西科技大学,2015.JIANG K.Study on high concentration ethanol fermentation of Saccharomyces cerevisiae GGSF16 micro-oxygenated 5L tank[D].Guangxi University of Science and Technology,2015.
[32] 国家质量监督检验检疫总局.葡萄酒、果酒通用分析方法:GB/T 15038-2006[S].北京:中国标准出版社,2006:7-8.Inspection and Quarantine of the People's Republic of China.General analytical method for wine and fruit wine:GB/T 15038-2006[S].Beijing:China Standards Press,2006:7-8.
[33] SPIROPOULOS A,TANAKA J,FLERIANOS I,et al.Characterization of hydrogen sulfide formation in commercial and natural wine isolates of Saccharomyces [J].American Journal of Enology and Viti culture,2000,51(3):233-248.
[34] 王春晓,江璐,刘延琳.DNS 法监控葡萄酒发酵进程的应用研究[J].中国酿造,2012,31(9):24-27.WANG C X,JIANG L,LIU Y L.Research on the application of DNS method to monitor wine fermentation process[J].China Brewing,2012,31(9):24-27.
[35] 刘宇鹏,郑璞,孙志浩.采用离子排斥色谱法分析发酵液中的琥珀酸等代谢产物[J].食品与发酵工业,2006(12):119-123.LIU Y P,ZHENG P,SUN Z H.Analysis of succinic acid and other metabolites in fermentation broth by ion exclusion chromatography[J].Food and Fermentation Industry,2006(12):119-123.
[36] 尹荐,陶永胜,孙玮璇,等.优选非酿酒酵母胞外酶增香酿造干白葡萄酒效果[J].农业工程学报,2020,36(4):278-286.YIN J,TAO Y S,SUN W X,et al.Optimizing the effect of non-Saccharomyces cerevisiae extracellular enzymes for aromatization and brewing of dry white wine[J].Journal of Agricultural Engineering,2020,36(4):278-286.
[37] 王荣荣,刘坤峰,朱静,等.野生猕猴桃酿酒酵母的筛选及其发酵特性[J].食品工业科技,2018,39(16):115-119.WANG R R,LIU K F,ZHU J,et al.Screening of wild kiwi fruit Saccharomyces cerevisiae and its fermentation characteristics[J].Food Industry Technology,2018,39(16):115-119.
[38] 王文娟,陈娟,张荣,等.黄心猕猴桃果酒主发酵工艺参数的优化[J].食品工业科技,2017,38(21):216-219,246.WANG W J,CHEN J,ZHANG R,et al.Optimization of main fermentation parameters of yellow heart kiwi fruit wine[J].Food Industry Technology,2017,38(21):216-219,246.
[39] 匡钰.优良菠萝果酒酵母的选育及其在菠萝果醋发酵中的应用研究[D].湛江:广东海洋大学,2012.KUANG Y.Study on the selection and breeding of fine pineapple wine yeast and its application in the fermentation of pineapple fruit vinegar[D].Zhanjiang:Guangdong Ocean University,2012.
[40] 何宇宁,黄和,钟赛意,等.菠萝蜜果醋发酵菌种的选育及发酵特性[J].食品科学,2020,41(14):183-189.HE Y N,HUANG H,ZHONG S Y,et al.Breeding of jackfruit vinegar fermentation strains and its fermentation characteristics[J].Food Science,2020,41(14):183-189.
[41] 田甜甜.青梅酒酿酒酵母的选育及耐酸机制解析[D].无锡:江南大学,2020.TIAN T T.Breeding of Saccharomyces cerevisiae from green plum wine and analysis of its acid tolerance mechanism [D].Wuxi:Jiangnan University,2020.
[42] 张晓萍,高贵田,王雪媛,等.“华优”猕猴桃果酒加工工艺研究[J].陕西师范大学学报(自然科学版),2018,46(6):99-108.ZHANG X P,GAO G T,WANG X Y,et al.Research on processing technology of ‘Huayou’ kiwi fruit wine[J].Journal of Shaanxi Normal University(Natural Science Edition),2018,46(6):99-108.
[43] VALERO E,MILLAN C,ORTEGA J M.Influence of oxygen addition during growth phase on the biosynthesis of lipids in Saccharomyces cerevisiae(M(3)30-9)in enological fermentations[J].Journal of Bioscience and Bioengineering,2001,92(1):33-38.
[44] JOLLY N P,AUGUSTYN O P H,PRETORIUS I S.The effect of non-Saccharomyces yeasts on fermentation and wine quality[J].South African Journal of Enology and Viticulture,2003,24(2):55-62.
[45] ROCKER J,STRUB S,EBERT K,et al.Usage of different aerobic non-Saccharomyces yeasts and experimental conditions as a tool for reducing the potential ethanol content in wines[J].European Food Research and Technology,2016,242(12):2051-2070.
[46] CIANI M,MORALES P,COMITINI F,et al.Nonconventional yeast species for lowering ethanol content of wines[J].Frontiers in Microbiology,2016,7:1-13.
[47] ALONSO-DEL-REAL J,CONTRERAS-RUIZ A,CASTIGLIONI G L,et al.The use of mixed populations of Saccharomyces cerevisiae and S.kudriavzevii to reduce ethanol content in wine:Limited aeration,inoculum proportions,and sequential inoculation[J].Frontiers in Microbiology,2017,8:2087.
[48] SHEKHAWAT K,BAUER F F,SETATI M E.Impact of oxygenation on the performance of three non-Saccharomyces yeasts in co-fermentation with Saccharomyces cerevisiae[J].Applied Microbiology and Biotechnology,2017,101(6):2479-2491.
[49] SHEKHAWAT K,PORTER T J,BAUER F F,et al.Employing oxygen pulses to modulate Lachancea thermotolerans-Saccharomyces cerevisiae chardonnay fermentations[J].Annals of Microbiology,2018,68(2):93-102.