氧化应激是指机体在受到有害刺激时,高活性分子产生的速度大于其清除的速度,使得氧化系统和抗氧化系统失衡,可能引起一系列的免疫功能降低,损害生物膜及其功能,最终引发各种疾病,如动脉粥样硬化、中风、糖尿病、癌症等[1]。在食品行业中,抗氧化剂是一种重要的食品添加剂,随着化学合成抗氧化剂的安全性逐渐受到质疑,寻找和开发安全性高、无毒的天然抗氧化剂资源愈发重要,成为食品添加剂研究领域的热点之一[2-3]。
芸香科柑橘属中的橘皮不仅具有防腐抑菌,改良食物理化性质,增强食品风味等作用,还具有预防或改善心血管疾病、癌症和炎症等重要的医学价值[4-6],这与其富含黄酮类化合物、挥发油、萜类和香豆素类等功能性成分有关,这些天然活性物质大多具有抗氧化作用,能够清除人体内多余的自由基,使机体免受活性氧自由基伤害[7],是天然的抗氧化剂。当前橘皮用作抗氧化剂的开发应用受到越来越多的关注,需要不断挖掘新的橘皮资源,以满足食品原料开发或临床需求。彭祖寿柑(Citrus reticulata Blanco)优株为彭山县从日本引进,经改良选育而成的桔橙杂交新品种[8],其果皮厚,包着紧,味清甜纯正,较易剥离,认可度较高,是极有发展前途的优良杂柑新品种[9]。目前研究主要集中于其栽培技术、资源分布等,未在市场上广泛销售,国内外尚未见其抗氧化活性及相关成分的系统性研究报道。为充分挖掘橘类植物中的抗氧化剂,本研究以彭祖寿柑优株果皮为研究对象,采用高效液相色谱-二极管阵列-电喷雾-串联质谱法(HPLC-DAD-ESI-MS/MS)和气相色谱-质谱法(GC-MS)对彭祖寿柑优株果皮中的化学成分进行表征,采用适用于批量样品操作的4 种体外抗氧化体系,对其抗氧化活性进行评价。
网络药理学是一门适用于考察多成分复杂体系对机体多靶点活性作用的生物信息学技术,多被用于中药复方的药理学机制研究,也适用于药食同源物品的分析,通过结构相似比对预测其可能作用的疾病靶点,构建“成分-靶点-通路”相互作用网络,探索其主要活性成分及其作用机制[10]。分子对接是利用计算机进行分子模拟的技术,以已知结构的蛋白为模板,构建一个结构未知的目标蛋白[11]。本研究在橘皮原有研究的基础上,结合含有酚类、烯类、萜类和醛类等生物活性物质的挥发性成分,利用网络药理学与分子对接技术筛选抗氧化潜在活性成分并初步阐释作用机制。为彭祖寿柑优株果皮用作抗氧化剂和植物源性有益化合物提供基础数据,为其用于功能性食品的开发、功能性饲料的研制等提供理论依据。本研究思路及方法如图1 所示。
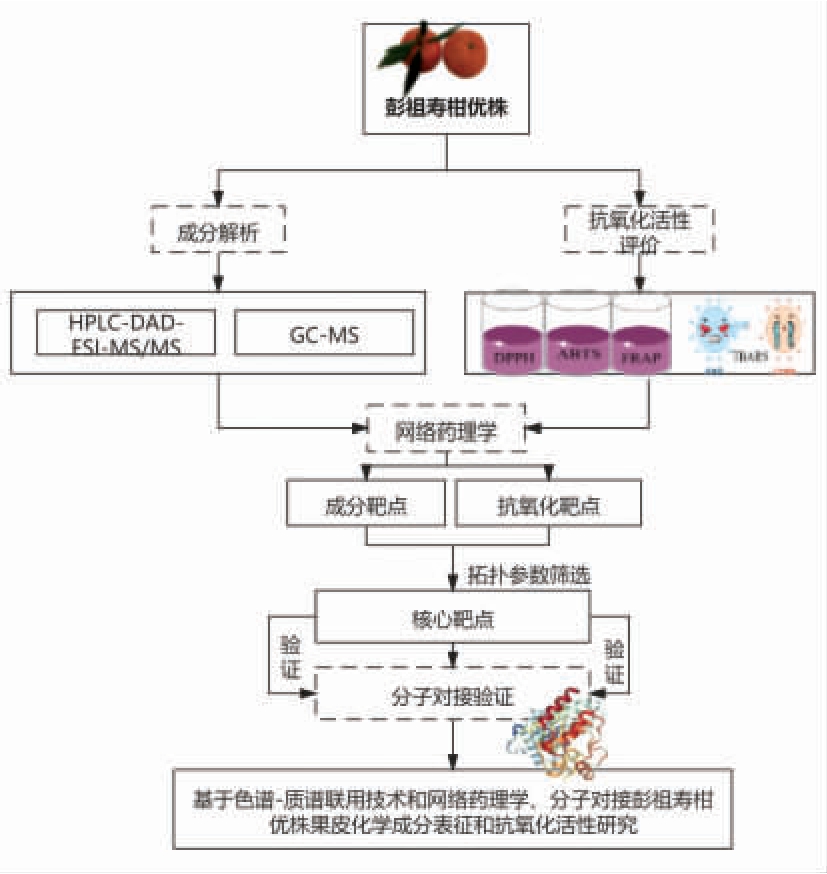
图1 研究思路和方法
Fig.1 Ideas and methods of research
1 材料与方法
1.1 材料和试剂
彭祖寿柑优株,桂林相凯农业科技有限公司,经华中农业大学潘志勇副教授鉴定为芸香科植物彭祖寿柑Citrus reticulate Blanco 优株。Wistar 雌性大鼠(动物许可证号SCXK(京)2016-0006),北京维通利华实验动物技术有限公司。
抗坏血酸、硫酸亚铁、三水合乙酸钠、氢氧化钠、盐酸、冰乙酸、过氧化氢,北京化工厂;1,1-二苯基-2-三硝基苯肼(DPPH),上海源叶生物科技有限公司;2,4,6-三吡啶基三嗪(TPTZ)、2,2'-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、硫酸巴比妥酸、三氯乙酸,上海麦克林生化科技有限公司;三氯化铁、过硫酸钾,天津市福晨化学试剂;甲醇、甲酸为色谱级,美国Fishier Scientific 公司;其它试剂为分析纯级。
1.2 仪器与设备
Agilent 1200 型高效液相色谱仪、Agilent 7890B/5977 GCMSD GC-MS 气质联用仪,美国Agilent 公司;紫外可见分光光度计(T6 新世纪),北京普析通用仪器有限责任公司;分析天平(CP224C 型,万分之一,Max=220 g),奥豪斯仪器(常州)有限公司;DB 超声清洗仪(40 kHz,200 W),昆山超声仪器有限公司。
1.3 方法
1.3.1 HPLC-DAD-ESI-MS/MS 检测
1.3.1.1 供试品溶液的配制 取彭祖寿柑优株鲜果皮,称取10.00 g,置500 mL 圆底烧瓶中,加200 mL 70%乙醇,80 ℃加热提取1 h,趁热减压过滤,取滤液经0.22 μm 微孔滤膜过滤即得。
1.3.1.2 检测条件 色谱条件:色谱柱为Hypersil GOLD C18 色谱柱(250 mm×4.6 mm,5 μm),流动相为0.1%甲酸水(A)-甲醇水(B)溶液。梯度洗脱(0~10 min,78%A;10~25 min,78%~60%A;25~40 min,60%A;40~45 min,60%~30%A;45~90 min,30%A),柱温25 ℃,体积流量0.7 mL/min,检测波长240,283,330 nm,进样量10 μL。
质谱条件:电喷雾离子源(ESI),正负离子模式,离子扫描范围设置为m/z 50~1 000;裂解电压80 V;碰撞能量10 eV。
1.3.2 GC-MS 检测
1.3.2.1 挥发油的提取 取彭祖寿柑优株鲜果皮,称取800 g,置于2 000 mL 圆底烧瓶中,加水1 600 mL,电热套加热,按《中国药典》2015 版第四部2204“挥发油测定法”甲法提取3 h 至无挥发油增加,收集挥发油,静置分层后吸出油层待用[12]。
1.3.2.2 检测条件 气相色谱条件:安捷伦气相色谱柱为HP-5MS 色谱柱(30 m×0.25 mm×0.25 μm);载气为高纯度氦气;进样量1 μL;分流比为10∶1。程序升温条件:60 ℃,保持3 min,以1 ℃/min 升温至80 ℃,保持3 min,以5 ℃/min 升温至250 ℃。
质谱条件:离子源为EI 源;电子能量70 eV;四极杆温度150 ℃;离子源温度为230 ℃;扫描质量范围m/z 30~550。
1.3.3 体外抗氧化活性研究
1.3.3.1 样品溶液配制 取适量彭祖寿柑优株果皮,打粉烘干后准确称取2.00 g 粉末加入40 mL 80%乙醇,超声提取30 min,过滤,得彭祖寿柑优株果皮提取液,备用。
1.3.3.2 DPPH 自由基清除能力测定 DPPH 自由基清除能力测定参照文献[13]报道的方法适当改进。以抗坏血酸溶液为标样做标准曲线。分别准确吸取不同浓度的溶于80%乙醇的抗坏血酸溶液,置于10 mL 比色管中,加入3.5 mL DPPH 自由基溶液,振荡摇匀,避光反应30 min,以DPPH 自由基溶液为对照,以80%乙醇溶液调零,在波长517 nm 处测吸光度,平行3 次。样品溶液用80%乙醇稀释至适当倍数,同抗坏血酸方法测定,按式(1)计算DPPH 自由基清除率,抗氧化能力用抗坏血酸当量表示。
式中,Ai——样品组吸光度;Aj——对照组吸光度;A0——空白组吸光度。
1.3.3.3 ABTS·+自由基清除能力测定 ABTS·+自由基清除能力测定参照文献[14]~[15]的方法。取ABTS 和乙酸钠,配制7 mmol/L ABTS 溶液;称取过硫酸钾配制成2.45 mmol/L 溶液,将ABTS 溶液与过硫酸钾溶液按1∶1 的体积比摇匀混合得ABTS 储备液,避光反应16 h。使用前用20 mmol/L 乙酸钠(pH 4.5)将ABTS 储备液稀释为工作液,使其在734 nm 波长处的吸光度为0.700±0.005。以抗坏血酸溶液为标样做标准曲线。分别准确吸取不同浓度的溶于80%乙醇的抗坏血酸溶液0.1 mL,置于10 mL 比色管中,加入4.9 mL ABTS 自由基工作液,振荡混匀,反应10 min。以ABTS 自由基工作液为对照,以80%乙醇溶液调零,于734 nm 波长处测定吸光度。样品溶液用80%乙醇稀释至适当倍数,同抗坏血酸方法测定,抗氧化能力用抗坏血酸当量表示,清除率计算同公式(1)。
1.3.3.4 铁离子还原能力测定 铁离子还原能力测定参照文献[15]和[16]的方法。称取5.1 g 乙酸钠置于250 mL 容量瓶中,加入20 mL 冰醋酸,加水定容至250 mL,再加入适量1 mmol/L 氢氧化钠溶液,调节至pH 值为3.6,制成醋酸-醋酸钠缓冲液;称取TPTZ 0.0312 g,置10 mL 容量瓶中,加40 mmol/L 盐酸溶液定容配成10 mmol/L 溶液;称取0.1625 g FeCl3,置50 mL 容量瓶中,加水定容配成20 mmol/L 溶液;将上述3 种溶液以10∶1∶1 的体积比混合均匀,即得FRAP 工作液。
标准曲线的绘制:取FeSO4 溶液,用80%乙醇稀释至一系列不同浓度的溶液(100~2 000 μmol/L)。分别准确吸取200 μL 溶液于10 mL 比色管中,加入3.8 mL FRAP 工作液,振荡混匀,在37℃条件下反应10 min。以80%乙醇溶液调零,在波长593 nm 处测定吸光度。样品溶液同FeSO4 溶液的测定方法。清除率计算同公式(1),抗氧化能力以毫摩尔硫酸亚铁当量每克干物质计(mmol FeSO4/g)。
1.3.3.5 TBA 比色法测定MDA 含量 断头处死大鼠(250~270 g),迅速取出肝脏置于预冷至4 ℃的生理盐水中,洗去表面残血,用滤纸吸干,制成10%肝匀浆生理盐水液。
参照文献[17]~[18]报道的试验方法适当改进。在TCA-盐酸中加入0.3 mL 0.68%硫代巴比妥酸(在0.125 mol/L 盐酸中加入168 mg/mL 三氯乙酸),即得TBARS 测定终止液。取0.2 mL 不同质量浓度的样品溶液(0.2~2 mg/mL)与10%的肝脏匀浆混合,加入0.1 mL FeSO4·7H2O(5 mmol/L)和0.1 mL H2O2(100 mmol/L)引发脂质过氧化,37 ℃孵育60 min。孵育完毕后加入终止液停止反应,将反应混合物在95 ℃加热60 min。将样品冷却并离心,在波长532 nm 处测量上清液的吸光度。抗坏血酸测定方法同样品溶液,抗氧化能力用半数抑制浓度(IC50)表示。
式中,A对照——对照组吸光度;A测试——样品组吸光度;A空白——空白组吸光度。
1.3.4 网络药理学研究
1.3.4.1 疾病靶点与彭祖寿柑优株果皮成分靶点的筛选 通过GeneCards(https://www.genecards.org)、TTD(http://db.idrblab.net/ttd/)、DisGeNet(https://www.disgenet.org/home/)、CTD(https://ctdbase.org/)、DrugBank(https://www.drugbank.ca/)、OMIM(https://omim.org/)、TCMSP(http://tcmspw.com/tcmsp.php)等数据库分别搜索“anti-oxidant”、“oxidative stress”、“anti-oxidative stress”,合并各数据库疾病靶点,去重后,运用Uniprot 蛋白数据库(https://www.uniprot.org)将靶点名称转化为基因名称,得到与抗氧化相关的靶点。通过调研文献及成分解析得到彭祖寿柑优株果皮成分,并在TCMSP、SwissTargetPrediction 数据库(http://www.Swisstargetprediction.ch/)中查询化合物的OB 值与DL值,获得活性成分相关的靶点蛋白,结合UniProt数据库查询靶点对应的基因名,规范靶点蛋白。
1.3.4.2 核心靶点的筛选和PPI 网络图的构建根据活性成分靶点和抗氧化靶点,绘制韦恩图,共有靶点为彭祖寿柑优株果皮干预抗氧化的潜在靶点。将潜在靶点录入STRING 11.5 数据库(https://string-db.org/cgi/input.pl)软件,限定蛋白种类为Homo sapiens,最低相互作用阈值设为Highest confidence(>0.4),隐藏网络中无联系的节点,其余参数设置不变,获取蛋白-蛋白相互作用(Protein-protein interaction,PPI)关系。将上述结果导入Cytoscape 3.8.2 软件进行可视化处理,绘制相互作用网络,并选取“度值”(Degree)、“介数中心性”(Betweenness centrality)、“接近中心性”(Closeness centrality)3 个重要拓扑参数均大于中位数的靶点作为核心靶点。
1.3.4.3 GO 功能富集分析和KEGG 通路富集分析 利用R 语言(clusterProfiler 包)对关键靶点蛋白进行基因本体(Gene ontology,GO)功能富集分析和基于京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。GO 功能富集包括基因产物生物功能(Biological process,BP)、细胞功能(Cellular component,CC)和分子功能(Molecular function,MF)分析,对基因进行注释和分类;KEGG 通路富集分析可以进一步明确靶点蛋白的生物学功能。GO 和KEGG 分析均根据P<0.05 表示具有统计学意义。
1.3.4.4 成分-靶点-通路网络构建 根据筛选得到的成分、靶点和通路,运用Cytoscape 3.8.2 软件构建“活性成分-关键靶点-通路”的分析网络。
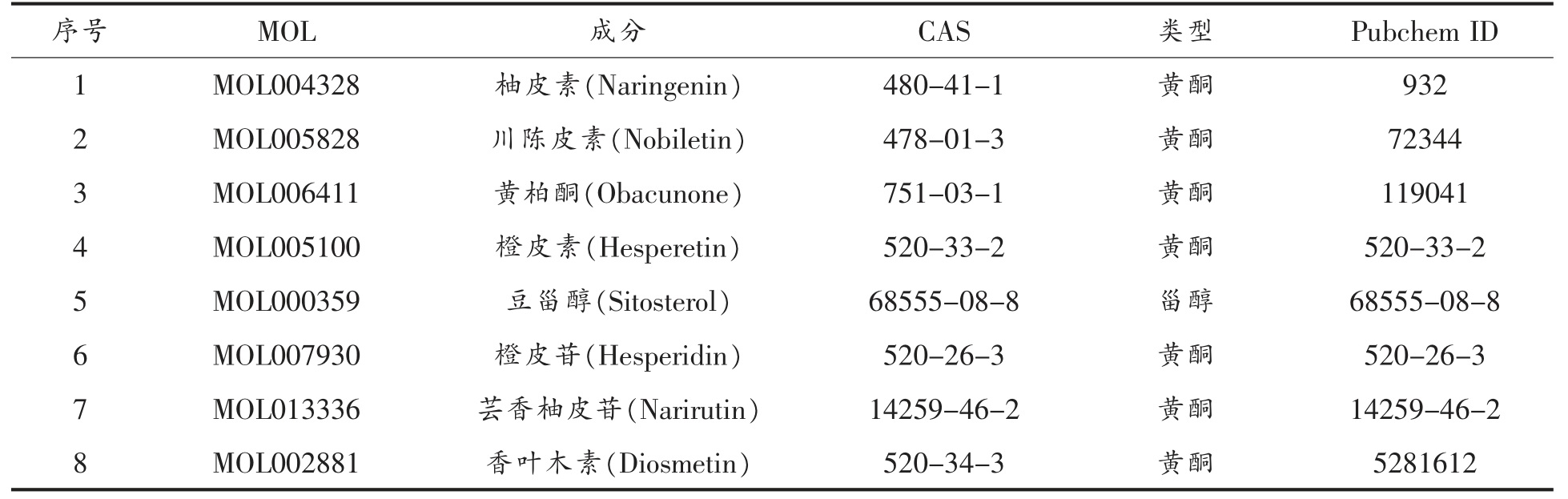
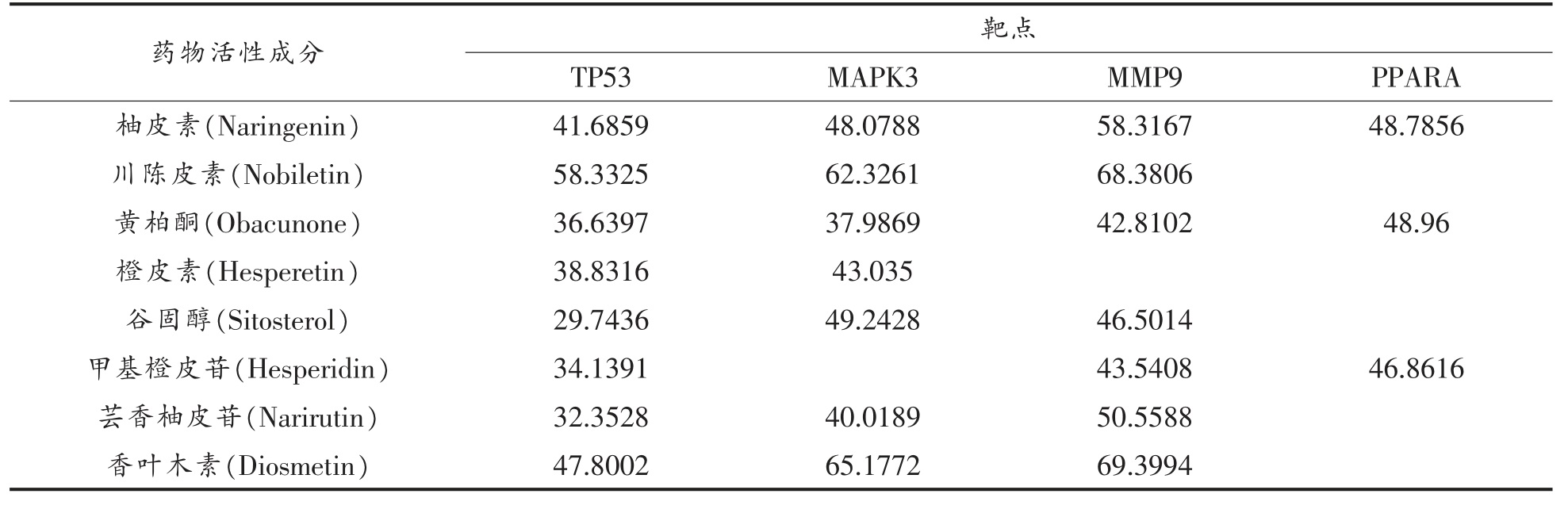
1.3.5 分子对接验证 结合文献[19]和[20]及网络药理学结果进行筛选,得到彭祖寿柑优株果皮抗氧化的7 个潜在活性成分,如表1 所示,借助PubChem(https://pubchem.ncbi.nlm.nih.gov)在 线数据库获取潜在活性成分的2D 结构,采用Discovery Studio 软件对各成分进行能量优化并保存。通过RSCB PDB(https://www.rcsb.org/)数据库筛选出网络药理学排名靠前的4 个核心靶点蛋白的晶体复合物,包括TP53、MAPK3、MMP9、PPARA。借助Discovery Studio 2016 Client 软件去除配体与非蛋白分子并保存。以原配体空间结构为中心活性口袋,用CDocker 模块将原配体对接到活性口袋中,计算原配体与对接构象的均方根偏差(Root -mean -square deviation,RMSD),当RMSD<2Å 时,说明既定数值能够较好地体现原配体与蛋白的结合模式[21]。最后采用CDocker 模块将各成分对接到活性口袋,以原配体与蛋白受体对接打分值的80%作为阈值,选择对接打分值接近或者高于阈值的化合物作为靶标潜在的活性成分[22],判断其与受体的关键氨基酸是否具有相互作用。
表1 彭祖寿柑优株果皮抗氧化的潜在活性成分
Table 1 Potential active ingredients of antioxidant of Citrus reticulate Blanco superior plants fruit peel
2 结果与分析
2.1 HPLC-DAD-ESI-MS/MS 化学成分鉴定
2.1.1 主要成分鉴定 采用HPLC-DAD-ESIMS/MS 技术,按照1.3.1 节的条件检测供试品溶液,对彭祖寿柑优株果皮的化学成分进行表征。利用Agilent MassHunter Qualitative Analysis B.07.00 软件生成化合物分子式,选择一定误差内的分子式与建立的数据库进行匹配,确定分子离子峰,对解析获得的数据信息根据参考文献和化合物裂解规律推断可能的化合物。得到正、负离子模型的总离子流图(TIC),见图2。
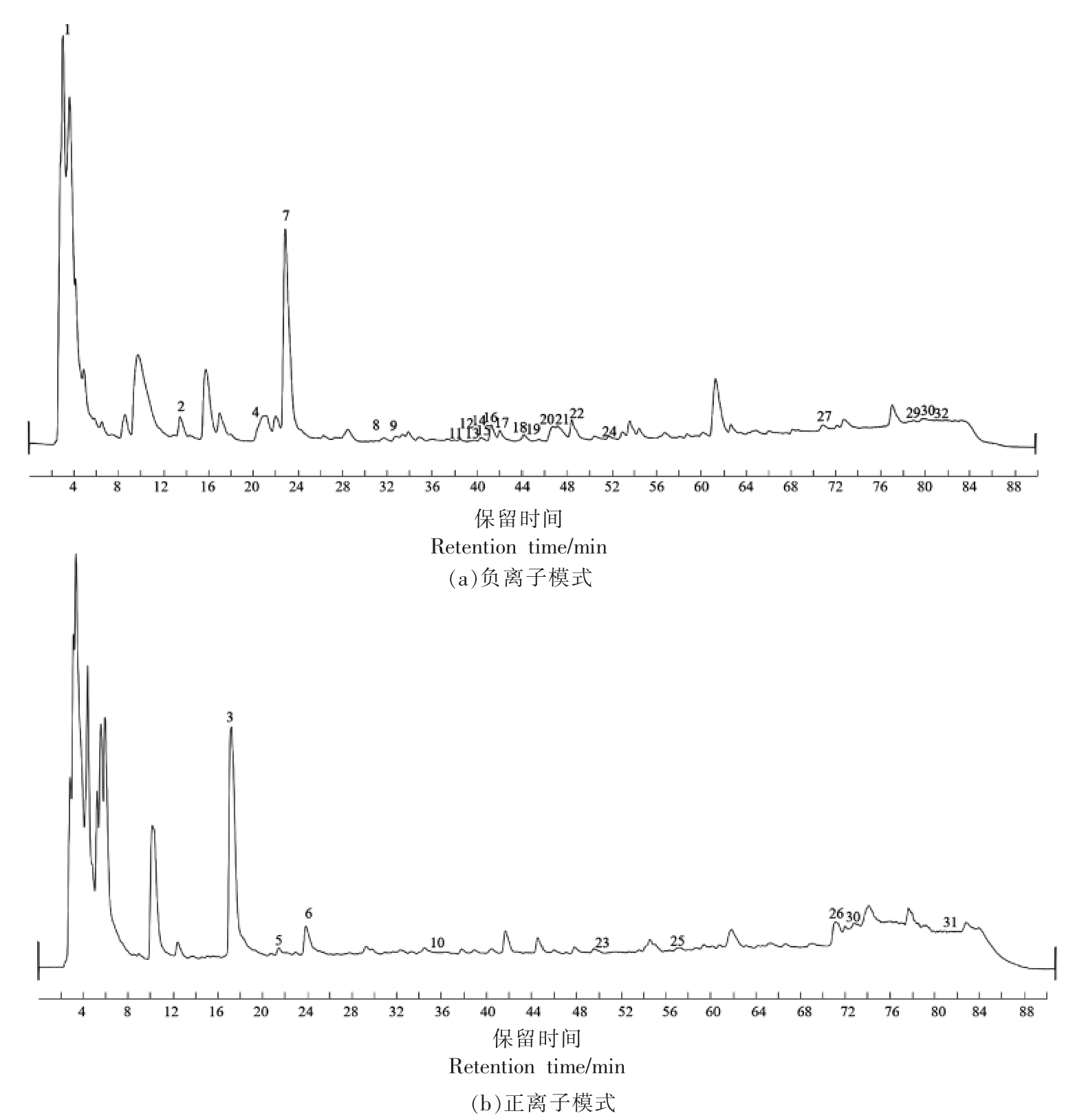
图2 样品总离子流图
Fig.2 Total ion flow diagram of sample


彭祖寿柑优株果皮中共检测到32 个化合物,具体包括黄酮类化合物15 个,有机酸类化合物7个,苯丙素类化合物4 个,甾体类化合物2 个及其它类型化合物4 个,结果见表2。4,6,9~10,12~17,19~20,22,26,28 号峰为黄酮类化合物;1,2,25,27,29,30,32 号峰为有机酸化合物;18,21,23,24 为苯丙素类化合物;3 号峰为氨基酸类化合物;5,31 号峰为甾醇类化合物,剩余为其它类型化合物。
2.1.2 质谱裂解规律分析 黄酮类化合物是具有2-苯基色原酮结构的化合物,其裂解方式主要是丢失中性碎片CO、H2O,黄酮苷类则常脱去糖基,当化合物中有甲氧基存在时,化合物首先失去甲基,然后C 环丢失碎片CO 等[43-44]。结合建立的数据库、参考文献推断出15 个黄酮类化合物,分别是5,7,8,4'-四甲氧基黄酮、山奈苷、芹菜素、牡荆素葡萄糖苷、香风草苷、橙皮苷、橘红素、5-羟基-3,6,7,8,3',4'-六甲氧基黄酮、5,4-二羟基-7,8-二甲氧基黄酮、柚皮素-7-O-葡萄糖苷、槲皮素、樱桃苷、白藜芦醇-3-O-葡萄糖苷、川陈皮素、黄柏酮。
以峰9,14,26 的解析为例,了解黄酮类化合物的质谱裂解规律。9 号峰的准分子离子峰为m/z 269.046[M-H]-,在二级质谱中,该母离子丢失1 分子H2O,形成m/z 251 的碎片离子,或丢失1 分子CO2,形成m/z 225 的碎片离子,根据该化合物的精确相对分子质量、断裂方式并参考相关文献[31],推断其为芹菜素(C15H10O5);14 号峰的准分子离子峰为m/z 609.1849 [M-H]-,在二级质谱中,该母离子丢失1 分子C6H10O5,形成m/z 447 的碎片离子,之后又失去了1 分子C6H10O4,形成m/z 301 的碎片离子,根据该化合物的精确相对分子质量、断裂方式并参考相关文献[28,34],推断其为橙皮苷(C28H34O15);26 号峰的准分子离子峰为m/z 403.1393[M+H]+,在二级质谱中,该母离子丢失2 分子CH3,形成m/z 373 的碎片离子,之后又失去了1 分子H2O,形成m/z 355 的碎片离子,根据该化合物的精确相对分子质量、断裂方式并参考相关文献[28,34],推断其为川陈皮素(C21H22O8)。芹菜素、橙皮苷和川陈皮素的碎片离子的裂解途径如图3 所示。
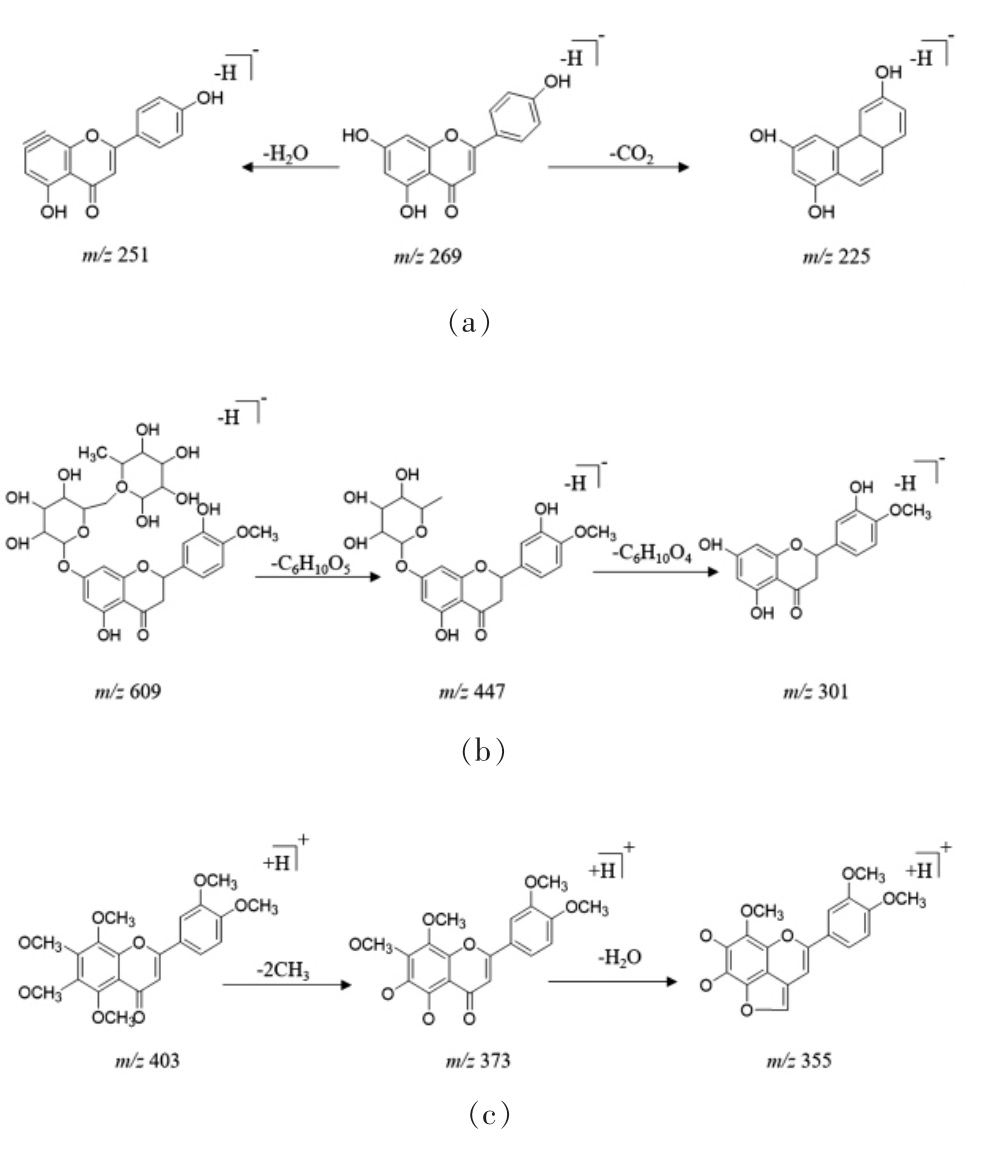
图3 黄酮类化合物可能的裂解途径
Fig.3 Possible fragmentation pathway of flavonoids
注:a~c 依次为芹菜素、橙皮苷、川陈皮素可能的裂解途径。
有机酸类化合物在负离子模式下主要以[MH]-的准分子离子峰形式存在,在高能碰撞下,易发生CO2、H2O 等中性分子丢失,形成[M-H-CO2]-或[M-H-H2O]-碎片离子[45-46]。结合建立的数据库和参考文献信息,推断出7 个有机酸类化合物,分别是苹果酸、柠檬酸、单棕榈酸甘油、亚油酸、十七烷酸、硬脂酸、花生四烯酸。以峰2 和峰27的解析为例,了解有机酸类化合物的质谱裂解规律。2 号峰的准分子离子峰为m/z 191[M-H]-,在二级质谱中,该母离子丢失1 分子CO2 形成m/z 147 的碎片离子,之后又失去1 分子H、1 分子CO2 和1 分子CH3,形成m/z 87 的碎片离子,根据该化合物的精确相对分子质量、断裂方式并参考相关文献[23-24],推断其为柠檬酸(C6H8O7);27 号峰的准分子离子峰为m/z 279.2338[M-H]-,在二级质谱中,该母离子丢失1 分子H2O,形成m/z 261 的碎片离子,或母离子丢失1 个C6H14O2,形成m/z 161 的碎片离子。根据该化合物的精确相对分子质量、断裂方式并参考相关文献[41],推断其为亚油酸(C18H32O2)。柠檬酸和亚油酸的碎片离子的裂解途径如图4 所示。
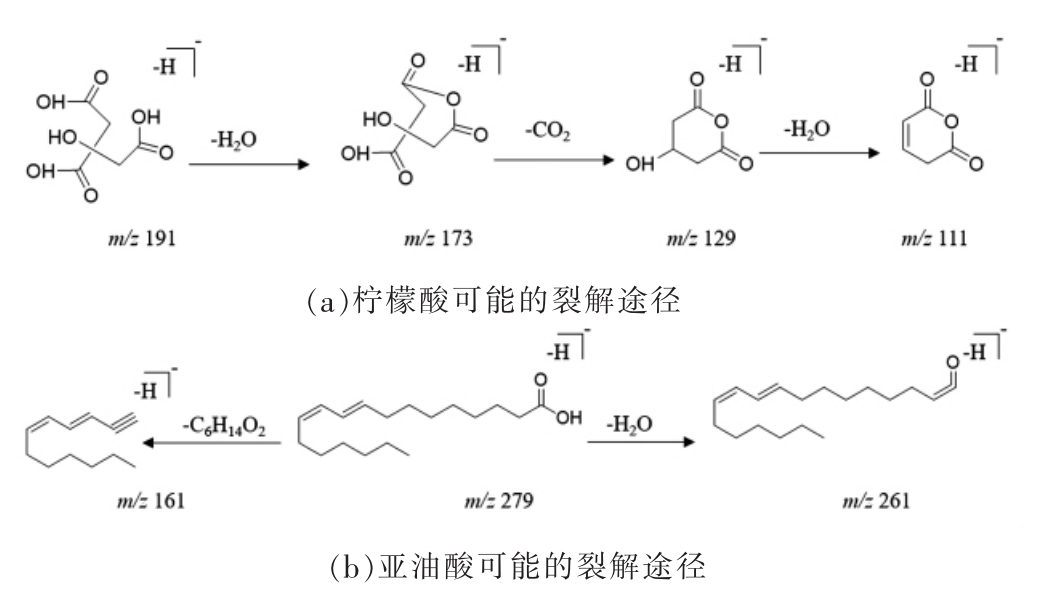
图4 有机酸可能的裂解途径
Fig.4 Possible fragmentation pathway of organic acids
苯丙素类化合物是含有1 个或几个C6-C3单元结构的化合物,包括苯丙素类、香豆素类和木脂素3 类成分,质谱裂解中容易丢失H2O、CO2及CO 等中性分子[47]。结合建立的数据库和参考文献信息,推断出4 个苯丙素类化合物,分别是水合橙皮内酯、异米拉素、阿魏酸、葡萄柚内酯,以峰23 的解析为例,了解有苯丙素类化合物的质谱裂解规律。23 号峰的准分子离子峰为m/z 195[M+H]+,在二级质谱中,该母离子丢失1 分子CH3,形成m/z 180 的碎片离子,或丢失1 分子COOH,形成m/z 151 的碎片离子。根据该化合物的精确相对分子质量、断裂方式并参考相关文献[39],推断其为阿魏酸(C10H10O4),其碎片离子的裂解途径如图5 所示。
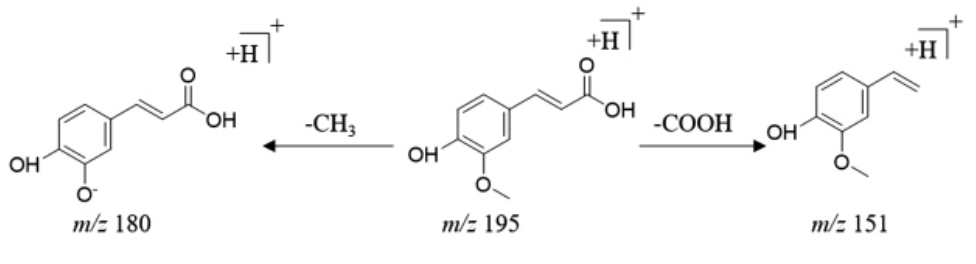
图5 苯丙素类化合物-阿魏酸可能的裂解途径
Fig.5 Possible fragmentation pathway of phenylpropanoids-ferulic acid
2.2 挥发油组成分析
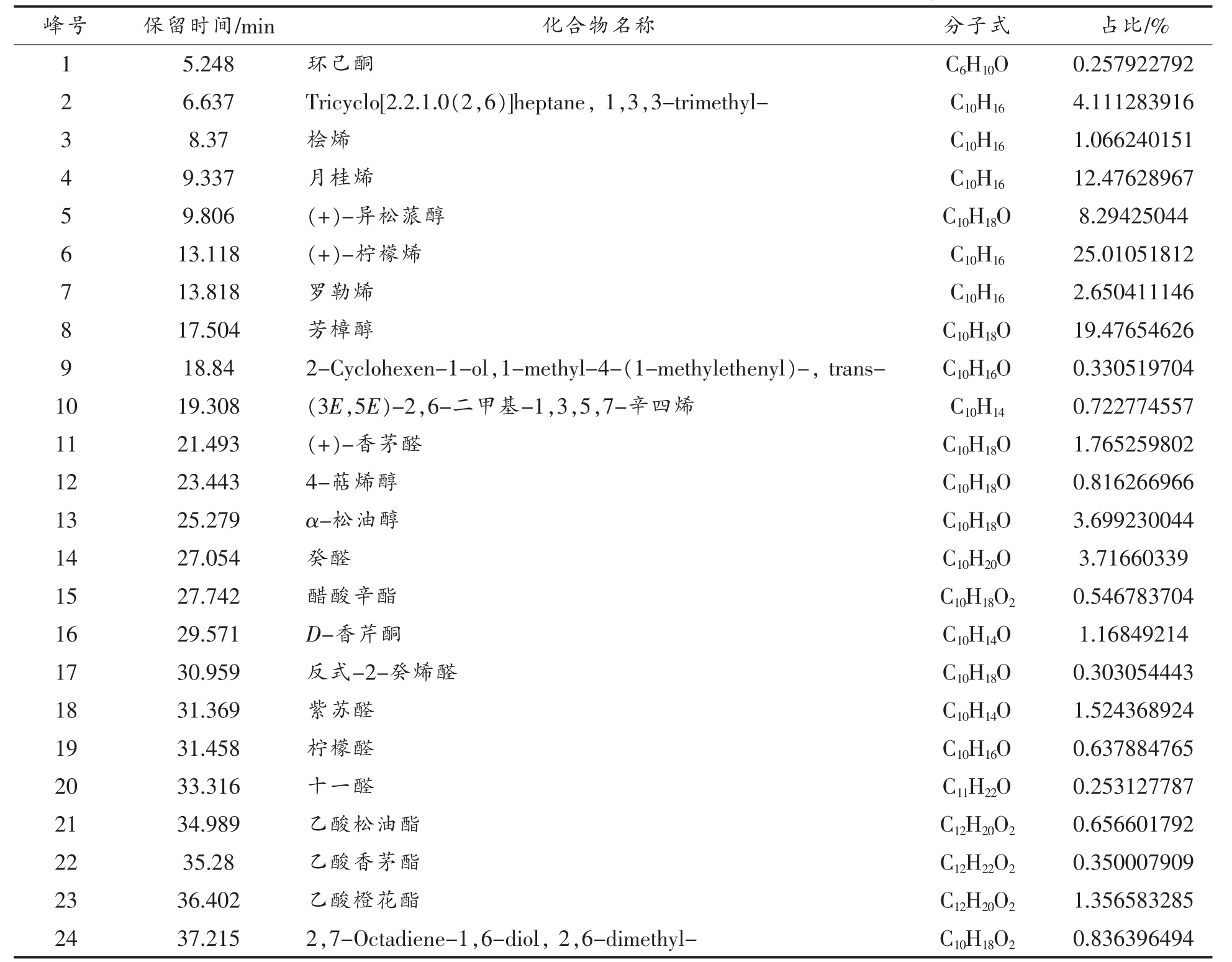
根据上述GC-MS 条件,对彭祖寿柑优株果皮挥发油成分进行分离鉴定,总离子流图见图6。经计算机质谱数据系统检索,采用NIST14.L 谱图库进行检索匹配,按积分查找,对色谱峰进行鉴定,并采用面积归一化法测得挥发油各组分的相对百分含量,其中总相似度80%以上的化合物有37 个,已鉴定出33 个化合物,结果见表3。
表3 彭祖寿柑优株果皮挥发油GC-MS 的化学成分分析
Table 3 Chemical composition analysis of volatile oil from Citrus reticulate Blanco superior plants fruit peel by GC-MS
(续表3)

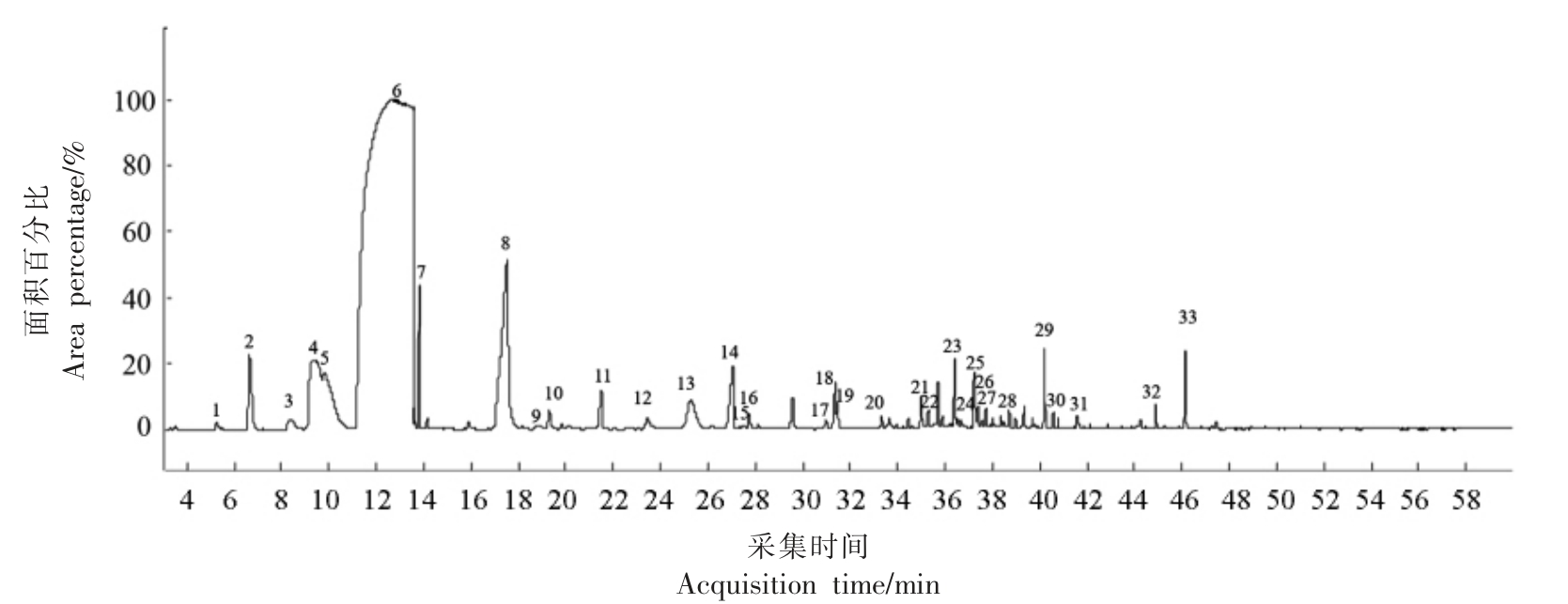
图6 彭祖寿柑优株果皮挥发油GC-MS 总离子流图
Fig.6 GC-MS total ion chron chromatogram of volatile oil from Citrus reticulate Blanco superior plants fruit peel
由表3 可知,提取的挥发油中共鉴定出33 种物质,包括烷烯类化合物8 种,烃类1 种,醇类化合物7 种,酮类化合物2 种,酯类化合物4 种,醛类化合物7 种,萜类化合物4 种,其中含量较高的成分为(+)-柠檬烯(25.077%)、芳樟醇(19.529%)、月桂烯(12.510%)、(+)-异松蒎醇(8.316%)、Tricyclo[2.2.1.0(2,6)]heptane,1,3,3-trimethyl-(4.122%)、α-松油醇(3.709%)、癸醛(3.727%)。
2.3 体外抗氧化活性研究
采用DPPH 法、ABTS 法、FRAP 法和TBARS法4 种不同的体系评价彭祖寿柑优株果皮体外抗氧化活性。DPPH 法、ABTS 法以抗坏血酸为标样做标准曲线,FRAP 法以FeSO4 为标样做标准曲线,样品带入公式计算其抑制率。结果表明,当彭祖寿柑优株果皮质量浓度为12.5063 mg/mL 时,DPPH 自由基清除能力为18.7128 μmol VC/g;ABTS 自由基清除能力抑制率为1 762.3 μmol VC/g;铁离子还原能力为50.4 μmol FeSO4/g,3 种抗氧化活性测试结果具有一致性。TBARS 法以抗坏血酸为阳性药,阳性药TBARS 的IC50 为0.347 mg/mL,样品TBARS 的IC50 为2.570 mg/mL。各标准曲线如图7 所示。

图7 抗氧化标准曲线
Fig.7 Antioxidant standard curve
与常见柑橘属植物相比,以上4 种不同体系体外抗氧化能力测定数据中,DPPH 自由基清除能力与铁离子还原能力更为显著,整体呈现较好的抗氧化能力[48]。彭祖寿柑优株果皮发挥抗氧化作用的成分可能是黄酮类成分和挥发性成分。过去的几十年中,柑橘黄酮的抗氧化能力通过各种体外自由基清除试验得到证实,其抗氧化活性强弱与结构中的酚羟基数目呈正相关,多个酚羟基能够提供大量电子,可将多种自由基转化为稳定结构进而中断其链式反应,从而起到抗氧化的作用[49]。如彭祖寿柑优株果皮解析出的柚皮苷、橙皮苷等黄酮类化合物具有较好的抗氧化作用。挥发油既是柑橘属植物的特征香气成分,也是有应用价值的生物活性成分,对O2-·的清除率较高,具有较好的总抗氧化能力[50]。如GC-MS 解析出的含量最高成分柠檬烯,王广超等[51]研究表明D-柠檬烯能够增强乙醇性肝损伤大鼠体内抗氧化酶的活性,减少脂质过氧化物的产生。当前对彭祖寿柑优株黄酮类和挥发性成分发挥抗氧化作用的具体机制尚不明确,有待进一步探讨。
2.4 网络药理学研究
2.4.1 疾病靶点与活性成分靶点的筛选 利用GeneCards 等数据库预测抗氧化作用靶点,并采用Uniprot 数据库对靶点进行校正,经筛选查重后共得到4 932 个疾病靶点。通过各数据库筛选到活性化合物7 个,得到181 种相关靶点基因。在筛选化合物中大多满足OB 值>30%,DL 值>0.18%。Tryptophan 和Cyclohexanone DL 值虽未达到要求,鉴于其有较高的口服利用度,本研究也将其列入研究范围。
2.4.2 PPI 网络图分析 根据药物活性成分靶点和抗氧化靶点,绘制韦恩图,得到146 个共有靶点,即为彭祖寿柑优株果皮干预抗氧化的潜在作用靶点,见图8。筛选得到的共有靶点导入STRING 11.3 数据库后进行PPI 网络分析,利用Cytoscape 3.8.2 的“Network Analyzer”功能对PPI网络中的靶点进行拓扑属性分析,见图9,图中包含53 个相互作用的节点,458 条相互作用的边。度(Degree)值排名前3 的AKT1、TP53、MAPK3 分别与47,37,35 个蛋白发生相互作用。
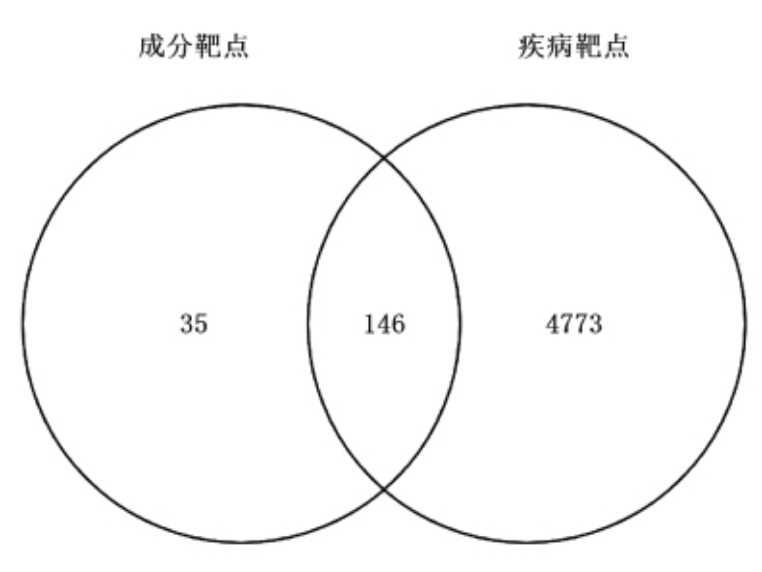
图8 成分靶点与抗氧化靶点交集韦恩图
Fig.8 Venn diagram of component targets and antioxidant targets
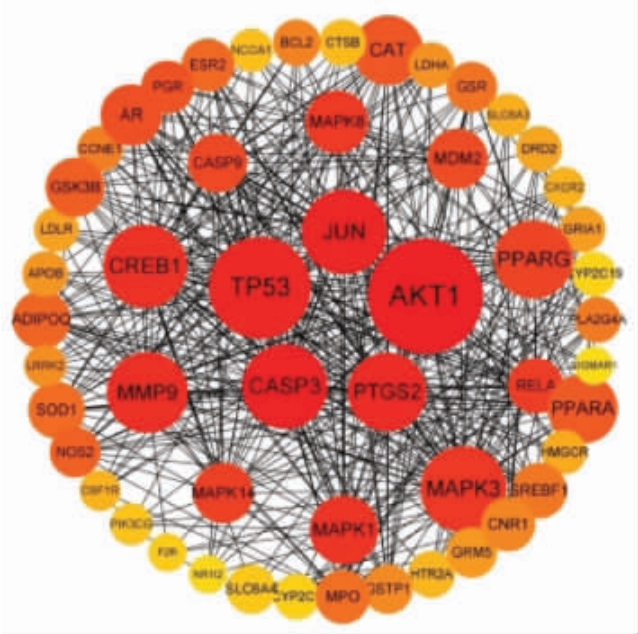
图9 蛋白-蛋白相互作用(PPI)网络
Fig.9 Protein-protein interaction(PPI)network
2.4.3 GO 功能富集分析与KEGG 通路分析 通过R 语言对核心靶点蛋白进行GO 功能富集分析。结果得到GO 条目1 017 个,其中BP 条目有921 个,涉及的生物过程有营养水平反应(Response to nutrient levels)、细胞外刺激反应(Response to extracellular stimulus)和衰老(Aging)等。CC 条目有45 个,主要富集在膜筏(Membrane raft)、膜微区(Membrane microdomain)、突触(Caveola)等。MF 条目有51 个,主要富集在DNA结合位点(DNA-binding transcription factor binding)、磷酸酶结合(Phosphatase binding)、DNA 结合的转录激活剂活性和RNA 聚合酶II 专用(DNA -binding transcription activator activity,RNA polymerase II-specific)等,分别选取BP、CC、MF 根据P 值排名前10 的条目,见图10。
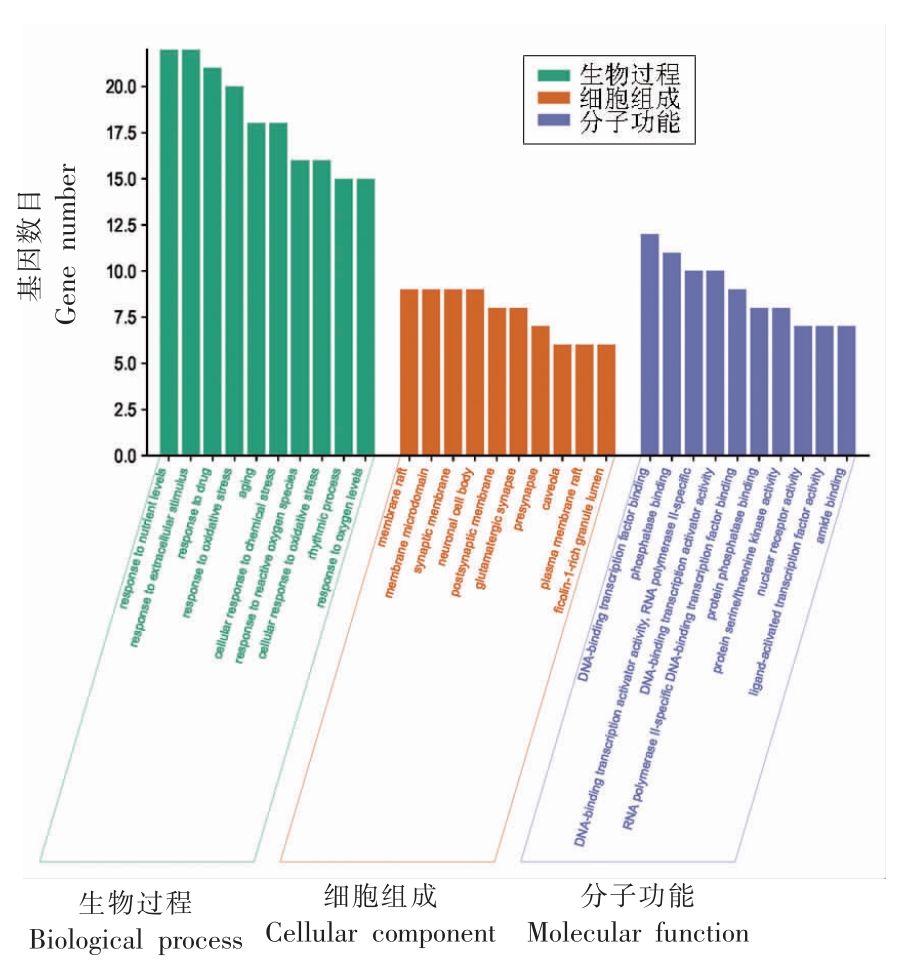
图10 GO 功能富集分析
Fig.10 GO function enrichment analysis
通过R 语言对核心靶点进行KEGG 通路富集分析。结果得到214 个条目,主要涉及的通路有PI3K-Akt 信号通路(PI3K-Akt signaling pathway)、血脂和动脉粥样硬化(Lipid and atherosclerosis)、乙型肝炎(Hepatitis B)等。并选取排名前20 的通路进行KEGG 通路富集分析气泡图的绘制,见图11。以上结果表明,彭祖寿柑优株果皮能通过多条通路达到抗氧化的作用。
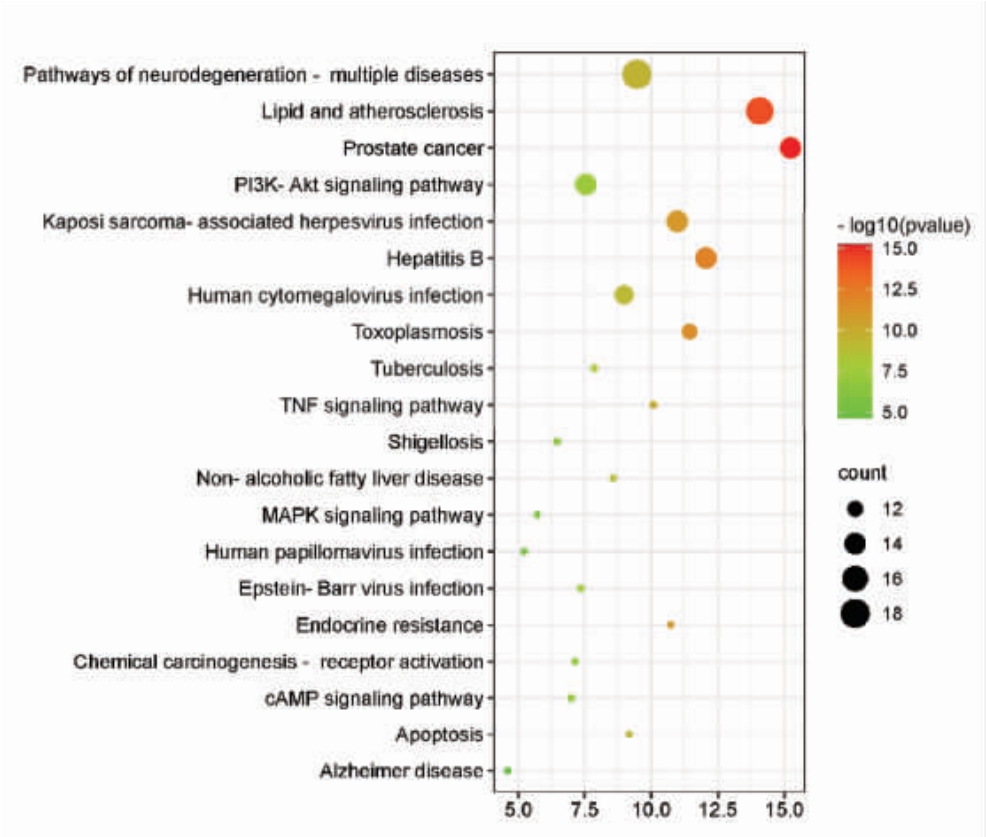
图11 KEGG 信号通路富集分析(top 20)
Fig.11 Enrichment analysis of KEGG signaling pathway(top 20)
2.4.4 “活性成分-靶点-通路网络”的构建 将KEGG 通路富集分析得到的238 条通路和这些通路涉及的146 个靶点,以及靶点所对应的7 种成分,导入Cytoscape 3.8.2 中构建彭祖寿柑优株果皮“活性成分-靶点-通路”网络,并进行可视化分析,见图12。
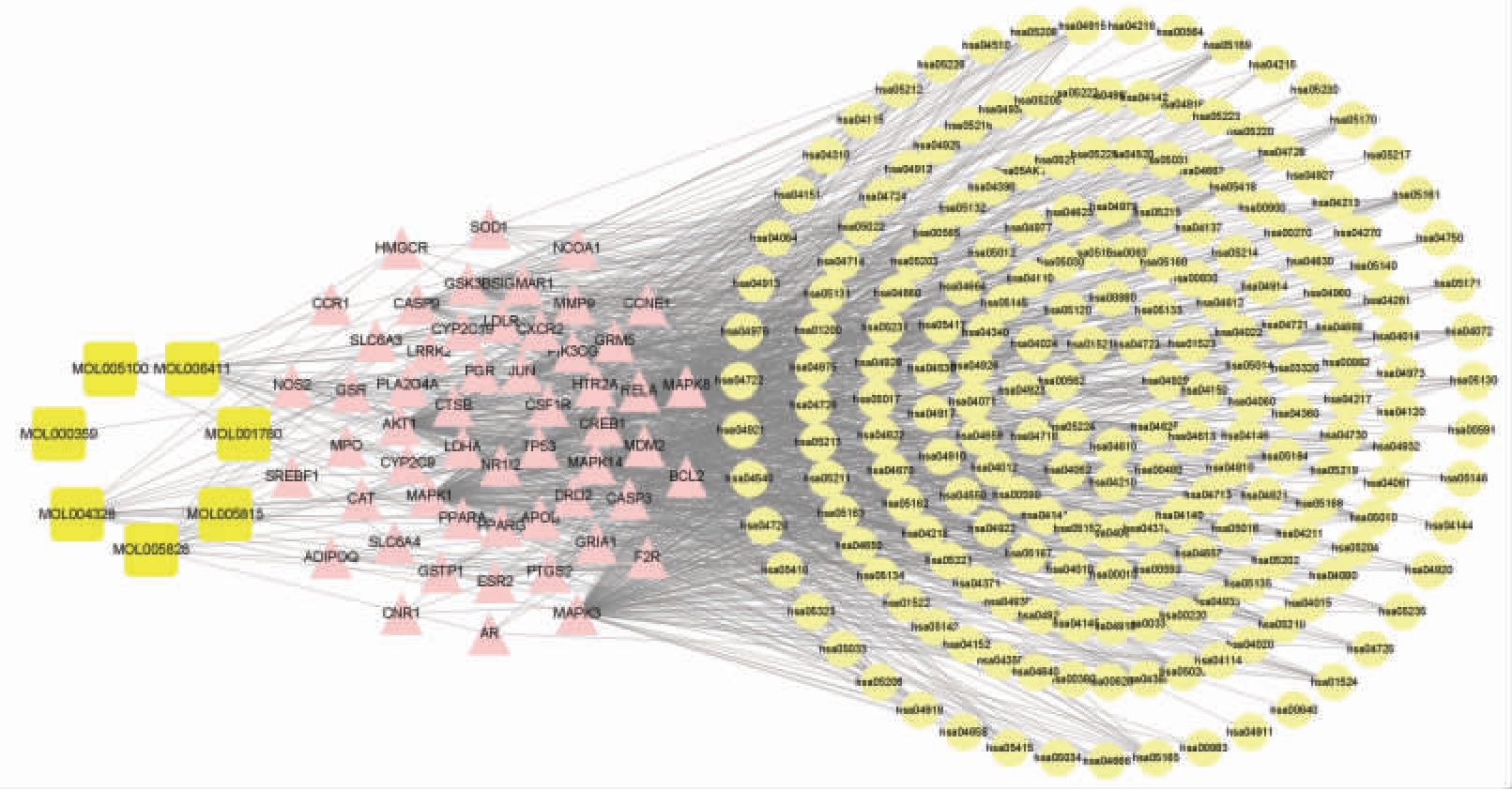
图12 彭祖寿柑优株果皮“成分-关键靶点-通路”网络
Fig.12 Network prediction of compound-target-pathway of Citrus reticulate Blanco superior plants fruit peel
2.5 分子对接
采用Discovery Studio 软件进行分子对接,结果受体和其原配体对接结果计算所得RMSD 值小于2.0 Å,说明既定数值能够较好的体现原配体与蛋白的结合模式。以TP53、MAPK3、MMP9、PPARA 受体与活性成分对接后,结果见表4,进一步分析其相互作用。
表4 活性成分与关键靶点对接的CDOCKER 得分
Table 4 The CDOCKER-energy value of the active ingredients dockes with the key targets
对接结果显示,柚皮素与黄柏酮与各个靶蛋白均有较好的结合。川陈皮素、甲基橙皮苷、柚皮素、芸香柚皮苷与MMP9 对接打分值最高,谷固醇、黄柏酮与MAPK3 对接打分值最高,橙皮素、香叶木素与PPARA 对接打分值最高。分析其相互作用可知,成分与靶蛋白的结合主要是发生氢键作用和疏水作用,分别选取与3 个靶蛋白对接分值最高的成分作图,如图13 所示。甲基橙皮苷与MMP9 的关键氨基酸ALA191、GLU111、PRO421、PHE110 发生氢键作用,与LEU188 发生疏水作用;橙皮素与PPARA 的关键氨基酸SER280、TYR464、ALA455 发生氢键作用,与ALA454、LEU456 发生疏水作用。谷固醇与MAPK3 的关键氨基酸LYS71、GLN122 发生氢键作用,与VAL56、CYS183、TYR130、LYS131 发生疏水作用[52]。分子对接结果进一步验证了网络药理学筛选出的靶点可能是彭祖寿柑优株果皮发挥抗氧化作用的关键作用靶点。
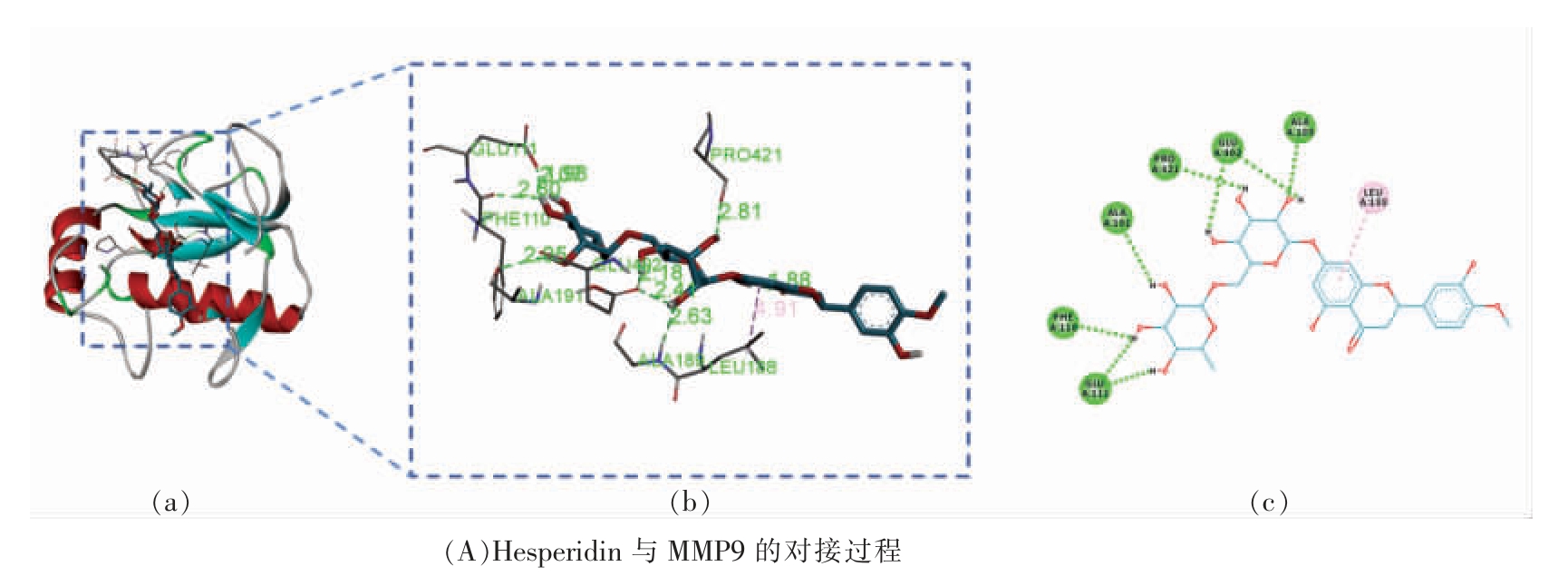

图13 活性成分与靶蛋白的分子对接过程示例图
Fig.13 Example diagram of molecular docking process between active ingredients and target protein
注:a 为成分与靶蛋白对接图,b 为配体受体结合处相互作用3D 图,c 为配体受体结合处相互作用2D 图。
3 讨论
质谱技术可以实现高效准确的复杂体系快速分析,通过化合物的质谱一级、二级信息可以快速获取其结构信息,而色谱/质谱联用技术可以为中药多组分鉴定研究提供更可靠的依据[43]。本研究通过HPLC-DAD-ESI-MS/MS 与GC-MS 法全面解析了彭祖寿柑优株果皮中的化学成分,共鉴定出65 个化合物,并研究总结了黄酮类、有机酸类和苯丙素类化合物在质谱中的裂解规律,为彭祖寿柑优株的药效物质基础研究提供了试验和理论依据。其次采用DPPH 法、ABTS 法、FRAP 法和TBARS 法评价其抗氧化性能,通过与文献对比发现,彭祖寿柑优株清除DPPH 自由基和铁离子还原能力较为显著。
网络药理学结果表明有7 个化合物为潜在活性成分,以橙皮素、柚皮素等黄酮类成分为主,综合文献与网络药理学结果进行分子对接验证,从整体水平对药物与机体相互作用及其机制进行研究。结果表明,TP53、MAPK3、MMP9、PPARA 等靶点参与PI3K-Akt 信号通路、MAPK 信号通路、TNF 信号通路、cAMP 信号通路、脂质和动脉硬化等信号通路发挥抗氧化作用。研究表明,氧化应激与PI3K/AKT、MAPK 信号通路的活化有关,氧化应激水平的增加可以促使活性氧(ROS)大量生成,进而阻断PI3K/AKT、MAPK 信号通路的激活,彭祖寿柑优株果皮中的柚皮素、川陈皮素、甲基橙皮苷等黄酮类化合物可能作用于TP53、MAPK3靶蛋白,调控并激活PI3K/AKT 和MAPK 信号通路,起到抗氧化的作用[53]。有相关文献报道柑橘属植物发挥抗氧化作用的关键物质基础和作用机制与上述相同[48]。
综上,芸香科柑橘属植物为现研究发现抗氧化作用较好的植物,既有药用价值,也有食用价值,然而鉴于彭祖寿柑优株尚未在市场上广泛销售,故没有文献对彭祖寿柑优株抗氧化作用及机制进行详细阐明,限制了该品种进一步的发展。本研究基于HPLC-DAD-ESI-MS/MS 与GC-MS 定性表征彭祖寿柑优株的化学成分,将柑橘属植物中的挥发性成分用于抗氧化网络药理学研究,并将网络药理学与分子对接技术用于筛选并验证其主要活性成分的作用靶点,对其发挥抗氧化作用的药效成分进行系统研究,为植物中的天然抗氧化剂筛选提供进一步信息,为该植物更长久的可持续发展提供理论依据。然而其体内抗氧化机制及相关化合物的活性仍有待进一步研究。
[1] FENG Y,WANG N,YE X,et al.Hepatoprotective effect and its possible mechanism of coRTidis rhizoma aqueous extract on carbon tetrachloride-induced chronic liver hepatotoxicity in Rats[J].Journal of Ethnopharmacology,2011,138(3):683-690.
[2] 王晶波,杨倬,秦文,等.牛肝菌多酚细胞抗氧化活性评价模型研究[J].中国食品学报,2021,21(6):273-279 WANG J B,YANG Z,QIN W,et al.Studies on evaluation model of cellular antioxidant activity for boletus polyphenols[J].Journal of Chinese Institute of Food Science and Technology,2021,21(6):273-279.
[3] 刘树兴,赵芳.从天然植物中开发抗氧化剂研究进展[J].食品研究与开发,2007(7):179-182.LIU S X,ZHAO F.Research progress on natural antioxidant from nature plant[J].Food Research and Development,2007(7):179-182.
[4] DUGO G,GIACOMO A D.Citrus:The genus citrus[EB/OL].CRC,2002.https://www.perlego.com/book/1712106/citrus-the-genus-citrus-pdf.
[5] BENAVENTE-GARCÍA O,CASTILLO J.Update on uses and properties of citrus flavonoids:New findings in anticancer,cardiovascular,and anti-inflammatory activity[J].J Agric Food Chem,2008,56(15):6185-6205.
[6] 温文英,林标声.橘皮提取物在蛋糕制作中的应用研究[J].安徽农业科学,2020,48(14):166-167,220.WEN W Y,LIN B S.Study on the application of orange peel extract in cake making[J].Journal of Anhui Agricultural Sciences,2020,48(14):166-167,220.
[7] 刘仙俊,李文华,孙红艳,等.橘子不同部位活性成分含量及其体外抗氧化能力研究[J].食品研究与开发,2021,42(17):13-18.LIU X J,LI W H,SUN H Y,et al.Study on the active ingredients contents and antioxidant capacity of different parts of tangerine[J].Food Research and Development,2021,42(17):13-18.
[8] 郑重禄.彭祖寿柑高接引种及栽培技术要点[J].福建果树,2007(2):52-53.ZHENG Z L.Key points of high graft introduction and cultivation techniques[J].Fujian Fruits,2007(2):52-53.
[9] 项梦辉,黄征槐.彭祖寿柑引种表现及优质低耗栽培技术[J].东南园艺,2015,3(5):40-42.XIANG M H,HUANG Z H.Introduction performance and high quality and low cost cultivation techniques of 'Pengzushougan' Tangor[J].Southeast Horticulture,2015,3(5):40-42.
[10] 刘育铖,毛思宇,李昱,等.黄花倒水莲总皂苷抗凝血和抗血栓作用及机制:基于网络药理学[J].食品科学,2021,42(23):206-213.LIU Y C,MAO S Y,LI Y,et al.Anticoagulant and antithrombotic effect and underlying mechanism of total saponins from the roots of Polygala fallax Hemsl:A study based on network pharmacology[J].Food Science,2021,42(23):206-213.
[11] 刘雪飞,吴晓芳,祁悦,等.基于分子对接的副溶血弧菌外膜蛋白OmpW 天然抑制剂的筛选[J].中国食品学报,2021,21(3):22-30.LIU X F,WU X F,QI Y,et al.Screening of natural inhibitors of outer membrane protein OmpW of vibrio parahaemolyticus based on molecular docking[J].Journal of Chinese Institute of Food Science and Technology,2021,21(3):22-30.
[12] 国家药典委员会.中华人民共和国药典[S].四部.北京:中国医药科技出版社,2015:248.National Pharmacopoeia Commission.Chinese pharmacopoeia[S].Part 4.Beijing:China Medical Science and Technology Press,2015:248.
[13] DAVIDE B,ERSILIA B,CORRADO C,et al.Kumquat(Fortuella japonica Swingle)juice:Flavonoid distribution and antioxidant properties[J].Food Research International,2011,44(7):2190-2197.
[14] 陆俊,敦惠瑜,向孝哲,等.体外模拟胃、肠消化对6 种黑色食品抗氧化成分及其活性的影响[J].食品科学,2018,39(5):47-56.LU J,DUN H Y,XIANG X Z,et al.Effect of in vitro simulated gastrointestinal digestion on bioactive components and antioxidant activities of six kinds of black foods[J].Food Science,2018,39(5):47-56.
[15] 周蕙祯,汤良杰,龚宇,等.瑞香狼毒花化学成分及其抗氧化活性研究[J].中草药,2020,51(9):2395-2401.ZHOU H Z,TANG L J,GONG Y,et al.Chemical constitutents from flowers of Stellera chamaejasme and their antioxidant activity[J].Chinese Traditional and Herbal Drugs,2020,51(9):2395-2401.
[16] WONG C,LI H,CHENG K,et al.A systematic survey of antioxidant activity of 30 Chinese medicinal plants using the ferric reducing antioxidant pow er assay[J].Food Chemistry,2006,97(4):705-711.
[17] 葛斌,张振明,许爱霞,等.水红花子醇提物抑制大鼠组织脂质过氧化反应的体外作用研究[J].第三军医大学学报,2007(6):516-518.GE B,ZHANG Z M,XU A X,et al.Effect of alcoholic extract from Fructus Polygoni Orientalis on lipid peroxidation in rat tissues[J].Acta Academiae Medicinae Militaris Tertiae,2007(6):516-518.
[18] HE T,LI X,WANG X P,et al.Chemical composition and anti-oxidant potential on essential oils of Thymus quinquecostatus Celak.from Loess Plateau in China,regulating Nrf2/Keap1 signaling pathway in zebrafish[J].Sci Rep,2020,10:11280.
[19] 许姗姗,许浚,张笑敏,等.常用中药陈皮、枳实和枳壳的研究进展及质量标志物的预测分析[J].中草药,2018,49(1):35-44.XU S S,XU J,ZHANG X M,et al.Research progress on Citri reticulatae pericarpium,Aurantii fructus immaturus,and aurantii fructus and Q -marker predictive analysis[J].Chinese Traditional and Herbal Drugs,2018,49(1):35-44.
[20] 杨放晴,何丽英,杨丹,等.不同陈化时间广陈皮中黄酮类成分的UPLC-Q-Orbitrap HRMS 分析[J].中国实验方剂学杂志,2021,27(12):125-132.YANG F Q,HE L Y,YANG D,et al.Analysis and identification of flavonoids in Citri reticulatae pericarpium with different aging time by UPLC-QOrbitrap HRMS [J].Chinese Journal of Experimental Traditional Medical Formulae,2021,27(12):125-132.
[21] 任萍,曹俊岭,林珀吏,等.基于分子对接技术探讨木犀草素调控脂氧合酶途径抗H9C2 心肌细胞缺氧缺糖/复氧复糖损伤的分子机制[J].中国中药杂志,2021,46(21):5665-5673.REN P,CAO J L,LIN B L,et al.Molecular mechanism of luteolin regulating lipoxygenase pathway againstoxygen-glucose deprivation/reperfusion injury in H9C2 cardiomyocytes based on molecular docking[J].China Journal of Chinese Materia Medica 2021,46(21):5665-5673.
[22] 谷宇,雒银珍,赵博文,等.基于分子模拟技术探讨豨莶通栓制剂的抗炎作用机制[J].中国中药杂志,2019,44(12):2572-2579.GU Y,LUO Y Z,ZHAO B W,et al.Anti-inflammatory mechanism of Xixian Tongshuan preparation based on molecular simulation methods[J].China Journal of Chinese Materia Medica,2019,44(12):2572-2579.
[23] 乔晓莉,吴士杰,祁向争,等.山楂中化学成分的UPLC/ESI-TOF/MS 分析[J].现代药物与临床,2014,29(2):120-124.QIAO X L,WU S J,QI X Z,et al.ldentification of chemical constituents in Crataegus pinnatifida var.major by UPLC/ESI-TOF/MS[J].Drugs &Clinic,2014,29(2):120-124.
[24] 孙宁宁,张可佳,耿婉丽,等.基于UPLC-Q-TOFMS 的加参片提取物化学成分分析[J].中草药,2018,49(2):293-304.SUN N N,ZHANG K J,GENG W L,et al.Analysis of chemical constituents of Jiashen Tablet extract by UPLC-Q-TOF-MS[J].Chinese Traditional and Herbal Drugs,2018,49(2):293-304.
[25] 张玉,董文婷,霍金海,等.基于UPLC-Q-TOFMS 技术的广地龙化学成分分析[J].中草药,2017,48(2):252-262.ZHANG Y,DONG W T,HUO J H,et al.Analysis on chemical constituents of Pheretima aspergillum by UPLC-Q-TOF-MS[J].Chinese Traditional &Herbal Drugs,2017,48(2):252-262.
[26] 郑玉莹,庞文静,白杨,等.基于UFLC-Triple TOF-MS/MS 技术的枳实传统饮片及破壁饮片化学成分系统分析[J].中南药学,2018,16(4):443-450.ZHENG Y Y,PANG W J,BAI Y,et al.Chemical constituents in traditional slices and ultrafine granular powder of Fructus aurantii immaturus by UFLCTriple TOF -MS/MS [J].Central South Pharmacy,2018,16(4):443-450.
[27] 邓桂明,向彪,肖小芹,等.基于GC-MS 和UPLCESI-MS/MS 法研究乌药化学成分[J].中药材,2016,39(10):2229-2236.DENG G M,XIANG B,XIAO X Q,et al.Study on chemical constituents of lindera aggregate by GC-MS and UPLC-ESI-MS/MS[J].Journal of Chinese Medicinal Materials,2016,39(10):2229-2236.
[28] 张雯霞,冯敏,苗雨露,等.基于UPLC-Q-TOFMS/MS 技术的还贝止咳方化学成分分析[J].中国中药杂志,2019,44(14):3022-3034.ZHANG W X,FENG M,MIAO Y L,et al.Analysis of chemical components of Huanbei Zhike prescription based on UPLC-Q-TOF-MS/MS technology[J].China Journal of Chinese Materia Medica,2019,44(14):3022-3034.
[29] 靳宝芬,叶昊,王凤云,等.基于UPLC/Q-TOF MS法分析生何首乌药材的化学成分[J].广东药科大学学报,2020,36(4):473-478.JIN B F,YE H,WANG F Y,et al.Chemical component analysis of raw Polygoni multiflori radix by UPLC/Q-TOF MS[J].Journal of Guangdong Pharmaceutical University,2020,36(4):473-478.
[30] 孙国东,霍金海,程团,等.基于UPLC-Q-TOF/MS技术的胡桃楸叶化学成分分析[J].中药材,2017,40(5):1123-1129.SUN G D,HUO J H,CHENG T,et al.Identification and characterization of chemical constituents in leaves of Juglans mandshurica based on UPLCQ-TOF/MS[J].Journal of Chinese Medicinal Materials,2017,40(5):1123-1129.
[31] 瑞芳,全庆华,郭晓宇,等.UPLC-LTQ-Orbitrap-MS 法快速分析鬼箭羽中的化学成分[J].质谱学报,2018,39(5):540-551.RUI F,QUAN Q H,GUO X Y,et al.Identification of chemical constituents of euonymus alatus by UPLC-LTQ-Orbitrap-MS[J].Journal of Chinese Mass Spectrometry Society,2018,39(5):540-551.
[32] 向青,王小花,林慧,等.HPLC-DAD-Q-TOF-MS/MS 法的银黄颗粒主要成分定性与定量研究[J].中成药,2015,37(1):105-112.XIANG Q,WANG X H,LIN H,et al.Qualitative and quantitative analysis of major constituents in Yinhuang Granules by HPLC-DAD-Q-TOF-MS/MS[J].Chinese Traditional Patent Medicine,2015,37(1):105-112.
[33] 龙红萍,李欣,王婷婷,等.基于UPLC-LTQ-Orbitrap-MS 的小儿扶脾颗粒的化学成分研究[J].中草药,2018,49(23):5522-5531.LONG H P,LI X,WANG T T,et al.Study on chemical constituents from Xiaoer Fupi Granules based on UPLC-LTQ-Orbitrap-MS [J].Chinese Tradi tional and Herbal Drugs,2018,49(23):5522-5531.
[34] 于国华,杨洪军,李俊芳,等.基于UHPLC-LTQOrbitrap-MS/MS 技术分析枳实中的化学成分[J].中国中药杂志,2016,41(18):3371-3378.YU G H,YANG H J,LI J F,et al.Analysis of chemical constituents from Citrus aurantium by UHPLC-LTQ-Orbitrap-MS/MS[J].China Journal of Chinese Materia Medica,2016,41(18):3371-3378.
[35] 张栋健,李薇,何庆文,等.UHPLC-Q-TOF-MS 分析枳壳炮制前后成分变化[J].中国中药杂志,2016,41(11):2070-2080.ZHANG D J,LI W,HE Q W,et al.Chemical variation in Aurantii fructus before and after processing based on UHPLC -Q -TOF -MS [J].China Journal of Chinese Materia Medica,2016,41(11):2070-2080.
[36] 乔湜,许海山,石晓伟,等.UHPLC-QTOF-MS 法分析鉴定止咳宝片在大鼠血浆中的代谢产物[J].药学学报,2018,53(9):1536-1544.QIAO S,XU H S,SHI X W,et al.Identification of major bioactive components and their metabolites in rat plasma after oral administration of Zhikebao tablet by UHPLC-QTOF-MS[J].Acta Pharmaceutica Sinica,2018,53(9):1536-1544.
[37] 曾美玲,沈耐涛,吴赛伟,等.基于UPLC-Triple-TOF/MS 方法的三叶青化学成分分析[J].中草药,2017,48(5):874-883.ZENG M L,SHEN N T,WU S W,et al.Analysis on chemical constituents in Tetrastigma hemsleyanum by UPLC-Triple-TOF/MS[J].Chinese Traditional and Herbal Drugs,2017,48(5):874-883.
[38] 於洪建,李赫宇,于滢慧,等.红酒泥成分的UPLC-Q-TOF-MS 分析[J].食品研究与开发,2017,38(3):162-165.YU H J,LI H Y,YU Y H,et al.The UPLC-QTOF-MS analysis of wine lees[J].Food Research and Development,2017,38(3):162-165.
[39] 吴吉洋,高方圆,叶晓岚,等.创新药物川阿格雷及其拼合分子阿魏酸和川芎嗪的质谱裂解规律[J].第二军医大学学报,2012,33(7):755-758.WU J Y,GAO F Y,YE X L,et al.Chuan'agelei and its flatten structure ferulic acid and ligustrazine:Mass fragmentation pathway[J].Academic Journal of Second Military Medical University,2012,33(7):755-758.
[40] 翟兴英,张凌,李冰涛,等.采用UPLC-Q-TOFMS/MS 分析半夏药材中的化学成分[J].中国实验方剂学杂志,2019,25(7):173-183.QU X Y,ZHANG L,LI B T,et al.Chemical components in pinelliae Rhizoma by UPLC-Q-TOFMS/MS[J].Chinese Journal of Experimental Traditional Medical Formulae,2019,25(7):173-183.
[41] 褚衍涛,魏文峰,霍金海,等.UPLC-Q-TOF-MS法分析芩百清肺浓缩丸中的化学成分[J].中成药,2016,38(6):1303-1310.CHU Y T,WEI W F,HUO J H,et al.Analysis of chemical constituents in Qinbai Qingfei concentrated pills by UPLCQ-TOF-MS[J].Chinese Traditional Patent Medicine,2016,38(6):1303-1310.
[42] 侯娅,马阳,邹立思,等.基于UPLC-Triple TOFMS/MS 技术分析不同产地太子参的差异化学成分[J].质谱学报,2015,36(4):359-366.HOU Y,MA Y,ZOU L S,et al.Difference of chemical compositions in Pseudostellariae radix from different origins by UPLC-Triple TOF -MS/MS [J].Journal of Chinese Mass Spectrometry Society,2015,36(4):359-366.
[43] 谭林威,金辉辉,刘永祥,等.基于HPLC-Q-TOFMS/MS 技术快速分析肠炎宁片中主要化学成分[J].中草药,2020,51(16):4124-4132.TAN L W,JIN H H,LIU Y X,et al.Main chemical constituents of Changyanning Tablets based on HPLC-Q-TOF-MS/MS[J].Chinese Traditional and Herbal Drugs,2020,51(16):4124-4132.
[44] 唐明,高霞,耿婷,等.基于HPLC-Q-TOF-MS/MS技术的七味通痹口服液化学成分分析[J].中草药,2021,52(8):2226-2236.TANG M,GAO X,GENG T,et al.Identification of chemical constituents in Qiwei Tongbi oral liquid by HPLC-Q-TOF-MS/MS[J].Chinese Traditional and Herbal Drugs,2021,52(8):2226-2236.
[45] 牛研,王书芳.LC-Q-TOF-MS 和LC-IT-MSn 分析当归芍药散中化学成分[J].中草药,2014,45(8):1056-1062.NIU Y,WANG S F.Analysis on chemical constituents in Danggui-Shaoyao-San by LC-Q-TOF-MS and LC-IT-MSn[J].Chinese Traditional and Herbal Drugs,2014,45(8):1056-1062.
[46] 黄斌,胡燕珍,李雪,等.基于UPLC-Q-TOF-MS技术分析乌蕨中的化学成分[J].实用中西医结合临床,2021,21(9):155-159.HUANG B,HU Y Z,LI X,et al.Analysis of chemical constituents in Odontosoria chinensis based on UPLC-Q-TOF-MS[J].Practical Clinical Journal of Integrated Traditional Chinese and Western Medicine,2021,21(9):155-159.
[47] 许如玲,范君婷,董惠敏,等.经典名方黄芪桂枝五物汤标准煎液化学成分的UPLC-Q-TOF-MS 分析[J].中国中药杂志,2020,45(23):5614-5630.XU R L,FAN J T,DONG H M,et al.UPLC-QTOF-MS analysis on chemical constituents of classical prescription Huangqi Guizhi Wuwu Tang standard decoction[J].China Journal of Chinese Materia Medica,2020,45(23):5614-5630.
[48] 张东峰,陈家豪,郭静,等.7 种柑橘多酚、黄酮含量及其抗氧化活性比较研究[J].食品研究与开发,2019,40(6):69-74.ZHANG D F,CHEN J H,GUO J,et al.Comparative study on the polyphenol,flavonoid and antiox idant activity of seven varieties of citrus[J].Food Research and Development,2019,40(6):69-74.
[49] ZHA X Q,WANG J H,YANG X F,et al.Antioxidant properties of polysaccharide fractions with different molecular mass extracted with hot -water from rice bran[J].Carbohyd Polym,2009,78:570-575.
[50] 陈华铮,朱凯.两种柑橘类精油及其主要成分的抑菌和抗氧化活性[J].林产化学与工业,2021,41(4):17-22.CHEN H Z,ZHU K.Antibacterial and antioxidant activities of two citrus essential oils and their main components [J].Chemistry and Industry of Forest Products,2021,41(4):17-22.
[51] 王广超,梁惠,韩磊,等.D-柠檬烯对乙醇性肝损伤大鼠抗氧化活性与NF-κB 及COX-2 表达影响[J].青岛大学医学院学报,2015,51(4):441-444.WANG G C,LIANG H,HAN L,et al.Effects of D-limonene on antioxidant ability and the expressions of NF-κB and COX-2 in rats with alcohol-induced hepatic injury[J].Acta Aacademiae Medicinae Qingdao Universitatis,2015,51(4):441-444.
[52] 李红燕,陈海,谢倩,等.基于网络药理学和分子对接探究黄连、厚朴配伍调控溃疡性结肠炎作用机制[J].世界科学技术-中医药现代化,2021,23(8):2749-2761.LI H Y,CHEN H,XIE Q,et al.Study on the mechanism of Rhizoma coptidis and Magnolia officinalis in regulating ulcerative colitis based on network pharmacology and molecular docking[J].Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology,2021,23(8):2749-2761.
[53] 亓金钗,陈静,李文,等.基于“干法+湿法”联用技术探究西藏沙棘抗氧化质量标志物[J].中国中药杂志,2021,46(11):2699-2709.QI J C,CHEN J,LI W,et al.Explore antioxidant quality markers of Hippophae tibetana based on "drymethod+wet-method" technology[J].China Journal of Chinese Materia Medica,2021,46(11):2699-2709.