冬枣(Zizyphus Jujuba Mill.cv.Dongzao)是鼠李科中的枣属植物,是我国主要的鲜食枣品种。冬枣果实皮薄,汁液较多而无渣,口感脆甜,风味极佳,形状近圆形,果皮色泽鲜亮,美观诱人,在成熟时果面呈赭红色,果肉多呈绿白色。冬枣果实具有很高的营养价值,除含有各种氨基酸、维生素、矿物质外,还含有功能性多糖、环磷酸腺苷、三帖酸、类黄酮、单宁等生物活性成分,有“枣中极品”的美誉,深受广大消费者青睐[1-5]。近年来,冬枣的栽培面积和年产量逐年增加,然而,新鲜的冬枣果实不耐贮藏,在采后运输和贮藏过程中易受到机械损伤和微生物的侵染,造成皱缩,酒软甚至腐败,失去食用价值和商业价值[6-8]。冷藏是冬枣采后最常用的保鲜方式,而长期冷藏也会造成冬枣果实品质的劣变,使其失去商品价值,造成经济损失[9-11]。引起冬枣果实冷藏过程中发生品质劣变的主要原因是其代谢物质的变化,而目前关于其冷藏过程中代谢物质的变化鲜见研究报道。
代谢组学是在整体水平上对某一生物、组织或细胞中的所有小分子的代谢化合物进行定量、定性分析的一种技术,通过高通量检测以及数据的处理进行系统性的信息整合,进而通过生物体内这些代谢物质的变化规律来揭示机体对不同生长环境、时期以及外界刺激下代谢水平的应答,在生物医药、营养科学、植物代谢和响应机制方面都有广泛的应用[12-17]。王乐飞等[18]通过超高效液相色谱-质谱联用技术及代谢组学分析3 个发育阶段“三变红”枣果果皮黄酮类化合物的变化及其与果皮颜色变化的内在关系。Feng 等[19]通过广泛靶向代谢组学技术分析壶瓶枣不同成熟时期代谢物质的变化。裴峰等[20]通过代谢组学技术对冷藏过程中梭子蟹的营养物质变化进行分析。Mabuchi 等[21]通过代谢组学技术分析五辐黄鱼肌肉在冷藏过程中的代谢物变化。Monti 等[22]通过代谢组和蛋白组学技术分析桃果实采后冷藏过程中营养物质的变化,揭示果肉絮状化机制。Zhao 等[23]通过转录组学和代谢组学技术分析长期冷藏苹果果实质量下降的代谢物质变化和基因变化。而运用代谢组学方法分析冬枣冷藏过程中的代谢物质及其差异尚未见报道。本研究以未经冷藏,冷藏60 d 及冷藏90 d 的冬枣果实为研究材料,利用UPLC-MS/MS 技术,分析冬枣果实在3 个时期的代谢物质差异,并对其差异性进行比较,从差异代谢物的角度研究冷藏对冬枣果实品质的影响。
1 材料与方法
1.1 材料与试剂
冬枣果实采摘自山西省临汾市尧都区大阳镇乔村,采摘半红期的冬枣果实,采收当天运回实验室,挑选大小一致,着色相近,无伤害的果实用于本试验。
甲醇、乙腈、标准品(均为色谱纯),标准品为德国Sigma-Aldrich 公司。
1.2 仪器与设备
NexeraX2 超高效液相色谱仪,日本岛津公司;4500 QTRAP 串联质谱仪(Tandem mass spectrometry,MS/MS),美国Applied Biosystems 公司。
1.3 方法
1.3.1 样品前处理 分别取采收当天、冷藏60 d和冷藏90 d 的冬枣果实的果皮(带果肉),迅速置于液氮中,并分别装于15 mL 的无酶管中,转至-80 ℃超低温冰箱中备用,每个取样点取样设置3 个重复。
预备70%的甲醇提取液;3 个取样点的冬枣样品分别经真空冷冻干燥后研磨至粉末状;取100 mg 研磨好的冬枣样品溶解于1.2 mL 提取液中,涡旋30 s,共6 次(每30 min 1 次),4 ℃冰箱冷藏过夜;在12 000 r/min 离心10 min,取上清液,用0.22 um 微孔滤膜过滤后存于进样瓶中。
1.3.2 UPLC-MS/MS 分析 液相条件和质谱条件及参数设定参照张琴等[24]的方法。
1.4 数据分析
根据迈维代谢生物科技有限公司自建数据库MVDB(Metware database)对冷藏不同时间冬枣果实中的代谢物进行分析,利用Analyst 1.6.3 处理质谱数据,并进行多元统计分析数据,具体参照张琴等[24]的方法。根据变量重要性投影(Variable importance in project,VIP)初步筛选差异代谢物,结合单变量分析的单维统计P 值或者差异倍数值进一步筛选差异代谢物(代谢物在对照组和试验组中差异为2 倍以上或0.5 以下为差异显著)。通过R 软件和KEGG 数据库对差异代谢物进行注释,聚类分析及代谢通路分析。
2 结果与分析
2.1 冬枣果实中代谢物总体分析
通过迈维代谢自建数据库MWDB,根据代谢物的定性、定量分析得到MRM 代谢物检测多峰图(图1a),多峰图中显示了样本中能够检测到的所有代谢物质,质谱峰的颜色差异表示检测到的不同代谢物,色谱峰的峰面积表示相对应物质的相对含量;对所有样本进行质控分析,得到总离子流图(图1b),为数据的可靠性提供保障[25]。从图1和图2 可看出,在冬枣果实样品中,可从数据库中提取到较多的相关代谢物,且结果重复性高,保证了结果的可靠性和后续分析的可行性。
图1 冬枣果实MRM 代谢物检测多峰图(a)和质控质谱检测TIC 重叠图(b)
Fig.1 Multimodal diagram of MRM metabolite detection in winter jujube(a)and TIC overlay of quality control mass spectrometry(b)
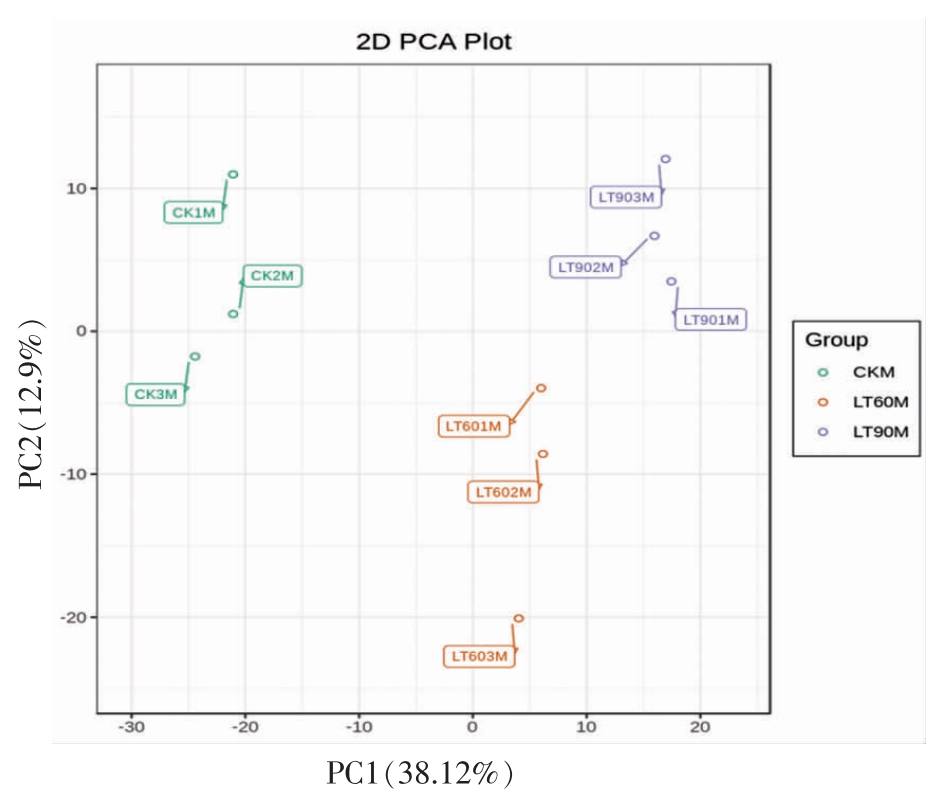
图2 3 组冬枣果实与质控样品质谱数据的PCA 得分图
Fig.2 PCA plot for discrimination of three winter jujube groups and quality control samples
注:CK:对照组(未经冷藏);LT60:冷藏60 d;LT90:冷藏90 d。下同。
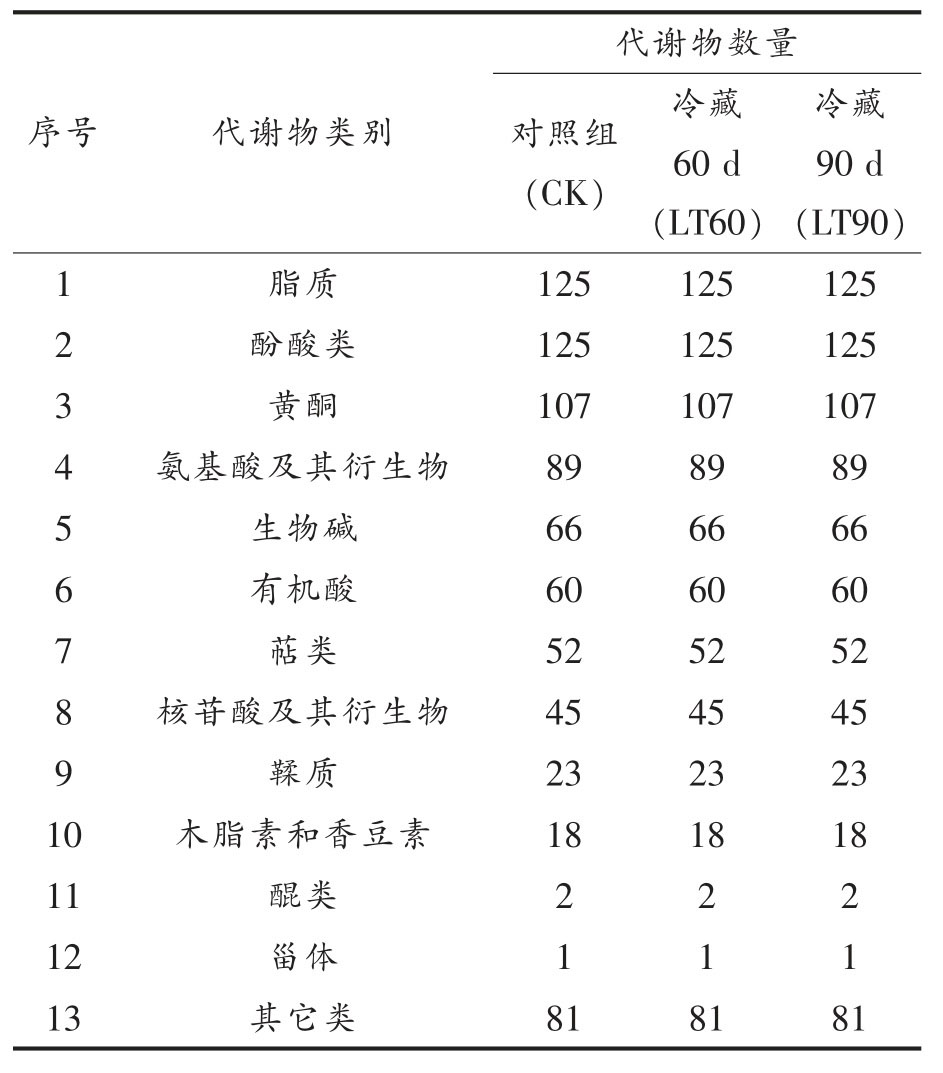
通过定性、定量分析,在冬枣果实样品中,共鉴定出794 个代谢物(表1,原始数据见附件1),其中,125 个属于脂质类,125 个属于酚酸类,107个属于黄酮类,89 个属于氨基酸及其衍生物类,66 个属于生物碱类,60 个属于有机酸类,52 个属于萜类,45 个属于核苷酸及其衍生物类,23 个属于鞣质类,18 个属于木脂素和香豆素类,2 个属于醌类,1 个属于甾体类,81 个属于其它类,这一结果与Zhang 等[26]在冬枣果实转色过程中共鉴定到的代谢物数量705 个属于23 类相近。在冷藏60 d 和90 d 的冬枣果实中均检测到这些代谢物,然而这些代谢物的含量对比对照组有一定的增加或减少,这些结果表明冷藏对冬枣果实中代谢物的组成影响不大,主要影响了代谢物的含量,进而影响冬枣果实的品质。
表1 冬枣果实代谢物定性、定量的结果
Table 1 Qualitative and quantitative results of metabolites in Dongzao jujube
2.2 总体样本主成分分析(Principal component analysis,PCA)及重复相关性分析
通过对样本进行PCA 分析,可判断各样本分组间的总体代谢物差异和组内重复样本间的变异度大小,显示各组之间代谢组分离趋势和样品组间代谢组是否存在差异[27]。3 组冬枣果实样品的总体PCA 二维图见图2,其中PC1 的贡献率为38.12%,PC2 的贡献率为12.9%,从图中可以看出对照组(未经冷藏的冬枣)和冷藏90 d 的冬枣果实中的3 个重复之间的代谢物分离程度较小,重复性较好,冷藏60 d 组中一个重复的分离程度稍大,而3 个组间的分离趋势明显,结果能够反映冷藏组和对照组之间的代谢物存在差异。
2.3 正交偏最小二乘判别(Orthogonal PLSDA,OPLS-DA)结果分析
根据OPLS-DA 模型分析得到的冬枣果实样本的代谢组数据,分别绘制冷藏60 d 与对照组(图3a),冷藏90 d 与对照组(图3b)相比较的得分图,进一步展示各分组之间的差异[28]。从图3A OPLS-DA 得分图中可以看出,对照组在左侧,冷藏60 d 和冷藏90 d 组在右侧,冷藏组与对照组样本区分效果明显;冷藏60 d 与对照组的得分结果中,PC1 的贡献率为42.7%,PC2 的贡献率为14.8%;冷藏90 d 与对照组的得分结果中,PC1 的贡献率为47.9%,PC2 的贡献率为14%。在图3B OPLS-DA 模型验证结果显示冷藏60 d 与对照组的模型中R2X=0.575,R2Y=1(P<0.005),Q2=0.895(P<0.005),其中Q2>0.5 认为是有效的模型;冷藏90 d 与对照组的模型中模型验证结果显示R2X=0.625,R2Y=1(P<0.005),Q2=0.944(P<0.005),其中Q2>0.9 认为是出色的模型。两个对比组中P<0.005,说明OPLS-DA 模型最佳,可进行差异代谢物的筛选分析[28]。
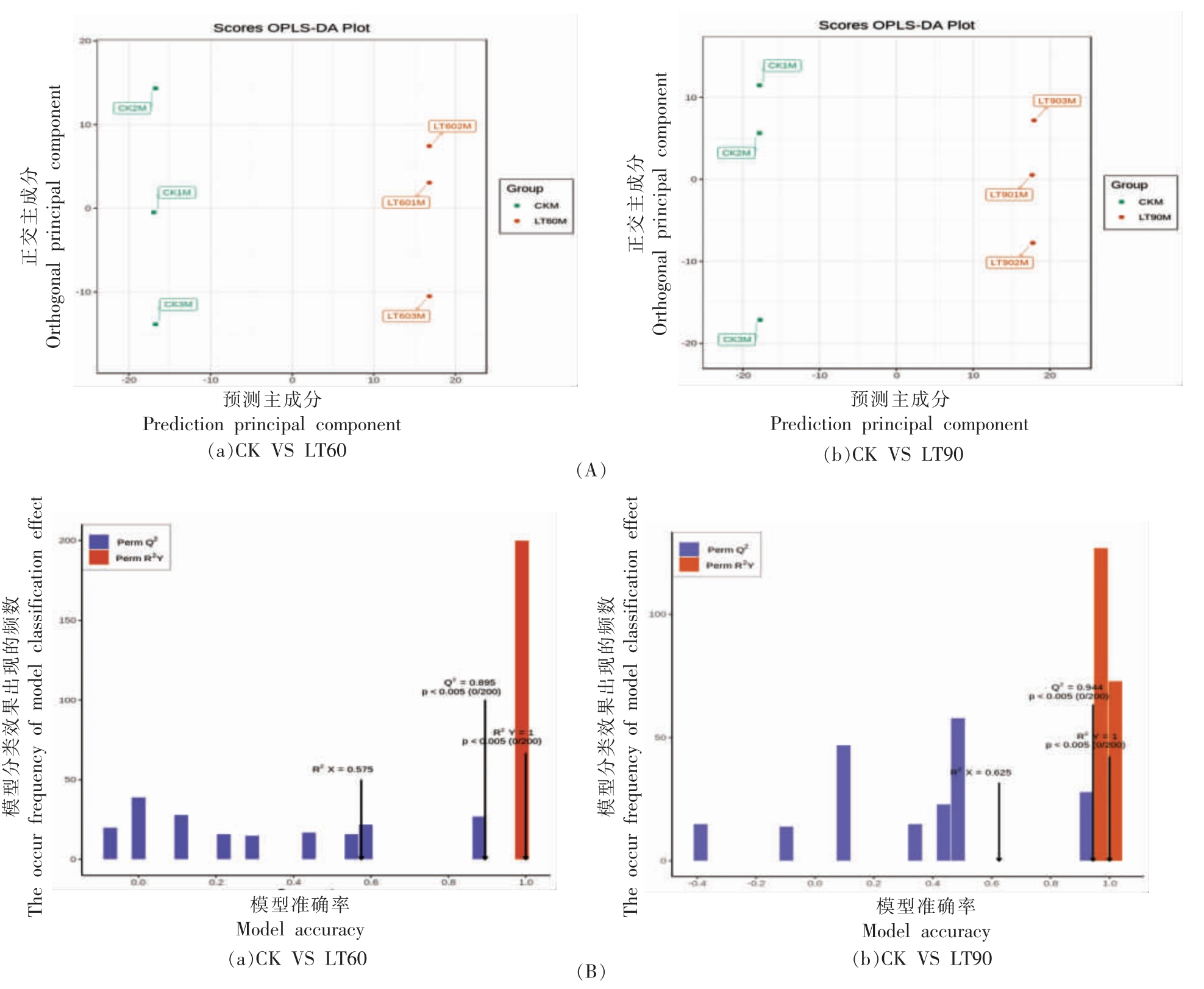
图3 OPLS-DA 得分图(A)和模型验证图(B)
Fig.3 OPLS-DA score plot(A)and verification(B)of OPLS-DA model
2.4 差异代谢物的鉴定分析
据OPLS-DA 结果,通过多变量分析OPLSDA 模型的VIP 值初步筛选冷藏组与对照组之间的差异代谢物,选取VIP 值大于1 的代谢物。同时结合单变量分析的P-value 值或者差异倍数值(Fold change)进一步筛选差异代谢物,选取Fold change 大于2 或小于0.5 的代谢物,最终筛选得到显著差异代谢物[29]。冷藏60 d 和90 d 的冬枣果实中对照组相比的差异代谢物火山图见图4a 和4b。冷藏60 d 的冬枣果实与对照组相比共筛选出93 个差异代谢物,其中属于黄酮类28 个,鞣质类16 个,酚酸类13 个,脂质类10 个,氨基酸及其衍生物类6 个,生物碱类5 个,有机酸类4 个,核苷酸及其衍生物类3 个,萜类3 个,木脂素和香豆素类2 个,其它类3 个,其中显著下调的代谢物71个,显著上调代谢物22 个。冷藏90 d 的冬枣果实中,与对照组相比,共筛选出154 个差异代谢物,其中显著下调代谢物100 个,显著上调代谢物54个,属于黄酮类41 个,酚酸类27 个,脂质类24个,鞣质类16 个,氨基酸及其衍生物类12 个,生物碱类9 个,有机酸类8 个,木脂素和香豆素类4个,核苷酸及其衍生物3 个,萜类3 个,其它类7个。从结果中可看出,冷藏冬枣果实中差异较大的是黄酮、酚酸、脂质及鞣质类。对比冷藏60 d VS对照组和冷藏90 d VS 对照组的差异代谢物(图4c),发现共有差异代谢物82 个,冷藏60 d VS 对照组特有的差异代谢物有11 个,分别为5-氨基戊酸、甲氧基吲哚乙酸、阿魏酸甲酯、肉豆蔻油酸、谷胱甘肽还原型、2-氨基-1,3-二十烷二醇、松脂醇-4-O-(6''-乙酰)葡萄糖苷、尿苷5'-二磷酸-D-葡萄糖、棉黄素-3-O-芸香糖苷、杨梅素-3-O-芸香糖苷和3,6'-二芥子酰基蔗糖;冷藏90 d VS对照组的差异代谢物有72 个,主要是黄酮类、酚酸类、脂质类和氨基酸及其衍生物类。研究表明黄酮类物质是枣果实中主要的生物活性物质[4],具有很强的抗氧化性,低温对黄酮类物质的稳定性有一定影响[10,30-31],低温对植物果实中脂质、氨基酸类物质的合成都有很大影响[32-33]。

图4 冷藏冬枣果实中差异代谢物火山图(a,b)及韦恩图(c)
Fig.4 Volcano map(a,b)and venn map(c)of differential metabolites in cold stored winter jujube
注:维恩图中红色圈代表对照组VS 冷藏60 d,绿色圈代表对照组VS 冷藏90 d。
2.5 TOP20 差异代谢物分析
比较冷藏60 d 和90 d 的冬枣果实与对照组中代谢物定量信息的差异倍数变化,将差异倍数进行log2Fold Change 处理,排在前20 的差异代谢物如图5 所示。图5a 为冷藏60 d VS 对照组,图中显示冷藏60 d 冬枣果实中的显著差异代谢物是N-乙酰-L-酪氨酸(10.74)、α-酮戊二酸(2.71)、2,2-二甲基琥珀酸(2.29)、氧化谷胱甘肽(1.85)、茄三糖(1.73)、9,12,13-三羟基-10,15-十八碳二烯酸(1.52)、3-O-对香豆酰奎宁酸(1.44)、9(S),12(S),13(S)-三羟基-10(E)-十八烯酸(1.39)、紫丁香苷(1.35)、5-甲氧基吲哚-3-甲醛(1.35)、槟榔鞣质(-2.69)、肉桂单宁(-2.75)、棕儿茶素A1(-2.79)、原花青素C1(-2.8)、原花青素B4(-3.02)、3,6'-二芥子酰基蔗糖(-3.2)、原花青素A6(-3.29)、肉桂单宁B2(-3.3)、三儿茶素(-3.48)和肉桂单宁A2(-4.96),分别属于氨基酸及其衍生物(1 个)、有机酸(2 个)、脂质(3 个)、酚酸类(3 个)、生物碱类(1 个)、鞣质(8 个)和黄酮(1 个)。图5b 为冷藏90 d VS 对照组,图中显示冷藏90 d 的冬枣果实中的显著差异代谢物是N-乙酰-L-酪氨酸(12.51)、紫丁香苷(3.69)、α-酮戊二酸(3.2)、2,2-二甲基琥珀酸(2.88)、2-羟基肉桂酸(2.27)、茄三糖(2.23)、对香豆酸(2.19)、5-O-对香豆酰奎宁酸-O-葡萄糖苷(2.06)、N-葡萄糖基对香豆酰腐胺(2.02)、3-O-对香豆酰奎宁酸-O-葡萄糖苷(1.94)、棕儿茶素A1(-4.13)、原花青素C1(-4.33)、肉桂单宁B1(-4.47)、三儿茶素(-4.65)、原花青素A6(-5.04)、肉桂单宁B2(-5.71)、溶血磷脂酰乙醇胺18∶4(-7.7)、顺丁烯二酰基-咖啡酰奎宁酸(-10.59)、绿原酸甲酯(-12.84)和肉桂单宁A2(-14.21),分别属于分别属于氨基酸及其衍生物(1 个)、有机酸(3 个)、脂质(1 个)、酚酸类(6个)、生物碱类(1 个)、鞣质(6 个)和黄酮(1 个)。结果中的一些差异代谢物在冬枣果实转色过程中及低温冷藏的其它果实中也有鉴定出为差异代谢物[23,25]。

图5 冷藏冬枣果实中代谢物含量差异倍数TOP20 柱状图
Fig.5 TOP twenty 20 bar-chart of the differential multiple of metabolites content in cold stored winter jujube
2.6 差异代谢物KEGG 功能注释及代谢通路分析
对冷藏60 d 和90 d 的冬枣果实与对照组相比较的差异显著代谢物的KEGG 注释结果进行KEGG 通路富集[34],见图6。从图6a 可看出,冷藏60 d 冬枣果实与对照组比较的差异代谢物富集到20 条代谢通路,分别为黄酮和黄酮醇生物合成,类黄酮生物合成,脂肪酸生物合成,赖氨酸合成,苯丙素生物合成,托烷、哌啶和吡啶生物碱生物合成,玉米素生物合成,谷胱甘肽代谢,亚油酸代谢,甘油脂代谢,戊糖和葡糖醛酸相互转化,抗坏血酸盐和醛酸盐代谢,柠檬酸循环(TCA 循环),C5-支链二元酸代谢,丁酸代谢,精氨酸和脯氨酸代谢,赖氨酸降解,鞘脂代谢,氨基糖和核苷酸糖代谢,牛磺酸和低牛磺酸代谢;差异代谢物数量较多的富集代谢途径是代谢途径(13 个,52%)和次生代谢物的生物合成(8 个,32%),以及类黄酮生物合成途径(4 个,16%)、黄酮和黄酮醇生物合成途径(4 个,16%)、亚油酸代谢途径(4 个,16%)和谷胱甘肽代谢(3 个,12%)。研究表明这几条代谢途径是与低温胁迫密切相关的代谢途径[22,35-36]。

图6 冷藏冬枣果实的差异代谢物KEGG 富集图
Fig.6 KEGG enrichment map for differential metabolites of cold stored winter jujube
从图6b 可知,冷藏90 d 冬枣果实与对照组比较的差异代谢物富集到20 条代谢通路,分别为异喹啉生物碱生物合成,黄酮和黄酮醇生物合成,类黄酮生物合成,叶酸生物合成,氨基酸生物合成,赖氨酸生物合成,苯丙素生物合成,硫磺中继系统,泛醌和其它萜类醌生物合成,甘油磷脂代谢,亚油酸代谢,鞘脂代谢,C5-支链二元酸代谢,半胱氨酸和蛋氨酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,色氨酸代谢,丁酸代谢,谷胱甘肽代谢,丙氨酸、天冬氨酸和谷氨酸代谢,牛磺酸和低牛磺酸代谢;差异代谢物数量较多的富集代谢途径是代谢途径(29 个,64.44%)和次生代谢物的生物合成(15 个,33.33%),以及氨基酸的生物合成(7 个,15.56%)、类黄酮生物合成途径(5 个,11.11%)、亚油酸代谢途径(5 个,11.11%)、苯丙素生物合成途径(5 个,11.11%)、半胱氨酸和蛋氨酸代谢(5 个,11.11%)和黄酮和黄酮醇生物合成(4 个,8.89%)。
3 结论
本研究利用超高效液相色谱-串联质谱技术测定冬枣果实冷藏期间的代谢物变化,通过对总体样本定性分析,在冬枣果实中共鉴定到794 个代谢物,其中脂质类、酚酸类、黄酮类、氨基酸及其衍生物类占的比例较大。通过OPLS-DA 的VIP 值大于1 和差异倍数值大于2 或t 检验P 值小于0.5 选取差异代谢物,最终在冷藏60 d 的冬枣果实中得到93 个差异代谢物,在冷藏90 d 的冬枣果实中筛选到154 个差异代谢物,这些差异代谢物主要属于黄酮类、鞣质类、酚酸类、脂质类、氨基酸及其衍生物类,这些差异代谢物主要来自黄酮类物质生物合成途径、谷胱甘肽代谢途径、亚油酸代谢途径、氨基酸及苯丙素生物合成途径。结果表明,随着冷藏时间的延长,差异代谢物增加,主要在代谢途径和次生代谢物的生物合成途径中明显增加。这些差异代谢物可作为冷藏后冬枣品质劣变的参考物质,进而通过对其参与的代谢通路进行调控,提高冷藏冬枣果实的品质。本研究也为进一步深入探究冷藏冬枣果实品质劣变机制提供理论基础。
[1] 李云飞.冬枣果皮红变分子机理的研究[D].天津:天津大学,2017.LI Y F.The molecular mechanism research on the red pigment development of Zizyphus Jujuba Mill.Cv Dongzao[D].Tianjin:Tianjin University,2017.
[2] 陈琼.枣主要功能因子综合评价及抗氧化、抗肿瘤活性成分鉴定[D].天津:天津大学,2015.CHEN Q.Comprehensive evaluation of the main functional factors and identification of the antioxidant and tumor-inhibition compounds in jujube[D].Tianjin:Tianjin University,2015.
[3] 武继云.不同涂膜处理对冬枣贮藏品质和抗氧化活性的影响[D].天津:天津大学,2016.WU J Y.Effects of coating treatments on storage quality and antioxidant capacity of Zizyphus Jujuba Miller.cv Dongzao[D].Tianjin:Tia njin University,2016.
[4] LI J W,FAN L P,DING S D,et al.Nutritional composition of five cultivars of Chinese jujube[J].Food Chemistry,2007,2(103):454-460.
[5] 申琳.冬枣果实采后酒软发生机制与调控研究[D].北京:中国农业大学,2002.SHEN L.Study on the mechanism and regulation of postharvest wine softening in Zizyphus Jujuba Miller.cv.Dongzao [D].Beijing:China Agricultural University,2002.
[6] 张慧然,张军.冬枣采后生理及保鲜技术研究进展[J].保鲜与加工,2017,17(1):134-138.ZHANG H R,ZHANG J.Research progress on postharvest physiology and storage technology of winter jujube[J].Storage and Process,2017,17(1):134-138.
[7] 郭一丹,李奎,蔚江涛,等.电子束和60Coγ-射线辐照对冬枣的保鲜效果[J].食品工业科技,2021,42(6):276-281.GUO Y D,LI K,WEI J T,et al.Effects of electron beam and 60Coγ-ray irradiations on the freshkeeping of winter jujube[J].Science and Technology of Food Industry,2021,42(6):276-281.
[8] 朱航.马鲛鱼鱼皮胶原蛋白提取、性质研究与在冬枣保鲜中的应用[D].福州:福建农林大学,2020.ZHU H.Study on the extraction and properties of collagen from mackerel skin and its application in the preservation of winter jujube[D].Fuzhou:Fujian Agriculture and Forestry University,2020.
[9] ZHU S H,SUN L N,ZHOU J.Effects of nitric oxide fumigation on phenolic metabolism of postharvest Chinese winter jujube(Zizyphus jujuba Mill.cv.Dongzao)in relation to fruit quality[J].LWTFood Science and Technology,2009,5(42):1009-1014.
[10] KOU X H,HE Y L,LI Y F,et al.Effect of abscisic acid(ABA)and chitosan/nano-silica/sodium alginate composite film on the color development and quality of postharvest Chinese winter jujube(Zizyphus jujuba Mill.cv.Dongzao)[J].Food Chemistry,2019,270:385-394.
[11] DENG B L,XIA C B,TIAN S,et al.Melatonin reduces pesticide residue,delays senescence,and improves antioxidant nutrient accumulation in postharvest jujube fruit[J].Postharvest Biology and Technology,2021,173:111419.
[12] HOLMES E,NICHOLSON J K,NICHOLLS A W,et a1.The identification of noval biomarkers of renal toxicity using automatic data reduction techniques and PCA of proton NMR spectra of urine [J].Chemometrics and IntelIigent Laboratory Systems,1988,44(1/2):245-255.
[13] PARK S,SEO Y S,HEGEMAN A.Plant metabolomics for plant chemical responses to below ground community change by climate change [J].Journal of P1ant Biology,2014,57(3):137-149.
[14] 张凤霞,王国栋.现代代谢组学平台建设及相关技术应用[J].遗传,2019,41(9):883-892.ZHANG F X,WANG G D.Current metabolomics platforms:Technical composition and applications[J].Hereditas,2019,41(9):883-892.
[15] 李鳌,孙宏伟,崔彦.代谢组学应用与研究进展[J].医学研究杂志,2020,49(1):168-171.LI A,SUN H W,CUI Y.Application and research progress of metabonomics[J].Journal of Medical Research,2020,49(1):168-171.
[16] 李思源,李培瑜,刘弈彤,等.代谢组学在食品科学中的应用进展[J].发酵与食品工业,2021,47(5):252-258.LI S Y,LI P Y,LIU Y T,et al.Application progress of metabolomics in food science[J].Food and Fermentation Industries,2021,47(5):252-258.
[17] 腊贵晓,郝西,理向阳,等.代谢组学在植物研究领域中的应用[J].植物学研究,2016,5(1):26-33.LA G X,HAO X,LI X Y,et al.Application of metabolomics in plant research[J].Botanical Research,2016,5(1):26-33.
[18] 王乐飞,古绍彬,吴影.基于UPLC-MS 代谢组学技术的枣果皮黄酮类化合物分析[J].食品科学,2020,41(24):155-161.WANG L F,GU S B,WU Y.Analysis of flavonoids in fruit of jujube(Ziziphus jujuba)by UPLC-MS-based metabonomics[J].Food Science,2020,41(24):155-161.
[19] FENG Z H,GAO Z F,JIAO X,et al.Widely targeted metabolomic analysis of active compounds at different maturity stages of 'Hupingzao' jujube [J].Journal of Food Composition and Analysis,2020,88:103417.
[20] 裴峰,母昌考,王春林,等.冷藏过程中三疣梭子蟹的营养物质变化[J].食品科学,2018,39(16):256-264.PEI F,MU C K,WANG C L,et al.Changes in nutrients of Portunus trituberculatus during chilled storage[J].Food Science,2018,39(16):256-264.
[21] MABUCHI R,ADACHI M,ISHIMARU A,et al.Changes in metabolic profiles of yellowtail(Seriola quinqueradiata)muscle during cold storage as a freshness evaluation tool based on GC -MS metabolomics[J].Food,2019,8(10):511.
[22] MONTI L L,BUSTAMANTE C A,BUDDE C O,et al.Metabolomic and proteomic profiling of Spring Lady peach fruit with contrasting woolliness phenotype reveals carbon oxidative processes and proteome reconfiguration in chilling-injured fruit[J].Postharvest Biology and Technology,2019,151:142-151.
[23] ZHAO J,QUAN P K,LIU H K,et al.Transcriptomic and metabolic analyses provide new insights into the apple fruit quality decline during long-term cold storage[J].Journal of Agricultural and Food Chemistry,2020,68(16):4600-4716.
[24] 张琴,黄世安,林欣,等.基于UPLC-MS/MS 的3个李品种果实初生代谢物分析[J].食品科学,2022,43(16):226-234.ZHANG Q,HUANG S A,LIN X,et al.Analysis of primary metabolites in three plum varieties using ultra-high performance liquid chromatographytandem mass spectrometry[J].Food Science,2022,43(16):226-234.
[25] CHEN W,GONG L,GUO Z L,et al.A novel integrated method for large-scale detection,identification,and quantification of widely targeted metabolites:Application in the study of rice metabolomics[J].Molecular Plant,2013,6(6):1769-1780.
[26] ZHANG Q,WANG L L,LIU Z G,et al.Transcriptome and metabolome profiling unveil the mechanisms of Ziziphus jujuba Mill.Peel coloration[J].Food Chemistry,2020,312:125903.
[27] CHEN Y H,ZHANG R P,SONG Y M,et al.RRLC-MS/MS-based metabonomics combined with in-depth analysis of metabolic correlation network:Finding potential biomarkers for breast cancer [J].Analyst,2009,134(10):2003-2011.
[28] THÉVENOT E A,ROUX A,XU Y,et al.Analysis of the human adult urinary metabolome variations with age,body mass index,and gender by implementing a comprehensive workflow for univariateand OPLS statistical analyses[J].Journal of Proteome Research,2015,14(8):3322-3335.
[29] ZHANG G,WANG H,XIE W,et a1.Comparison of triterpene compounds of four botanical parts from Poria cocos(Schw.)wolf using simultaneous qualitative and quantitative method and metabolomics approach[J].Food Research International,2019,121:666-677.
[30] ZHAO Y T,ZHU X,HOU Y Y,et al.Effects of harvest maturity stage on postharvest quality of winter jujube(Zizyphus jujuba Mill.cv.Dongzao)fruit during cold storage[J].Scientia Horticulturae,2021,277:109778.
[31] LOURDES C,BERTA A,GIANFRANCO D,et al.Curing and low-temperature combined post-harvest storage enhances anthocyanin biosynthesis in blood oranges[J].Food Chemistry,2021,342:128334.
[32] MADEBO M P,LUO S M,WANG L,et al.Melatonin treatment induces chilling tolerance by regulating the contents of polyamine,γ-aminobutyric acid,and proline in cucumber fruit[J].Journal of Integrative Agriculture,2021,20(11):3060-3074.
[33] HABIBI F,GARCIA-PASTOR M E,GUILLEN F,et al.Fatty acid composition in relation to chilling susceptibility of blood orange cultivars at different storage temperatures[J].Plant Physiology and Biochemistry,2021,166:770-776.
[34] KANEHISA M G.KEGG:Kyoto encyclopedia of genes and genomes[J].Nucleic Acids Research,2000,28(1):27-30.
[35] 罗枫.Bo PIF4 和Bob HLH66 转录因子对采后西兰花黄化关键基因的转录调控机理研究[D].沈阳:沈阳农业大学,2019.LUO F.Research on the transcriptional regulation mechanism of BoPIF4 and BobHLH66 transcription factors on key genes of postharvest broccoli yellowing[D].Shenyang:Shenyang Agricultural University,2019.
[36] ALVAREZ M V,SALAZAR-SALAS N Y,AUGULO G L,et al.Metabolomic changes in mango fruit peel associated with chilling injury tolerance induced by quarantine hot water treatment[J].Postharvest Biology and Technology,2020,169:111299.