植物中类胡萝卜素是构成许多园艺作物鲜艳的黄色、橙色和红色的主要物质基础[1]。在光合作用中作为天线(聚光)色素将捕获的光能传递给叶绿素,且具有光保护和清除自由基的功能,保护植物组织免受强光破坏[2]。不仅如此,类胡萝卜素还是脱落酸、独脚金内酯和胡萝卜内酯等植物激素的合成前体,对植物的生长发育起到重要作用[3]。据报道,类胡萝卜素还具有多方面的生理功能及营养价值,由于人体自身无法合成类胡萝卜素,必须通过外界摄入,因此是人体内维生素A 的主要来源,同时具有抗氧化,提高免疫调节,抗癌,延缓衰老等功效[4]。
茶叶中类胡萝卜素(Carotenoids)含量约占干物质的0.1%,是构成干茶和叶底色泽的重要成分,同时也是茶叶重要致香物质的前体物,如(α/β)-紫罗酮、α-法呢烯、二氢猕猴桃内酯等香气物质。这些香气物质大多呈现花果香的特性[5],对茶叶品质起到至关重要的作用[6]。茶叶中类胡萝卜素的种类和含量受茶树品种、成熟度等自身因素影响,同时也受到生长环境中生物和非生物因素的影响,如季节变化、虫害胁迫、外源诱导、茶叶加工工艺等。中国西南、江南、华南3 个产区的31 个茶树品种的7 种类胡萝卜素总量在324.8~528.8 μg/g 之间[7]。随着茶叶成熟度提高,类胡萝卜素总量增高,其中叶黄素和胡萝卜素的比值却下降[8]。不同的季节,茶叶中的类胡萝卜素含量表现为夏季最高,春季最低[9]。此外,不同茶叶的加工工艺,也显著影响茶叶中类胡萝卜素含量,研究表明乌龙茶因为鲜叶原料成熟度较高,类胡萝卜素含量最高;红茶发酵引起类胡萝卜素降解95%左右,含量最少;绿茶则在两者之间[10]。
茶树生长在动态环境中,容易受到来自外界的生物胁迫和非生物胁迫影响而发生基因-蛋白-代谢物水平的显著改变,最终影响其生长发育、产量、品质等[11-13]。茉莉酸甲酯(Methyl jasmonate,MeJA)是一种广泛存在于植物中的激素,参与植物防御和生长发育调节,如种子萌发,根系生长,开花、衰老等生理过程。近年来,茉莉酸甲酯的采前应用能显著提升水果和蔬菜等香气品质的研究结果已得到证实[14]。本团队前期研究证实,利用外源茉莉酸甲酯处理的茶树鲜叶制备的红茶香气品质显著提高,多种挥发性次生代谢产物含量显著提高[15]。现有研究证实,外源诱导能影响植物中类胡萝卜素的组成和含量。外源茉莉酸甲酯诱导处理过的生菜中,类胡萝卜素含量能较长时间维持在一个相对较高的水平,提高了生菜的营养价值[16],而未受茉莉酸甲酯诱导处理的生菜中,类胡萝卜素含量在短时间内显著减少。然而,目前鲜见有关外源茉莉酸甲酯诱导对茶叶中类胡萝卜素组成及含量影响的研究。
本研究利用外源茉莉酸甲酯诱导茶树鲜叶,分析诱导后茶树鲜叶中5 种最主要的类胡萝卜素成分(叶黄素、α-和β-胡萝卜素、玉米黄素、新叶黄素)含量的变化。对诱导后的鲜叶加工成红茶和绿茶,并对加工过程中这些成分的变化进行监测,明确外源茉莉酸甲酯诱导和不同加工工艺对类胡萝卜素含量的影响。进一步明确鲜叶采摘后加工中脂溶性色素类胡萝卜素组成和含量的变化规律,及其转化为重要风味物质的机理,为利用采前诱导技术提高鲜叶中类胡萝卜素含量,制作高类胡萝卜素含量的成品茶提供理论支撑。
1 材料与方法
1.1 材料与试剂
3~4 年生盆栽金萱茶树400 盆,种植于中国农业科学院茶叶研究所温室中。
甲醇,德国柏林Th.Geyer 公司;四氢呋喃,美国VWR International 公司;二氯甲烷、2-丁醇,德国Merck 公司。
1.2 仪器与设备
超高效液相色谱-四极杆飞行时间串联质谱(UHPLC-QToF/MS),安捷伦;分析色谱柱:C30-column(YMC Co.Ltd.,Kyoto,Japan,YMC C30,100 mm×2.1 mm,3 μm)。
1.3 试验方法
1.3.1 茶叶样品制备 利用0.25%茉莉酸甲酯对200 盆茶树鲜叶表面均匀喷施,分别于喷施后12,24,48,168 h 采摘一芽二叶,每个时间点采摘1 kg鲜叶,采摘后100 g 鲜叶用小袋分装后,液氮速冻保存于-80 ℃超低温冰箱,剩余鲜叶分别按照传统红茶加工工艺:鲜叶→萎凋12 h→揉捻(轻-重-轻,1 h)→发酵3 h→烘干(105 ℃,毛火10 min,90℃足火30 min)和绿茶加工工艺:鲜叶→摊放6 h→杀青后揉捻(轻-重-轻,1 h)→烘干(105 ℃,毛火10 min,90 ℃足火30 min),进行加工,得到成品红茶和绿茶。鲜叶及过程样取样后液氮固样,随后冷冻干燥待用。对照200 盆,利用纯水喷施,其余取样及茶叶加工工艺与喷施茉莉酸甲酯处理组保持完全一致。
1.3.2 成品(红茶、绿茶)的感官评价 依据《茶叶感官审评方法》(GB/T 22291-2018)[17]所述,称取茶样3.0 g 于150 mL 审评杯中,沸水冲泡,加盖静置5 min;将茶汤倒入审评碗中,重点嗅闻杯中香气,对茶叶香气进行定性评价。
1.3.3 茶叶中类胡萝卜素提取 准确称量50 mg冻干茶样(均匀研磨),置于Eppendorf 试管,加入500 μL 甲醇/四氢呋喃(THF)(1∶1,V/V),在20 ℃下以1 400 r/min 振荡5 min,随后在4 500 r/min转速下离心5 min,收集离心后上清液于4 mL 玻璃瓶中,重复以上步骤3~5 次,合并上清液。玻璃瓶置于氮吹仪上,吹干上清液中的有机溶剂。继续充入少量N2 作为保护气体,迅速盖上瓶盖,保存到-80 ℃冰箱,待UHPLC-QToF/MS 分析。
1.3.4 UHPLC-QToF/MS 分析 取出保存的样品,用50 μL 二氯甲烷(DCM)复溶后涡旋,继续加入200 μL 异丙醇后涡旋(可借助超声水浴助溶),将复溶液完全注入PTEE 过滤膜后,以3 000 r/min离心2 min,吸取离心液于进样瓶中,充入少量保护性气体N2,进行UHPLC-QToFMS 进样分析,具体参数如下:色谱柱选择,YMC C30(100 mm×2.1 mm,3 μm,YMC Co.Ltd,Japan);流动相选择,A:甲醇∶甲基叔丁基醚∶水混合溶液(81∶14∶4,V/V/V)B:甲醇∶甲基叔丁基醚∶水混合溶液(6∶90∶4,V/V/V);流速:0.2 mL/min;类胡萝卜素分离梯度设置,30 min 内流动相A 梯度由100%均匀降低至0%;分析设备,Agilent 1290 Infinity UHPLC 串联Agilent 6230 ToFMS,离子源切换至APCI,正离子模式。
1.3.5 定性定量分析 类胡萝卜素定性、定量方法参考Mageney 等[18]的方法,精确称取α-胡萝卜素、β-胡萝卜素、叶黄素、玉米黄质和新叶黄素2.5 mg 分别置于25 mL 容量瓶中,少量二氯甲烷溶解,纯乙腈定容,配制为质量浓度为100 μg/mL 的标准储备液,-20 ℃保存。分别配制0.01,0.05,0.1,0.5,1,5,10,40 μg/mL 等质量浓度的单一类胡萝卜素标准品溶液。UPLC-QToFMS 采集相应的质谱峰面积,α-胡萝卜素、β-胡萝卜素([M+H]+ 537.446),叶黄素([M-H2O+H]+ 551.425),玉米黄质([M+H]+569.435)以及新叶黄素([M-H2O+H]+ 583.415),建立外标曲线。随后借助Agilent Mass Hunter 进行定性、定量分析获得的数据,对茶叶中类胡萝卜素含量进行分析。
1.3.6 统计分析 获得的原始数据在Statistic 上进行多元统计分析。
2 结果与分析
2.1 金萱茶树鲜叶中类胡萝卜素含量
利用UPLC-QToF/MS 分析茶树鲜叶中主要的类胡萝卜素,通过与标准品比对进行定性、定量分析。结果表明,金萱茶树鲜叶中5 种类胡萝卜素(叶黄素、β-胡萝卜素、α-胡萝卜素、新叶黄素、玉米黄素)总含量为(859.98±60.20)μg/g,其中叶黄素含量最高为(405.06±17.71)μg/g,α-胡萝卜素含量最低为(42.24±3.87)μg/g。如图1 所示,金萱茶树鲜叶中叶黄素含量占47%,其次分别为β-胡萝卜素(21%)、新叶黄素(14%)、玉米黄素(13%)、α-胡萝卜素(5%)。
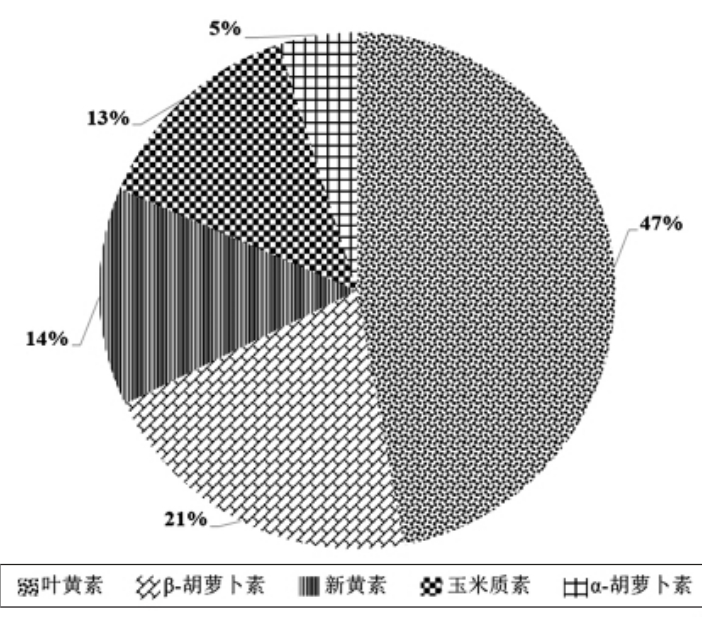
图1 金萱茶树鲜叶中5 种主要类胡萝卜素含量分布图
Fig.1 Distribution of five major carotenoids in Jinxuan tea leaves
2.2 成品(红茶、绿茶)中类胡萝卜素含量及其响应外源茉莉酸甲酯诱导变化
利用外源茉莉酸甲酯诱导后的金萱鲜叶加工成成品红茶和绿茶,对成品茶中的5 种类胡萝卜素进行绝对定量分析,叶黄素、β-胡萝卜素、α-胡萝卜素、新叶黄素、玉米黄素含量都发生显著变化。
金萱茶树鲜叶中类胡萝卜素组成和含量随外源茉莉酸甲酯诱导的时间(0 h 到168 h)的延长发生显著变化。如图2 所示,诱导处理12 h 后,鲜叶中类胡萝卜素总量下降;诱导24 h 后,鲜叶中类胡萝卜素总量较0 h 提升,随后在48 h 和168 h的样品中,含量再次逐渐下降。对照样品中(0 h),类胡萝卜素总量由鲜叶中的(859.98±60.20)μg/g下降至成品红茶中(406.17±32.21)μg/g 和绿茶中的(433.95±36.21)μg/g,下降幅度超过达到50%。这与此前的研究报道较为一致,鲜叶中的类胡萝卜素在茶叶加工过程中受到酶催化裂解成一些挥发性成分,同时受到光热等影响产生降解导致含量下降。
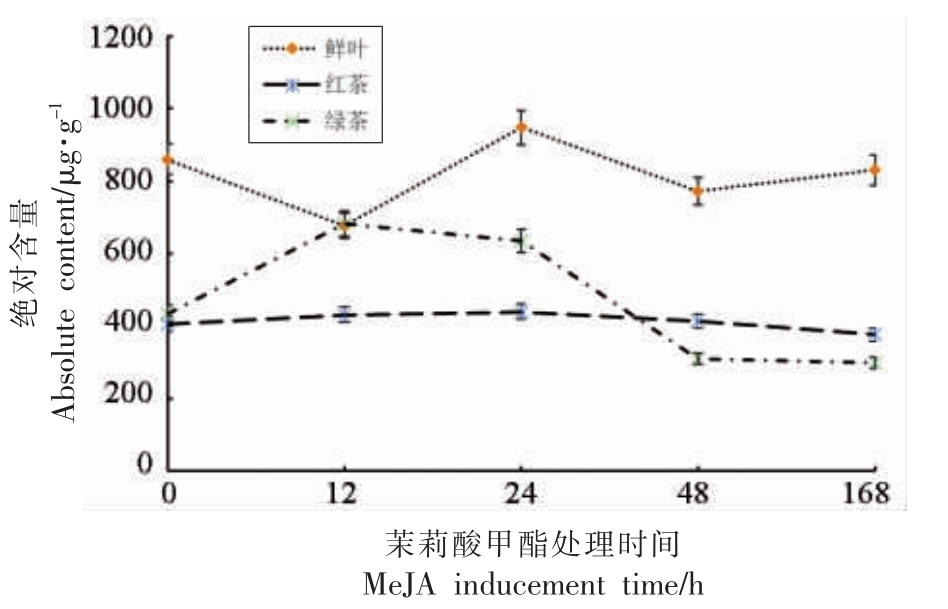
图2 茉莉酸甲酯处理不同时间下茶树鲜叶及成品红茶、绿茶中类胡萝卜素总量
Fig.2 Changes of total carotenoids contents in tea leaves and made black tea and green tea in different MeJA time duration
外源诱导后的鲜叶加工成的成品红茶中,类胡萝卜素的总量与未受诱导处理的鲜叶制作的成品红茶中的含量几乎保持相近水平。利用外源茉莉酸甲酯诱导处理后的鲜叶制作的成品绿茶中,类胡萝卜素含量较对照显著升高(12 h 和24 h 样品),随后显著降低(48 h 和168 h 样品)。外源诱导12 h 和24 h 的鲜叶样品制作的绿茶中,类胡萝卜素总量分别为(682.69±46.12)μg/g 和(635.25±47.01)μg/g,其总含量维持在相对较高的水平,与0 h 鲜叶原料相比仅下降了20%左右。茉莉酸甲酯诱导后,在基因、转录水平影响了较多代谢途径,这在本团队此前的研究中有报道[19],尤其是萜类代谢途径中的一些关键酶活性发生显著变化,类胡萝卜素是一类多萜成分,因此其合成降解途径中也有许多酶活性,因外源诱导而发生变化,这些分子层面的变化是类胡萝卜素含量差异的内在原因。
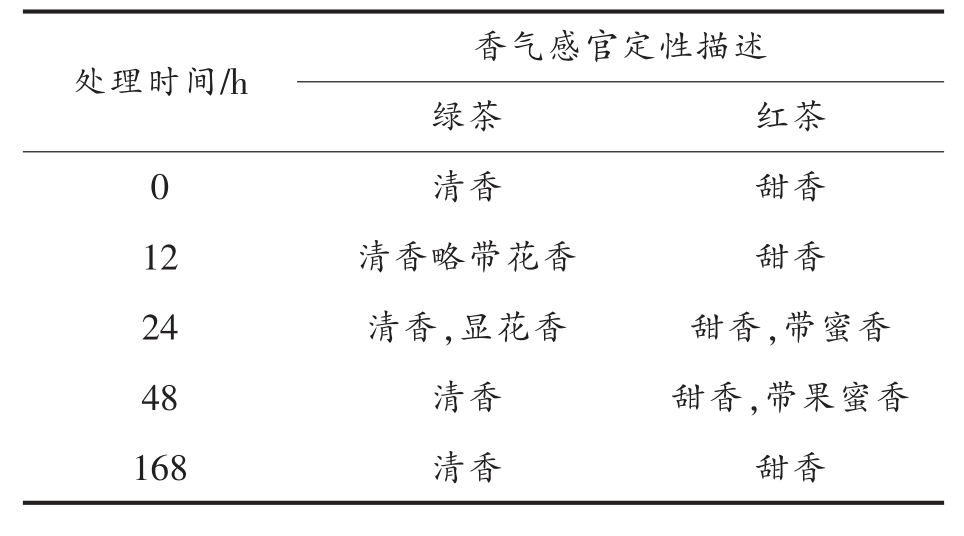
此外,本研究对制作得到的红茶和绿茶,重点开展了香气品质感官评价,结果如表1 所示。外源茉莉酸甲酯诱导不同时长的鲜叶加工成品茶的香气品质发生显著变化。外源诱导12 h,茶树鲜叶加工制作得到的绿茶略带花香,红茶则具有明显的甜香;诱导24 h,采摘茶树鲜叶加工制作的成品绿茶香气感官评价得分>94,显著高于其它时长加工得到的绿茶,具有轻微的花香,该时长制作的红茶具有蜜香。该结果表明,茉莉酸甲酯诱导12 h 和24 h 后,利用该鲜叶加工成品绿茶和红茶的香气品质显著提升。
表1 外源茉莉酸甲酯诱导后茶鲜叶加工的成品红茶和绿茶香气感官定性评价
Table 1 Sensory evaluation of made black tea and green tea prepared from MeJA-induced fresh tea leaves
利用GC-MS 对茉莉酸甲酯诱导24 h 的鲜叶制作的成品绿茶和红茶进行挥发性成分分析,结果如表2 所示,鉴定并筛选出66 种茶叶中重要的挥发性成分。其中,14 种为类胡萝卜素裂解衍生香气,包括茶螺烯酮、柠檬烯、α/β-紫罗酮、α-法呢烯、二氢猕猴桃内酯、藏红花醛、β-环柠檬烯、β-大马酮、香叶基丙酮等。这些类胡萝卜素衍生香气物质的香气阈值低,绝大多数贡献花香、果香等品质,对于成品茶香气品质具有重要的提升作用。茉莉酸甲酯诱导后鲜叶制作的成品绿茶,与对照未受处理的鲜叶加工的绿茶相比,茶螺烯酮、柠檬醛相对含量降低,其它11 种香气成分相对含量均显著提升,其中香叶基丙酮、β-大马酮以及β-紫罗酮的相对含量增加超过2 倍。在诱导处理红茶样品中,14 种类胡萝卜素衍生香气成分均显著提升,二氢猕猴桃内酯、茶螺烯酮、β-紫罗酮等对于红茶花果香品质形成具有重要的贡献。
表2 外源茉莉酸甲酯诱导24 h 后茶鲜叶加工的成品红茶和绿茶中类胡萝卜素衍生香气物质
Table 2 Carotenoid-derived aromas in made black tea and green tea prepared from fresh tea leaves by MeJA inducement for 24 h

(续表2)

(续表2)
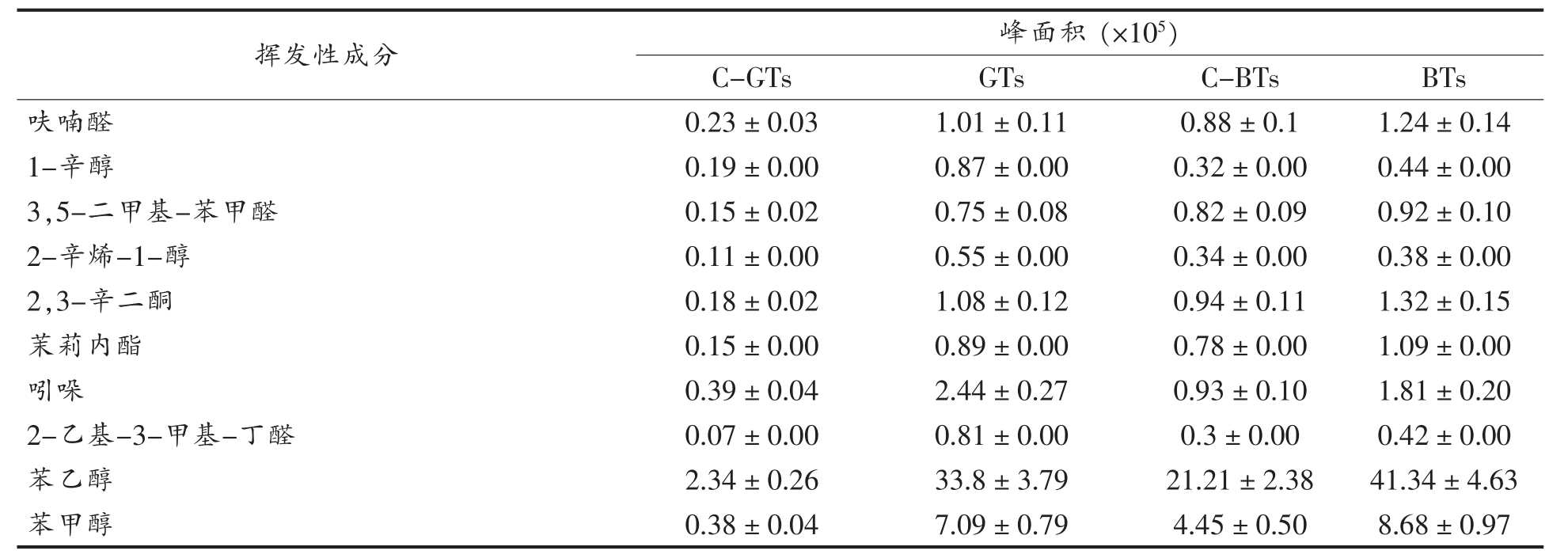
注:C-GTs.未经茉莉酸甲酯诱导的鲜叶制作的成品绿茶;GTs.经茉莉酸甲酯诱导(24 h)的鲜叶制作的成品绿茶;C-BTs.未经茉莉酸甲酯诱导的鲜叶制作的成品红茶;BTs.经茉莉酸甲酯诱导(24 h)的鲜叶制作的成品红茶;字体加粗的香气物质为类胡萝卜素衍生香气成分。
2.3 红茶加工工序影响外源茉莉酸甲酯诱导后茶树鲜叶中类胡萝卜素含量动态变化
红茶是一类全发酵茶叶,其加工工艺主要包含“鲜叶→萎凋→揉捻→发酵→烘干”。外源茉莉酸甲酯诱导12,24,48,168 h 后的茶树鲜叶加工成红茶样品,利用UPLC-QToF/MS 对成品茶样品中的类胡萝卜素定量分析后,从图3 可以看出5种主要类胡萝卜素的绝对含量发生显著变化。叶黄素在未受茉莉酸甲酯处理的对照样品(0 h)中含量最高,随着诱导时间延长至168 h,其含量逐渐减少。与对照样品相比,外源诱导处理12 h 和24 h 的样品中玉米质素和新黄素的含量显著增加,β-胡萝卜素和α-胡萝卜素的含量也有不同程度的升高。茉莉酸甲酯诱导48 h 后的鲜叶加工的红茶样品中,新叶黄素含量与对照样品相比增加了1.28 倍,超过叶黄素成为含量最高的类胡萝卜素成分。
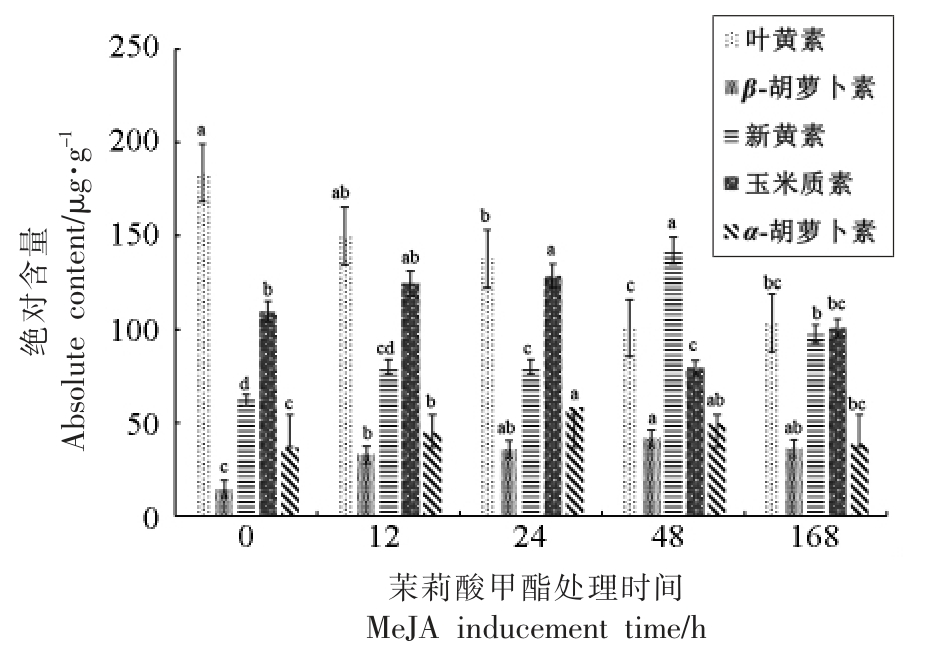
图3 茉莉酸甲酯不同时间诱导后采摘鲜叶制作的红茶成品茶中类胡萝卜素组成及含量差异
Fig.3 Difference in composition and content of carotenoids in made black tea prepared from fresh leaves by different time-series MeJA inducementd
红茶茶叶在加工过程中,其风味品质成分会发生变化,此前研究者主要关注茶鲜叶中儿茶素等成分发生的氧化、聚合等生化反应生成茶黄素、茶红素的变化[20],以及挥发性成分的显著变化[21],对类胡萝卜素类成分的含量变化研究不多。本试验对红茶加工过程中,上述关键工序中的茶叶冻干样品中,叶黄素、β-胡萝卜素、新叶黄素、玉米黄素和α-胡萝卜素的动态变化进行监测,精确定量后分析类胡萝卜素在鲜叶、萎凋样品、揉捻样品、发酵样品、成品红茶中的含量变化(图4)。结果表明,鲜叶受到茉莉酸甲酯诱导后,与对照(0 h)相比,12 h 的鲜叶中叶黄素、β-胡萝卜素、新叶黄素、玉米黄素和α-胡萝卜素含量都有所下降,而诱导24 h 后含量又显著升高。其中,β-胡萝卜素最为特殊,经茉莉酸甲酯诱导后,该成分含量始终处于下降状态。茉莉酸甲酯诱导处理后的鲜叶制作得到的红茶与对照鲜叶制得的红茶相比,前者样品中的叶黄素含量有所减少而β-胡萝卜素含量显著提高。

图4 红茶加工过程中5 种主要类胡萝卜素的动态变化
Fig.4 Dynamics of five major carotenoids before,during and after black tea manufacturing process
萎凋是决定红茶品质的关键加工环节[22-23],萎凋不足导致鲜叶中低沸点挥发性成分,如青叶醇、青叶醛等多种绿叶挥发物会较多保留在鲜叶中,不能形成很好的转化;萎凋过度则可能造成鲜叶的不均匀失水,引起部分红变,甚至死青的现象。类胡萝卜素是茶叶中一类重要的香气前体,研究萎凋过程中类胡萝卜素组分及含量的变化较为重要,因此,本研究利用超高效液相色谱时间飞行质谱对加工过程中5 个类胡萝卜素成分进行靶标分析。在红茶萎凋过程中,茉莉酸甲酯诱导处理的样品中,随着诱导时间的延长(0~168 h),叶黄素、玉米质素、(α/β)-胡萝卜素较对照样品中含量都有不同程度的降低。新黄素则表现较为不同,在茉莉酸甲酯诱导12 h 的样品中,其含量下降,而后呈现显著升高的趋势。
萎凋到位后,茶叶的揉捻能够促使茶叶细胞在一定程度上破碎,促使细胞液中的底物和一些特异性酶结合,促使风味品质成分更好的转化。从图5 可以看出,揉捻过程茉莉酸甲酯处理12 h 和24 h 的样品中,5 种类胡萝卜素含量与0 h 相比,基本保持稳定;在48 h 和168 h 的样品中,除了新黄素以外,这5 种类胡萝卜素含量都有不同程度的下降,特别是β-胡萝卜素,呈现显著减少的趋势。研究推测,茉莉酸甲酯诱导可能提升了β-胡萝卜素代谢分支中相关蛋白的表达,促使向新黄素的转化,最终表现出累积效果。在红茶加工过程中,揉捻工艺能够促进茶鲜叶中底物和生物酶的接触,而发酵则是在相对高温、高湿的环境中进行,能够加速酶促转化作用。不同于前2 步加工过程,叶黄素、β-胡萝卜素、玉米黄素在茉莉酸甲酯诱导12 h 和24 h 的样品中显著增加,而随着诱导时间的延长,其含量最终较对照有所下降。在发酵过程中,最值得关注的是12 h 和24 h 的样品中,β-胡萝卜素含量显著提高。
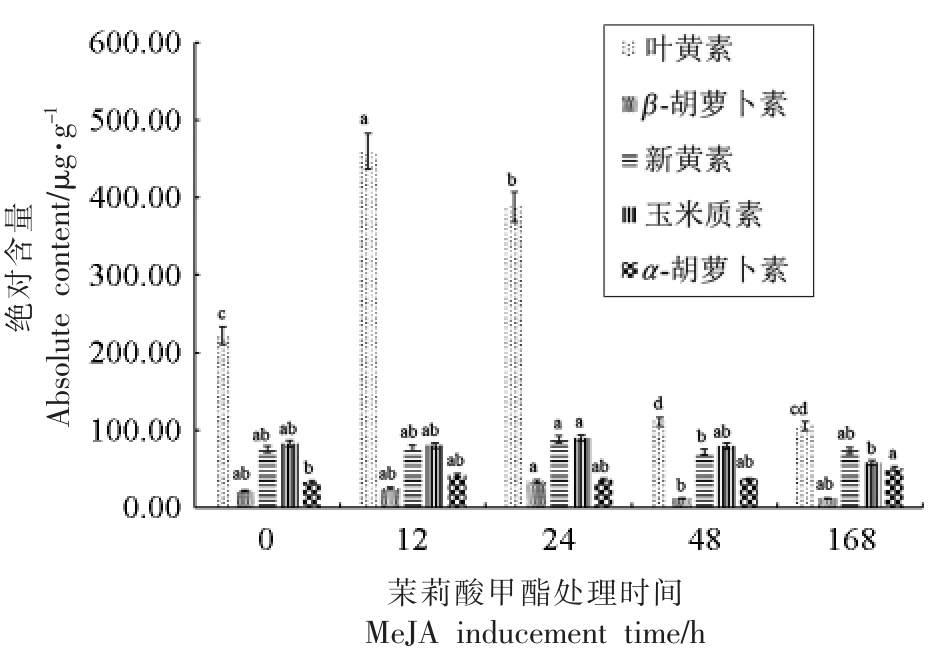
图5 茉莉酸甲酯不同时间诱导后采摘鲜叶制作的绿茶成品茶中类胡萝卜素组成及含量差异
Fig.5 Difference in composition and content of carotenoids in made green tea prepared from fresh leaves by different time-series MeJA inducementd
2.4 绿茶加工工序影响外源茉莉酸甲酯诱导后茶树鲜叶中类胡萝卜素含量的动态变化
与红茶完全不同,绿茶是不发酵茶,其加工工艺主要包含“鲜叶→摊放→杀青→揉捻→烘干”。外源茉莉酸甲酯诱导12,24,48,168 h 的茶树鲜叶加工成绿茶,利用UPLC-QToF/MS 对成品茶样品中的类胡萝卜素定量分析后,如图5 所示,5 种主要类胡萝卜素的含量存在显著差异。叶黄素在未受茉莉酸甲酯处理的对照样品中含量最高,随着诱导时间的延长,其绝对含量逐渐减少。与对照样品(0 h)相比,外源诱导处理12 h 和24 h 的样品中叶黄素的绝对含量显著增加,增加幅度超过1 倍;而新叶黄素、玉米黄素、β-胡萝卜素和α-胡萝卜素的含量则保持相对稳定,类胡萝卜素总量与0 h 样品相比,呈现增加的趋势。随着诱导时间的延长,绿茶样品中叶黄素含量与0 h 样品相比显著降低。
绿茶加工过程中风味品质成分发生变化[24],包括此前研究主要关注的以儿茶素为主的多酚类成分以及挥发性成分。本研究重点关注样品中类胡萝卜素成分的变化,对鲜叶、摊放样品、杀青后揉捻样品、绿茶成品茶中的类胡萝卜素含量变化进行动态监测分析。图6 为叶黄素、β-胡萝卜素、新叶黄素、玉米黄素和α-胡萝卜素在绿茶加工过程中,关键工序中的动态变化。在鲜叶样品中,与对照(0 h)相比,茉莉酸甲酯诱导24 h 和48 h 的样品中,类胡萝卜素组分及含量变化最为显著,24 h 的样品中除了β-胡萝卜素含量减少以外,其余4 种类胡萝卜素含量均显著增加,然而48 h 后的样品中,除了叶黄素保持含量增加,另外4 种类胡萝卜素的含量均显著下降。

图6 绿茶加工过程中5 种主要类胡萝卜素的动态变化
Fig.6 Dynamics of five major carotenoids before,during and after green tea manufacturing process
有研究结果表明,β-紫罗酮、二氢猕猴桃内酯等都是绿茶成品茶中重要的芳香成分,而它们主要是由类胡萝卜素在加工过程中降解产生[25-26]。在绿茶摊放工序中,与对照鲜叶样品比较,茉莉酸甲酯诱导12 h 的样品中,叶黄素和β-胡萝卜素含量显著下降,而新黄素、玉米质素、α-胡萝卜素含量有不同程度增加;诱导24 h 的样品中,叶黄素和α-胡萝卜素含量显著上升,其它3 种类胡萝卜素含量呈现下降趋势;诱导48 h 的样品中,5 种类胡萝卜素含量全部增加。相较于红茶制作过程中长时间的萎凋,绿茶加工过程中鲜叶摊放的时间较红茶短,随后的杀青是绿茶制作的关键工序,通过高温瞬时钝化鲜叶中的酶活性。与对照相比,茉莉酸甲酯诱导不同时间后的鲜叶样品,在杀青后揉捻这一过程中,含量发生极显著变化,然而并未呈现相互间的显著相关性。其中,叶黄素的含量最高,诱导12 h 后的样品中其含量显著上升,48 h后与对照相比含量逐渐下降;新叶黄素在诱导后所有时间点的样品中均呈现减少的趋势。杀青这一关键工序使鲜叶中酶活性钝化,绝大多数酶促转化终止,保证了绿茶的风味品质特征,类胡萝卜素也最大程度保留在绿茶鲜叶中。
3 讨论
类胡萝卜素是一类多萜次生代谢产物,茶树鲜叶中其主要合成来源是萜类代谢途径,较多研究表明[23-24],在茶叶加工过程中,酶促和光、热等影响类胡萝卜素降解生成一些重要的芳香性成分(β-紫罗酮、二氢猕猴桃内酯等)[26-27]。茶叶加工过程中,由于存在高温(杀青、干燥)和酶促(揉捻、发酵)等作用,茶叶中类胡萝卜素类成分,特别是叶黄素大幅度降解,较对照减少约65%以上。此外,在茶叶加工过程中,尤其是鲜叶萎凋过程中的α-和β-胡萝卜素等则降解成为挥发性成分α-和β-紫罗酮(图7),玉米黄素和新叶黄素则会在类胡萝卜素氧化裂解酶的作用下降解成其它一些挥发性成分[28-29]。
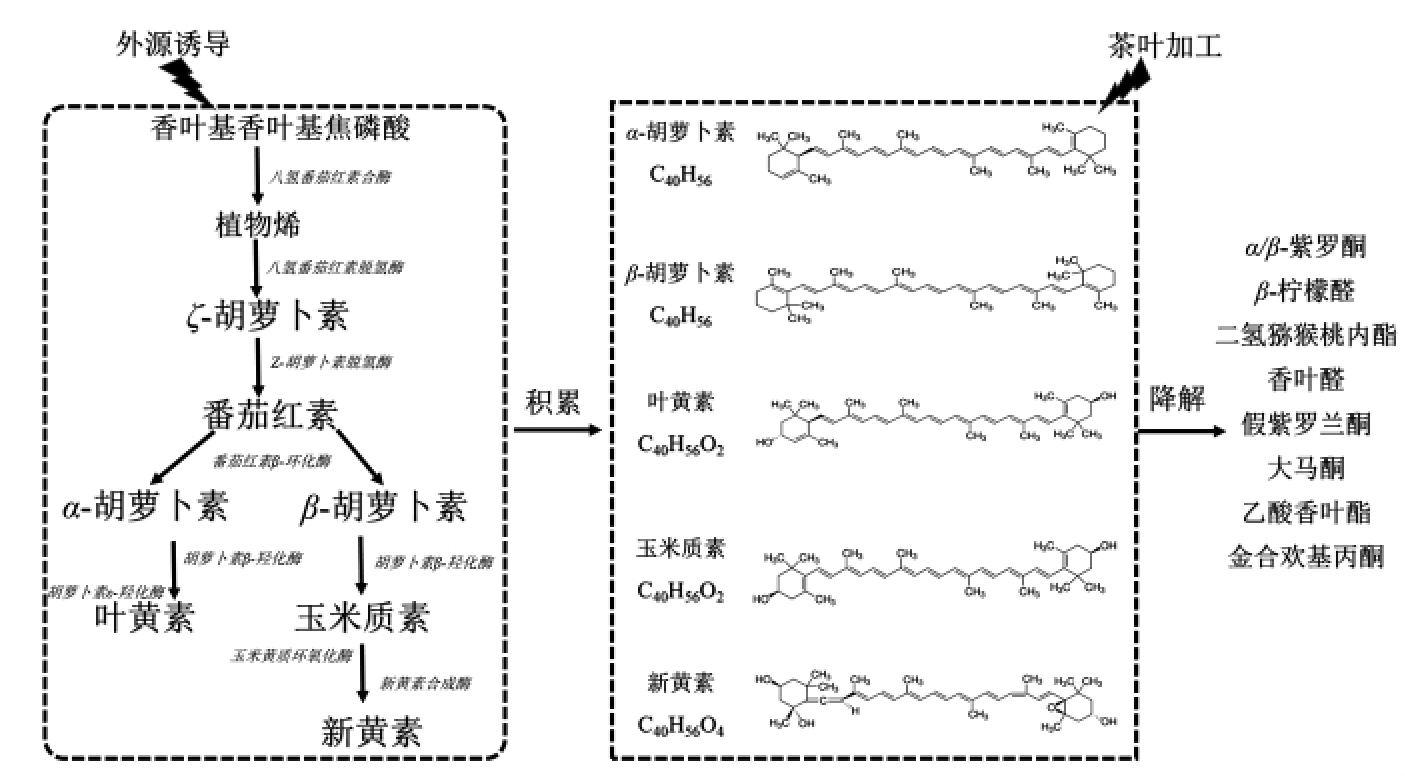
图7 茶叶中类胡萝卜素代谢及主要降解香气成分简图
Fig.7 Simplified scheme of carotenoids metabolism and its cleavage volatile products in tea
本研究结果表明,利用外源茉莉酸甲酯对茶树鲜叶诱导处理,类胡萝卜素含量发生显著差异变化。随着处理时间的延长,鲜叶中的类胡萝卜素总量发生不规律变化,成品红茶中(诱导12,24,48,168 h)叶黄素含量较对照显著减少,而β-胡萝卜素的含量显著增加;成品绿茶(诱导12 h 和24 h)叶黄素含量显著增加,α-和β-胡萝卜素含量也有不同程度的增加。受到外源茉莉酸甲酯诱导影响茶树鲜叶中类胡萝卜素合成的前体物质香叶基焦磷酸含量发生显著变化,其下游代谢通路中的基因和蛋白表达也发生了显著变化[198],而在红茶加工过程中,鲜叶首先经过长时间的萎凋处理,茉莉酸甲酯诱导的效果持续影响萜类代谢途径中的类胡萝卜素氧化裂解酶等的活性提高,因此更多的α-和β-胡萝卜素发生酶促氧化裂解生成更多的芳香成分[28-29],而α-胡萝卜素是叶黄素合成的直接前体,因此推测可能是叶黄素含量降低的一部分原因[6]。与红茶正好相反,在绿茶制作过程中,鲜叶短时间摊放后进行高温杀青,绝大部分的蛋白失去酶活,因此α-和β-胡萝卜素大部分能够保留下来,叶黄素在茶叶加工过程中受到高温会很快降解[6],然而在绿茶加工过程中却不存在该现象,本研究推测必然存在1 种或者某几种叶黄素合成中间体,在高温作用下发生非酶促结构变化,生成叶黄素,因此保持降解与合成的动态平衡。
总结来说,目前,类胡萝卜素类成分在茶叶加工前、中、后自身相关的代谢研究并不多见。本研究通过基于UPLC-QToF/MS 靶标代谢组学技术对茶叶中5 种最主要的类胡萝卜素成分进行绝对定量,明确了叶黄素是茶鲜叶和成品茶中含量最高的类胡萝卜素成分,掌握了类胡萝卜素成分在红茶和绿茶加工过程中的变化规律。本研究利用外源诱导改变鲜叶中5 种重要类胡萝卜素含量,提高成品茶中类胡萝卜素含量。本试验结果与此前报道结果存在显著差异,推测外源茉莉酸甲酯诱导显著改变了茶树鲜叶中类胡萝卜素的组成,然而目前只对茶叶中最主要的5 种类胡萝卜素成分进行了定量分析,为深入解析茶叶中类胡萝卜素其它组分及含量的变化响应外源诱导的机理,今后需要对其它多种类胡萝卜素进行准确定性、定量分析。通过茉莉酸甲酯外源诱导,在一定诱导时长(12,24 h)下,采摘鲜叶加工得到的成品茶中,类胡萝卜素含量能够维持在一个相对较高的含量,利用该时间点的鲜叶加工得到的成品红茶、绿茶的香气品质显著提升。目前,该诱导提升鲜叶及成品茶中类胡萝卜素含量仍旧处于基础研究阶段,本研究为后续寻找茉莉酸甲酯替代诱导剂在茶园的大面积应用,具有重要意义。
[1] YUAN H,ZHANG J,NAGESWARAN D,et al.Carotenoid metabolism and regulation in horticultural crops[J].Horticulture Research,2015,2:e15036.
[2] FREDE K,SCHREINER M,BALDERMANN S.Light quality-induced changes of carotenoid composition in pak choi Brassica rapa ssp.chinensis[J].Journal of Photochemistry and Photobiology B-Biology,2019,193:19-30.
[3] BOACHON B,JUNKER R,MIESCHI L,et al.Allouche LCYP76C1(Cytochrome P450)-mediated linalool metabolism and the formation of volatile and soluble linalool oxides in Arabidopsis flowers:A strategy for defense against floral antagonists[J].The Plant Cell,2015,27(10):2972-2990.
[4] HARRISON E,QUADRO L.Apocarotenoids:Emerging roles in mammals[J].Annual Review of Nutrition,2018,38(1):152-173.
[5] 陈丽,坤吉瑞,王静,等.HPLC-PDA 法分析不同茶树品种类胡萝卜素香气前体[J].食品科学,2020,41(4):193-198.CHEN L,KUN J R,WANG J,et al.Analysis of carotenoids as aroma precursors in different varieties of tea leaves by high performance liquid chromatography with photodiode array detection[J].Food Science,2020,41(4):193-198.
[6] 冯琳,龚自明,郑鹏程,等.茶类胡萝卜素研究进展[J].植物科学学报,2018,36(6):129-135.FENG L,GONG Z M,ZHENG P C.Advances in studies on carotenoids in Camellia sinensis[J].Plant Science Journal,2018,36(6):129-135.
[7] WEI X,HOU Y,YE Y,et al.Determination of carotenoid contents in 31 elite Chinese tea [Camellia sinensis(L)O.Kuntze] cultivars[J].Academia Journal of Agricultural Research,2016,4(8):525-533.
[8] WANG X,CHEN L,MA C,et al.Genotypic variation of β -carotene and lutein contents in tea germplasms,Camellia sinensis(L)O.Kuntze[J].Journal of Food Composition and Analysis,2010,23(1):9-14.
[9] DU Y,SHIN S,WANG K,et al.Effect of temperature on the expression of genes related to the accumulation of chlorophylls and carotenoids in albino tea[J].Journal of Pomology and Horticultural Science,2009,84(3):365-369.
[10] PREEDY V.Tea in health and disease prevention[M].San Diego:Elsevier Science Publishing Co.Inc,2012:207-212.
[11] MEI X,LIU X,ZHOU Y,et al.Formation and emission of linalool in tea(Camellia sinensis)leaves infested by tea green leafhopper(Empoasca(Matsumurasca)onukii Matsuda)[J].Food Chemistry,2017,237:356-3630.
[12] ZENG L,ZHOU Y,FU X,et al.Biosynthesis of jasmine lactone in tea(Camellia sinensis)leaves and its formation in response to multiple stresses[J].Journal of Agricultural and Food Chemistry,2018,66(15):3899-3909.
[13] JING T,ZHANG N,GAO T,et al.Glucosylation of(Z)‐3‐hexenol informs intraspecies interactions in plants:A case study in Camellia sinensis[J].Plant,Cell &Environment,2018,42(4):1352-1367.
[14] 施江,马成英,吕海鹏,等.外源茉莉酸甲酯改善农产品品质及其机理研究进展[J].食品工业科技,2013,13(34):364-368.SHI J,MA C Y,LÜ H P,et al.Research progress in quality improvement of agricultural products induced by exogenous methyl jasmonate and its mechanism[J].Science and Technology of Food Industry,2013,13(34):364-368.
[15] SHI J,QI D,XIE D,et al.Methyl jasmonate-induced changes of flavor profiles during the processing of green,oolong,and black tea[J].Frontiers in Plant Science,2019,10:1-13.
[16] KIM H,FONSECA J,CHOI J,et al.Effect of methyl jasmonate on phenolic compounds and carotenoids of romaine lettuce(Lactuca sativa L.)[J].Journal of Agricultural and Food Chemistry,2007,55(25):10366-10372.
[17] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.茶叶感官审评方法:GB/T 23776-2018[S].北京:中国标准出版社,2018:2-5.General Administration of Quality Supervision,Inspection and Quarantine of the People's Republic of China,Standardization Administration of the People's Republic of China.Methodology for sensory evaluation of tea:GB/T 23776-2018[S].Beijing:Standards Press of China,2018:2-5.
[18] MAGENEY V,BALDERMANN S,ALBACH D C.Intraspecific variation in carotenoids of Brassica oleracea var.sabellica[J].Journal of Agricultural and Food Chemistry,2016,64(16):3251-3257.
[19] SHI J,MA C,QI D,et al.Transcriptional responses and flavor volatiles biosynthesis in methyl jasmonate-treated tea leaves [J].BMC Plant Biology,2015,15(1):e233.
[20] DONG C,LI J,WANG J,et al.Rapid determination by near infrared spectroscopy of theaflavins-tothearubigins ratio during Congou black tea fermentation process[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2018,205(5):227-234.
[21] 刘飞,王云,张厅,等.红茶加工过程香气变化研究进展[J].茶叶科学,2018,38(1):9-19.LIU F,WANG Y,ZHANG T,et al.Review on aroma change during black tea processing[J].Tea Science,2018,38(1):9-19.
[22] HOU Z,WANG J,XU S,et al.Effects of dynamic and static withering technology on volatile and nonvolatile components of Keemun black tea using GC-MS and HPLC combined with chemometrics[J].LWT-Food Science and Technology,2020,130:e109547.
[23] YU L,LI H,ZHOU T,et al.Nonvolatile metabolism in postharvest tea(Camellia sinensis L.)leaves:Effects of different withering treatments on nonvolatile metabolites,gene expression levels,and enzyme activity[J].Food Chemistry,2020,327:1-12.
[24] HAN X,MOHAMMAD R,LIU F,et al.Green tea flavour determinants and their changes over manufacturing processes[J].Food Chemistry,2016,212:739-748.
[25] WANG M,MA W,SHI J,et al.Characterization of the key aroma compounds in Longjing tea using stir bar sorptive extraction(SBSE)combined with gas chromatography-mass spectrometry(GC-MS),gas chromatography-olfactometry(GC-O),odor activity value(OAV),and aroma recombination [J].Food Research International,2020,130:e108908.
[26] HO C,ZHENG X,LI S.Tea aroma formation[J].Food Science and Human Wellness,2015,4(1):9-27.
[27] YANG Z,BALDERMANN S,WATANABE N.Recent studies of the volatile compounds in tea[J].Food Research International,2013,53(2):585-599.
[28] WANG J,WU B,ZHANG N,et al.Dehydrationinduced carotenoid cleavage dioxygenase 1 reveals a novel route for β -ionone formation during tea(Camellia sinensis)withering[J].Journal of Agricultural and Food Chemistry,2020,68(39):10815-10821.
[29] WANG J,ZHANG N,ZHAO M Y,et al.Carotenoid cleavage dioxygenase 4 catalyzes the formation of carotenoid-derived volatile β-ionone during tea(Camellia sinensis)withering[J].Journal of Agricultural and Food Chemistry,2020,68(6):1684-1690.