利用微生物发酵食品,可改善原产品的质地、风味、营养价值,提高其附加值。相较于传统食品,发酵食品的品质得到极大地提升。然而,在发酵以及贮存过程中,产品的色泽和某些功能也会随之发生改变。在富含花色苷的发酵产品中,花色苷作为主要的功能色素,它自身的降解、微生物的吸附作用、代谢产物与花色苷的相互作用都会对产品色泽产生影响。
花色苷是一种天然水溶性色素,属于类黄酮类化合物,是高等植物次生代谢产物之一。自然界已知的花色苷有22 大类,500 多种[1],广泛分布于27 个科,72 个属的被子植物的花、果实、茎、叶和根器官[2]。这些色素一般均匀地溶解在表皮细胞的液泡溶液里,赋予水果和蔬菜红色、蓝色和紫色[3]。常见富含花色苷的水果和蔬菜有红葡萄、接骨木、黑加仑、覆盆子、黑莓、红甘蓝、黑胡萝卜、紫玉米和紫薯等。
花色苷的基本母核是2-苯基苯并吡喃阳离子,即由2 个苯环通过中间三碳链相互连接而成C6-C3-C6 结构,结构如图1 所示,其母核O 上缺少1 个电子而形成氧正离子。然而以游离苷元形式存在的花色苷稳定性较差,且在自然界中也极其少见[4],往往与一种或多种葡萄糖、鼠李糖、半乳糖、木糖和阿拉伯糖等糖苷结合,以单糖、二糖或三糖苷较为常见[5-6]。绝大多数花色苷在其母核的3-,5-,7-位碳上有取代羟基,以3 位碳上取代最为常见。至今,从自然界中分离和鉴定出的花色苷多达600 余种,主要由6 种花色苷衍生而来,根据其B 环上的羟基取代数和甲氧基化的差别,分别是矢车菊色素(Cyanidin,Cy)、飞燕草色素(Delphindin,Dp)、天竺葵色素(Pelargonidin,Pg)、芍药色素(Peonidin,Pn)、矮牵牛色素(Petunidin,Pn)和锦葵色素(Malvidin,Mv)[7]。此外,研究表明,花色苷具有抗氧化[8],保护视力、抗衰老[9],预防糖尿病[10],降血脂[11],抑制肿瘤,保护肝损伤,修复辐射损伤,保护心血管,保护脑功能,预防生殖毒性[12]等多种生理功效。
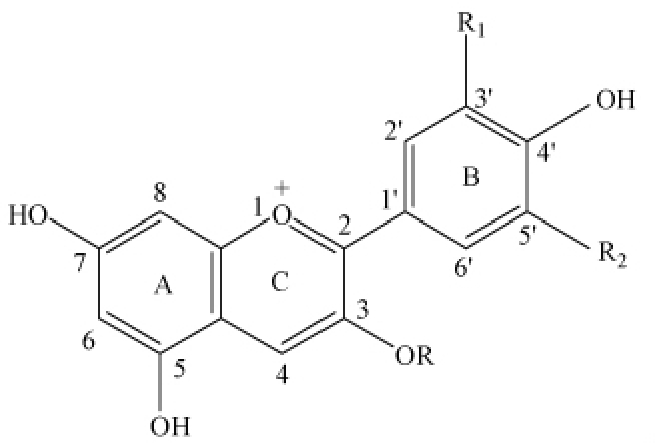
图1 花色苷的常见化学结构
Fig.1 Common chemical structures of anthocyanins
1 传统发酵食品中常用的微生物
食品发酵源于人类生活中食品保藏期间偶然的腐败变质。历史上,面包和啤酒等发酵技术的掌握推进了人们对植物原料的使用,间接推动了农业的发展和社会的变革。时至今日,人们并未满足于主食类食品的发酵,而是向风味食品和保健医药等方向发展,研发出一批又一批各具功能和特色的发酵食品,使用到的菌种不计其数,可主要归为以下四大类。
1.1 酵母
酵母(Yeast)是一类以出芽繁殖为主要特征的单细胞真菌的统称,以异养型兼性厌氧最为多见,在无氧环境下能将糖发酵成酒精和二氧化碳。食品行业中常见的有酿酒酵母、马克思克鲁维酵母、乳酸克鲁维酵母和汉逊德巴利酵母等[13],它们常被用作生产酒精饮料、糕点、功能性食品和调味品等。
1.2 乳酸菌
乳酸菌(Lactic acid bacteria,LAB)是一类无芽孢革兰氏阳性细菌,常分为异养型兼性厌氧、微好氧和厌氧3 种,可发酵碳水化合物产生大量乳酸。食品行业中常见的乳酸菌有乳杆菌、乳球菌和链球菌等[14],他们常用于生产酸奶、奶酪、泡菜、豆乳和调味品等。
1.3 醋酸菌
醋酸菌(Acetic acid bacteria,AAB)是一类无芽孢革兰氏阴性细菌,为异养型专性好氧菌,在有氧环境下能将乙醇氧化为醋酸,并可将醋酸和乳酸氧化成CO2 和水。食品行业中常见有奥尔兰醋杆菌、许氏醋杆菌、产醋醋酸杆菌和恶臭醋杆菌等[15],它们常被用于佐料醋和饮用果醋的生产。
1.4 霉菌
霉菌(Mold)是一类在营养基质上能形成绒毛状、网状或絮状菌丝体的丝状真菌的统称,可以将多糖和蛋白质酶解成单糖、多肽和氨基酸等小分子物质。食品行业中常见的霉菌有米曲霉、毛霉、红曲霉和青霉等,它们常被用于制作豆酱、腐乳、豆豉和酱油等[16]。
2 发酵食品中微生物对花色苷的影响
通过添加益生菌进行发酵是一种较为经济和安全的食品保存方法,这些益生菌发酵后产生的代谢产物,如有机酸、烯醇类、多酚类和细菌素类等物质,不仅改善了食品风味,延长了食品的保藏期,而且对人体有很大的健康效益。对于一些富含花色苷的果蔬,这些微生物还会促进某些花色苷的转化和衍生。
2.1 酵母
酵母常用来发酵红葡萄酒,而花色苷作为红葡萄的主要呈色物质,赋予了红葡萄酒鲜艳的红紫色,然而,在红葡萄酒发酵以及老化过程中,花色苷在酵母的作用与影响下经历多阶段的变化。发酵初期的红葡萄酒为红紫色,随着发酵时间的延长颜色会稍微变浅,亮度增大。然而成熟或老化后的红葡萄酒并没有变成浅红色或浅紫色的趋势,而是向着砖红色和橙红色靠近。在这个过程中,虽然检测到单体花色苷大幅度损失和降解,但是新型花色苷衍生物同时也开始出现,并对红葡萄酒的颜色做出贡献。
2.1.1 促进花色苷衍生物生成 发酵过程中酵母的代谢产物会促进花色苷在结构上的转变,从而起到稳定色素的作用。在发酵过程中,酵母会释放出丙酮酸、乙醛、乙烯基苯酚和乙酰乙酸等代谢产物[17],这些被认为是葡萄酒陈化后出现的花色苷衍生物的前体物质,可以促进花色苷向吡喃型花色苷转变,即在原花色苷的基础结构上,在A 环中的C5 位置和C 环中的C4 位置的羟基之间,经环加合反应形成另外的第4 个吡喃环的花色苷衍生物,如图2 所示。在这些代谢产物的影响下,人们逐渐发现了一些新鲜葡萄中原本不含有的吡喃花色苷。
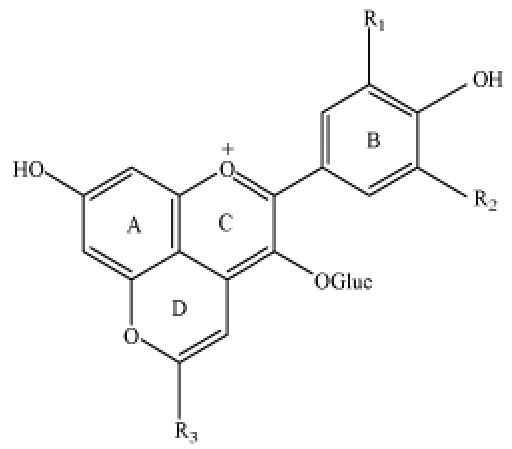
图2 吡喃花色苷的常见化学结构
Fig.2 Common chemical structure of pyranoanthocyanins
其中,与酵母代谢产物有直接联系的花色苷衍生物主要有Vitisins 型、黄烷醇-吡喃花色苷(Pyranoanthocyanins-flavanols)和酚基吡喃花色苷(Hydroxyphenyl-pyranoanthocyanins)这3 种类型。一般来说,Vitisins 又分为Vitisin A 和Vitisin B,它们分别是由丙酮酸[18]和乙醛[19]与锦葵素-3-O-葡萄糖苷进行环加合形成的产物(图3)。相比前体花色苷,Vitisins 少了1 个羟基,多了1 个吡喃环,这使得Vitisins 具有较低的降解速率和较高的稳定性[20]。单体花色苷与酵母代谢产物丙酮酸结合生成的花色苷-丙酮酸衍生物Vitisin A 后,还可以继续通过其C-10 位与8-乙烯基-黄烷醇加合物的乙烯基反应,最后失去甲酸基团,并进一步氧化,产生新的花色苷衍生物黄烷醇-吡喃花色苷(Pyranoanthocyanins-flavanols)[21](图3)。在这种结构中,π 电子的扩展共轭很可能赋予黄烷醇-吡喃花色苷分子更高的稳定性,以及拥有比其它单体花色苷更高的抗二氧化硫漂白和贮藏期间降解的能力[22]。

图3 相关花色苷衍生物的形成
Fig.3 Formation of primary anthocyanin derivatives
除此之外,当使用具有羟基肉桂酸脱羧酶的酵母时,在发酵过程中,能将羟基肉桂酸水解转化为乙烯基苯酚,进而与锦葵素-3-O-葡萄糖苷或其它花色苷缩合形成锦葵素-3-O-葡萄糖苷-4-酚基或其它酚基吡喃花色苷(Hydroxyphenylpyranoanthocyanins)[23](图3),这种新形成的结构中p 电子的扩展共轭可能赋予它更高的稳定性[24]。Morata 等[25]对比多株不同类型酵母对葡萄酒陈化颜色稳定性影响的研究发现,酚基吡喃花色苷的形成有利于增强红酒颜色强度,提高红酒中稳定色素的浓度,这让红酒在长时间贮藏时,能够保持较好的色泽。不仅如此,羧基吡喃花色苷也能在乙烯基苯酚或羟基肉桂酸类化合物存在的情况下,经多步反应缩合而成二代花色苷代谢产物酚基-乙烯基吡喃花色苷(Hydroxyphenyl-vinylpyranoanthocyanins)[26]。这些吡喃型花色苷的形成,促使红葡萄酒的颜色从红色或紫色向黄色或橙色色调转移,是稳定陈酿红酒颜色稳定性的重要物质[20]。
另一方面,酵母细胞成分也可以促进体系中的花色苷保持稳定。在红酒陈化过程中,一些死亡的酵母细胞自溶后会从细胞壁释放出甘露糖蛋白,对花色苷的稳定也起到重要作用。Sun 等[27]将不同含量甘露糖蛋白作为单一变量添加到蓝莓酒中,结果显示,添加甘露糖蛋白后蓝莓酒的L* 值和b* 值都显著降低,且花色苷总含量比对照组高,与甘露糖蛋白添加量呈正关系(P<0.05),其中以0.3 g/L 组的效果最好。这可能是由于甘露糖蛋白能抑制发酵过程中花色苷的降解,有利于蓝莓酒颜色的维持。而Rodrigues 等[28]却认为甘露糖蛋白可以保护花色苷的原因可能是由于甘露糖蛋白延缓了红酒中单宁的聚合,使其在贮藏期有较好的色泽保持能力。
2.1.2 花色苷的损失 首先,酵母细胞酶系可以直接降解花色苷。其中常见的是β-葡萄糖苷酶,它们可以切下糖苷供酵母生长繁殖,还可以促进一些萜烯类化合物的释放,增加葡萄酒的芳香性。然而对于有着糖苷结构的花色苷而言是不利的,β-葡萄糖苷酶会使其变成更不稳定的游离态,更容易氧化和降解。这个过程一般发生在酒精发酵过程中,对单体花色苷有严重的破坏作用,Kokkinomagoulos 等[29]用酵母发酵石榴时发现单体花色苷矢车菊素-3-葡萄糖苷含量从105.2 mg/L 下降至78.7 mg/L,减少了将近30%。
其次,酵母菌株对花色苷具有吸附作用。不同酵母菌株在花色苷吸附量方面有很大差异,其吸附机理取决于花色苷的极性,吸附范围可在1.6%~5.8%之间[30]。Morata 等[31]发现酵母菌株对肉桂酰衍生物(6-对香豆酰加合物和6-咖啡酰加合物)的吸附性较强(36.58%,6.61%),而对Vitisins 吸附性较弱(0.15%),对花色苷的平均吸附率为3.67%。相比之下,吡喃花色苷被酵母的细胞壁吸附率较低,可能由于它们形成于酒精发酵的中间或结束时,细胞壁对花色苷的吸附性已经趋于饱和。
除此之外,酵母关键代谢产物的损失也会使吡喃花色苷的合成量降低。二氧化硫是一种亲核分子,可以很容易地与丙酮酸或丙醛等亲电分子反应,形成加合物,从而去除形成吡喃花色苷的前体,阻碍花色苷衍生物的形成。因此,在红酒发酵过程中,减少二氧化硫的使用量也是促进吡喃花色苷形成的一条途径[30]。
2.2 乳酸菌
乳酸菌除了可用于酸奶的发酵,还可用于果蔬汁和酵素饮料的发酵,通过代谢柠檬酸,产生乳酸、乙酸、丁酸、二乙酰和乙酰乙酸等,这些酸类不仅能够迅速降低pH,还具有一定的营养和抗微生物的作用[32],对开发新型功能果蔬产品颇具潜力。尽管益生菌饮料的前景非常被看好,但是目前有关乳酸菌发酵果蔬汁的品质分析、功能评价和作用机理的报道尚不多见。花色苷作为一些水果的主要呈色物质,为果蔬汁提供了鲜艳的颜色,但是大多数的研究都表明,乳酸菌的加入会使花色苷降解,使得饮品颜色品质略微降低。因此如何稳定发酵果蔬汁饮料的色泽,将是亟待解决的行业技术问题。
乳酸菌含有β-葡萄糖苷酶,可以水解并利用花色苷。此过程先通过β-葡萄糖苷酶切割花色苷的糖苷键,随后通过酶池将花色苷环裂变降解为间苯二酚醛和相应的酚酸[33]。Zhu 等[34]用双歧杆菌和乳杆菌发酵处理矢车菊素-3-O-葡萄糖苷(C3G)后,做出了更加详细的解释,如图4 所示。起初,C3G 可能由于双歧杆菌和乳杆菌分泌的β-葡萄糖苷酶的存在而失去1 个葡萄糖苷,降解为矢车菊素,接着矢车菊素和查耳酮假碱通过氧化脱羟基、α-氧化、β-氧化、重排反应和甲基化进一步降解为羟基苯丙烯、羟基苯乙酸和羟基苯甲酸等酚酸。这些有机物会直接导致培养基环境pH值的降低。
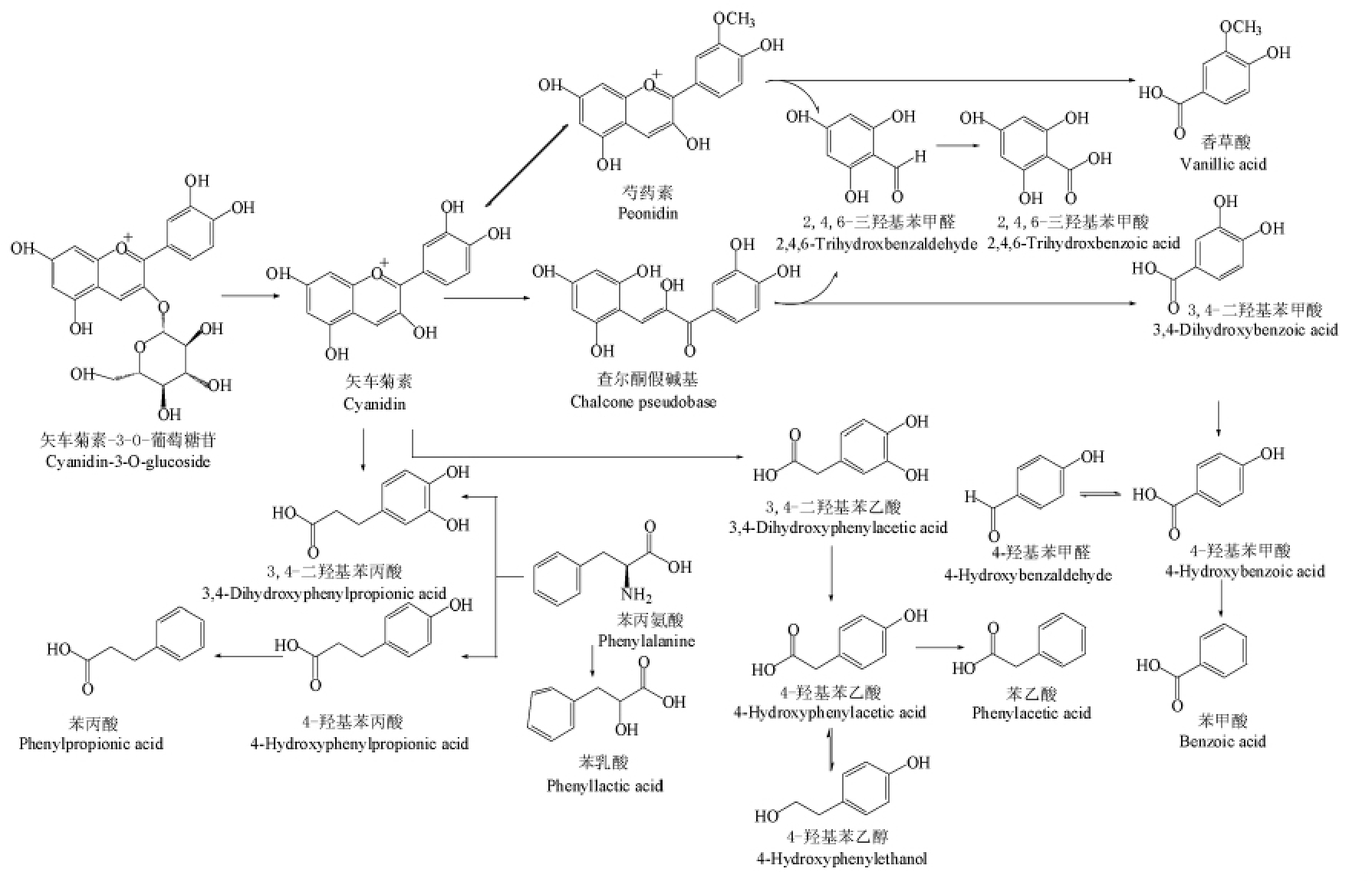
图4 乳酸菌降解矢车菊素-3-O-葡萄糖苷的途径及产物[36]
Fig.4 Degradation pathways and products of cyanidin-3-O-glucoside by lactic acid bacteria[36]
虽然乳酸菌会水解花色苷造成一定的颜色消退,但是在乳酸菌酶系作用下形成的酚类物质却是提升发酵液自由基清除能力和抗氧化活性的关键[35]。许多研究者通过乳酸菌发酵果蔬并测定它们的发酵产物与抗氧化活性之间的关系都得出了类似的结论。Mousavi 等[36]用植物乳杆菌和嗜酸乳杆菌发酵石榴汁,发现发酵后不同的花色苷(除了飞燕草素-3-O-葡萄糖苷之外)的含量虽有所下降,但发酵液的DPPH 自由基清除能力显著增加。Sripo 等[37]用保加利亚乳杆菌发酵黑糯米溶液时也发现,发酵后溶液的酚类含量和抗氧化活性同步增加,并认为两者之间存在紧密的联系。乳酸菌发酵时对果汁和糖的消耗会导致游离羟基和相关的苷元的释放,这可能导致酚类化合物的生物利用度和果蔬汁的抗氧化活性的提高[38]。一般而言,多酚和黄酮类化合物与抗氧化活性之间的关系可能是由于酸性和酚羟基的数量决定的,它们的芳香苯环与自由电子对在酚氧上的共振导致电子离域增加,从而增加它们对自由基的抗氧化活性。
与酵母一样,乳酸菌在发酵过程中也能吸附花色苷。与酵母不同的是,乳酸菌对花色苷的吸附能力并不取决于花色苷的极性。Devi 等[39]对比O.oeni 和L.plantarum 两种乳酸菌对花色苷和槲皮素糖苷的吸附作用和酶电位时发现,花色苷的选择性吸附是由静电相互作用导致的,而且不同的乳酸菌对花色苷吸附能力存在差异,这可能涉及其细胞壁组成的差异。
2.3 醋酸菌
醋酸菌是醋类调味品、饮料酿造中不可或缺的重要微生物,这类微生物能够使用乙醇作为生存物质并产生醋酸和其它有机酸,这些酸类有促进人体血管软化和控制血液胆固醇水平的作用,颇具保健功能[40]。醋酸菌产品以食品佐料醋为代表构成各方菜系的特点,比如山西老陈醋、镇江香醋、保宁醋和永春老醋等中国四大名醋;此外,一些可以直接饮用的果醋,如苹果醋、杨梅醋、桑葚醋等也逐渐走进了人们的日常,受到消费者的欢迎和追捧。对于一些富含花色苷的水果来说,果醋的开发也不失为一个具有潜力的产品创新和增值的机会,那么如何把控醋酸的发酵工艺以达到对果蔬资源的最大利用度成为关键,研究醋酸发酵对花色苷的影响尤为重要。
醋酸发酵是醋酸菌通过乙醇脱氢酶和乙醛脱氢酶逐步把乙醇氧化成乙醛和乙酸,过程中需要保持氧气的通入,这对于花色苷的保存是不利的。相比于酵母和乳酸菌的厌氧性发酵,醋酸菌的需氧型发酵对花色苷的降解更为明显。Wu 等[41]用醋酸菌发酵紫薯醋时发现,花色苷浓度从652.07 g/mL 下降到301.73 g/mL,花色苷含量损失了一半。Hornedo-Ortega 等[42]研究发酵工艺对草莓醋花色苷组成的影响时也发现,醋酸发酵对花色苷的损失较大(91%),其中损失最严重的花色苷分别是矢车菊素-3-葡萄糖苷(97.4%)、天竺葵素-3-丙二酰葡萄糖苷(95.3%)和天竺葵素-3-葡萄糖苷(89.3%)等这些具有大量羟基的花色苷。这使得采用醋酸发酵后的草莓醋颜色也随之变化,其L*和b* 有所增加,而a* 值有所下降,最终颜色范围介于红色和橙色之间。
与乳酸菌发酵不同的是,醋酸发酵并不能提高发酵液总酚含量,反而还会引起这些物质含量的降低。一般来说,醋酸发酵的通氧条件是引起这些抗氧化物质含量下降的主要原因。Cunha 等[43]用醋酸菌发酵黑莓后,检测到发酵液的总酚含量从199.25 mg GAE/L 下降到165.2 mg GAE/L。在缓慢的乙酸转化过程中,氧化会导致此类化合物的损失,最终影响果醋的抗氧化能力。Ubeda 等[44]也检测到草莓醋的DPPH 值(9 113±331 μmol TE/kg)和ORAC 值(19 784±117 μmol TE/kg)均比草莓酒【(9 652±378)μmol TE/kg,(2 2910±315)μmol TE/kg】略有降低。除此之外,醋酸发酵容器对果醋品质也起到重要作用,橡木桶和樱花桶的使用可以使草莓醋获得更高含量的酚类物质,而且木材有利于氧的渗透,其营造的微氧环境可能有利于花色苷衍生化合物的形成。
Cerezo 等[45]试验证明微氧环境可以促进Vitisin 型花色苷的形成,其对比赤霞珠红葡萄酒精发酵和醋酸发酵过程中花色苷的变化时,观察到Vitisin A、Vitisin B 和香豆酰Vitisin B 等含量显著增加,这揭示了微氧条件可能是复杂花色苷衍生物形成的关键一步。然而遗憾的是,研究者们对醋酸发酵过程花色苷演变机理知之甚少,还需要进行更进一步的研究。
2.4 霉菌
霉菌是豆豉、腐乳等发酵食品的主要菌种,与上述3 种菌种最大的差别在于霉菌发酵以固态形式发酵,即在没有或基本没有游离水的固态基质上的发酵方式[46]。固态发酵需要的温度条件较低,约25~30 ℃,接近常温,对于花色苷这种热不稳定的活性物质来说,具有较低的损伤水平,是一种较为理想的发酵方式。而且通过霉菌的酶系作用,更多的大分子蛋白质被降解成小分子肽,不仅使食物更具细腻口感,还更利于人体消化吸收,一举多得。
在发酵过程中,霉菌庞大的酶系统被激活,促进花色苷和酚类物质的释放。尤其是纤维素酶、木质素酶和果胶酶等能够有效分解植物细胞壁成分,并水解连接酚类化合物和细胞壁的酯键,帮助酚类物质从基质中释放出来。Lee 等[47]发现在30℃下,用毛曲霉对黑豆曲发酵3 d 时,可提取花色苷含量比未发酵组(0.8 mg C3G/g 干黑豆曲)增加了0.6 mg C3G/g 干黑豆曲。然而随着发酵时间的延长,花色苷的含量也随之降低,发酵过程中花色苷很容易被代谢,其由β-葡萄糖苷酶切割下的糖基被霉菌用于生长和繁殖[48]。Mushollaeni 等[49]用根霉发酵贝乐豆时,观测到发酵后颜色由深变浅和花色苷含量逐渐降低的现象,且较长时间的发酵将导致微生物数量增加,并与发酵产物中花色苷水平的降低呈正相关。此外,Fan 等[50]发现紫薯经霉菌发酵后提取到的花色苷纯度更高,其中超过80.7%是酰基化花色苷,降解指数更低。这可能是花色苷母环与酰基氧原子空间折叠成更稳定的“三明治”结构,使得酰化花色苷的消耗速度比非酰化花色苷慢。
酚类物质的大量释放,极有可能赋予了发酵底物更高的抗氧化水平。Dulf 等[51]用黑曲霉和少孢根霉对黑果腺肋花楸果进行固态发酵时发现,其可提取的酚类物质均增加了1.7 倍以上,在发酵第9 天,DPPH 自由基清除能力提高了1.70 倍。Lee 等[52]也检测到霉菌发酵黑豆后的DPPH 自由基清除能力和Fe2+-离子螯合能力分别是未发酵组的2.78 倍和2.16 倍。Vattem 等[48]用少孢根霉固态发酵蔓越莓渣时,还检测到β-葡萄糖苷酶活性的增加,并认为酚类物质含量的增加可能与霉菌中β-葡萄糖苷酶活性有关。因为这种酶在固态发酵过程中有助于酚类物质和糖苷的解离,以暴露出酚类物质更多的羟基,而这些羟基是酚类物质具有清除自由基能力的关键。还有研究表明,发酵介质的低氮环境会阻碍自由酚类化合物的产生[53],那么为了提高总酚的产量,可以在固态发酵时适当使用或补充有机或无机氮源。
此外,Bu 等[54]首次发现花色苷可以在曲霉A.sydowii H-1 中产生,并鉴定出31 个可能参与花色苷生物合成的候选转录本,其中CHS 和C4H 被称为花色苷生物合成的关键基因,这表明这2 个基因可能有助于花色苷在H-1 中的产生。这一发现扩大了人们对花色苷生物合成的认识,为花色苷的生产提供了方向。
3 结语与展望
随着十九大健康中国战略的提出,治未病的思想深入人心,大健康产业也得到了前所未有的发展,发酵产品因独特的风味和健康效益而受到广泛的关注。目前市场上富含花色苷的发酵产品,如果酒、果醋、酵素等琳琅满目,而决定这类产品品质的一个重要因素就是色泽稳定性以及功能性。在酵母、乳酸菌、醋酸菌和霉菌等食品微生物复杂的酶系统及代谢产物的作用和影响下,花色苷的结构与性质也会随之改变。一方面,葡萄糖苷酶对花色苷的酶解作用、菌种的细胞壁对花色苷的吸附作用和发酵过程的氧环境等都能造成发酵过程花色苷的损失;另一方面,微生物代谢产物如丙酮酸、乙醛和乙酰乙酸等会促使单体花色苷向更稳定的吡喃型花色苷进行转化。此外,发酵过程游离的酚类物质与花色苷的聚合对产品的色泽和抗氧化功能活性也有重要影响。如何利用现代生物技术筛选新的菌种,对传统食品发酵以及赋予其新的营养和功能,成为未来食品开发的重要方向。
[1] 徐青,王代波,刘国华,等.花青素稳定性影响因素及改善方法研究进展[J].食品研究与开发,2020,41(7):232-238.XU Q,WANG D B,LIU G H,et al.Influencing factors and improving methods of anthocyanin stability[J].Food Research And Development,2020,41(7):232-238.
[2] 许明秀,解思琦,张岩,等.关于果实中花色苷提取和稳定性的研究[J].果树资源学报,2020,1(4):60-65.XU M X,XIE S Q,ZHANG Y,et al.Research progress on extraction and stability of anthocyanins in fruit[J].Journal of Fruit Resources,2020,1(4):60-65.
[3] LIU J,ZHOU H,SONG L,et al.Anthocyanins:Promising natural products with diverse pharmacological activities[J].Molecules,2021,26(13):3807.
[4] 赵立仪.矢车菊素-3-O-葡萄糖苷的月桂酸酰化,结构分析及性质评价[D].北京:北京林业大学,2015.ZHAO L Y.Acylation reaction of Cyanidin-3-Oglucoside with lauric acid,its structure analysis and property evaluations[D].Beijing:Beijing Forestry University,2015.
[5] LIU J,ZHUANG Y,HU Y,et al.Improving the color stability and antioxidation activity of blueberry anthocyanins by enzymatic acylation with p-coumaric acid and caffeic acid[J].LWT-Food Science and Technology,2020,130:109673.
[6] 付辉战,胡腾根,邹宇晓,等.花色苷的功能活性及提取方法概述[J].农产品加工,2017,16(15):48-54.FU H Z,HU T G,ZOU Y X,et al.Overview on functional characteristics and extraction methods of anthocyanins[J].Farm Products Processing,2017,16(15):48-54.
[7] MA E B,SANTOS-BUELGA C,RIVAS-GONZALO J C.Anthocyanins in cereals[J].Journal of Chromatography A,2004,1054(1/2):129-141.
[8] YANG W,KORTESNIEMI M,YANG B,et al.Enzymatic acylation of anthocyanins isolated from alpine bearberry(arctostaphylos alpina)and lipophilic properties,thermostability,and antioxidant capacity of the derivatives[J].Journal of Agricultural &Food Chemistry,2018,6(11):2909-2916.
[9] REHMAN S U,SHAH S A,ALI T,et al.Anthocyanins reversed D -galactose -induced oxidative stress and neuroinflammation mediated cognitive impairment in adult rats[J].Molecular Neurobiology,2017,54(1):255-271.
[10] GOWD V,JIA Z,WEI C.Anthocyanins as promising molecules and dietary bioactive components against diabetes -A review of recent advances[J].Trends in Food Science &Technology,2017,68:1-13.
[11] SKATES E,OVERALL J,DEZEGO K,et al.Berries containing anthocyanins with enhanced methylation profiles are more effective at ameliorating high fat diet-induced metabolic damage[J].Food and Chemical Toxicology,2018,111:445-453.
[12] LI X,YAO Z,YANG D,et al.Cyanidin-3-Oglucoside restores spermatogenic dysfunction in cadmium-exposed pubertal mice via histone ubiquitination and mitigating oxidative damage[J].Journal of Hazardous Materials,2019,387:121706.
[13] RAI A K,PANDEY A,SAHOO D.Biotechnological potential of yeasts in functional food industry[J].Trends in Food Science &Technology,2019,83:129-137.
[14] HU Y,ZHANG L,WEN R,et al.Role of lactic acid bacteria in flavor development in traditional Chinese fermented foods:A review[J].Critical Reviews in Food Science and Nutrition,2020,62(10):11-15.
[15] 阳飞,覃凌云,张华山,等.醋酸菌分类及其应用研究进展[J].中国调味品,2015,40(10):112-115,124.YANG F,QING L Y,ZHANG H S,et al.Research progress of classification and application of acetic acid bacteria[J].China Condiment,2015,40(10):112-115,124.
[16] 陈玉婷,乌日娜.传统发酵制品中霉菌的应用研究[J].中国酿造,2019,38(7):1-4.CHEN Y T,WU R N.Application of mold in traditional fermented products[J].China Brewing,2019,38(7):1-4.
[17] LIU S X,LAAKSONEN O,YANG W,et al.Pyranoanthocyanins in bilberry(Vaccinium myrtillus L.)wines fermented with Schizosaccharomyces pombe and their evolution during aging[J].Food Chemistry,2020,305(C):125438.
[18] HE F,LIANG N N,MU L,et al.Anthocyanins and their variation in red wines II.Anthocyanin de rived pigments and their color evolution [J].Molecules,2012,17(2):1483-1519.
[19] MORATA A,CALDERÓN F,GONZÁLEZ M C,et al.Formation of the highly stable pyranoanthocyanins(vitisins A and B)in red wines by the addition of pyruvic acid and acetaldehyde[J].Food Chemistry,2005,100(3):1144-1152.
[20] MARQUEZ A,SERRATOSA M P,MERIDA J.Pyranoanthocyanin derived pigments in wine:Structure and formation during winemaking[J].Journal of Chemistry,2013,2013:1-15.
[21] MATEUS N,SILVA A,RIVAS-GONZALO J C,et al.A new class of blue anthocyanin-derived pigments isolated from red wines[J].Journal of Agricultural and Food Chemistry,2003,51(7):1919-1923.
[22] HE J,CARVALHO A R F,MATEUS N,et al.Spectral features and stability of oligomeric pyranoanthocyanin -flavanol pigments isolated from red wines[J].Journal of Agricultural and Food Chemistry,2010,58(16):9249-9258.
[23] SCHWARZ M,WABNITZ T C,WINTERHALTER P.Pathway leading to the formation of anthocyaninvinylphenol adducts and related pigments in red wines[J].Journal of Agricultural &Food Chemistry,2003,51(12):3682.
[24] MATEUS N,OLIVEIRA J,PISSARRA J,et al.A new vinylpyranoanthocyanin pigment occurring in aged red wine[J].Food Chemistry,2006,97(4):689-695.
[25] MORATA A,GONZÁLEZ C,SUÁREZ-LEPE J A.Formation of vinylphenolic pyranoanthocyanins by selected yeasts fermenting red grape musts supplemented with hydroxycinnamic acids[J].International Journal of Food Microbiology,2007,116(1):144-152.
[26] 何静仁,邝敏杰,齐敏玉,等.吡喃花色苷类衍生物家族的研究进展[J].食品科学,2015,36(7):228-234.HE J R,KUANG M J,QI M Y.et al.Recent progress in research on pyranoanthocyanins derivatives[J].Food Science,2015,36(7):228-234.
[27] SUN X Y,YAN Z C,ZHU T,et al.Effects on the color,taste,and anthocyanins stability of blueberry wine by different contents of mannoprotein[J].Food Chemistry,2019,279:63-69.
[28] RODRIGUES A,RICARDO-DA-SILVA J M,LUCAS C,et al.Effect of commercial mannoproteins on wine colour and tannins stability[J].Food Chemistry,2011,131(3):907-914.
[29] KOKKINOMAGOULOS E,NIKOLAOU A,KOURKOUTAS Y,et al.Evaluation of yeast strains for pomegranate alcoholic beverage production:Effect on physicochemical characteristics,antioxidant activity,and aroma compounds[J].Microorganisms,2020,8(10):1583-1583.
[30] SUÁREZ-LEPE J A,MORATA A.New trends in yeast selection for winemaking[J].Trends in Food Science &Technology,2012,23(1):39-50.
[31] MORATA A,GÓMEZ-CORDOVÉS M C,COLOMO B,et al.Cell wall anthocyanin adsorption by different Saccharomyces strains during the fermentation of Vitis vinifera L.cv Graciano grapes[J].European Food Research &Technology,2005,220(3/4):341-346.
[32] YAN Y H,ZHANG F,CHAI Z Y,et al.Mixed fermentation of blueberry pomace with L.rhamnosus GG and L.plantarum-1:Enhance the active ingredient,antioxidant activity and health -promoting benefits[J].Food and Chemical Toxicology,2019,131:110541.
[33] ÁVILA M,HIDALGO M,SÁNCHEZ-MORENO C,et al.Bioconversion of anthocyanin glycosides by Bifidobacteria and Lactobacillus[J].Food Research International,2009,42(10):1453-1461.
[34] ZHU Y,SUN H,HE S,et al.Metabolism and prebiotics activity of anthocyanins from black rice(Oryza sativa L.)in vitro[J].PloS One,2018,13(4):e0195754.
[35] WU T Y,TSAI C C,HWANG Y T,et al.Effect of antioxidant activity and functional properties of chingshey purple sweet potato fermented milk by Lactobacillus acidophilus,L.delbrueckii subsp.lactis,and L.gasseri strains[J].Journal of Food Science,2012,77(1):M2-M8.
[36] MOUSAVI Z E,MOUSAVI S M,RAZAVI S H,et al.Effect of fermentation of pomegranate juice by Lactobacillus plantarum and Lactobacillus acidophilus on the antioxidant activity and metabolism of sugars,organic acids and phenolic compounds[J].Food Biotechnology,2013,27(1):1-13.
[37] SRIPO K,PHIANMONGKHOL A,WIRJANTORO T I.Effect of inoculum levels and final pH values on the antioxidant properties of black glutinous rice solution fermented by Lactobacillus bulgaricus[J].International Food Research Journal,2016,23(5):2207-2213.
[38] KWAW E,MA Y,TCHABO W,et al.Effect of Lactobacillus strains on phenolic profile,color attributes and antioxidant activities of lactic-acid-fermented mulberry juice[J].Food Chemistry,2018,250:148-154.
[39] DEVI A,AIYAPPAA A K,WATERHOUSE A L.Adsorption and biotransformation of anthocyanin glucosides and quercetin glycosides by[J].Journal of the Science of Food and Agriculture,2020,100(5):2110-2120.
[40] HO C W,LAZIM A M,FAZRY S,et al.Varieties,production,composition and health benefits of vinegars:A review[J].Food Chemistry,2017,221:1621-1630.
[41] WU X F,YAO H L,CAO X M,et al.Production of vinegar from purple sweet potato in a liquid fermentation process and investigation of its antioxidant activity[J].3 Biotech,2017,7(5):308.
[42] HORNEDO-ORTEGA R,ALVAREZ-FERNANDEZ M A,CEREZO A B,et al.Influence of fermentation process on the anthocyanin composition of wine and vinegar elaborated from strawberry[J].Journal of Food Science,2017,82(1/2/3):364-372.
[43] CUNHA M,LIMA K,SANTOS V,et al.Blackberry vinegar produced by successive acetification cycles:Production,characterization and bioactivity parameters[J].Braz Arch Biol Technol,2016,59:1-16.
[44] UBEDA C,CALLEJÓN R M,HIDALGO C,et al.Employment of different processes for the production of strawberry vinegars:Effects on antioxidant activity,total phenols and monomeric anthocyanins [J].LWT-Food Science and Technology,2013,52(2):139-145.
[45] CEREZO A B,CUEVAS E,WINTERHALTER P,et al.Anthocyanin composition in Cabernet Sauvignon red wine vinegar obtained by submerged acetification[J].Food Research International,2010,43(6):1577-1584.
[46] SADH P K,DUHAN S,DUHAN J S.Agro-industrial wastes and their utilization using solid state fermentation:A review[J].Bioresources and Bioprocessing,2018,5(1):1-15.
[47] LEE I H,HUNG Y H,CHOU C C.Total phenolic and anthocyanin contents,as well as antioxidant activity,of black bean koji fermented by Aspergillus awamori under different culture conditions[J].Food Chemistry,2007,104(3):936-942.
[48] VATTEM D A,SHETTY K.SOLID-STATE Production of phenolic antioxidants from cranberry pomace by rhizopus oligosporus.[J].Food Biotechnology,2002,16(3):189-210.
[49] MUSHOLLAENI W,KUMALANINGSIH S,WIGNYANTO,et al.Effect of solid-state fermentation on anthocyanin and physicochemical content of Lebui bean(Cajanus sp)[J].Bioscience Research,2017,14(4):1096-1102.
[50] FAN G,HAN Y,GU Z,et al.Composition and colour stability of anthocyanins extracted from fermented purple sweet potato culture[J].LWT-Food Science and Technology,2008,41(8):1412-1416.
[51] DULF F V,VODNAR D C,DULF E H,et al.Liberation and recovery of phenolic antioxidants and lipids in chokeberry(Aronia melanocarpa)pomace by solid-state bioprocessing using Aspergillus niger and Rhizopus oligosporus strains[J].LWT-Food Science &Technology,2018,87:241-249.
[52] LEE I H,HUNG Y H,CHOU C C.Solid-state fermentation with fungi to enhance the antioxidative activity,total phenolic and anthocyanin contents of black bean[J].International Journal of Food Microbiology,2008,121(2):150-156.
[53] DULF F V,VODNAR D C,DULF E H,et al.Total phenolic contents,antioxidant activities,and lipid fractions from berry pomaces obtained by solid-state fermentation of two Sambucus species with Aspergillus niger[J].Journal of Agricultural and Food Chemistry,2015,63(13):3489-3500.
[54] BU C,ZHANG Q,ZENG J,et al.Identification of a novel anthocyanin synthesis pathway in the fungus Aspergillus sydowii H-1[J].BMC Genomics,2020,21(1):1-16.