中国是世界上最大的小麦生产国和消费国,约有70%的小麦用于制粉,用面粉制作成面制品。小麦蛋白质在水的作用下可以相互缠结形成网络结构,使面团具有黏弹性,是制作面制品的基础[1-2]。面团制造是小麦加工与面制品制造的重要环节。其理化特性与小麦粉中蛋白质组成,尤其是麦谷蛋白大聚体(Glutenin macropolymer,GMP)含量和构象密切相关。作为面团结构中面筋网络结构的重要组成部分,麦谷蛋白大聚体的含量及构象直接影响面团的流变学性质,进而影响面制品的制作和最终的感官品质[3-4]。
本文从小麦籽粒储存、籽粒不同部位(制粉中的粉路粉)、面团形成和醒发等面团制造链,分析麦谷蛋白大聚体的含量及构象变化,整理、归纳麦谷蛋白大聚体在其中可能的变化机理,旨在为小麦加工和面团制造质量调控提供参考。
1 小麦蛋白质组分
小麦籽粒中的蛋白质组分对食用品质起着重要作用。按照Osborne 的经典方法,根据在蒸馏水、盐水、醇和碱溶液中溶解度不同,小麦蛋白可以分为清蛋白、球蛋白、麦醇溶蛋白和麦谷蛋白4种[5]。麦醇溶蛋白和麦谷蛋白是构成面筋网络的主要组分。麦谷蛋白是由高分子量麦谷蛋白亚基(High molecule weight subunit,HMW-GS)和低分子量麦谷蛋白亚基(Low molecule weight subunit,LMW-GS)通过分子间二硫键交联而成的聚集体蛋白,HMW-GS 被认为在面筋聚合中起主要作用。根据在十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)溶液中的溶解度不同,小麦蛋白又分为SDS 可溶蛋白和SDS 不可溶蛋白。SDS 可溶蛋白包括清蛋白、球蛋白、麦醇溶蛋白以及摩尔质量较小的麦谷蛋白聚集体。SDS 不可溶蛋白主要是摩尔质量较大的麦谷蛋白聚集体,也被称为麦谷蛋白大聚体。可见,GMP 属于麦谷蛋白中的一部分,在一些还原剂作用下或经过超声处理后,也会分散或溶解在SDS 溶液中[6-8]。GMP 含量可能反映了麦谷蛋白的聚集程度,在外部条件作用下,麦谷蛋白颗粒聚集程度下降后,才被十二烷基硫酸钠溶液提取出来。根据分子间二硫键连接的麦谷蛋白分子的数量,麦谷蛋白大聚体的分子质量从50 万u 到1000 多万u 不等[9]。
2 麦谷蛋白大聚体在小麦籽粒储存中的变化
新收获的小麦籽粒新陈代谢旺盛,品质不稳定,需经过2~3 个月的储藏后品质才逐渐稳定,这个过程被称为“后熟”[10]。Miroslav 等[11]研究表明,储藏50 d 后,Pobeda 和Apache 两个品种的高分子量谷蛋白亚基(HMW-GS)含量分别从34.9%和20.2%增加到37.8%和35.2%。Rao 等[12]研究表明,储藏4 个月后,麦谷蛋白/麦醇溶蛋白的比值从0.3~0.9 增加到1.3~1.9。Yue 等[13]研究表明,储藏14 周后,麦谷蛋白含量和麦谷蛋白大聚体含量分别从35.1 mg/g 和13.3 mg/g 增加到45.5 mg/g 和14.5 mg/g,麦谷蛋白大聚体含量变化与González-Torralba 等[14]的研究结果一致。Ahmed[15]研究表明,储藏30 d 后,湿面筋含量平均增加了3%;![]() lu 等[16]研究表明,储藏3 个月后,湿面筋含量和干面筋含量分别从38.2%和12.3%增加到40.6%和13.3%。随着储藏时间的延长,谷蛋白溶胀指数从2.9 增加到3.6,面筋指数从48.1%增加到63.7%[13];Pobeda、Zvezdana 两个品种的面团储能模量值分别从15 674 Pa 和17 250 Pa 增加到18 065 Pa 和19 795 Pa[11]。Rao 等[12]研究表明,随储藏时间延长至4 个月,面团吸水率平均增加1.7 个百分点,面团形成时间平均增加2.7 min,与Lancelot 等[17]和Wang 等[18]的研究结果一致;Karao
lu 等[16]研究表明,储藏3 个月后,湿面筋含量和干面筋含量分别从38.2%和12.3%增加到40.6%和13.3%。随着储藏时间的延长,谷蛋白溶胀指数从2.9 增加到3.6,面筋指数从48.1%增加到63.7%[13];Pobeda、Zvezdana 两个品种的面团储能模量值分别从15 674 Pa 和17 250 Pa 增加到18 065 Pa 和19 795 Pa[11]。Rao 等[12]研究表明,随储藏时间延长至4 个月,面团吸水率平均增加1.7 个百分点,面团形成时间平均增加2.7 min,与Lancelot 等[17]和Wang 等[18]的研究结果一致;Karao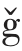 lu[19]研究表明,随着储藏时间延长到9 个月,面团稳定时间从14.1 min 增加到17.2 min,面团最大拉伸阻力从297 BU 增加到517 BU。蛋白质大聚体含量、面筋指数、面团流变学特性等蛋白质理化特性都随着储藏时间的延长逐渐增加,表明储藏过程中,蛋白质在逐渐收缩聚集,形成较大的聚集体。
lu[19]研究表明,随着储藏时间延长到9 个月,面团稳定时间从14.1 min 增加到17.2 min,面团最大拉伸阻力从297 BU 增加到517 BU。蛋白质大聚体含量、面筋指数、面团流变学特性等蛋白质理化特性都随着储藏时间的延长逐渐增加,表明储藏过程中,蛋白质在逐渐收缩聚集,形成较大的聚集体。
3 麦谷蛋白大聚体在籽粒中的分布
在小麦籽粒中,GMP 的分布并不均匀,越接近小麦籽粒皮层部分,所含的GMP 含量越高;越靠近胚乳中心,GMP 储能模量和损耗模量平台值越大[20]。
Liu 等[21]以Glenn 品种的小麦籽粒为试验样品,用磨粉机磨粉,得到代表籽粒由外到内的粉路粉B3,B2,B1,R3,R2,R1。结果显示,皮磨粉中B1~B3,GMP 含量呈现增加的趋势,在面粉中的百分含量从4.4%上升至6.0%,占总蛋白质的比例从31.8%上升到34.1%;芯磨粉中R1~R3,GMP 在面粉中的含量变化不大,变化范围为4.2%~4.3%,然而GMP 占总蛋白的比例呈上升趋势,从35.7%上升至37.1%。Dai 等[22]以师栾02-1 为试验材料,从外到内逐层碾磨出6 个组分样品,代表籽粒外层到中心的组分,结果显示,小麦籽粒由外到内,越靠近胚乳中心,GMP 含量越低,含量从54.4 mg/g下降至30.0 mg/g。GMP 的储能模量(G')和弹性模量(G'')平台值总体上呈现逐渐增加的趋势,分别上升约84 Pa 和12 Pa。Sutton 等[23]以Monad 品种小麦为试验样品,测定了不同粉路中GMP 含量变化情况。结果显示,从接近籽粒中心的皮磨(B1)到接近皮层的皮磨(B4)所得面粉中GMP 的含量从0.035 g/g 上升至0.055 g/g;整体高于全部芯磨所得面粉中GMP 含量(0.025 g/g)。Poji 等[24]以制粉工艺中不同粉路粉为试验样品,研究结果表明,在皮磨粉中,B1~B4 中蛋白质含量呈现递增的趋势,百分含量从11.8%上升到16.1%,对应的面团流变学参数也有显著差异,稳定时间从12.7 min 上升到20.2 min;面团延伸度从163 mm 上升到251 mm。Sakhare 等[25]以商用磨粉机中不同粉路粉为样品,分别测定皮磨粉和芯磨粉的粉质参数,结果表明,皮磨粉所和面团的形成时间及稳定时间均显著高于芯磨粉。皮磨粉面团形成时间和稳定时间范围分别为5.8~10.6 min 和6~10 min;芯磨粉分别为4.9~5.0 min 和4~6 min。
4 麦谷蛋白大聚体在面团形成中的变化
面粉与适量的水经过机械搅拌混合后形成具有一定黏弹性的面团。在面团形成过程中,在机械搅拌和水的作用下,在二硫键、疏水相互作用和氢键等交换下,面团中的麦谷蛋白呈现拉伸形态,倾向于形成相互黏连或缠结复杂的网络结构;麦醇溶蛋白和部分低分子量麦谷蛋白亚基,通过氢键、疏水作用等次级相互作用结合在麦谷蛋白的网络骨架上,共同构成面筋网络[9,26]。
4.1 面团形成过程中麦谷蛋白大聚体含量的变化
麦谷蛋白大聚体的含量可以预测面粉的品质、面团性质和面团结构的形成情况[27]。Aussenac等[28]采用几种具有不同GMP 含量的小麦品种作为试验样品,研究面团混合时间与谷蛋白聚合物含量的关系。结果显示,在面团搅拌混合过程中,麦谷蛋白聚合物的数量呈指数级下降,而且这种下降与所使用的面粉种类无关。在搅拌至峰值浓度期间(0~4 min),GMP 含量降低了近70%,4 min以后下降速度放缓,GMP 含量趋于稳定。
Fang 等[27]研究挤压机和面过程GMP 含量的变化,结果显示,经过不同挤压条件,面团中GMP含量均呈现下降的趋势;GMP 含量与挤压过程单位机械能输入呈负相关。面团经过1 次挤压后,GMP 含量下降2.3 mg/g;经过2 次挤压后,面团中GMP 含量再次下降3.1 mg/g;当经过3 次挤压时,与第1 次挤压后的面团相比下降了10.4 mg/g。
4.2 面团形成过程中麦谷蛋白大聚体颗粒的变化
Don 等[29]提出,面筋网络是一个粒子网络,在0.1~100 μm 尺度上粒子的物理相互作用影响面团的特性。以Estica、Soissons 和Baldus 三个小麦品种的面粉作为样品,在形成面团的各个阶段,从面团中分离出GMP 组分,并研究其物理性质的变化,结果显示,在面团搅拌混合过程中,GMP 颗粒的平均尺寸会逐渐减小,最小体积均为0.11 L/g,该趋势和最小体积与品种无关。推测在1.5%SDS条件下,0.11 L/g 可能是蛋白质是否可溶的临界体积。此外,在粉质仪峰值稠度附近,不同品种GMP颗粒粒径也基本一致。机械搅拌对面团产生剪切和撕裂作用,在一定程度上破坏了面筋结构,因此GMP 颗粒粒径减小的机理以物理破坏为主[30]。分析面团GMP 凝胶的G' 与形成过程中能量输入的关系发现,G' 随着面团形成过程中能量的输入而显著下降;随着能量增加,Estica、Soissons 和Baldus品种GMP 胶的G' 下降速率分别为20.8,6.9,3.1 Nm/Pa。同时,GMP 胶中蛋白质的浓度基本不变[22]。Aussenac 等[28]通过HPSEC-MALLS 方法揭示面团形成过程中谷蛋白聚合物尺寸分布的变化。结果表明,在混合过程中,高分子量聚合物的相对含量减少,而最低分子量聚合物的相对含量增加。在面粉中,聚合物摩尔质量大于1.0×10-6 g/mol 的聚合物约占59%,而混合4 min 后降低至47%;摩尔质量小于4.0×10-6 g/mol 的聚合物占比上升9.4%。
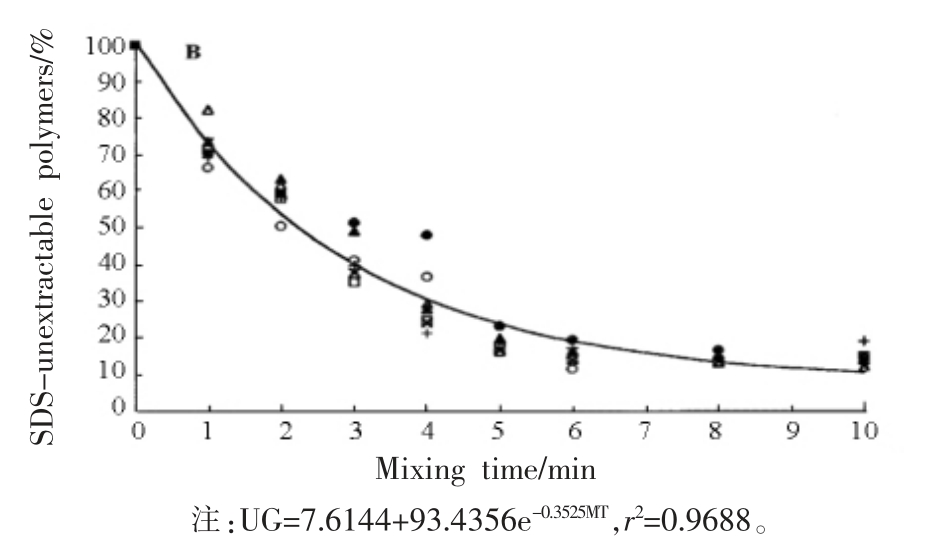
图1 面团搅拌混合过程对麦谷蛋白大聚体含量的影响[28]
Fig.1 The effect of dough mixing process on glutenin macropolymer content[28]
图2 面团搅拌混合过程中可溶性麦谷蛋白形状系数变化示意图[33]
Fig.2 Diagram of shape factor change of soluble glutenin during dough mixing[33]
麦谷蛋白聚集体大小与面团流变学特性密切相关,物质的量大的聚合蛋白对面团强度有显著贡献。Bersted 和Anderson 认为[31],对于多分散聚合物,只有那些形成有效缠结的分子有助于拉伸强度。Bueche 认为[32],键的断裂是由于分子链在应力剪切作用下不能充分快速地解开。只有当聚合物存在缠结时,才会发生剪切降解;分子质量高于临界尺寸的分子链会被分解,而低分子质量的物质不会被分解。因此,面团在机械搅拌的作用下,部分高分子谷蛋白大聚体会降解为一些粒径较小的聚合物。
麦谷蛋白大聚体粒径在变化过程中,其形态也随之变化。Li 等[33]分析麦谷蛋白介观结构的变化,发现在混合之前,聚合物形状因子为1.0,表明其形态是单分散的、无相互作用的球形;随着混合的进行,在4.5 min 时形状因子变为2.6,表明聚合物变成了延伸的棒状/雪茄状;在9.0 min 时形状因子为2.0,表明变成更细长的椭球形状。面团的表观稠度是由麦谷蛋白聚集体的有效(回旋)体积控制的,当麦谷蛋白聚集体从球形拉伸至椭球形,甚至雪茄形时,其有效(回旋)体积增加,表观稠度增加。再进一步搅拌,聚集体会恢复球状,由于大小不等,导致异质性增加,故表观稠度缓慢下降。
5 麦谷蛋白大聚体在面团醒发过程中的变化
面团形成过程中形成的复杂黏连和缠结结构产生的应力,在面团醒发时会得到松弛,部分应力过大的区域会断裂形成多个独立的区域,拉伸形态会收缩,蛋白间的相互作用会重新分布,结构趋向于有序性,体系朝着能量降低的方向变化,以提高其稳定性。
Feng 等[34]通过设定不同和面时间,探究在面团醒发过程中,GMP 含量、粒径、二硫键等变化对麦谷蛋白大聚体的影响。结果显示,醒发过程增加了GMP 含量,在醒发时间为60 min 时,GMP 含量达到峰值。和面搅拌时间3 min 或5 min 的面团,醒发60 min 后,GMP 平均含量从7.2%增加11.5%;二硫键平均含量从2.0 μmol/g 增加至3.0 μmol/g[35]。然而,进一步延长醒发时间,如超过60 min,麦谷蛋白大聚体会进一步收缩,导致结构的连续性被破坏,GMP 含量和二硫键含量均呈下降趋势[36]。通常而言,面团醒发过程中GMP 含量的增幅小于搅拌过程中GMP 降低的量,即GMP 含量无法恢复至原料中的含量水平[9]。醒发过程中GMP 粒径呈现先增加后减小的趋势。在短时间醒发过程中(30~60 min),大粒径GMP(50~231 μm)平均百分含量由41.8%增加至47.1%;随着醒发时间进一步延长,大粒径GMP 平均百分含量下降至43.7%[34]。有研究认为是氧气、面团中的微生物和蛋白酶等作用,破坏了二硫键,切断了亚基间的连接,从而使大粒径GMP 含量减少[36]。
激光共聚焦显微镜(CSLM)观察面团醒发过程中GMP 颗粒的微观结构发现,在醒发过程中,GMP 颗粒逐渐呈现更规则的椭球形状,变得更饱满,边缘完整光滑[34]。Wang 和Weegels 等[37-38]研究发现面团混合会导致面团结构的重新排列,而面团醒发会使面筋网络结构被修剪和重新排列,从而产生更连续、更均匀的结构。傅里叶转换红外光谱分析样品中GMP 的二级结构发现,随着醒发时间的延长,GMP 中α-螺旋结构平均占比由28.1%增加至32.6%;β-折叠结构平均占比由29.5%上升至33.5%[34]。α-螺旋含量增加,表明形成的结构更加有序,β-折叠含量增加,表明面筋蛋白的结构稳定性增强[39]。而无规卷曲结构含量呈下降趋势,GMP 的蛋白质结构趋于稳定和有序。一些研究还指出,GMP 中分子间二硫键和β-折叠结构在稳定蛋白质构象方面有协同作用[40-41]。GMP 胶的动态流变特性显示,随着醒发时间的延长,GMP 胶的储能模量(G')和损耗模量(G'')均降低,表明GMP的缠结和连续性下降[37,42]。

图3 不同醒发时间面团GMP 胶黏弹性模量G'(a)和G''(b)[34]
Fig.3 Viscoelastic modulus G′(a)and G′′(b)for the GMP of dough with different rest time[34]
注:Flour:未经搅拌混合及醒发的小麦粉。M3R0-M3R90:搅拌混合3 min,醒发0,30,60,90 min。M5R0-M5R90:搅拌混合5 min,醒发0,30,60,90 min。
6 面团制造中麦谷蛋白大聚体可能的变化机理
Wieser 等[9]通过分析面粉中蛋白质组成及相互作用提出了面筋网络结构的简化模型,认为高分子麦谷蛋白亚基间通过共价键以及相互作用等形成网络骨架,低分子麦谷蛋白亚基或醇溶蛋白会结合在骨架上。在此基础上,Don 等[43]提出超聚合模型(Superaggregation model)来解释在搅拌混合过程中GMP 结构变化情况,如图4[43]所示。HMW-GS 和LMW-GS 形成麦谷蛋白粒子。HMWGS/LMW-GS 比例增大会使形成的麦谷蛋白粒度增大。麦醇溶蛋白会通过共价键以及一些次级相互作用结合在麦谷蛋白大聚体上,共同构成面筋网络结构。该模型将麦谷蛋白粒子中的相互作用力分为共价作用(Covalent interactions)和非共价作用或物理相互作用(Physical interactions)。

图4 面团制作中麦谷蛋白超聚集模型示意图[43]
Fig.4 Schematic diagram of glutenin superaggregation model in dough processing[43]
高分子量麦谷蛋白亚基的类型影响聚集体中相互作用[44-45]。Lafiandra 和Popineau 等[46-47]已经证明HMW-GS‘5+10’亚基的存在与黏弹性面筋相关,当HMW-GS‘5+10’亚基被等位HMW-GS‘2+12’取代时,面筋黏弹性显著降低。Wieser 等[9]研究发现x-型HMW-GS 对面团性质的贡献比y-型HMW-GS 更重要,这可能是因为x 型亚基的物质的量高于y 型[48]。
动态流变中的储能模量(G')、黏性与弹性行为的比率(δ)与稳定GMP 的相互作用的程度和强度有关。Don 等[49]采用Galahad-7、Caprimus、Soissons 和Classic 四个品种小麦发现,弱筋小麦品种Galahad-7 样品的GMP 结构的稳定性相对较弱,随着应力的增加,δ 增加值最多。含有‘5+10’亚基的Classic 和Soissons 样品的GMP 更坚固,更有弹性,采用CSLM 在GMP 分散体系中可以清楚地观察到10~30 μm 的球形颗粒。Barak 等[50]研究表明,具有2* 型、‘5+10’型或‘7+9’型亚基的PBW590和PBW550 两个品种对应面团稳定性较好,具有‘2+12’型的HW2004 和C306 品种对应面团稳定性较差,其稳定时间均为1.5 min,显著低于PBW550 样品的6.5 min。
超聚合模型认为,面粉加水搅拌混合形成面团时,在搅拌初期(Under-mix)阶段,麦谷蛋白粒子开始吸水溶胀,体积逐渐增加,粒子密度逐渐降低,粒子间相互作用逐渐增加,表现为粉质仪的表观稠度逐渐增加,然而此时所形成的面团网络结构不稳定且弹性较差。在适当搅拌(Optimal mix)阶段,粒子充分溶胀,麦谷蛋白形成连续相,颗粒数量有所下降,粒子呈现拉伸形态,倾向于形成相互黏连或缠结复杂的网络结构,粉质仪表观稠度增加至最大值。过度搅拌(Overmix)阶段,麦谷蛋白颗粒间相互作用会被破坏,逐渐由数量较少的大连续相转变为数量较多的小连续相,粉质仪表观稠度缓慢下降。面团经过醒发,因搅拌形成的复杂相互作用中,部分应力得到松弛,所形成的面团具有较好的稳定性。
7 小结与展望
高分子量麦谷蛋白亚基通过分子间二硫键形成骨架,低分子量麦谷蛋白亚基通过二硫键结合在骨架上,骨架间通过疏水相互作用、氢键、静电作用等非共价相互作用进一步形成聚集体。部分聚集体内相互作用较为复杂,以致于可以破坏疏水和静电作用的SDS 溶液都无法将其提取出来,这部分聚集体被称为麦谷蛋白大聚体。籽粒在60~120 d 的储存过程中,麦谷蛋白大聚体含量逐渐增加,表明麦谷蛋白逐渐收缩和聚集。在籽粒中心,麦谷蛋白大聚体占总蛋白的比例较高,表明籽粒中心的蛋白质发生了更多的聚集。在面粉加水搅拌形成面团过程中,麦谷蛋白颗粒吸水溶胀,麦谷蛋白大聚体含量逐渐下降,表明聚集程度下降;在面团醒发过程中,麦谷蛋白大聚体含量增加,表明麦谷蛋白重新聚集。
综上,麦谷蛋白的聚集、解聚是影响面团黏弹性的主要原因。目前已明确‘5+10’、‘2+12’等麦谷蛋白亚基所形成的麦谷蛋白大聚体含量较高,颗粒体积较大,即聚集程度较高,面团稳定时间较长,面包体积较大等。在更多尺度或层级解析蛋白质的聚集和解聚动态平衡,如蛋白质相互作用层级,对揭示麦谷蛋白大聚体在小麦面团制造过程中的变化机理,面筋形成、面团黏弹性变化等都将有重要的指导意义。
[1] DELCOUR J A,JOYE I J,PAREYT B,et al.Wheat gluten functionality as a quality determinant in cereal-based food products[J].Annual Review of Food Science &Technology,2012,3(1):469.
[2] WANG X,APPELS R,ZHANG X,et al.Proteintransitions in and out of the dough matrix in wheat flour mixing[J].Food Chemistry,2017,217:542-551.
[3] 张莹莹,陈园园,郭兴凤.面制品制作过程中蛋白质的行为及作用[J].粮食加工,2019,44(1):9-14.ZHANG Y Y,CHEN Y Y,GUO X F.Behavior and role of protein in flour production[J].Grain processing,2019,44(1):9-14.
[4] 杨钏,乔文臣,张影全,等.小麦面粉蛋白质特性和面团流变学特性的关系[J].食品安全质量检测学报,2020,11(12):4075-4082.YANG C,QIAO W C,ZHANG Y Q,et al.Relationship between protein properties of wheat flour and rheological properties of dough[J].Journal of Food Safety and Quality,2020,11(12):4075-4082.
[5] SNYDER H.The proteins of the wheat kernel[J].Science,1907,26:865-865.
[6] SOUTHAN M,MACRITCHIE F.Molecular weight distribution of wheat proteins[J].Cereal Chemistry,1999,76(6):827-836.
[7] WUJUN M A,ZITONG Y U,SHE M,et al.Wheat gluten protein and its impacts on wheat processing quality[J].Frontiers of Agricultural Science and Engineering,2019,6(3):279-287.
[8] 李芳,张影全,李明,等.小麦面筋形成及其理化特性影响因素研究进展[J].中国食品学报,2019,19(11):284-291.LI F,ZHANG Y Q,LI M,et al.Research progress on gluten formation and influencing factors of wheat physiochemical properties[J].Chinese Journal of Food Science,2019,19(11):284-291.
[9] WIESER H.Chemistry of gluten proteins[J].Food Microbiology,2007,24(2):115-1193.
[10] 刘鸿飞,张波,张影全,等.基因、灌溉和贮藏对小麦蛋白质理化特性影响的研究进展[J].中国粮油学报,2021,36(11):1-9.LIU H F,ZHANG B,ZHANG Y Q,et al.Research progress on effects of gene,irrigation and storage on protein physicochemical properties of wheat[J].Chinese Journal of Cereals and Oils,2021,36(11):1-9.
[11] HADNADEV M,DAPCEVIC H T,POJIC M,et al.Changes in the rheological properties of wheat dough during short-term storage of wheat[J].Sci Food Agric,2015,95(3):569-575.
[12] RAO V S,VAKIL U K,SREENIVASAN A.Comparative studies on physicochemical and baking properties of newly harvested and stored indian varieties of wheat[J].Journal of the Science of Food &Agriculture,2010,29(2):155-164.
[13] YUE Y,LIU X,WANG J,et al.Change in physicochemical characteristics and molecular weight distribution of glutenin macropolymer induced by postharvest wheat maturation[J].Quality Assurance and Safety of Crops &Foods,2019,11(8):789-798.
[14] GONZÁLEZ-TORRALBA J,ARAZURI S,JARÉN C,et al.Influence of temperature and r.h.during storage on wheat bread making quality[J].Journal of Stored Products Research,2013,55:134-144.
[15] AHMED M.Effect of storage temperature and periods on some characteristics of wheat flour quality[J].Food &Nutrition Sciences,2015,6(12):1148-1159.
[16] KARAO LU M M,AYDENIZ M,KOTANCILAR H G,et al.A comparison of the functional characteristics of wheat stored as grain with wheat stored in spike form[J].International Journal of Food Science&Technology,2010,45(1):38-47.
LU M M,AYDENIZ M,KOTANCILAR H G,et al.A comparison of the functional characteristics of wheat stored as grain with wheat stored in spike form[J].International Journal of Food Science&Technology,2010,45(1):38-47.
[17] LANCELOT E,FONTAINE J,GRUA-PRIOL J,et al.Effect of long-term storage conditions on wheat flour and bread baking properties[J].Food Chemistry,2021,346(1):128902.
[18] WANG R,LIU L,GUO Y,et al.Effects of deterioration and mildewing on the quality of wheat seeds with different moisture contents during storage[J].RSC Advances,2020,10:14581-14594.
[19] KARAO LU M M.Dough characteristics of wheat flour milled from wheat grains stored in spike form[J].International Journal of Food Science &Technology,2011,46(9):1905-1911.
LU M M.Dough characteristics of wheat flour milled from wheat grains stored in spike form[J].International Journal of Food Science &Technology,2011,46(9):1905-1911.
[20] 代美瑶,巩艳菲,李芳,等.小麦籽粒不同部位蛋白质理化特性研究进展[J].中国粮油学报,2019,34(7):132-138.DAI M Y,GONG Y F,LI F,et al.Research progress on physicochemical properties of proteins in different parts of wheat grain[J].Journal of the China Cereals and Oils Society,2019,34(7):132-138.
[21] LIU Y,OHM J B,HARELAND G,et al.Sulfur,protein size distribution,and free amino acids in flour mill streams and their relationship to dough rheology and breadmaking traits[J].Cereal Chemistry,2011,88(2):109-116.
[22] DAI M,ZHANG Y,PAN W,et al..Physicochemical properties of protein from pearling fractions of wheat kernels[J].Cereal Chemistry,2020,97(5):1084-1092.
[23] SUTTON K H,SIMMONS L D.Molecular level protein composition of flour mill streams from a pilot-scale flour mill and its relationship to product quality[J].Cereal Chemistry Journal,2006,83(1):52-56.
[24] POJI M M,SPASOJEVI N B,ATLAS M.Chemometric approach to characterization of flour mill streams:Chemical and rheological properties[J].Food&Bioprocess Technology,2014,7(5):1298-1309.
[25] SAKHARE S D,INDRANI D,INAMDAR A A,et al.Chemical,rheological and bread making characteristics of bran duster flours from roller flourmills[J].Journal of Food Science &Technology,2014,51(10):2699-2705.
[26] 田建珍,温纪平.小麦加工工艺与设备[M].北京:科学出版社,2011:18-22.TIAN J Z,WEN J P.Wheat processing technology and equipment[M].Beijing:Science Press,2011:18-22.
[27] FANG L,ZHANG Y Q,MING L,et al.The impact of extrusion parameters on the glutenin macropolymer content of flour-water dough[J].Journal of Cereal Science,2019,90:102849.
[28] AUSSENAC T,CARCELLER J L,KLEIBER D.Changes in SDS solubility of glutenin polymers during dough mixing and resting[J].Cereal Chemistry,2001,78(1):39-45.
[29] DON C,LICHTENDONK W J,PLIJTER J J,et al.Understanding the link between GMP and dough:From glutenin particles in flour towards developed dough[J].Journal of Cereal Science,2003,38(2):157-165.
[30] YANG Y,GUAN E,ZHANG T,et al.Influence of water addition methods on water mobility characterization and rheological properties of wheat flour dough[J].Journal of Cereal Science,2019,89:102791.
[31] BERSTED B H,ANDERSON T G.Influence of molecular weight and molecular weight distribution on the tensile properties of amorphous polymers[J].Journal of Applied Polymer Science,1990,39(3):499-514.
[32] BUECHE F.Mechanical degradation of high polymers[J].Journal of Applied Polymer Science,2010,4(10):101-106.
[33] LI F,ZHANG Y,GUO B,et al.The mesoscopic structure in wheat flour dough development[J].Journal of Cereal Science,2020,95:103087.
[34] FENG Y L,ZHANG H J,WANG J,et al.Dynamic changes in glutenin macropolymer during different dough mixing and resting processes[J].Molecules,2021,26(3):541.
[35] 王灵昭,陆启玉.面筋蛋白组分在制面过程中的变化及与面条质地差异的关系[J].河南工业大学学报:自然科学版,2005,26(1):11-14.WANG L Z,LU Q Y.Changes of gluten protein components in noodle preparation and its relationship with texture difference of noodles [J].Journal of Henan University of Technology:Natural Science Edition,2005,26(1):11-14.
[36] CHEN J,WANG L,LÜ Y,et al.Effect of resting time on moisture distribution and glutenin macropolymer of stewed noodles dough[J].Journal of Chinese Institute of Food Science and Technology,2018,18(6):167-173.
[37] WANG X Y,GUO X N,ZHU K X.Polymerization of wheat gluten and the changes of glutenin macropolymer(GMP)during the production of Chinese steamed bread[J].Food Chemistry,2016,201:275-283.
[38] WEEGELS P L,HAMER R J,SCHOFIELD J D.Depolymerisation and Re -polymerisation of wheat glutenin during dough processing.II.changes in composition[J].Journal of Cereal Science,1997,25(2):155-163.
[39] FERRER E G,BOSCH A,YANTORNO O,et al.A spectroscopy approach for the study of the interactions of bioactive vanadium species with bovine serum albumin[J].Bioorg Med Chem,2008,16(7):3878-3886.
[40] BELTON P S.New approaches to study the molecular basis of the mechanical properties of gluten[J].Journal of Cereal Science,2005,41(2):203-211.
[41] GEORGET D M,BELTON P S.Effects of temperature and water content on the secondary structure of wheat gluten studied by FTIR spectroscopy [J].Biomacromolecules,2006,7(2):469.
[42] DON C,LICHTENDONK W J,PLIJTER J J,et al.The effect of mixing on glutenin particle properties:Aggregation factors that affect gluten function in dough[J].Journal of Cereal Science,2005,41(1):69-83.
[43] DON C.Factors affecting the hyper-aggregation of glutenin particles[D].Wageningen:Wageningen University,2005.
[44] SHEWRY P R,HALFORD N G,TATHAM A S,et al.The high molecular weight subunits of wheat glutenin and their role in determining wheat processing properties[J].Advances in Food &Nutrition Research,2003,45(3):219-302.
[45] SHEWRY P R,POPINEAU Y,LAFIANDRA D,et al.Wheat glutenin subunits and dough elasticity:Findings of the EUROWHEAT project[J].Trends in Food Science &Technology,2000,11(12):433-441.
[46] LAFIANDRA D,D'OVIDIO R,PORCEDDU E,et al.New data supporting high mr glutenin subunit 5 as the determinant of quality differences among the pairs 5+10 vs.2+12[J].Journal of Cereal Science,1993,18(2):197-205.
[47] POPINEAU Y,CORNEC M,LEFEBVRE J,et al.Influence of high M r glutenin subunits on glutenin polymers and rheological properties of glutens and gluten subfractions of near-isogenic lines of wheat Sicco[J].Journal of Cereal Science,1994,19(3):231-241.
[48] 王晓龙.和面过程蛋白质行为对小麦品种面团流变学特性的影响[D].杨凌:西北农林科技大学,2017.WANG X L.Effect of protein behavior during dough mixing on rheological properties of wheat dough[D].Yangling:Northwest A&F University,2017.
[49] DON C,LICHTENDONK W,PLIJTER J J,et al.Glutenin macropolymer:A gel formed by glutenin particles[J].Journal of Cereal Science,2003,37(1):1-7.
[50] BARAK S,MUDGIL D,KHATKAR B S.Relationship of gliadin and glutenin proteins with dough rheology,flour pasting and bread making performance of wheat varieties[J].LWT-Food Science and Technology,2013,51(1):211-217.