山楂(Crataegus pinnatifida Bge.)是原产于中国的蔷薇科山楂属植物,在中国已有1 000 多年的栽培历史,在22 个省份均有分布,目前主要种植区为河北、山东、山西和辽宁等省份[1-2]。山楂营养物质丰富,含有黄酮、黄烷醇、酚酸、果胶、有机酸类等多种营养功效组分,是中国原卫生部公布的“食药同源”果品之一[3-5]。山楂普遍口感较酸,质地偏硬,除少部分用于鲜食和药用外,70%以上的山楂被加工为果丹皮、果片、果糕、果茶等中国传统食品,目前已形成以河北兴隆、天津蓟县、山东青州、山西闻喜县和绛县等地为中心的山楂加工产业集群。
果胶是一种广泛存在于高等植物细胞壁初生壁和中间片层的天然高分子多糖,具有良好的增稠性、凝胶性、稳定性,常作为天然食品添加剂广泛应用于果汁饮料、果冻、果酱、酸奶等食品中[6]。山楂中果胶含量高达近9%,远高于其它果蔬[7]。丰富的果胶含量赋予山楂不同于其它果品的独特加工性能。然而,在实际生产过程中,不同省份主要加工用山楂的加工适宜性并不相同。例如:河北产山楂多加工成果丹皮、果糕、果浆等产品,而山东产山楂多加工成山楂酥片、山楂原浆等产品。有研究指出,果胶含量丰富的山楂适宜加工成罐头、果酱、果丹皮、软糖、山楂果茶等,而较高的果胶含量影响酥片成型、原浆流动及果汁出汁等,给山楂酥片、山楂原浆、山楂汁的加工带来不利影响[8]。
果胶是一类主要由半乳糖醛酸(Galacturonic acid,Gal A)组成的杂多糖,由至少17 种单糖通过20 多种键接方式组成[9]。果胶分子含有同型半乳糖醛酸聚糖(Homogalacturonan,HG)、鼠李半乳糖醛酸聚糖Ⅰ(Rhamngalacturonan-I,RG-I)和鼠李半乳糖醛酸聚糖Ⅱ(RhamngalacturonanⅡ,RGⅡ)3 类主要结构。HG 是果胶的骨架结构,约占果胶结构的65%,是由Gal A 通过α-1,4 糖苷键聚合形成的线性平滑区域。Gal A 的C-6 位会发生甲酯化,C-2 或C-3 位会发生乙酰化。RG-I约占果胶结构的20%~35%,其骨架由Gal A 与鼠李糖(Rhamnose,Rha)组成的二糖重复聚合而成,其中Gal A 残基的C-6 位很难被甲酯化或被侧链基团取代,而20%~80%的Rha 残基在C-4 位带有复杂性不同的中性或酸性低聚糖侧链。RG-II约占果胶结构的10%,是果胶中最为复杂的结构,由至少8 个Gal A 组成骨架结构,侧链由至少12种单糖以超过20 种键接方式组成[10-11]。果胶的性质与化学结构密切相关。酯化度、分子质量、线性度、支化度等参数均会对果胶的理化性质与营养功能造成显著影响[12]。果胶的结构首先取决于来源,推测不同省份主要加工用山楂中的果胶结构可能存在差异,从而导致不同的加工适宜性,而目前尚缺乏相关研究。
本研究选取山东、山西、河北、辽宁等中国主要山楂加工省份的加工用山楂为试验原料,通过对果胶结构的表征和流变学行为分析,揭示不同省份山楂果胶的结构特征与流变特性的差异以及二者之间的相关性,从果胶结构角度为山楂的加工适宜性提出新的见解。
1 材料与方法
1.1 材料与试剂
河北主产山楂由承德瑞泰食品有限公司提供,品种为铁山楂;山东、山西和辽宁主产山楂分别购自潍坊市、运城市和鞍山市当地山楂加工厂,品种分别为大金星、大金星和铁山楂。
α-枯草芽孢杆菌淀粉酶(60.1 U/mg)、淀粉葡萄糖苷酶(420 U/mg)、半乳糖醛酸(Gal A)、葡萄糖(Glu)、半乳糖(Gal)、鼠李糖(Rha)、阿拉伯糖(Ara)和木糖(Xyl)标准品均购于Sigma-Aldrich上海贸易有限公司;其它试剂均为分析纯级,购于国药集团化学试剂有限公司。
1.2 仪器与设备
LG-1.0 真空冷冻干燥机,沈阳航天新阳速冻设备制造有限公司;TENSOR27 傅里叶红外光谱仪(Fourier transform infrared,FT-IR),德 国Bruker 公司;UV1800 紫外-分光光度计,日本岛津公司;PhysicaMCR301 流变仪,奥地利Anton Paar公司;ICS-5000 离子色谱仪,美国Dionex 公司;DAWN HELEOS-II 多角度激光光散射-凝胶色谱联用仪,美国Wyatt 公司;原子力显微镜,韩国Park Systems 公司。
1.3 方法
1.3.1 试验材料预处理 山楂洗净晾干后去核切块,经液氮速冻后粉碎,所得山楂粉储存在-40 ℃冰箱备用。山东、山西、辽宁、河北的山楂粉干重依次为20.81%,20.60%,21.58%,24.42%。测定方法如下:取适量山楂粉于铝盒中,准确记录质量后在105 ℃烘箱中烘干至2 次质量差值低于2 mg,按式(1)计算干重。
式中,M1——干燥后山楂粉及铝盒的质量,g;M2——铝盒质量,g;M3——干燥前山楂粉质量,g。
1.3.2 果胶提取
1.3.2.1 醇不溶性物质(Alcohol -insoluble residue,AIR)参考Mcfeeters 等[13]的方法,稍作修改。100 g 山楂粉与500 mL 95%乙醇混合,经分散机混匀1 min 后浸泡1 h 抽滤。滤渣中加入500 mL 95%乙醇,重复上述步骤2 次,滤渣再加入300 mL 丙酮,混匀1 min 后浸泡30 min,抽滤,滤渣于40 ℃干燥12 h,即得AIR。
1.3.2.2 粗果胶 参考Zhou 等[14]的方法,略作修改。1 g AIR 使用200 mL 90 ℃蒸馏水搅拌提取20 min,冷却后抽滤,滤渣重复提取1 次。合并滤液,蒸馏水透析72 h,冻干后即得粗果胶。
1.3.2.3 酶解处理 参考Zhou 等[14]的方法,使用α-枯草芽孢杆菌淀粉酶和淀粉葡萄糖苷酶处理粗果胶,以除去淀粉对果胶结构造成的影响。0.5 g粗果胶样品与1 000 U α-枯草芽孢杆菌淀粉酶溶解于100 mL 0.08 mol/L pH 6.0 的磷酸缓冲液,65℃下反应1 h,90 ℃灭酶5 min 后,pH 值调至4.3,加入1 000 U 淀粉葡萄糖苷酶,60 ℃下反应1 h,灭酶后冷却至室温,酶解液透析48 h,冻干后即得果胶样品。提取自山东、山西、辽宁和河北的山楂果胶样品分别标记为SDHP、SXHP、LNHP 和HBHP。
1.3.3 酯化度测定 果胶样品的酯化度(Degree of methoxylation,DM)采用FT-IR 法测定[15]。取约1 mg 样品与溴化钾充分研磨混匀后压片扫描。光谱扫描范围4 000~400 cm-1,分辨率为4 cm-1,累积扫描64 次。DM 通过以下公式计算:DM=136.86X+3.987,R2=0.962,其中X 是样品于1 740 cm-1 波长的吸收强度(与C=O 拉伸有关)与1 740 cm-1 波长的吸收强度和1 630~1 600 cm-1(与COO-拉伸有关)的最大吸收强度总和的比值[16]。
1.3.4 半乳糖醛酸测定 采用比色法测定半乳糖醛酸(Gal A)含量[17]。称取约8 mg 样品于50 mL锥形瓶中,准确记录质量。冰浴条件下,加入4 mL浓硫酸,磁力搅拌后逐滴加入2 mL 蒸馏水,混合5 min,再逐滴加入2 mL 蒸馏水,搅拌混合1 h 后定容至10 mL。吸取质量浓度为0,40,80,120,140,160,180,200,220,240 μg/mL Gal A 标准品储存液及水解后待测样品各0.6 mL 于玻璃试管中,冰水浴条件下,加入3.6 mL 0.0125 mol/L 硫酸-四硼酸钠溶液,混匀,100 ℃水浴5 min 后迅速放入冰水浴中冷却,再加入60 μL 3-苯基苯酚溶液混匀,每个样品设置平行空白样品,空白样品加入60 μL 0.5%氢氧化钠溶液代替3-苯基苯酚。所有样品于520 nm 波长处测定吸光度。以Gal A 质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线为y=0.0118x+0.0014,R2=0.995。根据标准曲线计算出待测样品中半乳糖醛酸含量。
1.3.5 中性糖测定 采用离子色谱法测定中性糖含量[18]。称取约10 mg 样品溶解于4 mL 2 mol/L三氟乙酸中,120 ℃水解1 h,冷却后氮气吹干,用蒸馏水定容至10 mL,稀释一定倍数过0.22 μm 滤膜后进样。分析柱为Carbo Pac PA10,流动相为0.2 mol/L 氢氧化钠和1 mol/L 的醋酸钠,流速为1 mL/min,进样体积为10 μL,柱温35 ℃,检测器为脉冲安培检测器。标准品包括Rha、Ara、Gal、Glu、Xyl 用作鉴定和定量的外部标准。
1.3.6 分子质量测定 采用高效液相体积排阻色谱与多角度激光光散射检测器联用(HPSECMALLS)测定果胶样品的分子质量参数[14]。果胶溶液(2 mg/mL)过0.45 μm 滤膜后进样。进样体积为200 μL,流动相为0.1 mol/L 氯化钠,流速为0.5 mL/min,色谱柱为OHpak SB-806M,柱温为40℃。
1.3.7 特性黏度测定 采用乌氏粘度计法于25℃测定果胶样品的特性黏度([η])[16]。使用蒸馏水溶解果胶样品配制成不同质量浓度的溶液(1.0,0.9,0.8,0.7,0.6 mg/mL),记录溶剂及不同质量浓度果胶溶液通过毛细管(直径为0.52 mm)的流出时间。[η]值由Huggins-Kramer 方程计算[19]:
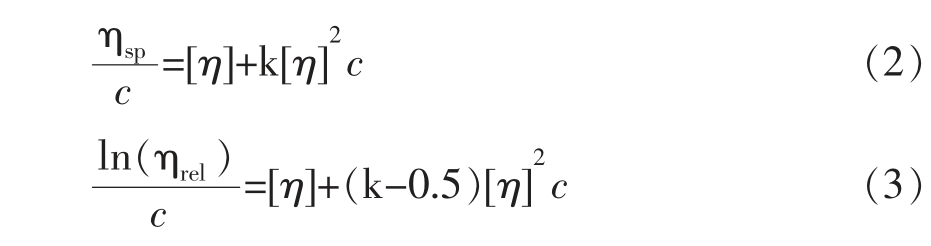
式中,c——果胶溶液的质量浓度,mg/mL;ηsp——比黏度,1;ηrel——相对黏度,1;k——Huggins-Kramer 方程常数。
1.3.8 AFM 扫描 使用蒸馏水配制10 μg/mL 的果胶样品溶液,充分混匀后,吸取10 μL 均匀滴在新切割的云母片表面上,室温下干燥后,进行AFM 扫描观察[16]。
1.3.9 流变学测定 使用蒸馏水配制质量浓度为1%的果胶样品溶液[16]。使用流变仪的稳态剪切模式扫描样品,剪切速率从0.1 s-1 至100 s-1 呈指数增加,温度为25 ℃,转子型号为pp40,直径25 mm,间隙1 mm。
1.4 数据处理与分析
所有测试进行3 次平行试验,结果以平均值±标准差表示。使用SPSS 22 软件对数据进行方差分析,检验方法为Tukey 检验,显著水平P<0.05。图像处理使用Origin 2018 进行绘制。
2 结果与分析
2.1 不同省份主要加工用山楂的果胶含量及酯化度
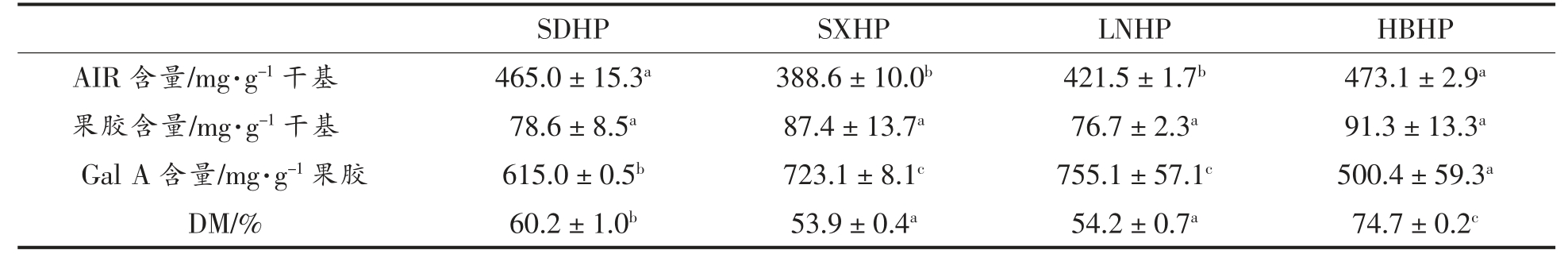
表1 列出了不同省份主要加工用山楂果实中AIR 和果胶的产量以及果胶中Gal A 含量及DM。河北山楂果实中AIR 含量最高,为(473.1 ± 2.9)mg/g 干基,其后依次是山东、辽宁和山西山楂,含量分别为(465.0±15.3),(421.5±1.7)mg/g 干基和(388.6±10.0)mg/g 干基。结果表明,河北山楂与其它山楂相比含有更多的细胞壁成分。不同山楂的果胶含量在76.7~91.3 mg/g 干基之间,差异不显著,含量接近前人报道的山楂果实中果胶含量(9.94%)[7]。
表1 不同省份主要加工用山楂的AIR 和果胶含量及果胶中半乳糖醛酸含量和酯化度
Table 1 Alcohol-insoluble residue(AIR)yield,pectin yield and its galacturonic acid(GalA)contents and degree of methoxylation(DM)of the main processing hawthorn from different provinces
注:同行不同字母表示差异显著(P<0.05)。
4 种山楂中果胶的Gal A 含量范围为500.4~755.1 mg/g 果胶,具有显著性差异。其中HBHP 的Gal A 含量最低,表明HBHP 中HG 结构域的丰度较低。通过果胶和Gal A 含量,可以计算出AIR中Gal A 的含量,SDHP、SXHP、LNHP 和HBHP的AIR 中Gal A 含量分别为104.0,162.6,137.4 mg/g AIR 和96.6 mg/g AIR,此含量显著高于其它来源AIR 中Gal A 的含量,如西兰花、胡萝卜和番茄[20],说明果胶在山楂细胞壁成分中的占比较高。
4 种山楂中果胶的DM 均大于50%,属于高甲氧基果胶,与前人研究结果一致[21-24]。然而,不同果胶样品的DM 存在显著性差异,HBHP 的DM最高,为74.7%,其后依次为SDHP、LNHP 和SXHP,分别为60.2%,54.2%和53.9%。较高的DM值可增强果胶的溶解性和增稠性,在糖作为共溶质的条件下凝胶性更强[6]。因此,HBHP 较高的DM值可能是河北山楂浆料在加工过程中更加黏稠的原因。
2.2 不同省份主要加工用山楂果胶的单糖组成
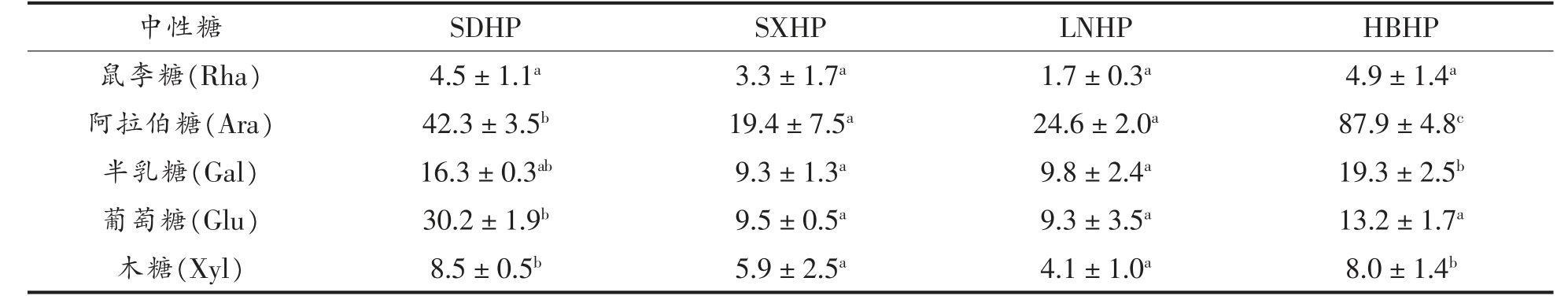
各山楂果胶中Rha、Ara、Gal、Glu 和Xyl 等主要中性糖含量如表2 所示。所有样品中Glu 含量均处在合理水平,说明酶处理去除了样品中非果胶相关的Glu,确保了结果的可靠性。所有样品中性糖含量最高的是Ara,且Gal 的含量也较高。由于果胶RG-I 区的支链主要是由Ara 和Gal 组成,因此所有果胶中都含有一定比例的RG-I 结构。其中,HBHP 的Ara 和Gal 含量最高,尤其是Ara含量远高于其它山楂果胶,表明HBHP 中RG 区域支链最为丰富。
表2 不同省份主要加工用山楂中果胶的中性单糖组成(mg/g 果胶)
Table 2 Neutral sugars composition of pectin from the main processing hawthorn of different provinces(mg/g Pectin)
注:同行不同字母表示差异显著(P<0.05)。
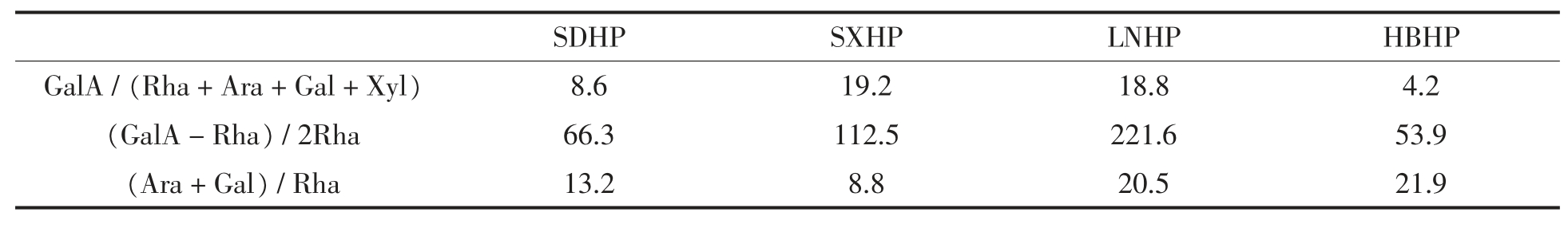
为进一步分析不同山楂果胶的结构,计算得到3 种糖比率,结果如表3 所示。糖比率1(Gal A/Rha+Ara+Gal+Xyl))表征果胶中HG 区域在整体果胶分子中的比重,代表果胶的线性度。由结果可知4 种山楂中果胶的HG 结构比重均处于较高水平,最低值达到4.2,说明山楂果胶普遍线性度较高。相比之下,SXHP 和LNHP 的线性度较高,SDHP 和HBHP 线性程度较低。糖比率2【(Gal A -Rha/2Rha)】表示果胶中HG 结构对RG 结构的比例,样品的糖比率2 范围为53.9~221.6,说明山楂果胶中HG 结构丰度普遍较高,RG 结构丰度较低,与前人结论一致[25]。其中LNHP 中HG 结构比例最高,其后依次为SXHP、SDHP 和HBHP。糖比率3【(Ara+Gal)/Rha】表示RG-I 区域中支链的分支程度,即连接到RG-I 主链上中性糖残基的数量。欧李果胶中该值为5.87[26],咖啡浆果胶为3.3[27],不同品种的苹果果胶在1.1~25 之间[28],柿子果胶为1.28,商业柑橘果胶约为1[29]。与其它原料相比,4 种山楂果胶的该值在8.8~21.9 之间,说明山楂果胶的支链较长。其中HBHP 和LNHP 的糖比率3 的值均高于20,说明它们RG-I 结构的鼠李糖单元上平均连接了至少20 个阿拉伯糖残基或半乳糖残基。丰富的支链有助于果胶分子间的交联与相互作用,在凝胶过程中形成更稳定的网络结构[30]。
表3 不同省份主要加工用山楂果胶的糖比率
Table 3 Sugar ratios of pectin samples from the main processing hawthorn of different provinces
2.3 不同省份主要加工用山楂果胶的分子质量与构象参数
不同省份主要加工用山楂果胶的分子质量参数见表4。所有果胶样品的数均分子质量(Mn)和重均分子质量(Mw)均大于105 g/mol,且存在显著性差异。其中HBHP 的Mw 最大,为9.20×105 g/mol,其余依次是SXHP、LNHP、SDHP,分别为7.85×105,3.92×105,2.86×105 g/mol。各果胶样品的Mn 大小排序虽与Mw 一致,但变化范围小于Mw。Mn 和Mw 的一致顺序导致所有的样品多分散系数(Mw/Mn)无显著性差异,范围是2.85~3.09。
表4 不同省份主要加工用山楂果胶的分子质量与构象参数
Table 4 Molecular weight and conformational parameters of pectin from the main processing hawthorn of different provinces
注:同行不同字母表示差异显著(P<0.05)。
特性黏度([η])是反映聚合物分子在给定溶剂中所占的流体力学体积的关键参数。较高的[η]值表示聚合物具有更加伸展的分子链[19]。给定聚合物的[η]值与分子质量呈正相关关系。因此基于分子质量的大小,HBHP 具有最高的[η]值,SDHP 具有最低的[η] 值。虽然LNHP 的分子质量小于SXHP,但其[η]值更高,这可能是由于LNHP 包含更多的侧链,导致其比SXHP 具有更多的延伸链[31]。
均方回转半径(Rg)是描述聚合物构象的关键参数,表征线性聚合物分子尺寸,Rg 值越高聚合物分子链的尺寸更长。所有果胶样品的Rg 值经HPSEC-MALLS 直接测得,结果见表4。虽然HBHP 具有最大的分子质量,但4 种果胶样品的Rg 值无显著性差异。此结果结合HBHP 最低的Gal A 含量及HG 结构丰度,说明HBHP 的较高分子质量一部分源于其丰富的侧链,其主链相对较短,导致其分子链尺寸与其它果胶样品相似。
流体动力学半径(Rh)是另一个描述聚合物构象的关键参数,由Einsteine-Simha 方程计算得出[32]:
式中,Mw——重均分子质量,g/mol;NA——阿伏伽德罗常数(6.02×1023 mol-1);[η]——特性黏度,dL/g。
4 种山楂果胶的Rh 值存在显著性差异。HBHP 的Rh 值最大,这与其较高的分子质量和支化度有关。Rg 与Rh 的比值能够表征溶液中聚合物形状,用ρ(Rg/Rh)表示。ρ 值与果胶的链结构、构象及多分散性有关,而与分子质量无关[33],ρ 值大于2 表示延伸链(圆柱体),1.5~1.8 则为柔性无规则线圈,0.775 表示为致密球体。4 种山楂果胶的ρ值均大于2,说明所有果胶样品在溶液中是延展且刚性的。尤其SDHP 的ρ 值最大,为4.14,表明SDHP 分子高度延伸。HBHP 的ρ 值最小,为2.15,表明其分子链的延伸程度和刚性不是很强,分子构象更接近于柔性无规则线圈。
2.4 不同省份主要加工用山楂果胶的AFM 图像
通过AFM 观察到的SDHP、SXHP、LNHP 和HBHP 的分子形态见图1。可以观察到SDHP 的分子交联性较差,以线性主链和少量侧链伸展在云母片表面,这与上述的单糖组成、分子质量和构象参数分析得出的SDHP 的结构特征一致。从HBHP 的图像中可观察到由侧链形成的纠缠结构。SXHP 和LNHP 的图像类似,果胶分子均形成了一定量的聚集,这通常是由分子间相互作用所致[19]。SXHP 和LNHP 的DM 相对较低,进而允许更多的未甲基化的Gal A 单元通过氢键相互作用,导致更多的聚集。

图1 不同省份主要加工用山楂果胶分子的原子力显微镜扫描图
Fig.1 AFM images of pectin from the main processing hawthorn of different provinces
2.5 不同省份主要加工用山楂的结构特征总结
以上结果表明山东、山西、辽宁和河北主产加工用山楂中的果胶伸展差别较小,主链长度大致相同,线性度普遍较高,Mw 均大于105 g/mol,结构差异主要源于DM、RG-I 区及其侧链,如图2 所示。HBHP 的DM 最高,RG 区比例最高,支链最长。SDHP 的DM 中等,RG 区比例较高,支链长度中等;SXHP 的DM 与RG 占比均较低,且支链最短;LNHP 的DM 较低,RG 区占比最低,支链较长。
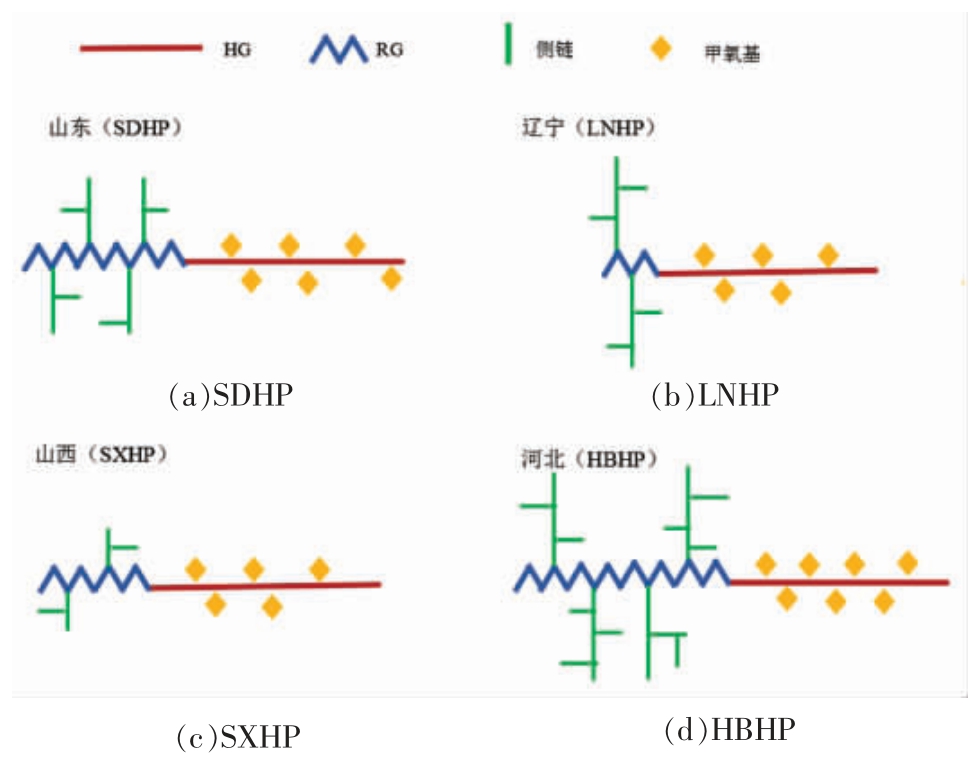
图2 不同省份主要加工用山楂果胶的结构示意图
Fig.2 Schematic diagram of structure features of pectin from the main processing hawthorn of different provinces
2.6 不同省份主要加工用山楂果胶的流动行为
4 种山楂果胶溶液(1%)的流动行为如图3 所示。所有果胶样品溶液均为非牛顿流体,其表观黏度随剪切速率的增加而减小,具有明显的剪切稀化特性。果胶溶液的黏度高度依赖于分子质量,分子质量较大的聚合物会导致流体系统中的有效体积分数增加,从而获得更高的黏度[34]。由于HBHP的分子质量最高,故其溶液的表观黏度也明显高于其它3 种果胶溶液。然而,与HBHP 分子质量无显著性差异的SXHP 的黏度却明显低于HBHP,说明HBHP 丰富的侧链也是导致高黏度的原因。近期研究表明去除支链后果胶的表观黏度明显下降。高度支化的果胶中存在更多的分子链缠结,从而限制了果胶链的运动[30,35]。然而,HBHP 溶液剪切稀化现象明显强于与其它3 种果胶溶液。这可能是由于随着剪切力的增加HBHP 分子链的缠结被破坏,导致HBHP 分子在剪切流场中逐渐解聚并沿剪切力方向重新移动[36-37]。虽然SXHP 的分子质量高于SDHP 和LNHP,但因侧链含量较低使其没有表现出比二者更高的黏度。相比之下,虽然LNHP 的分子质量比SXHP 小,但其侧链较长使其黏度与SXHP 相当。对于SDHP 来说,其RG-I 区比例相对较高且侧链含量合理均利于提高黏度。
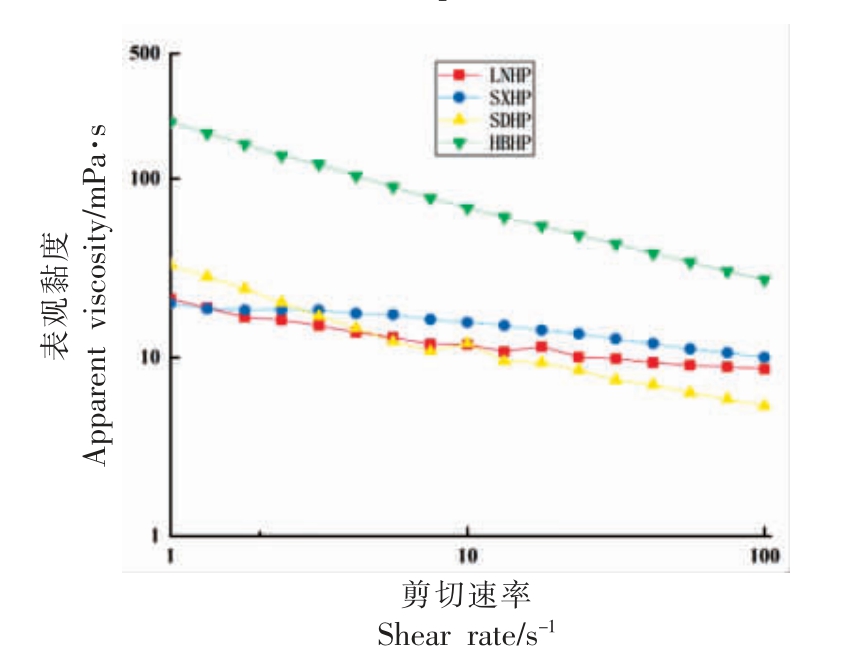
图3 不同省份主要加工用山楂果胶的稳态剪切流动曲线
Fig.3 Steady state shear flow curves of hawthorn pectin used for processing in different provinces
3 结论
本研究为分析中国不同省份主要加工用山楂的不同加工适应性,对山东、山西、辽宁和河北山楂中的果胶进行了全面的结构表征和流变学分析。结果表明,4 种山楂的果胶含量虽不存在显著性差异,但果胶结构在DM、MW、线性度、分支度侧链的长度等方面却呈现出差异化特征,从而导致不同的流变特性。HBHP 溶液具有最高的黏度,因其结构具有以下4 个特点:高DM、高MW、高RG-I 区的占比和较长的侧链。其它3 种果胶样品(SDHP、SXHP 和LNHP)只具有上述结构特征中的一种或两种,所以其溶液黏度明显低于HBHP溶液。本研究结果有助于深入理解山楂果胶的结构与特性的关系,并从果胶结构角度为不同省份主要加工用山楂的加工适宜性差异提供了新的见解。
[1] 李志武.山楂的经济价值及其初加工利用[J].农产品加工,2014(10):28-29.LI Z W.The economic value of hawthorn and its primary processing and utilization[J].Farm Products Processing,2014(10):28-29.
[2] GUO T J,JIAO P J.Hawthorn(Crataegus)resources in China[J].HortScience:A Publication of the American Society for Horticultural Science,1995,30(6):1132-1134.
[3] LIU P Z,YANG B R,KALLIO H.Characterization of phenolic compounds in Chinese hawthorn(Crataegus pinnatifida Bge.var.major)fruit by high performance liquid chromatography-electrospray ionization mass spectrometry[J].Food Chemistry,2010,121(4):1188-1197.
[4] 姚园,崔丽贤,刘素稳,等.山楂功能成分及加工研究进展[J].食品研究与开发,2017(15):211-215.YAO Y,CUI L X,LIU S W,et al.Research progress on functional components and processing of hawthorn[J].Food Research and Development,2017(15):211-215.
[5] 刘武.山楂的营养化学成分及保健作用[J].食品研究与开发,2002,23(5):65-66.LIU W.The nutritional chemical composition and health effects of hawthorn[J].Food Research and Development,2002,23(5):65-66.
[6] CHAN S Y,CHOO W S,YOUNG D J,et al.Pectin as a rheology modifier:Origin,structure,commercial production and rheology[J].Carbohydrate Polymers,2017,161:118-139.
[7] CHEN X W,QI Y J,ZHU C H,et al.Effect of ultrasound on the properties and antioxidant activity of hawthorn pectin[J].International Journal of Biological Macromolecules,2019,131:273-281.
[8] 于铭章.果胶对山楂加工的影响[J].河北林果研究,2009,24(3):309-310,323.YU M Z.The effects of pectin on hawthorn processing[J].Forestry and Ecological Sciences,2009,24(3):309-310,323.
[9] VORAGEN A,COENEN G J,VERHOEF R P,et al.Pectin,a versatile polysaccharide present in plant cell walls[J].Structural Chemistry,2009,20(2):263-275.
[10] O'NEILL M A,ISHII T,ALBERSHEIM P,et al.Rhamnogalacturonan II:Structure and function of a borate cross-linked cell wall pectic polysaccharide[J].Annual Review of Plant Biology,2004,55(1):109-139.
[11] 谢明勇,李精,聂少平.果胶研究与应用进展[J].中国食品学报,2013,13(8):1-14.XIE M Y,LI J,NIE S P.A review about the research and applications of pectin[J].Journal of Chinese Institute of Food Science and Technology,2013,13(8):1-14.
[12] CHRISTIAENS S,VAN B S,HOUBEN K,et al.Process -Structure -Function relations of pectin in food[J].C R C Critical Reviews in Food Technology,2016,56(6):1021-1042.
[13] MCFEETERS R F,ARMSTRONG S A.Measurement of pectin methylation in plant cell walls[J].Analytical Biochemistry,1984,139(1):212-217.
[14] ZHOU M,BI J F,LV J et al.Structural conversion of pectin fractions during heat processing in relation to the ability of inhibiting lipid digestion:A case study of hawthorn pectin[J].Food Hydrocolloids,2021,117(6):106721.
[15] PARK J K,KHAN T,JUNG J Y.Structural studies of the glucuronic acid oligomers produced by Gluconacetobacter hansenii strain [J].Carbohydrate Polymers,2006,63(4):482-486.
[16] ZHOU M,BI J F,CHEN J X,et al.Impact of pectin characteristics on lipid digestion under simulated gastrointestinal conditions:Comparison of water-soluble pectins extracted from different sources[J].Food Hydrocolloids,2020,112:106350.
[17] BLUMENKRANTZ N,ASBOE -HANSEN G.New method for quantitative determination of uronic acids[J].Analytical Biochemistry,1973,54(2):484-489.
[18] WANG L,ZHAO Z W,ZHAO H Q,et al.Pectin polysaccharide from Flos Magnoliae(Xin Yi,Magnolia biondii Pamp.flower buds):Hot-compressed water extraction,purification and partial structural characterization[J].Food Hydrocolloids,2022,122:107061.
[19] ZHANG H,NIE S P,GUO Q B,et al.Conformational properties of a bioactive polysaccharide from Ganoderma atrum by light scattering and molecular modeling[J].Food Hydrocolloids,2018,84:16-25.
[20] HOUBEN K,JOLIE R P,FRAEYE I,et al.Comparative study of the cell wall composition of broccoli,carrot,and tomato:Structural characterization of the extractable pectins and hemicelluloses[J].Carbohydrate Research,2011,346(9):1105-1111.
[21] 吴瞻邑,刘素稳,崔丽贤,等.酸提山楂果胶理化特性及抗氧化性[J].食品工业科技,2018,39(18):1-5,11.WU Z Y,LIU S W,CUI L X,et al.The physicochemical properties and antioxidation of hawthorn pectin by hydrochloric acid extraction[J].Science and Technology of Food Industry,2018,39(18):1-5,11.
[22] 张鑫雨.山楂果胶的体外抗氧化和抗糖基化活性及其应用研究[D].沈阳:辽宁大学,2019.ZHANG X Y.Antioxidant and antiglycation activities of hawthorn pectin in vitro and applied research[D].Shenyang:Liaoning University,2019.
[23] 侯玉婷,苏金芳,陈诗悦,等.不同方法提取的山楂果胶理化性质及体外抗糖化活性的对比[J].现代食品科技,2018,34(4):159-166.HOU Y T,SU J F,CHEN S Y,et al.Effects of different extraction methods on physicochemical properties and anti-glycation activity of pectin extracted from hawthorn[J].Modern Food Science and Technology,2018,34(4):159-166.
[24] 方园,崔楠,代银银,等.制备方法对山楂果胶理化特性的影响[J].食品科学,2021,42(11):130-136.FANG Y,CUI N,DAI Y Y,et al.Effect of preparation methods on physicochemical properties of hawthorn pectin[J].Food Science,2021,42(11):130-136.
[25] GUO Q B,DU J H,JIANG Y,et al.Pectic polysaccharides from hawthorn:Physicochemical and partial structural characterization[J].Food Hydrocolloids,2019,90:146-153.
[26] ZHANG S K,HE Z Y,CHENG Y,et al.Physicochemical characterization and emulsifying properties evaluation of RG-I enriched pectic polysaccharides from Cerasus humilis[J].Carbohydrate Polymers,2021,260(14):117824.
[27] RCEICHEMBACH L H,PETKOWICZ C.Extraction and characterization of a pectin from coffee(Coffea arabica L.)pulp with gelling properties[J].Carbohydrate Polymers,2020,245:116473.
[28] CALVETE -TORRE I,MUNOZ -ALMAGRO N,PACHECO M T,et al.Apple pomaces derived from mono-varietal Asturian ciders production are potential source of pectins with appealing functional properties[J].Carbohydrate Polymers,2021,264:117980.
[29] 许钰桦.柿子皮果胶的提取及其乳化特性研究[D].泰安:山东农业大学,2020.XU Y Y.Extraction and emulsifying properties of pectin from persimmon peel[D].Taian:Shandong Agricultural University,2020.
[30] ZHENG J Q,CHEN J L,ZHANG H,et al.Gelling mechanism of RG-I enriched citrus pectin:Role of arabinose side-chains in cation-and acidinduced gelation[J].Food Hydrocolloids,2019,101:105536.
[31] PETROVA A A,KOZLOVA L V,GAIFULLINA I Z,et al.AFM analysis reveals polymorphism of purified flax rhamnogalacturonans I of distinct functional types [J].Carbohydrate Polymers,2019,216:238-246.
[32] FISHMAN M L,CHAU H K,QI P X,et al.Characterization of the global structure of low methoxyl pectin in solution[J].Food Hydrocolloids,2015,46:153-159.
[33] QIU W Y,WU D,WANG M,et al.Effect of ultrasonic intensity on the conformational changes in citrus pectin under ultrasonic processing [J].Food Chemistry,2019,297:125021.1-125021.10.
[34] MCCLEMENT D J.Comments on viscosity enhancement and depletion flocculation by polysaccharides[J].Food Hydrocolloids,2000,14(2):173-177.
[35] SOUSA A G,NIELSEN H L,ARMAGAN I,et al.The impact of rhamnogalacturonan -I side chain monosaccharides on the rheological properties of citrus pectin[J].Food Hydrocolloids,2015,47:130-139.
[36] WANG S N,ZHAO L L,LI Q H,et al.Rheological properties and chain conformation of soy hull water-soluble polysaccharide fractions obtained by gradient alcohol precipitation[J].Food Hydrocolloids,2019,91:34-39.
[37] BERNAERTS T M M,KYOMUGASHO C,VAN L N,et al.Molecular and rheological characterization of different cell wall fractions of Porphyridium cruentum[J].Carbohydrate Polymers:Scientific and Technological Aspects of Industrially Important Polysaccharides,2018,195:542-550.