曲霉属在自然界分布极广,广泛应用于传统酿造业、现代发酵业及生物工程研究中,具有重要的经济意义[1]。该属是引起多种物质霉腐的主要微生物之一,会产生有毒次级代谢物,如赭曲霉毒素,污染食品、饲料及中药,严重危害动物及人类健康[2-3]。作为重要的发酵工业菌属,黑曲霉能导致水分较高的粮食霉变。食品行业一般通过筛选谷物产品中是否存在这类真菌,并使用抗生素抑制其生长,防止食品腐败[4]。然而,食品中残留的抗生素会导致人体耐药性增加,这在很大程度上限制了临床治疗的选择,严重影响人类健康[5]。亟待开发具有生物降解性的新型无毒、高效的抗菌剂,以保障食品品质和保护人类健康。
壳寡糖(COS)是壳聚糖的降解产物,是由2~20 个氨基葡萄糖通过β-1,4 糖苷键链接而成的寡聚糖,具有良好的水溶性及生物活性,在食品、医药、农业等领域有广泛的应用前景[6]。刘芳等[7]研究发现COS 对原料乳中细菌总数和嗜冷菌数均有显著的抑制作用,且COS 的浓度和抑菌效果呈正相关,进一步验证了抗菌活性与COS 氨基含量和氨基质子化密切相关。Plascencia 等[8]研究认为壳聚糖能够提高几丁质酶的活性,影响细胞壁的形成,并且可以聚集孢子,造成细胞形态异常,胞内物质渗漏,甚至导致微生物死亡。此外,COS 溶解性好、易于吸收,可作为生物保鲜剂应用于医药、食品及化妆品等领域,并且有降血脂、抗衰老、提高免疫力等功效,被认为是一种潜在的天然抗菌防腐剂[9-10]。
COS 是一种具有生物活性的壳聚糖低聚物,有潜力作为一种天然抗菌防腐剂来改变微生物细胞膜的通透性,并影响微生物的生长和存活。目前,COS 对腐败真菌的抑制研究还鲜有报道。本实验室前期研究发现COS 对黄曲霉和烟曲霉有较好抑制作用[10]。本文通过测定最低抑菌浓度(MIC)、菌丝生长抑制率和孢子萌发抑制率揭示COS 对黑曲霉、赭曲霉和杂色曲霉的抑菌活性,通过观测细胞微观结构、浆膜损伤、细胞膜透性、几丁质含量和活性及可溶性蛋白含量变化来评估细胞壁和细胞膜的完整性,厘清COS 对黑曲霉、赭曲霉和杂色曲霉的抑菌活性及抑菌机制,为COS在食品贮藏领域的开发和应用提供技术参考。
1 材料与方法
1.1 材料与试剂
COS(水分质量分数9.07%,纯度≥90%,聚合度为3~6),济南海得贝海洋生物工程有限公司;菌株(GDMCC 3.386 黑曲霉,GDMCC 3.28 赭曲霉,GDMCC 3.473 杂色曲霉),广东省微生物菌种保藏中心;马铃薯葡萄糖肉汤(PDB),上海博微生物科技有限公司;丙二醛含量测试盒(G0110W),苏州格瑞锐思生物科技有限公司;几丁质酶活性测定试剂盒(BC0820),北京索莱宝科技有限公司;蛋白浓度测定试剂盒(G3522-200T),广州捷倍斯生物科技有限公司。
1.2 设备
BXM-75VE 灭菌锅,上海博讯实业有限公司;HNY-200B 恒温摇床,天津市欧诺有限公司;HP150MJ-B 霉菌培养箱,武汉瑞华有限责任公司;SpectraMax M2e 酶标仪,美国Molecular Devices;EVOLUTION220 紫外光光度计,美国Thermo scientific;Sorvall RC6 plus 离心机,美国赛默飞世尔;S-3000N 扫描电镜,日本日立公司;F-4600 荧光光谱仪,日本日立HITACHI;FV1200 激光共聚焦显微镜,日本Olympus。
1.3 方法
1.3.1 COS 对真菌最小抑菌浓度的测定 通过微量稀释法对COS 的MIC 进行评估。首先取10 g COS 溶于20 mL 的无菌水混合制成COS 溶液,再用二倍稀释法稀释成500~0.24 mg/mL 至96 孔板。制备一排阴性对照(PDB)和一排阳性对照(PDB+真菌),将孔板于28 ℃条件下培养2 d,记录最小抑菌浓度MIC[11]。
1.3.2 COS 对菌丝生长抑制率的测定 先将COS制成MIC、2MIC 浓度的两种COS 溶液,再往含有90 mL 的PDA 培养基中吸取不同浓度的10 mL COS 溶液,每个平板培养基中加入1 块直径为6.00 mm 的菌饼,菌丝体向下,28 ℃培养箱下3 d,测定菌落直径[12],根据下列公式计算菌丝抑制率:

1.3.3 COS 对真菌孢子萌发抑制率的测定 取一支已经活化好的菌种,在无菌条件下,用PDB 溶液制成孢子悬浮液,取凹玻片,滴入45 μL 的菌孢子悬浮液和15 μL 不同浓度的COS,并设置对照。将凹玻片于28 ℃条件下培养2 d,在显微镜下统计100 个孢子[13],根据下列公式计算孢子萌发抑制率:


1.3.4 细胞微观结构的测定 将菌悬液接种于含有MIC 和2MIC 浓度COS 的PDB 培养基中,在180 r/min、28 ℃的条件下培养2 d,收获菌丝体,用蒸馏水洗涤2 次,弃去上清液,真菌菌体沉淀用2.5%戊二醛溶液固定24 h,冷冻干燥,喷金,最后在扫描电镜下观察[14]。
1.3.5 浆膜损伤的测定 将真菌悬液接种于含有MIC 和2MIC 浓度COS 的PDB 培养基中,于180 r/min、28 ℃下培养箱中培养12 h,对照组为未经过COS 处理的样品。收获菌丝体,用蒸馏水洗涤2次,将细胞洗净,弃去上清液,用0.5 mL PBS 重悬,用终质量浓度为1 mg/mL PI 溶液在PBS 中室温黑暗染色30 min,然后用激光共聚焦显微镜观察每个样品[15]。
1.3.6 细胞膜渗透性的测定 将菌悬液接种于含有MIC 和2MIC 浓度COS 的PDB 培养基中,于180 r/min、28 ℃的条件下培养1~2 d,将菌丝在4℃、10 000 r/min 条件下离心20 min,得到上清液,测定其电导率[11]。
1.3.7 核酸泄露值的测定 将菌悬液接种于含有MIC 和2MIC 浓度COS 的PDB 培养基中,在180 r/min、28 ℃的条件下培养2 d。未经COS 处理的样本作为对照组。在4 ℃、10 000 r/min 离心20 min,得到上清液,然后,用紫外分光光度计测定260 nm 时各菌液的吸光值为核酸泄露值[16]。
1.3.8 几丁质含量的测定 将真菌悬液接种于含有MIC 和2MIC 浓度COS 的PDB 培养基中,于180 r/min、28 ℃条件下接种12 h 后,未经过COS处理的样品作为对照。用蒸馏水洗涤2 次,用0.025%刚果红在暗光中染色5 min,样品用荧光光谱仪检测,选择540 nm 激发波长和500~900 nm 发射光谱进行分析[11]。
1.3.9 几丁质酶活性的测定 在无菌条件下,将1 mL 菌悬液直接接种于含有MIC、2MIC 浓度COS 的PDB 培养基中,于180 r/min、28 ℃摇床培养3 d 后,洗涤,收集菌丝,称重。然后研磨至糊状,转入离心管中,8 000 r/min,4 ℃离心25 min,取上清液为所提酶液,用几丁质酶活性测定试剂盒测定。
1.3.10 可溶性蛋白浓度的测定 在无菌条件下,将菌悬液直接接种于含有MIC 和2MIC 浓度COS的PDB 培养基中,于180 r/min、28 ℃的条件下培养2 d,经过滤、冲洗菌丝后,再用磷酸缓冲液(0.2 mo1/L,pH 7.5)冲洗3 次,用滤纸吸干后获得菌丝,再称取0.5 g 菌丝于研钵中,依次加入2 mL磷酸缓冲液和1 g 石英砂在冰浴中将菌丝研磨至糊状,转移至离心管中,不足10 mL 通过添加磷酸缓冲液补足,并于4 ℃,10 000 r/min 条件下离心15 min,未用COS 处理的样本作为对照组,取上清液于-20 ℃冰箱中保存备用,再用蛋白浓度测定试剂盒测定。
1.3.11 数据分析与处理 每组试验重复测定3次,结果表示为:平均值±标准误差。利用Origin 8.5 软件对原始数据进行绘图。
2 结果与分析
2.1 COS 对真菌最小抑菌浓度的影响
最小抑菌浓度(MIC)可用于定量表示抑菌剂的抑菌性能,COS 对3 种真菌的最小抑菌浓度(MIC)见表1。由表可知,COS 对被试菌的MIC 范围在15.6~31.2 mg/mL 之间,COS 对赭曲霉、杂色曲霉的MIC 值为15.6 mg/mL,而对黑曲霉的MIC值为31.2 mg/mL,这与前人的研究结果有相似之处。钱建瑛等[17]研究发现,40 mg/mL 的COS 对大肠杆菌抑菌活性有56%。穆晓丽[18]研究发现COS对米曲霉有抑制作用,COS 质量浓度为12 g/L 时抑菌效果最好。从表1 也可知,COS 质量浓度在32 mg/mL 以上时可以有效的抑制3 种真菌的生长,但3 株腐败真菌对COS 的敏感程度不同,该现象可能与菌株的自身活力有关,即COS 对不同真菌的抑菌效果不同,说明COS 对不同菌种的抑制作用是一致而特异的。
表1 COS 对真菌的最小抑菌浓度(MIC)
Table 1 MICs of COS against fungi
2.2 COS 对菌丝生长抑制率的影响
COS 对不同真菌菌丝生长抑制如表2 所示。由表2 可知,COS 对3 种真菌的菌丝生长均有抑制作用,且COS 对真菌菌丝生长的影响随着COS浓度的增加而逐渐增大,即存在浓度依赖性。当COS 浓度为MIC 时,对3 种真菌菌丝生长抑制率都在30%以上,其中对杂色曲霉的菌丝生长抑制作用最明显,达到40%,原因可能是杂色曲霉的生长活性最弱;当COS 浓度为2MIC 时,对3 种真菌菌丝生长抑制作用明显,抑制率都在55%以上,对黑曲霉菌丝生长抑制率最明显达到82%以上。马增新等[19]也研究发现,COS 对4 种青霉菌菌丝生长均具有抑制作用,且存在浓度依赖性,随浓度的升高抑制作用加强。周国春[20]研究发现,200 μg/mL COS 处理组对交链孢菌丝生长抑制率有7.94%。胡国元等[21]研究得出COS 对烟草赤星病病原菌(链格孢菌)有明显的抑制作用,抑菌率可达到80%以上。顾丽嫱[22]研究发现,COS 浓度对灰霉病菌的抑制作用呈正相关,1 500 mg/L COS 对灰霉病菌菌丝生长的抑制率均在80%以上,菌丝直径明显增粗,间隔变多。臧珉等[23]研究发现,COS浓度增加,抑制率提高,5 g/L COS 对棉花枯萎病菌的抑制率达到20%,对烟草赤星菌菌丝生长的抑制率为14%。
表2 COS 对真菌菌丝生长抑制率
Table 2 Inhibitory rate of COS on hypha growth of fungi

2.3 COS 对真菌孢子萌发抑制率的影响
COS 对3 种真菌孢子萌发影响结果如表3 所示。由表3 可知,COS 对不同真菌孢子萌发的影响不同,当COS 浓度为MIC 时,对3 种真菌孢子均有抑制作用,对杂色曲霉的孢子萌发抑制能力最强,与菌丝生长抑制实验结果相符合。COS 随着浓度的增加对3 种真菌抑制作用稍加明显,当COS浓度为2MIC 时,对这3 种真菌孢子萌发抑制率也都在36%以上,表明2MIC 的COS 能有效地抑制孢子萌发,这可能是菌株经过COS 处理后,引起芽管产生畸形,芽管长度与对照组相比较短,使萌发率下降。COS 对真菌孢子萌发抑制率与菌丝生长抑制率结果类似。马增新等[19]研究发现,COS对4 种青霉菌孢子萌发均具有抑制作用,且随着COS 浓度的升高,抑制效果逐渐增强。顾丽嫱[22]研究发现,在1 500 mg/L 的质量浓度下,COS 对灰霉病菌的产孢抑制率为83.82%,抑制孢子萌发率达52.97%。周国春[20]研究发现,在50~500 μg/mL 的浓度范围内,COS 对交链孢菌孢子萌发抑制作用强于产孢作用。随着COS 浓度的增大,抑制作用逐渐增强。100 μg/mL COS 处理组的孢子萌发抑制率在50%以上,500 μg/mL COS 处理组对孢子萌发的抑制率达到了100%。本研究中,COS 对孢子萌发的抑制作用要小于对菌丝的抑制作用,这可能是因为孢子和菌丝对COS 的敏感程度不同。
表3 COS 对真菌孢子萌发影响
Table 3 Effects of COS on spore germination of fungi
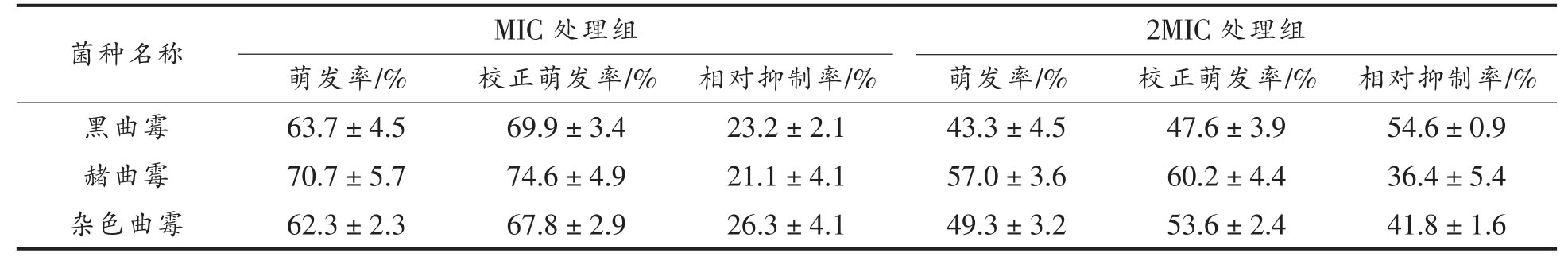
2.4 COS 对真菌细胞微观结构的影响
扫描电镜试验结果如图1 所示,各组供试菌对照组的真菌菌丝形状规则且完整,菌丝饱满且比较均匀一致,对于黑曲霉、杂色曲霉,在COS 浓度为MIC 时,菌丝变得皱缩畸形,干瘪,甚至出现菌丝断裂,出现塌陷现象,在COS 浓度为2MIC时,菌丝表面粗糙有突起,出现菌丝断裂、内容物外渗的现象;对于赭曲霉,在COS 浓度为MIC 和2MIC 时,菌丝表面粗糙有突起,内容物也有外渗的现象。表明COS 对这3 种腐败真菌有明显损伤作用。该结果与周国春[20]的研究结果相似,通过扫描电镜观察到菌丝经过COS 处理后,菌丝干瘪,发生皱缩,且有菌丝断裂现象,表面凹凸不平,菌丝破坏严重,且随着浓度的增大,菌丝的破坏程度増加,这可能是浓度越大,菌丝与COS 的接触机会越多,COS 对菌丝的破坏也就越大。

图1 COS 对真菌细胞微观结构的影响
Fig.1 Effects of COS on the cell microstructure of fungi
2.5 COS 对真菌浆膜损伤的影响
碘化丙啶(Propidium Iodide,PI)可穿过受损的细胞膜进入细胞,并与DNA 特异性结合,发出红色荧光,但无膜通透性,不能透过活细胞膜,只能染死细胞,因此,在荧光显微镜下观察,正常细胞不能着色,坏死细胞呈红色荧光[14]。所以本研究中我们采用的是PI 染色的方法,再通过共聚焦激光扫描显微镜观察真菌细胞染色后荧光强度来反映COS 对3 种真菌浆膜损伤的影响,结果如图2所示。
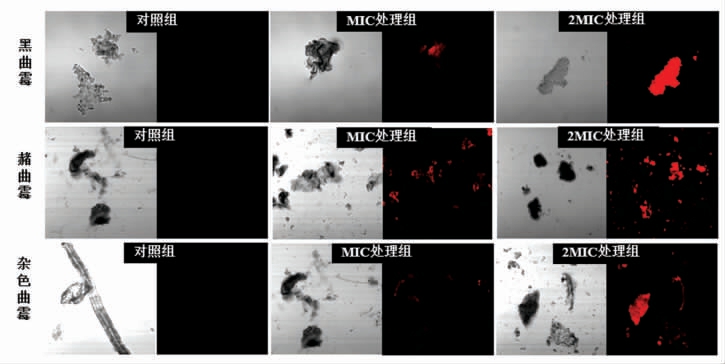
图2 COS 对真菌浆膜损伤的影响
Fig.2 Effects of COS on serosal membrane injury of fungi
由图2 可知,相对于对照组,经COS 处理的3种真菌都能观察到荧光信号,并且可以看到COS浓度为2MIC 的处理组荧光强度明显强于COS 浓度为MIC 的处理组,因此说明COS 对真菌的细胞膜有一定的影响,会破坏细胞膜的完整性,也使得真菌有不同程度的死亡,并呈浓度依赖性,随COS浓度越高,对细胞膜的完整性破坏越严重,菌的死亡率越高。王莹[24]通过激光共聚焦研究发现当50 ku 的壳聚糖进入黑曲霉内部时,细胞膜破坏,与本文研究结果一致。
2.6 COS 对真菌细胞膜渗透性的影响
渗透压决定着细胞内外的水平衡,水能通过半透膜出入细胞,蔗糖与蛋白质等大分子则不能通过,因此可以通过测定溶液电导率的变化来了解细胞膜渗透性的变化[15]。COS 作用于3 种真菌后电导率的变化结果如表4 所示,由表可知,经COS 处理后,各组腐败真菌培养液的电导率均升高,且处理组溶液的电导率随COS 浓度的增大而增大,其中黑曲霉组由0.10 ms/cm 升高至0.98 ms/cm,赭曲霉组由0.04 ms/cm 升高至0.52 ms/cm,杂色曲霉组由0.12 ms/cm 升高至0.59 ms/cm,相比较而言,黑曲霉的变化最明显。上述试验结果表明,COS 对真菌的细胞膜渗透性有作用,提高了细胞膜通透性,菌丝体内部的一些重要离子如钾离子和钠离子会泄漏,外渗进入到培养液中,更多的小分子,如电解质被释放[25],这些离子的流失会影响细胞内多种生物酶的合成和工作,使细胞的代谢活动受阻,此外,离子的流失也会影响细胞内外渗透压,使细胞破裂,最终导致菌体死亡[26]。Liu等[27]研究也发现壳聚糖的抑菌作用是通过增加菌膜的通透性,导致胞内物质外渗实现的。对于黄曲霉,经MIC 及2MICCOS 溶液处理后,电导率与对照组相差较大,电导率的增加更为显著,即COS易导致黄曲霉细胞内成分的泄漏,可能是抗菌成分与胞质膜相互作用所致[28]。这3 种真菌的电导率改变不一样可能与同一COS 处理时不同成分和细胞膜结合位点的作用有关[29]。
表4 COS 对真菌电导率的影响
Table 4 Effects of COS on the electrical conductivity of fungi
注:同一行不同字母表示有显著差异(P<0.05)。
2.7 COS 对真菌核酸泄露值的影响
细胞膜是多数抑菌剂的作用位点,抑菌剂与细菌细胞膜相互作用导致细胞膜的功能发生改变,通过测定260 nm 处的吸光度值,可以对COS对真菌的细胞膜的通透性进行推测[12]。在260 nm下,通过测定不同溶度的COS 溶液处理后的真菌菌液的吸光值,了解COS 溶液对真菌核酸泄露的影响,吸光值越大说明核酸泄露越多。
COS 对3 种真菌核酸泄露的影响结果如表5所示。从表5 可以看出,与对照组相比,COS 浓度为MIC、2MIC 的处理组菌液吸光值都增大了,其中,当COS 浓度为MIC 时,黑曲霉、赭曲霉、杂色曲霉菌液吸光度值分别增大了0.149,0.084,0.110,当COS 浓度为2MIC 时,黑曲霉、赭曲霉、杂色曲霉菌液吸光度值分别增大了0.242,0.124,0.183,即菌液的吸光值与COS 浓度成正比。吸光度增大可能原因是加入多糖后,可以增加菌体细胞膜的通透性,导致细胞溶出物显著增加,对膜结构造成不可修复的伤害,多糖浓度越高,伤害越大[30]。有研究表明,壳聚糖的低聚物能进入大肠杆菌内部[24],壳聚糖存在的大量阳离子基团NH3+能够与菌外膜上带负电的脂多糖、磷脂、脂蛋白等反应,进而改变外膜的结构使得外膜的通透性增加[12]。
表5 COS 对真菌核酸泄露的影响
Table 5 Effects of COS on nucleic acid leakage of fungi

注:同一行不同字母表示有显著差异(P<0.05)。
2.8 COS 对真菌几丁质含量的影响
几丁质是真菌细胞质的重要组成部分,对维持细胞壁结构的完整性有重要作用,在正常情况下,几丁质的组成和降解过程是在动态平衡下进行的,这种平衡的紊乱会导致细胞死亡[5]。COS 对真菌几丁质含量的影响结果如图3,由图3 可知,当黑曲霉、赭曲霉、杂色曲霉经过MIC 浓度的COS 处理后,与对照组相比,其几丁质含量分别下降了56.87%,56.34%和39.55%,当COS 的浓度为2MIC 时,跟对照组相比,几丁质含量分别下降了88.12%,81.54%和84.03%,结果表明,不同浓度的COS 对真菌的几丁质含量有显著的抑制作用,并且几丁质含量呈浓度依赖性下降,推测可能原因是,COS 破坏了真菌的几丁质组成和降解过程的动态平衡,对细胞壁结构的完整性有破坏作用,产生紊乱并导致真菌细胞的死亡。

图3 COS 对真菌几丁质的影响
Fig.3 Effect of COS on fungi chitin
2.9 COS 对真菌几丁质酶活性的影响
几丁质酶能够催化细胞壁中的几丁质水解为几丁寡糖,破坏细胞器,从而抑制真菌的生长[12]。通过测定COS 处理的几种真菌培养液中几丁质酶活性可以推测COS 对真菌的抑菌方式。本试验测定了菌体胞内的几丁质酶活性,不同浓度COS对真菌几丁质酶活性结果如图4 所示。
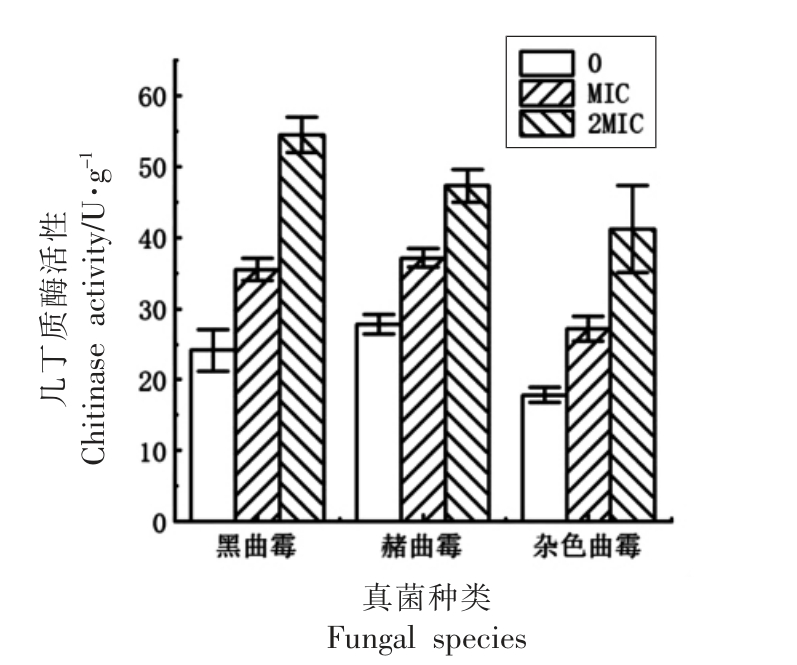
图4 COS 对真菌几丁质酶活性的影响
Fig.4 Effect of COS on chitinase activity of fungi
由图4 可以看出,与对照组相比,这3 种腐败真菌经COS 处理后其菌体胞内的几丁质酶活性显著增大,且随着COS 浓度的增加而增大,呈正相关关系。其中经过不同浓度的COS 处理后黑曲霉菌体胞内几丁质酶活性由对照组的24.16 U/g升高到54.49 U/g,赭曲霉由对照组的27.82 U/g 升高到47.28 U/g,杂色曲霉由对照组的17.82 U/g 升高到41.20 U/g,黑曲霉、赭曲霉、杂色曲霉在MIC处理后几丁质酶活性较对照组分别增加了46.9%,33.5%,52.6%。研究结果表明,随着COS 浓度的增加,几丁质酶活性增强,促进几丁质酶解,最终导致细胞表皮变薄,阻碍其生长[5]。有研究发现壳聚糖作为几丁质酶的底物,能激活真菌内的几丁质酶的活性,导致细胞变形使其繁殖受阻[24],与本研究结果一致。
2.10 COS 对真菌可溶性蛋白浓度的影响
可溶性蛋白是细胞重要的渗透调节物质和营养物质,其增加和积累能提高细胞的保水能力,对细胞的生命物质及生物膜起到保护作用[16]。本试验分别用0、MIC、2MIC 不同浓度的COS 溶液来处理几种真菌,观察其对真菌可溶性蛋白的影响,结果如图5 所示。
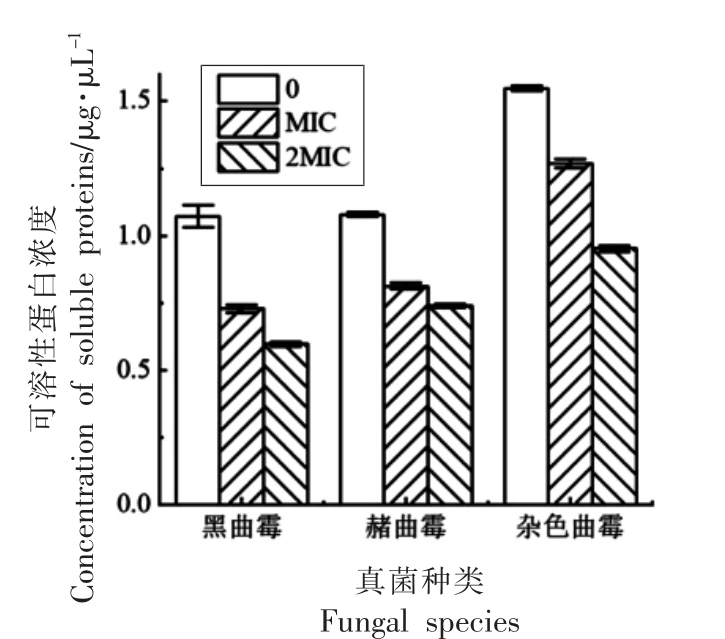
图5 COS 对真菌可溶性蛋白浓度的影响
Fig.5 Effects of COS on the concentration of soluble proteins in fungi
从图5 可以看出,3 种真菌在经过一段时间的培养后,处理组的菌丝蛋白浓度均与对照组不同,经各种浓度的COS 作用的菌丝体之间以及与对照组菌丝体间的可溶性蛋白质含量差异显著。与对照组相比,经COS 处理后真菌菌丝内可溶性蛋白质大量外渗,且COS 浓度越高,外渗量越高,菌丝体内浓度越低,即随COS 浓度的增大,菌丝体内可溶性蛋白浓度呈降低的趋势,其中,经过不同浓度的COS 处理后黑曲霉的可溶性蛋白浓度由对照组的1.07 μg/μL 降低到0.60 μg/μL,赭曲霉由对照组的1.08 μg/μL 降低到0.74 μg/μL,杂色曲霉由对照组的1.55 μg/μL 降低到0.95 μg/μL,黑曲霉、赭曲霉、杂色曲霉MIC 处理组可溶性蛋白浓度较对照组分别降低了32.0%,24.6%,18.1%,2MIC 处理组可溶性蛋白浓度较对照组分别降低了44.4%,31.4%,38.5%。这说明MIC、2MIC 的COS 使得细胞已经破损,使其可溶性蛋白的合成受到影响,或者是因为COS 破坏了菌的细胞膜结构,使可溶性蛋白通过细胞膜渗出,造成3 种真菌菌丝可溶性蛋白质的严重流失。
3 结论
本文探讨了COS 对黑曲霉、赭曲霉、杂色曲霉的抗菌活性及机理。研究得到结论如下:COS 对供试菌的抑菌质量浓度范围在15.6~31.2 mg/mL,COS 处理导致菌丝体变形、膜透性增加、浆膜损伤和细胞质内容物渗漏,COS 还呈剂量依赖性地减少几丁质的产生,增强几丁质酶的活性,并导致可溶性蛋白质大量外渗。这些特性表明COS 可以通过破坏细胞壁和细胞膜以及破坏正常的细胞代谢来抑制食物腐败真菌生长。此外,COS 对人和动物无毒,在食品工业中的应用前景广阔。
[1]姚粟,李辉,程池.23 株曲霉属菌种的形态学复核鉴定研究[J].食品与发酵工业,2006,32(12):37-43.YAO S,LI H,CHENG C.Studies on identification of 23 Aspergillus sp.strains in morphology[J].Food and Fermentation Industries,2006,32(12):37-43.
[2]杨家玲,岳田利,高振鹏,等.赭曲霉毒素A 检测方法的研究进展[J].农产品加工(学刊),2008(6):4-7.YANG J L,YUE T L,GAO Z P,et al.Research advance on the determination methods of Ochratoxin A[J].Academic Periodical of Farm Products Processing,2008(6):4-7.
[3]黄晓静,王少敏,毛丹,等.曲霉属真菌毒素的毒性研究进展[J].食品安全质量检测学报,2017,8(5):1679-1687.HUANG X J,WANG S M,MAO D,et al.Research progress on toxicity of aspergillus mycotoxins[J].Journal of Food Safety &Quality,2017,8(5):1679-1687.
[4]MOON Y S,CHOI W S,PARK E S,et al.Antifungal and antiaflatoxigenic methylenedioxy-containing compounds and piperine -like synthetic compounds[J].Toxins,2016,8(8):240.
[5]YANG Q,WANG J,ZHANG P,et al.In vitro and in vivo antifungal activity and preliminary mechanism of cembratrien -diols against Botrytis cinerea[J].Industrial Crops and Products,2020,154(4):112745.
[6]郑晓杰,何跃,周环,等.壳寡糖-乳酸链球菌素复合物的制备、表征及其抑菌活性研究[J].中国食品学报,2019,19(11):108-115.ZHENG X J,HE Y,ZHOU H,et al.Preparation,characterization and antimicrobial activity of chitosan Oligosaccharide-Nisin Conjugate[J].Journal of Chinese Institute of Food Science and Technology,2019,19(11):108-115.
[7]刘芳,杜鹏,霍贵成,等.壳寡糖对原料乳中微生物抑制作用的研究[J].中国乳品工业,2005,33(6):28-30.LIU F,DU P,HUO G C,et al.Study on inhibitant activities of chitosan oligosaccharide against microbes from milk[J].China Dairy Industry,2005,33(6):28-30.
[8]PLASCENCIA-JATOMEA M,VINIEGRA G,OLAVO R,et al.Effect of chitosan and temperature on spore germination of Aspergillus niger [J].Macromolecular Bioscience,2003,3(10):582-586.
[9]赵倩,谢全喜,徐海燕,等.壳寡糖抑菌性能的研究[J].中国酿造,2021,40(3):44-47.ZHAO Q,XIE Q X,XU H Y,et al.Antibacterial property of oligochitosan[J].China Brewing,2021,40(3):44-47.
[10]YUAN K,BEIBEI D,MIAOMIAO Z,et al.Study on inhibitory activity and mechanism of chitosan oligosaccharides on Aspergillus flavus and Aspergillus fumigatus[J].Carbohydrate Polymers,2022,275(2):118673.
[11]WU T,DAN C,HE M,et al.Antifungal action and inhibitory mechanism of polymethoxylated flavones from Citrus reticulata Blanco peel against Aspergillus niger[J].Food Control,2014,35(1):354-359.
[12]邱苗.壳聚糖对绿芦笋保鲜和抑菌机理的研究[D].杭州:浙江工商大学,2013.QIU M.Effect of chitosan on postharvest green asparagus quality and antimicrobial mechanism against pathogen in vitro[D].Hangzhou:Zhejiang Gongshang University,2013.
[13]周梦娇.桂枝提取物对柑橘采后主要病原真菌抑菌活性的研究[D].南昌:江西农业大学,2014.ZHOU M J.Antifungal effects of Ramulus cinnamomi extracts on the main pathogens of citrus postharvest disease[D].Nanchang:Jiangxi Agricultural University,2014.
[14]ZHANG J,WU X,ZHANG S Q.Antifungal mechanism of antibacterial peptide,ABP -CM4,from Bombyx mori against Aspergillus niger[J].Biotechnology Letters,2008,30(12):2157-2163.
[15]TIAN J,BAN X,ZENG H,et al.The mechanism of antifungal action of essential oil from dill(Anethum graveolens L.)on Aspergillus flavus[J].PloS One,2012,7(1):30147.
[16]刘琼.茼蒿提取物对西瓜枯萎病菌抑菌活性及主要活性成分分析[D].南昌:江西农业大学,2016.LIU Q.Antifungal activity of Chrysanthemum coronarium L extract on watermelon fusarium wilt and its active components[D].Nanchang:Jiangxi Agricultural University,2016.
[17]钱建瑛,丁振中,朱玉霞,等.壳寡糖对大肠杆菌抑菌活性研究[J].工业微生物,2016,46(6):13-19.QIAN J Y,DING Z Z,ZHU Y X,et al.Antibacterial activity of chitosan oligosaccharide on Escherichia coli[J].Industrial Microbiology,2016,46(6):13-19.
[18]穆晓丽.壳寡糖在乳及乳制品中抑菌作用的研究[D].哈尔滨:黑龙江大学,2013.MU X L.Study on antibacterial effect of chitosan oligosaccharides in milk and dairy products [D].Harbin:Heilongjiang University,2013.
[19]马增新,杨玲玉,孟祥红.壳聚糖和壳寡糖对四种青霉病菌生长和病害控制的比较研究[J].食品科学,2011(S1):72-77.MA Z X,YANG L Y,MENG X H.Study on the inhibition of chitosan and oligochitosan against the growth and development of Penicillium[J].Food Science,2011(S1):72-77.
[20]周国春.壳寡糖对番茄果实保鲜机理的研究[D].天津:天津科技大学,2016.ZHOU G C.The study on freshness keeping mechanism of oligochitosan to tomato fruit[D].Tianjin:Tianjin University of Science and Technology,2016.
[21]胡国元,胡坚,李超影,等.壳寡糖对烟草赤星病病原菌的抑制作用[J].武汉工程大学学报,2012(12):4-7.HU G Y,HU J,LI C Y,et al.Inhibition activites of oligochitosan against alternaria alternate of tobacco[J].Journal of Wuhan Institute of Technology,2012(12):4-7.
[22]顾丽嫱.壳寡糖对番茄灰霉病菌的抑制作用[J].江苏农业科学,2014,42(9):115-117.GU L Q.Inhibitory effect of chitosan oligosaccharides on boea cinerea of tomato[J].Jiangsu Agricultural Sciences,2014,42(9):115-117.
[23]臧珉,陈斌.壳寡糖抑菌及抗氧化性的研究[J].中国野生植物资源,2016(6):27-30.ZANG M,CHEN B.Study on the antibacterial activity and antioxidant activity of chitosan oligosaccharide[J].Chinese Wild Plant Resources,2016(6):27-30.
[24]王莹.低聚壳聚糖的制备及抑菌活性的研究[D].大庆:黑龙江八一农垦大学,2012.WANG Y.The preparation and research of the antibacterial activity of chitosan oligosaccharide [D].Daqing:Heilongjiang August First Land Reclamation University,2012.
[25]IS AA C G,PETER V H,EREZ K.From amino acids polymers,antimicrobial peptides,and histones,to their possible role in the pathogenesis of septic shock:a historical perspective[J].Journal of Inflammation Research,2017,10:7-15.
[26]TRAPNELL C,WILLIAMS B A,PERTEA G,et al.Transcript assembly and quantification by RNASeq reveals unannotated transcripts and isoform switching during cell differentiation[J].Nature Biotechnology,2010,28(5):511-515.
[27]LIU H.Chitosan kills bacteria through cell membrane damage[J].International Journal of Food Microbiology,2004,95(2):147-155.
[28]MING K,XI G C,CHENG S L,et al.Antibacterial mechanism of chitosan microspheres in a solid dispersing system against E.coli[J].Colloids and Surfaces B:Biointerfaces,2008,65(2):197-202.
[29]XI T,SHAO Y L,TANG Y J,et al.Antifungal activity of essential oil compounds(geraniol and citral)and inhibitory mechanisms on grain pathogens(Aspergillus flavus and Aspergillus ochraceus)[J].Molecules,2018,23(9):2108.
[30]胡静,赵小慧,朱春玉,等.槐糖脂对金黄色葡萄球菌的抑菌机理[J].食品科学,2012(5):33-36.HU J,ZHAO X H,ZHU C Y,et al.Inhibitory effect and mechanisms of sophorolipids against staphyloccocus aureus[J].Food Science,2012(5):33-36.
[31]徐颖,王斌,姜启兴,等.壳寡糖对酒精诱导的大鼠肠道损伤的干预作用[J].食品科学,2021,42(3):158-164.XU Y,WANG B,JIANG Q X,et al.Intervention effect of chitooligosaccharide on alcohol-induced intestinal damage in rats[J].Food Science,2021,42(3):158-164.
[32]谷新晰,王晨笑,于宏伟,等.壳寡糖对泡菜品质、微生物多样及演替规律的影响[J].中国食品学报,2021,21(10):125-132.GU X X,WANG C X,YU H W,et al.Effects of chitosan oligosaccharides on the quality and microbial diversity of pickles[J].Journal of Chinese Institute of Food Science and Technology,2021,21(10):125-132.