脂肪酶(Triacylglycerol acylhydrolases,EC 3.1.1.3)属于羧基酯水解酶类,作用于酰基甘油的羧酸酯键,可以水解甘油三酯生成脂肪酸和甘油[1-2],广泛应用于食品、化工、医药、皮革等领域。大量研究表明,脂肪酶广泛存在于动物、植物和微生物组织中。与动植物合成脂肪酶相比,微生物合成脂肪酶具有种类丰富,生产成本低,温度和pH 值适应范围广,稳定性高,底物选择性强,有机溶剂耐受度好等优良特点[3]。同时,生产脂肪酶的微生物具有繁殖快、生长周期短且不受季节影响等优点,适合用于工业化生产[4-7]。微生物生产脂肪酶已成为当前市售脂肪酶的主要来源。为满足脂肪酶应用领域的多种消费需求,研究人员主要围绕脂肪酶菌株的挖掘、产酶条件优化、菌株基因改造等方面展开研究。卢鑫[8]将米根霉脂肪酶基因在毕赤酵母中进行表达,添加共表达伴侣蛋白,结果脂肪酶活提高了1.7 倍。钱忠英等[9]利用同源重组方式将疏棉状嗜热丝孢菌脂肪酶基因整合到毕赤酵母中,筛选并纯化得到一个具有高拷贝数转化子的菌株。李牧[10]将嗜麦芽糖寡养单胞菌脂肪酶基因在重组大肠杆菌中进行表达,脂肪酶活较野生菌株提高了3.3 倍。景智波等[11]通过单因素和响应面试验优化培养条件和培养基成分,结果显著提高了乳酸菌脂肪酶活。Abu 等[12]将耐热细菌脂肪酶基因导入毕赤酵母中进行表达,同时利用响应面法对培养基组分进行优化,脂肪酶活提高了3 倍。吴蓉等[13]将南极假丝酵母脂肪酶基因在大肠杆菌中进行表达和发酵优化,脂肪酶活提高了17.7 倍,是目前大肠杆菌生产脂肪酶的较高水平。孙建安[14]利用基因工程和发酵工程技术在枯草芽孢杆菌中高效表达脂肪酶,通过对碳源、氮源等培养基组分以及培养条件进行优化,最终脂肪酶活提高了5.62 倍。
蚜虫莫氏黑粉菌(Moesziomyces aphidis,M.aphidis)是一种能够利用植物油作为单一碳源进行生长繁殖,并且大量合成甘露糖赤藓糖醇脂的菌株[15],其可以高效利用和转化甘油三酯。目前,蚜虫莫氏黑粉菌的研究主要围绕甘露糖赤藓糖醇脂的合成和代谢调控展开,研究发现脂肪酶在合成甘露糖赤藓糖醇脂过程中具有重要作用,而关于其脂肪酶的合成和酶学特性研究基本处于空白[16]。
基于此,本研究以蚜虫莫氏黑粉菌为试验菌株,以脂肪酶活为主要评价指标,进行单因素、Plackett-Burman、最陡爬坡和响应面等试验,对合成脂肪酶的培养基组成和发酵条件进行优化,以期提高脂肪酶产量。本研究旨在拓宽脂肪酶生产菌株来源,挖掘蚜虫莫氏黑粉菌工业化应用潜力,为脂肪酶的分离纯化、酶学性质和应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种 蚜虫莫氏黑粉菌(Moesziomyces aphidis,M.aphidis),本实验室保藏。
1.1.2 培养基
1)活化培养基(g/L)酵母浸粉3.0,麦芽浸粉3.0,葡萄糖10.0,蛋白胨5.0。
2)发酵培养基1(g/L)NaNO3 3.0,MgSO4·7H2O 0.3,KH2PO4 0.3,酵母浸粉1.00,葡萄糖40.0。
3)发酵培养基2(g/L)NaNO3 3.0,MgSO4·7H2O 0.3,KH2PO4 0.3,酵母浸粉1.00,大豆油80.0 mL。
1.1.3 相关试剂 葡萄糖、乳糖、糊精、(NH4)2SO4、NH4NO3、CaSO4、MnSO4、FeSO4、MgSO4 无水乙醇,津市科密欧化学试剂有限公司;麦芽糖、蔗糖、果糖、蛋白胨、胰蛋白胨、牛肉膏均为生化级,北京奥博星生物试剂有限公司;可溶性淀粉、ZnSO4、Fe2(SO4)3、KH2PO4,天津市恒兴化学试剂制造有限公司;橄榄油、阿拉伯胶,迈瑞尔生物试剂有限公司;吐温-20、曲拉通-100 均为化学纯,天津市光复精细化工有限公司;酵母浸粉为化学纯,安琪酵母股份有限公司;CuSO4,西陇化工股份有限公司;吐温-80 化学纯,天津市凯通化学试剂有限公司;磷酸,洛阳昊华化学试剂有限公司;异丙醇,天津市东力化学试剂有限公司;三羟甲基氨基甲烷盐酸盐(Tris-HCL),索莱宝试剂;对硝基苯酚(PNP),阿拉丁试剂;考马斯亮蓝G250,北京鼎国昌盛生物技术有限公司;咪唑啉,麦克林试剂。上述试剂无特别说明均为分析纯。
1.2 仪器与设备
PL1502-S 分析天平,瑞士Mettler Toledo 公司;ZHJH-C1109C 超净工作台,上海智城分析仪器制造有限公司;YXQ-LS 立式压力蒸汽灭菌锅,上海博讯实业有限公司;Vortex-2 Genie 涡旋振荡器,美国Scientific Industries 公司;SevenEasy S20 pH 计,梅特勒-托利多仪器(上海)有限公司;5424 高速离心机,德国Eppendorf 公司;UV-2550紫外分光光度计,日本岛津公司;HH-4 数显恒温水浴锅,上海华燕医疗器械有限公司;ZQZY-C8振荡培养箱,上海知楚仪器有限公司;SPARK 酶标仪,澳大利亚Tecan 公司。
1.3 方法
1.3.1 菌株活化与培养 -80 ℃冰箱中取出液体甘油保存的菌株,取1.00 mL 接种至50.00 mL 活化培养基中(250 mL 锥形瓶),28 ℃、180 r/min 培养48 h。取1.00 mL 活化液接种到50.00 mL 发酵培养基中(250 mL 锥形瓶),28 ℃,180 r/min 培养7 d,获得发酵液。发酵液在12 000 r/min 条件下离心5 min,收集上清液即为胞外粗脂肪酶液,用于测定脂肪酶活和蛋白含量。
1.3.2 脂肪酶活和蛋白含量的测定 脂肪酶活测定以对硝基苯粉棕榈酸酯(p-NPP)为底物,根据Winkler 等[17]和赵敏洁等[18]的方法稍作修改。在2.00 mL 离心管中加入600.0 μL p-NPP 溶液,同时加入适当稀释的粗酶液25.0 μL,空白对照加入等量0.05 mmol/L Tris-HCl pH 8.0 缓冲液,70 ℃水浴反应10 min,500.0 μL 无水乙醇终止反应。12 000 r/min 条件下离心5 min,在410.0 nm 处测定吸光度值。定义:1 min 催化水解底物硝基苯粉棕榈酸酯(p-NPP)生成1 μmol 对硝基苯酚(pNP)所需酶量为1 个酶活单位(U)[19]。蛋白含量测定采用Bradford 方法[20]。
1.3.3 生物量的测定 生物量的测定采用干重法,根据Amal Najjar 等[21]和蔡海莺[22]的方法稍做修改。50.0 mL 离心管称重m1(g),取2.00 mL 发酵液,4 ℃、12 000 r/min 离心5 min,弃上清,保留菌体。用蒸馏水洗涤2 次,60 ℃烘至恒重m2(g),称重并计算生物量Bm(g/L)。
1.3.4 试验设计
1.3.4.1 初始培养基的确定和产酶曲线测定 查阅文献可知,1.1.2 节中的3 种培养基常用于蚜虫莫氏黑粉菌的培养和发酵,测定3 种培养基中的脂肪酶活,选择脂肪酶活最高的培养基作为初始培养基。将蚜虫莫氏黑粉菌接种至初始培养基中发酵144 h,每隔24 h 测定脂肪酶活,获得产酶曲线。
1.3.4.2 单因素实验
1)培养基成分 分别研究碳源、氮源、金属离子、表面活性剂和诱导剂等培养基组分及其添加量对蚜虫莫氏黑粉菌生长和合成脂肪酶的影响,试验方案为:
选取葡萄糖、麦芽糖、乳糖、蔗糖、果糖、可溶性淀粉和糊精等7 种常用碳源,分别添加40.0 g/L,对比菌体生物量和脂肪酶活,明确脂肪酶活最高的碳源种类,进一步研究该碳源添加量对脂肪酶活的影响。
选取NaNO3、酵母浸粉、蛋白胨、胰蛋白胨、(NH4)2SO4、NH4NO3、尿素、牛肉膏等8 种常见氮源,分别添加4.0 g/L,对比菌体生物量和脂肪酶活,明确脂肪酶活最高的氮源种类,进一步研究该氮源添加量对脂肪酶活的影响。
选取Ca2+、Mn2+、Zn2+、Cu2+、Fe2+、Fe3+、Mg2+ 7 种金属离子,均以硫酸盐形式分别按不同浓度添加入发酵培养基中,研究对菌体生长和脂肪酶活的影响。
选取吐温-80、吐温-20、咪唑啉、SDS、TX-100、阿拉伯胶等6 种常用表面活性剂,分别添加0.1%(质量分数),测定菌体生物量和脂肪酶活,明确促进脂肪酶合成的表面活性剂种类,进一步研究该表面活性剂添加量对脂肪酶合成的影响。
选取橄榄油、葵花油、大豆油、玉米油、花生油、芝麻油等6 种常用诱导剂,分别添加2.0%,对比菌体生长和脂肪酶活,明确脂肪酶活最高的诱导剂种类,进一步研究该类诱导剂添加量对脂肪酶活的影响。
2)培养条件 研究初始接种量(2.0%,4.0%,6.0%,0.80%,10.0%)、装液量(250 mL 锥形瓶中分别装入10.0,30.0,50.0,70.0,90.0,110.0 mL)、初始pH(4.0,5.0,6.0,7.0,8.0,9.0,10.0)和培养温度(20.0,25.0,30.0,35.0,40.0,45.0 ℃)对菌体生长和脂肪酶合成的影响,明确显著影响脂肪酶合成的培养条件。
1.3.4.3 优化试验设计
1)Plackett-Burman(PB)试验 针对上述对脂肪酶合成有影响的影响因素,利用Design Expert 10.0.7 软件进行PB 试验设计,筛选出对脂肪酶合成最显著的影响因素。
2)最陡爬坡试验 基于PB 试验筛选出的显著影响因素,以试验值变化的梯度方向为爬坡方向,根据各因素效应值的大小确定变化步长,逼近最大响应值区域。
3)响应面试验 通过最陡爬坡试验逼近最大脂肪酶活区域后,基于Design Expert 10.0.7 软件对关键因子进行响应面试验设计,确定产脂肪酶的最佳条件。
2 结果与分析
2.1 初始培养基的选择及产酶曲线测定结果
将蚜虫莫氏黑粉菌接种至3 种培养基中发酵144 h,每隔24 h 测定脂肪酶活,结果见图1a。可以看出,发酵培养基1 中脂肪酶活最高,第6 天可达(27.66±0.7)U/mL。随后在发酵培养基1 中接种后,每隔12 h 测定脂肪酶活,结果见图1b。可以看出,168 h 后发酵液中脂肪酶活最高达(32.10±1.72)U/mL,且酶活随发酵时间延长基本保持稳定。因此,选取发酵培养基1 作为初始培养基,后续研究中均在培养7 d 后测定脂肪酶活。
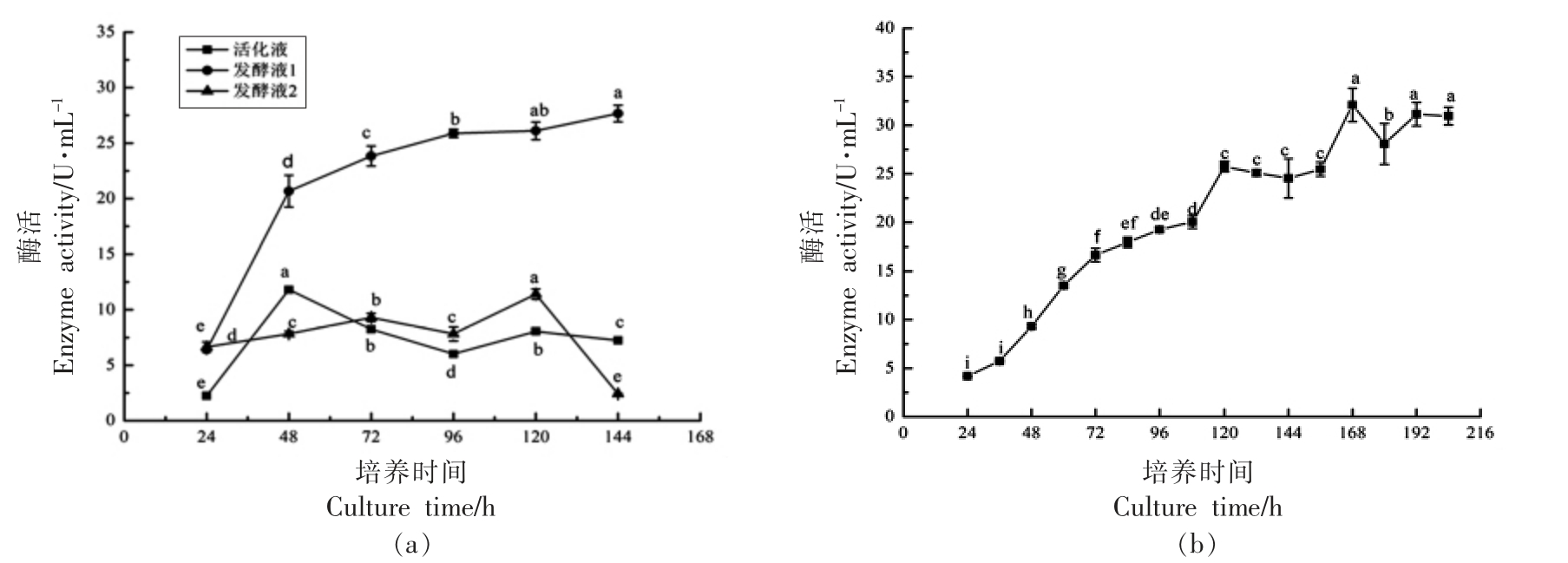
图1 培养基种类对脂肪酶合成的影响及产酶曲线测定
Fig.1 Effects of medium types on lipase synthesis and determination of lipase production curve
2.2 单因素实验结果
2.2.1 碳源对蚜虫莫氏黑粉菌产脂肪酶的影响 碳源是微生物生长代谢的主要营养物质,对脂肪酶的合成具有调控作用。研究7 种糖类碳源对蚜虫莫氏黑粉菌合成脂肪酶活的影响,结果见图2a。碳源为葡萄糖时,发酵液中脂肪酶活最高可达(36.82±0.05)U/mL。进一步对葡萄糖添加量进行研究,结果见图2b。可以看出,葡萄糖添加量为(0.0~80.0)g/L 时,随着添加量增加,发酵液中生物量不断增加,脂肪酶活、蛋白含量和发酵后pH 值均呈现出先增加后降低的趋势,表明葡萄糖添加量对蚜虫莫氏黑粉菌的生长代谢具有调控作用。其中,脂肪酶活在葡萄糖添加量为50.0 g/L 时达到最高,为(39.18±0.02)U/mL。因此,初步确定葡萄糖添加量为50.0 g/L。

图2 碳源种类和添加量对蚜虫莫氏黑粉菌合成脂肪酶的影响
Fig.2 Effects of carbon source types and supplemental levels on lipase synthesis by M.aphidis
2.2.2 氮源对蚜虫莫氏黑粉菌产脂肪酶的影响 氮源直接影响微生物体内蛋白酶的合成和活力,研究8 种氮源对蚜虫莫氏黑粉菌生长和合成脂肪酶活的影响,结果见图3a。可以看出,有机氮源组的脂肪酶活均高于无机氮源组,与Maia 等[23]的研究结果一致。而硝酸钠和酵母浸粉复配添加的初始培养基中脂肪酶活最高,进一步探究硝酸钠和酵母浸粉添加比例的影响,结果见图3b。可以看出,硝酸钠和酵母浸粉添加比例为1∶1~11∶1时,脂肪酶活先增加后保持稳定,蛋白含量先增加后降低,生物量和发酵后pH 值基本不变。其中,硝酸钠和酵母浸粉复配添加比例为3∶1 时,脂肪酶活最高达(40.22±0.05)U/mL。因此,初步确定培养基中氮源组成为硝酸钠和酵母浸粉复配添加比例为3∶1。

图3 氮源种类和添加量对蚜虫莫氏黑粉菌合成脂肪酶的影响
Fig.3 Effects of nitrogen source types and supplemental levels on lipase synthesis by M.aphidis
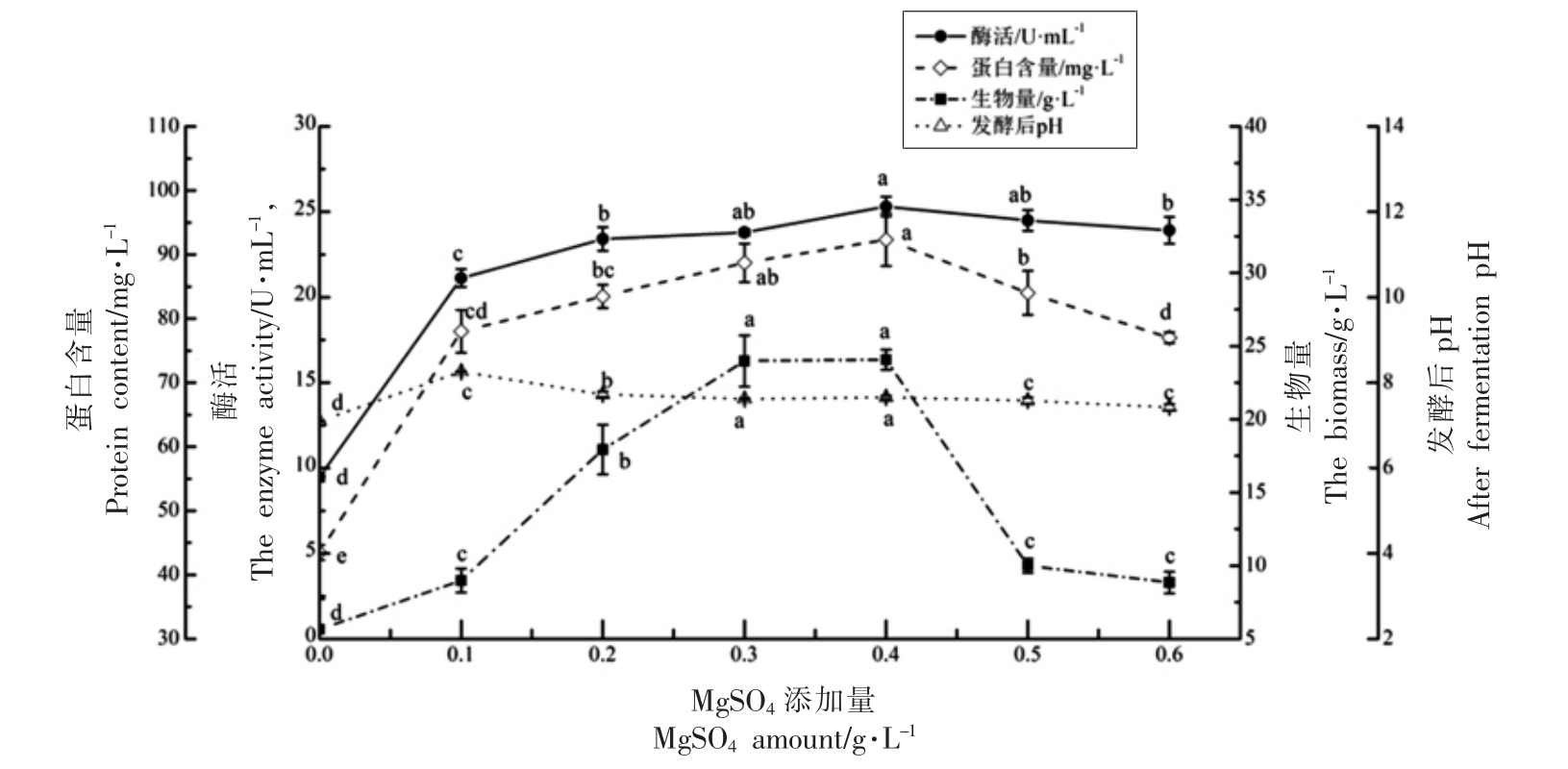
图4 MgSO4 添加量对蚜虫莫氏黑粉菌合成脂肪酶的影响
Fig.4 Effects of MgSO4 supplementation on lipase synthesis by M.aphidis
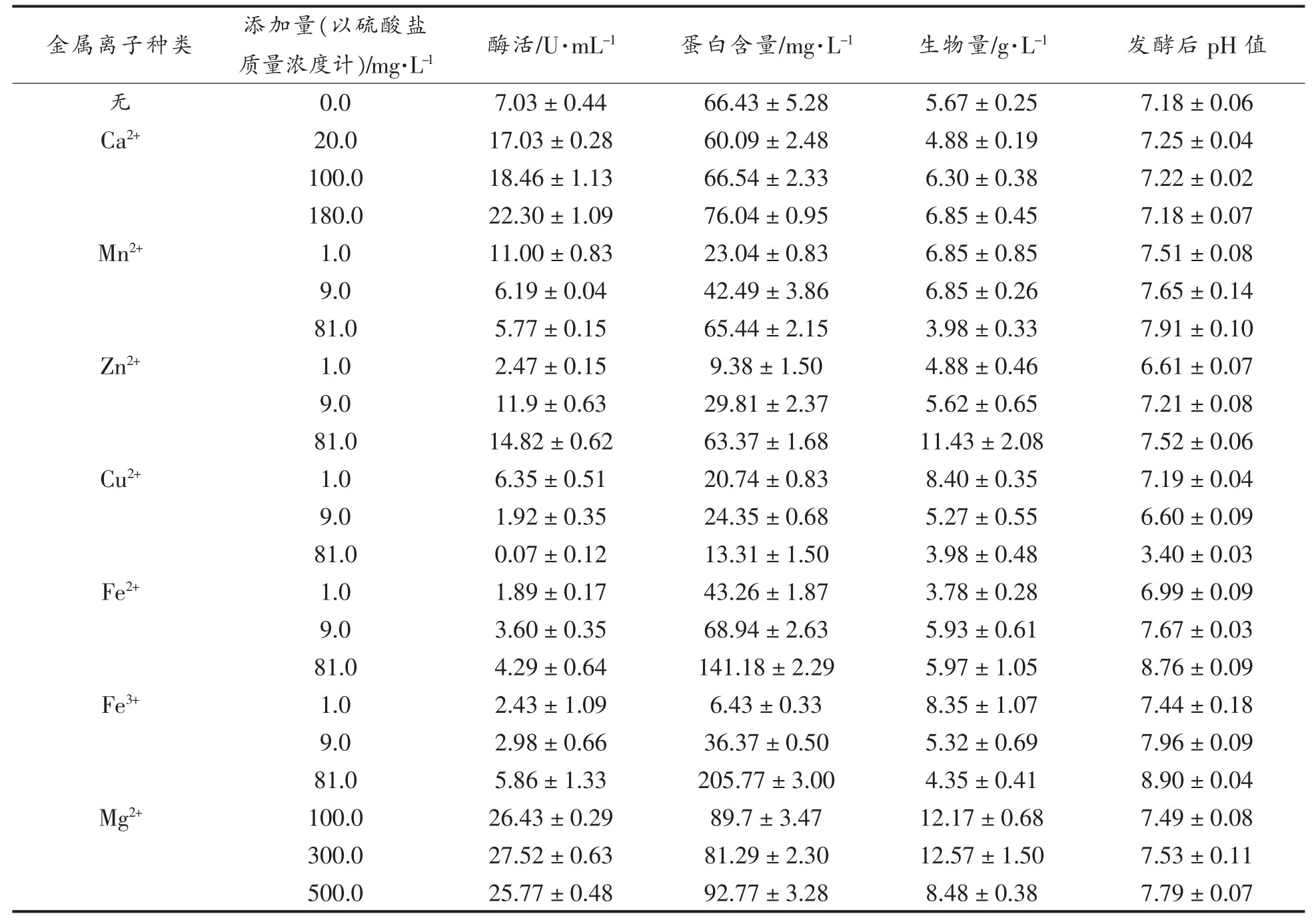
2.2.3 金属离子对蚜虫莫氏黑粉菌产脂肪酶的影响 探究7 种金属离子对蚜虫莫氏黑粉菌合成脂肪酶活的影响,结果见表1。与对照组比较,添加Ca2+、Mg2+、Mn2+或Zn2+均可以显著提高发酵液的脂肪酶活,而添加Cu2+、Fe2+或Fe3+进一步降低发酵液中脂肪酶活。其中,MgSO4 添加量为300 mg/L 时,脂肪酶活最高,达(27.52±0.63)U/mL。进一步探究MgSO4 添加量对脂肪酶活的影响,结果见图7。可以看出,MgSO4 添加量在0.00~0.60 g/L 时,发酵液中脂肪酶活、蛋白含量、生物量和发酵后pH 值均为先增加后降低的趋势,当MgSO4 的添加量为0.40 g/L 时,脂肪酶活最高,为(25.00±0.05)U/mL。因此,初步确定MgSO4 添加量为0.40 g/L。
表1 金属离子种类和浓度对蚜虫莫氏黑粉菌合成脂肪酶活的影响
Table 1 Effects of metal ion species and concentration on lipase activity of M.aphidis
2.2.4 表面活性剂对蚜虫莫氏黑粉菌产脂肪酶的影响 表面活性剂可以增加细胞膜的通透性从而加速氧气在培养基中的传递,有利于微生物更好地合成并分泌胞外脂肪酶[24]。从非离子、两性离子、阴离子和阳离子等4 类表面活性剂中选取具有代表性的种类,研究其对蚜虫莫氏黑粉菌合成脂肪酶活性的影响,结果见图5a。可以看出,添加吐温-80 的发酵液脂肪酶活最高,为(35.55±0.05)U/mL。进一步研究吐温-80 添加量的影响,结果见图5b。添加量在0.00%~0.35%时,脂肪酶活和蛋白含量呈现先增加后降低的趋势,而生物量和发酵后pH 值无明显变化。当添加0.30%吐温-80时,脂肪酶活最高,为(44.72±0.02)U/mL。因此,初步确定吐温-80 的添加量为0.30%。

图5 表面活性剂种类和添加量对蚜虫莫氏黑粉菌合成脂肪酶的影响
Fig.5 Effects of surfactant types and dosage on lipase synthesis by M.aphidis
2.2.5 诱导剂对蚜虫莫氏黑粉菌产脂肪酶的影响 脂肪酶分为结构型脂肪酶和诱导型脂肪酶[25],诱导剂能够促进诱导型脂肪酶的合成并提高酶活。研究诱导剂种类对蚜虫莫氏黑粉菌合成脂肪酶活的影响,结果见图6a。可以看出,花生油作为诱导剂时,脂肪酶活最高,为(36.77±0.02)U/mL。进一步研究花生油添加量的影响,结果见图6b。花生油的添加量在0.0%~6.0%时,脂肪酶活和蛋白含量呈现出先增加后降低的趋势,而生物量和发酵后pH 值呈现出逐渐降低的趋势。当花生油的添加量为2.0%时,脂肪酶活最高达(45.78±0.20)U/mL。因此,蚜虫莫氏黑粉菌合成的脂肪酶可能属于诱导型脂肪酶,初步确定花生油最佳添加量为2.0%。

图6 诱导剂种类和添加量对蚜虫莫氏黑粉菌合成脂肪酶的影响
Fig.6 Effects of inducer type and amount on lipase synthesis by M.aphidis
2.2.6 培养条件对蚜虫莫氏黑粉菌产脂肪酶的影响 分别研究接种量、初始pH 值、装液量和温度对蚜虫莫氏黑粉菌合成脂肪酶活的影响,结果见图7。从图7a、7b 可以看出,接种量为2.0%~10.0%,初始pH 值为4.0~9.0 时,发酵7 d 后的脂肪酶活、生物量、发酵后pH 值无明显差别。因此,后续PB 试验、最陡爬坡试验和响应面试验不考虑接种量、初始pH 值作为优化因子。由图7c 可知,250 mL 锥形瓶中装液量在10.0~110.0 mL 时,发酵液中脂肪酶活、蛋白含量等呈现逐渐降低的趋势。已有研究表明,装液量主要影响培养液中的溶氧浓度,表明氧气充足的条件更有利于蚜虫莫氏黑粉菌合成脂肪酶。然而,考虑到本研究发酵时间较长,发酵液蒸发损失较大,初步确定为30.0 mL的装液量做进一步研究。由图7d 可知,在25.0~45.0 ℃范围内,脂肪酶活、蛋白含量以及发酵后pH 值均呈现出先增加后降低的趋势。其中,25.0℃条件下所得发酵液中的脂肪酶活最高,为(49.99±0.05)U/mL。试验过程中观察发现,蚜虫莫氏黑粉菌在高于40.0 ℃及以上条件下基本不生长,但测定生物量过高,主要原因是在生物量测定的烘干过程中,出现具有流动性的黏稠液体,水分含量较大,导致测定值过高。因此,初步确定培养温度为25.0 ℃。

图7 培养条件对蚜虫莫氏黑粉菌合成脂肪酶的影响
Fig.7 Effects of culture conditions on lipase synthesis by M.aphidis
2.3 PB 试验结果
PB 试验是通过比较2 水平因素与整体差异性之间的显著效果,从众多因素中筛选出关键影响因素,大幅减少试验次数,提高试验响应值的试验设计方法[26]。根据单因素实验结果,设计N=12[27-28],对葡萄糖(A)、NaNO3(B)、酵母浸粉(D)、MgSO4(E)、花生油(G)、吐温-80(H)、装液量(J)、温度(K)共8 个因素进行试验,每个因素各取高、低2个水平,响应值为脂肪酶活,另设3 个虚拟项考察试验误差[29],试验设计水平和响应值分别见见表2和表3。
表2 PB 试验设计因素水平
Table 2 PB experimental design factor levels

表3 PB 试验设计方案及试验响应值(N=12)
Table 3 PB design and response values(N=12)
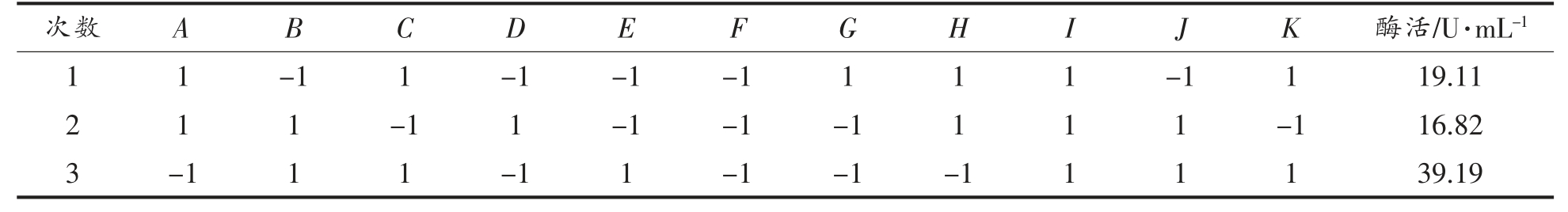
(续表3)
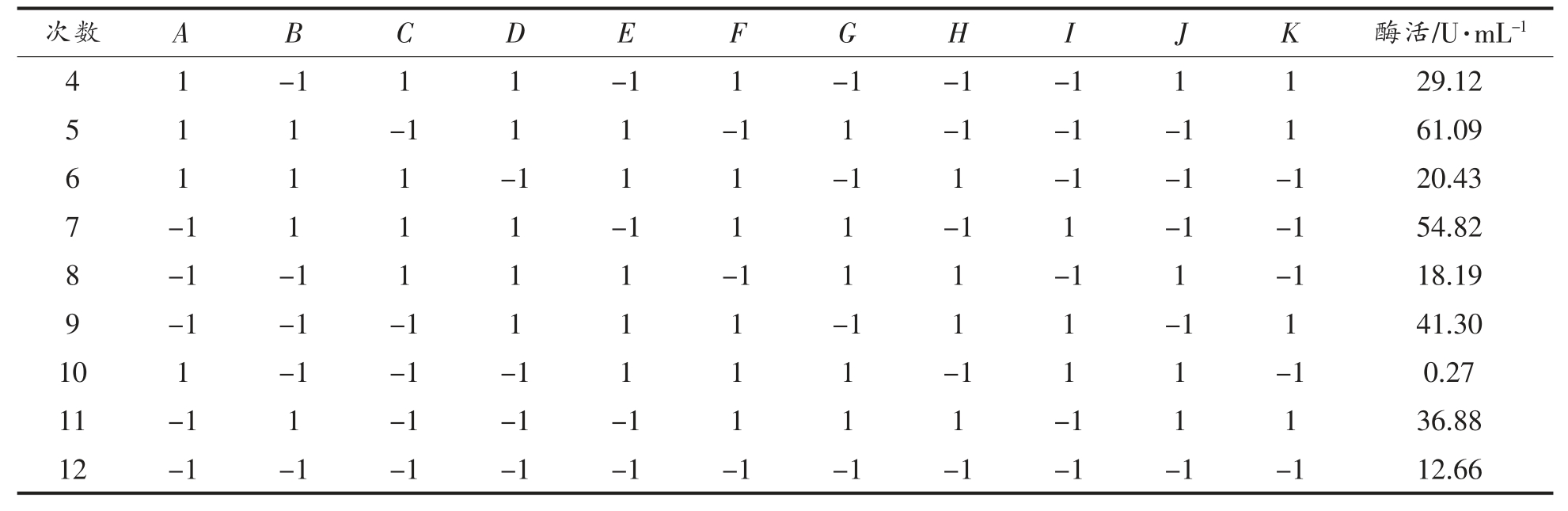
利用Design Expert 10.0.7 软件对PB 试验结果进行分析,结果见表4。可以看出,葡萄糖、吐温-80、装液量对发酵产脂肪酶具有负效应,NaNO3、酵母浸粉、MgSO4、花生油、温度对发酵产脂肪酶具有正效应。8 个因素对脂肪酶活的影响顺序为:NaNO3>温度>酵母浸粉>装液量>葡萄糖>吐温-80>花生油>MgSO4。
表4 PB 试验设计各因素对脂肪酶活的影响情况
Table 4 Effects of various factors on lipase activity in PB experimental design
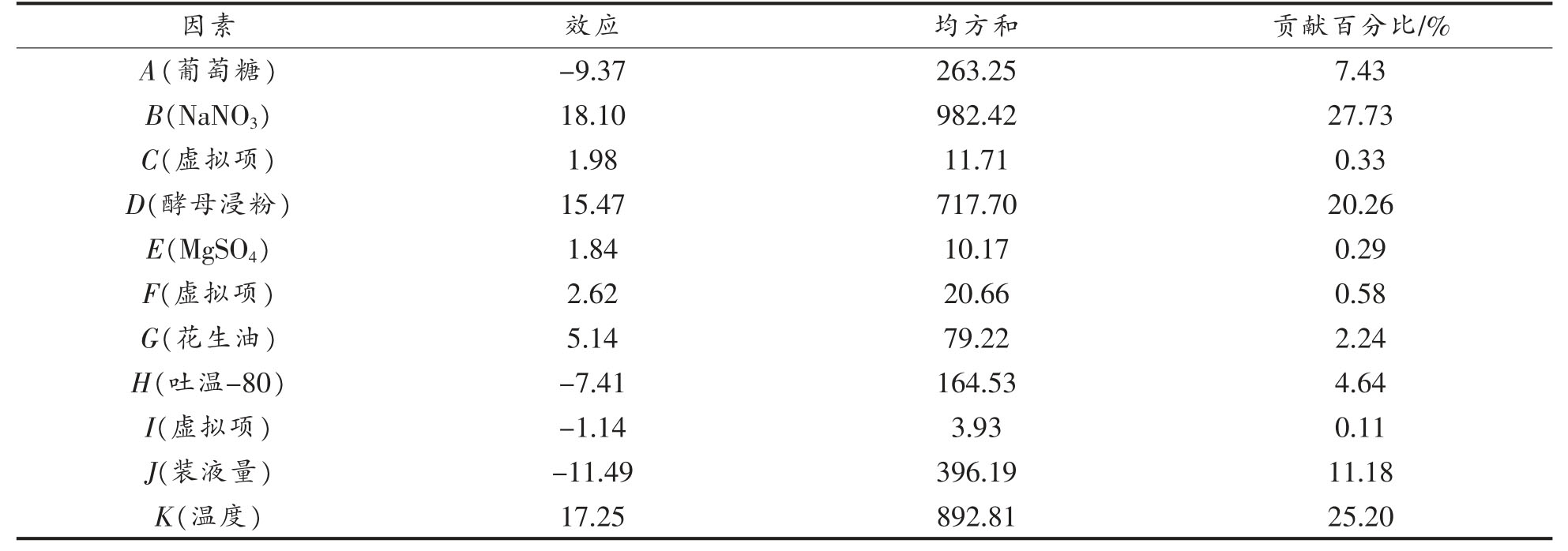
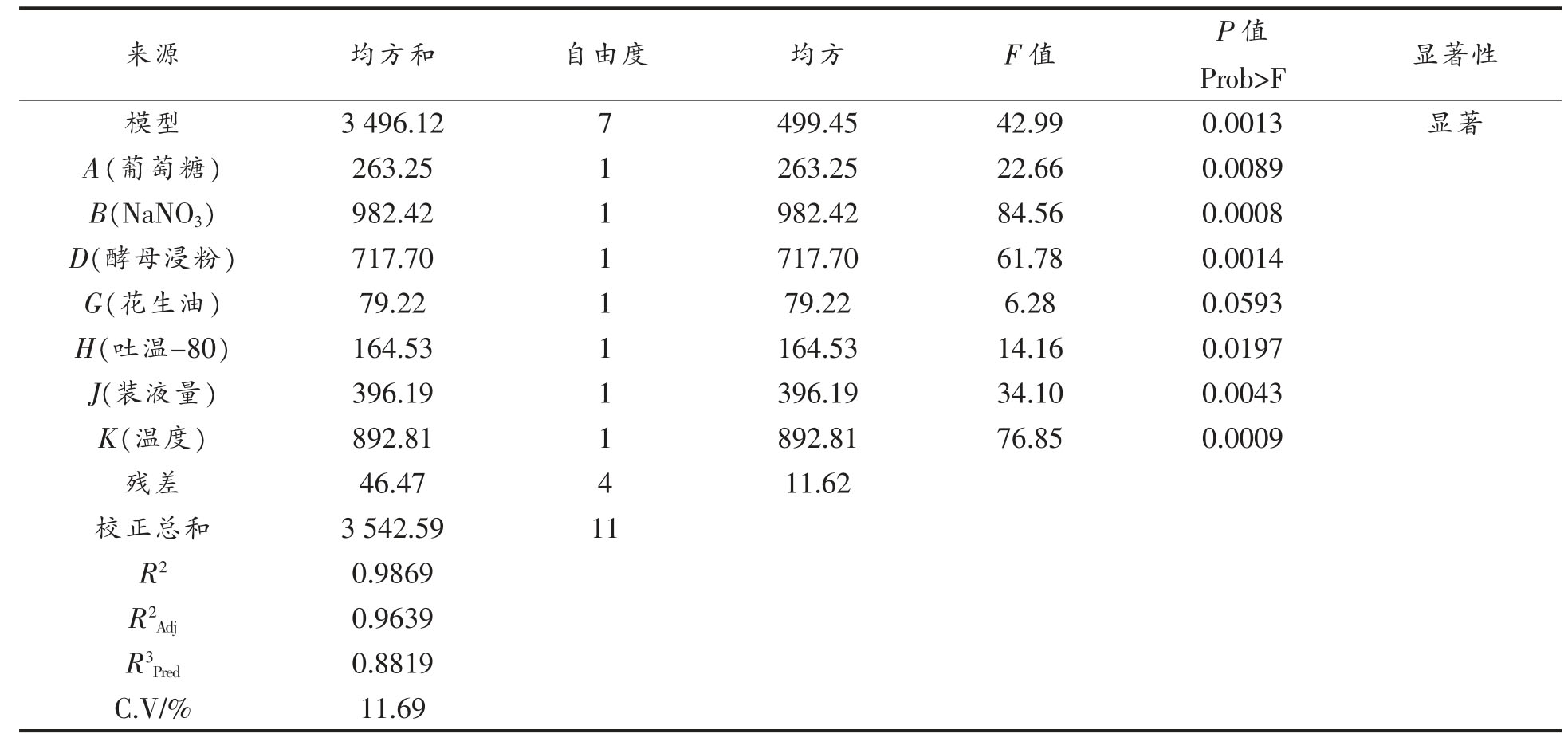
本试验拟合的模型显著,P=0.0013<0.05,R2=0.9869,经方差分析所得的回归方程为:Y=29.16-4.68A+9.05B+7.73D+2.57G-3.70H-5.75J+8.63K。该模型的F 值为42.99,仅有0.13%的概率不能用该模型表示。表5 中所列因素,除了花生油,其它因素F 值均小于0.05,说明这些因素对模型影响显著。其中最显著的3 个因素为:NaNO3>温度>酵母浸粉。
表5 PB 试验因素显著性分析
Table 5 Significance analysis of PB experimental factors
2.4 最陡爬坡试验
响应面拟合模型只有在临近最优区域内才能更准确地反映模型的真实情况[30],因此,利用最陡爬坡试验逼近最优点附近区域并进行模拟分析[31]。根据PB 试验所得的3 个最显著因素:NaNO3、温度、酵母浸粉,设计最陡爬坡试验,以脂肪酶活为响应值,试验设计及结果见表6。可以看出,脂肪酶活最大响应值在第2 组与第4 组之间。因此,以第3 组条件为响应面试验中心点。
表6 最陡爬坡试验设计及结果
Table 6 Experimental design and results of steepest climb

2.5 响应面优化试验
通过最陡爬坡试验逼近产脂肪酶活最高区域后,采用响应面分析法中Box-Behnken 设计法,对NaNO3 添加量、温度和酵母浸粉添加量等3 个关键因子设置3 个水平,编码和对应值见表7。试验设计和各组脂肪酶活测定结果见表8。以脂肪酶活为响应值,利用Design Expert 10.0.7 软件对数据进行回归分析,拟合得到脂肪酶活与各因素变量的二次回归模型:
表7 响应面设计因素及水平
Table 7 Response surface design factors and levels
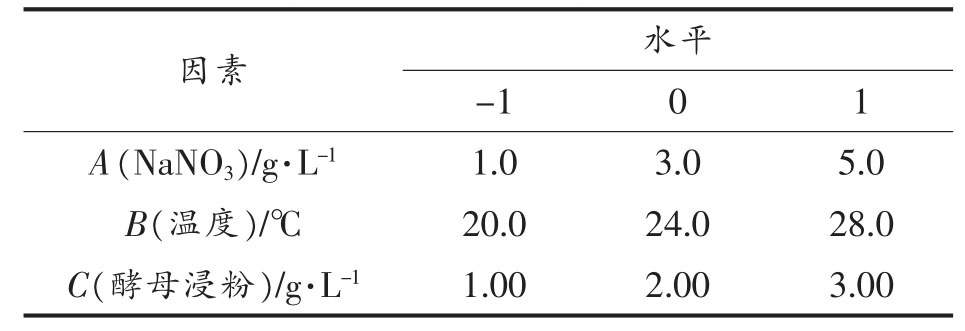
表8 响应面设计结果
Table 8 Response surface design results
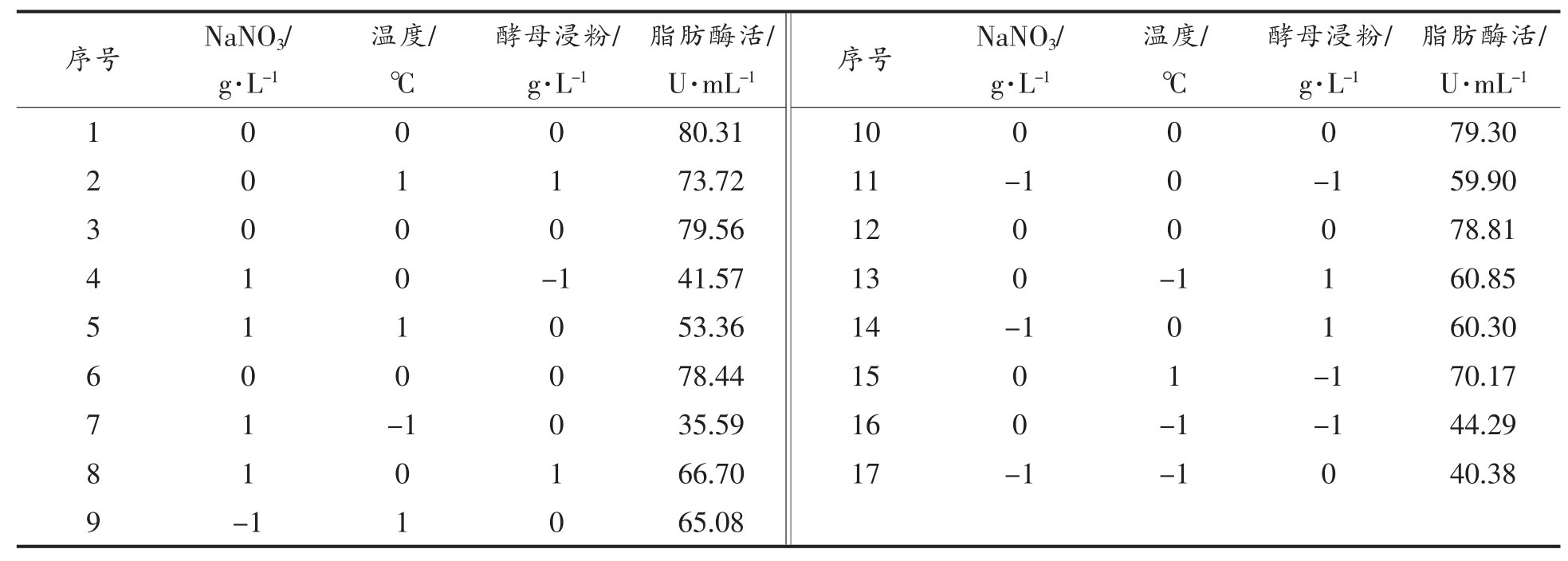
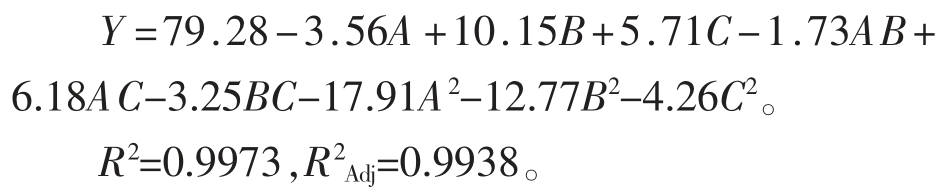
回归方程的方差分析和模型可信度分析见表9。可知,模型在α=0.01 水平上回归显著,失拟项不显著,说明试验数据与模型相符,模型建立正确。且一次项和平方和项对酶活均有显著性影响。模型的决定系数R2=0.9973,变异系数C.V.%=1.91,说明拟合较好,较为真实地反应各因素与脂肪酶活之间的关系,试验结果可信。
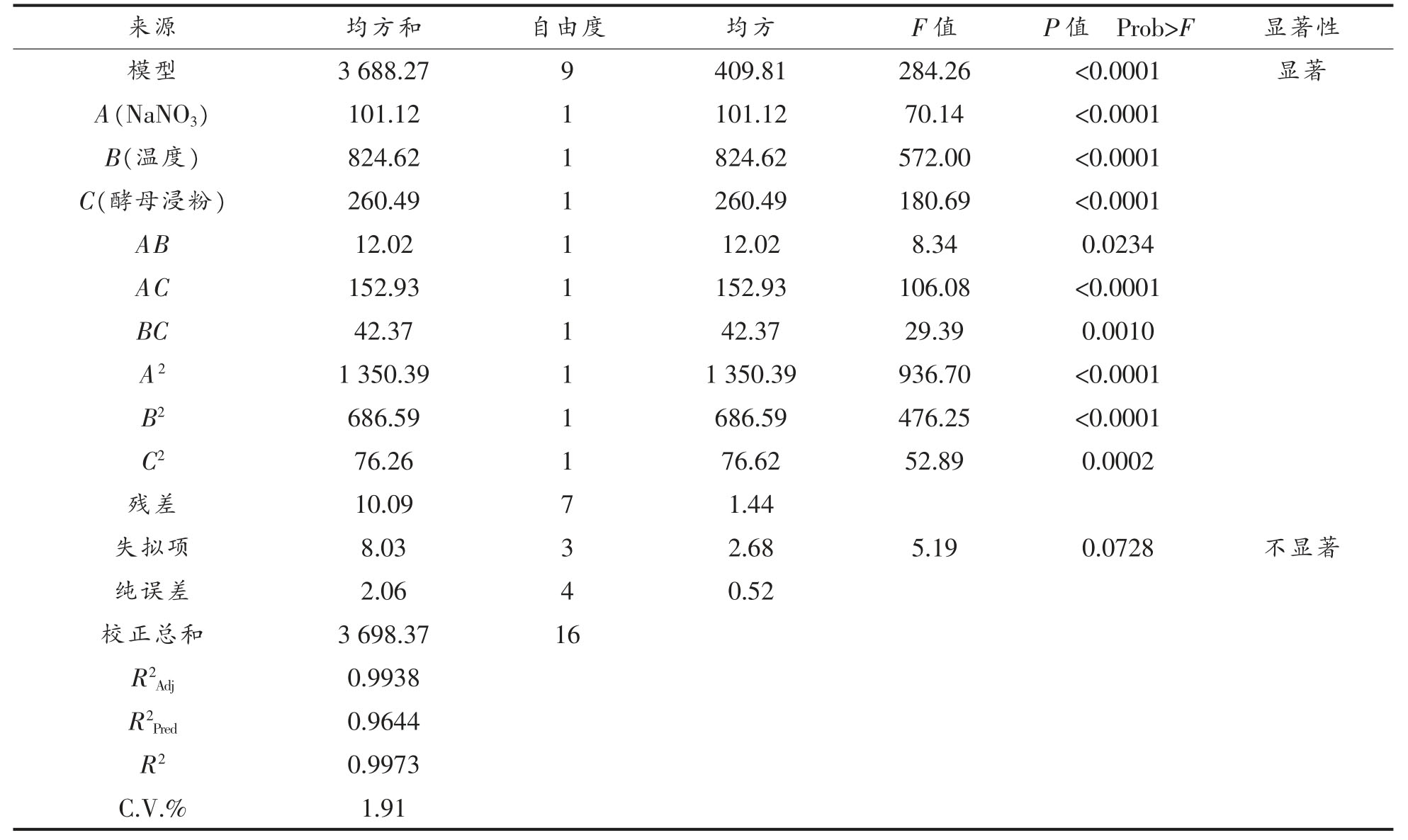
表9 回归模型方差分析
Table 9 Regression model variance analysis
2.6 响应曲面分析
响应面曲面图是开口向下的凸面曲线,存在最高值,响应面的陡峭程度反映了随自变量的变化,曲线越陡峭,说明响应值越灵敏[32]。等高线图反映了两因素的交互作用,呈圆形说明两因素作用不显著,呈椭圆形说明交互作用显著。设计试验结果的响应面图和等高线图见图8。可以看出,酵母浸粉和硝酸钠、酵母浸粉和温度的交互作用对脂肪酶活有显著影响,而硝酸钠和温度的交互作用不显著。进一步利用软件计算分析,预测脂肪酶活最高值为81.90 U/mL,此时培养温度为25.8℃,硝酸钠添加量为3.1 g/L,酵母浸粉添加量为2.24 g/L。

图8 NaNO3、酵母浸粉和温度对酶活影响的响应面图和等高线图
Fig.8 Response surface and contour plots of NaNO3,yeast extract and temperature on enzyme activity
2.7 模型验证试验
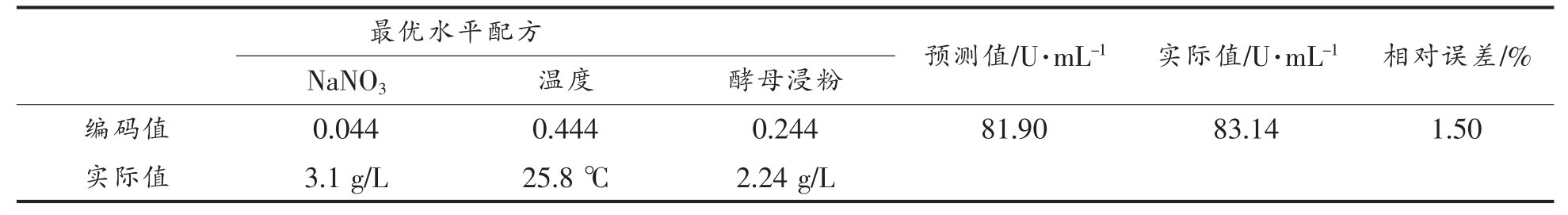
为验证模型的准确性和有效性,对预测的最佳培养基组分和条件进行摇瓶发酵试验,结果见表10。可知,验证试验测定脂肪酶活为(83.14±1.09)U/mL,比优化前的发酵液中脂肪酶活提高约2.6 倍,且与模型预测值相差小于1.50%,说明响应面优化法能显著提高蚜虫莫氏黑粉菌合成脂肪酶活,所得模型能够真实反映所筛选关键因素对脂肪酶活的影响。
表10 最优水平及验证结果
Table 10 Optimal level and verification results
3 结论
通过单因素实验和PB 试验筛选出对蚜虫莫氏黑粉菌合成脂肪酶活影响最显著的3 个因素:NaNO3 添加量、温度、酵母浸粉添加量。利用最陡爬坡试验探究脂肪酶活的最大响应值区域,确定响应面的中心点。通过响应面试验得到蚜虫莫氏黑粉菌合成脂肪酶的最佳条件:NaNO3 添加量为3.1 g/L,温度为25.8 ℃,酵母浸粉添加量为2.24 g/L,此时脂肪酶活为(83.14±1.09)U/mL,比未优化前提高了约2.6 倍。本研究对实现蚜虫莫氏黑粉菌高效合成脂肪酶具有重要意义,为脂肪酶的提取纯化、酶学特性和应用研究奠定基础。
[1]ORTIZ C,FERREIRA M L,BARBOSA O,et al.Novozym 435:The ‘perfect’ lipase immobilized biocatalyst?[J].Catalysis Science &Technology,2019,9(10):2380-2420.
[2]OKUMURA S,IWAI M,TSUJISAKA Y.Synthesis of various kinds of esters by four microbial lipases[J].Biochimica et Biophysica Acta(BBA)-Lipids and Lipid Metabolism,1979,575(1):156-165.
[3]ISMAIL A R,KASHTOH H,BAEK K H.Temperature-resistant and solvent-tolerant lipases as industrial biocatalysts:Biotechnological approaches and applications [J].International Journal of Biological Macromolecules:Structure,Function and Interactions,2021,187:127-142.
[4]SHARMA S,KANWAR S.Organic solvent tolerant lipases and applications [J].The Scientific World Journal,2014,2014:1-16.
[5]KUMAR A K,GUDIUKAITE R G,GRICAJEVA A,et al.Microbial lipolytic enzymes -promising energy-efficient biocatalysts in bioremediation[J].Energy,2020,192:1-12.
[6]BARRIUSO J,EUGENIA M E,PRIRTO A,et al.Structural traits and catalytic versatility of the lipases from the Candida rugosa -like family:A review[J].Biotechnology Advances,2016,34(5):874-885.
[7]VITORINO L C,BESSA L A.Technological microbiology:Development and applications[J].Frontiers in Microbiology,2017,8:1-23.
[8]卢鑫.重组毕赤酵母表达米根霉(Rhizopus oryzae)脂肪酶的发酵调控及酶稳定性研究[D].无锡:江南大学,2013.LU X.Optimization of Rhizopus oryzae lipase expressed in recombinant Pichia pastoris and enzyme stability[D].Wuxi:Jiangnan University,2013.
[9]钱忠英,李杨,蔡海莺,等.疏棉状嗜热丝孢菌脂肪酶基因在毕赤酵母工程菌中的遗传稳定性[J].微生物学通报,2019,46(11):2821-2829.QIAN Z Y,LI Y,CAI H Y,et al.Hereditary stability of Thermomyces lanuginosus lipase gene in recombinant Pichia pastoris strain[J].Chinese Journal of Microbiology,2019,46(11):2821-2829.
[10]李牧.嗜麦芽糖寡养单胞菌脂肪酶的筛选、异源表达及在催化制备l-薄荷醇中的应用[D].杭州:浙江大学,2013.LI M.Screening and heterologous expression of Stenotrophomonas maltophilia lipase,and its application in enzymatic preparation of L-menthol[D].Hangzhou:Zhejiang University,2013.
[11]景智波,田建军,赵丽华,等.Box-Behnken 优化培养条件提高乳酸菌产脂肪酶活性[J].中国食品学报,2020,20(10):124-133.JING Z B,TIAN J J,ZHAO L H,et al.Optimization of culture conditions by Box-Behnken for Improving the lipase activity in Lactic Acid Bacteria[J].Journal of Chinese Institute of Food Science and Technology,2020,20(10):124-133.
[12]ABU M L,MOHAMMAND R,OSLAN S N,et al.The use of response surface methodology for enhanced production of a thermostable bacterial lipase in a novel yeast system[J].Preparative biochemistry&biotechnology:An international journal for rapid communication,2021,51(4):350-360.
[13]吴蓉,曹佳睿,曹君,等.南极假丝酵母脂肪酶B基因在大肠杆菌中的表达和发酵优化[J].生物技术通报,2021,37(2):138-148.WU R,CAO J R,CAO J,et al.Expression and fermentation optimization of Candida antarctica lipase B in Escherichia coli[J].Biotechnology Bulletin,2021,37(2):138-148.
[14]孙建安.一种在枯草芽孢杆菌中高效表达脂肪酶的方法:202110482278.7[P].2021-06-29.SUN J A,A method for high efficient expression of lipase in Bacillus subtilis,202110482278.7 [P].2021-06-29.
[15]NIU Y W,WU J N,WANG W,et al.Production and characterization of a new glycolipid,mannosylerythritol lipid,from waste cooking oil biotransformation by Pseudozyma aphidis ZJUDM34[J].Food science &nutrition,2019,7(3):937-948.
[16]FAN L L,LI H J,NIU Y W,et al.Characteriza tion and inducing melanoma cell apoptosis activity of mannosylerythritol lipids-A produced from Pseudozy ma aphidis[J].PLoS ONE,2017,11(2):148-198.
[17]WINKLER U K,STUCKMANN M.Glycogen,hyaluronate,and some other polysaccharides greatly enhance the formation of exolipase by Serratia marcescens[J].Journal of Bacteriology,1979,183(3):663-670.
[18]赵敏洁,蔡海莺,李杨,等.出芽短梗霉产脂肪酶培养基的响应面优化[J].中国食品学报,2017,17(7):77-85.ZHAO M J,CAI H Y,LI Y,et al.Statistical optimization of oulture medium for enhanced lipase production by Aureobasidium pullulans using response surface methodology[J].Journal of Chinese Institute of Food Science and Technology,2017,17(7):77-85.
[19]DIMITRIJEVIC A,VELICKOVIC D,BEZBRADICA,et al.Production of lipase from Pseudozyma aphidis and determination of the activity and stability of the crude lipase preparation in polar organic solvents[J].Journal of the Serbian Chemical Society,2011,76(8):1081-1092.
[20]李杨.耐高温脂肪酶高产菌株的筛选及其脂肪酶表达、纯化和性质研究[D].杭州:浙江大学,2015.LI Y.Screening and isolation of a high-yeild thermostable lipase producing strain and research on the production,purification and properties of the lipase[D].Hangzhou:Zhejiang University,2015.
[21]NAJJAR A,ROBERT S,GUERIN C,et al.Quantitative study of lipase secretion,extracellular lipolysis,and lipid storage in the yeast Yarrowia lipolytica grown in the presence of olive oil:Analogies with lipolysis in humans [J].Applied Microbiology and Biotechnology,2011,89(6):1947-1962.
[22]蔡海莺.sn-1,3 专一性脂肪酶的筛选、重组表达和分子改造研究[D].杭州:浙江大学,2016.CAI H Y.Screening,recombinant expression and molecular modification of sn-1,3-specific lipase[D].Hangzhou:Zhejiang University,2016.
[23]MAIA M M,HEASLEY A,CAMARGO M M,et al.Effect of culture conditions on lipase production by Fusarium solani in batch fermentation[J].Bioresource Technology:Biomass,Bioenergy,Biowastes,Conversion Technologies,Biotransformations,Production Technologies,2001,76(1):23-27.
[24]HAMADA T,HAGIHARA H,MORITA M.Physicochemical profiling of surfactant-induced membrane dynamics in a cell-sized liposome[J].Journal of Physical Chemistry Letters,2012,3(3):430-435.
[25]李唯一.产低温脂肪酶菌株筛选、发酵条件优化及其酶学性质研究[D].哈尔滨:东北林业大学,2021.LI W Y Screening of low temperature lipase producing strain,Optimization of fermentation conditions and study on enzymatic properties [D].Harbin:Northeast Forestry University,2021.
[26]汪彬彬,车振明.Plackett-Burman 和Box-Benhnken Design 实验设计法优化华根霉产糖化酶发酵培养基的研究[J].食品科技,2011,36(5):41-45.WANG B B,CHE Z M.Optimization of Rhizopus fermentation medium for glucoamylase production by Plackett-Burman and Box-Benhnken Design[J].Food Science and Technology,2011,36(5):41-45.
[27]梁秋艳.低温脂肪酶产生菌株的筛选、发酵条件优化及其酶学性质研究[D].石河子:石河子大学,2014.LIANG Q Y.Study on screening,optimization of its fermentation conditions and enzymatic properties of a cold-adapted lipase-producing strain [D].Shihezi:Shihezi University,2014.
[28]张震,石凯欣,潘思轶.Plackett-Burman 联合效应面法优化超声辅助乙醇提取枳雀总酚工艺[J].华中农业大学学报,2021,40(4):182-190.ZHANG Z,SHI K X,PAN S Y.Optimization of ultrasound-assisted ethanol extraction of polyphenols from Citrus wilsonii Tanaka using Plackett-Burman coupled with response surface design[J].Journal of Huazhong Agricultural University,2021,40(4):182-190.
[29]安攀宇,汪静心,肖岚,等.Plackett-Burman 试验设计联用Box-Behnken 响应面法优化脂肪替代物的制备[J].食品科学,2020,41(10):255-264.AN P Y,WANG J X,XIAO L,et al.Optimization of the preparation of fat substitutes using Plackett-Burman Design combined with Box-Behnken Response Surface Methodology[J].Food Science,2020,41(10):255-264.
[30]张昊月,郭正彦,吕志堂,等.应用响应面法优化发酵培养基提高达托霉素产量[J].微生物学通报,2021,48(1):113-122.ZHANG H Y,GUO Z Y,LV Z T,et al.Medium optimization with the response surface methodology to improve daptomycin production [J].Microbiology Bulletin,2021,48(1):113-122.
[31]代志凯,张翠,阮征.试验设计和优化及其在发酵培养基优化中的应用[J].微生物学通报,2010,37(6):894-903.DAI Z K,ZHANG C,RUAN Z.The application of experimental design and optimization techniques in optimization of microbial medium [J].Microbiology Bulletin,2010,37(6):894-903.
[32]徐显睿,李翠凤,隋勇军,等.响应面法优化乳双歧杆菌Z-1 冷冻干燥保护剂配方[J].乳业科学与技术,2020,43(3):6-11.XU X R,LI C F,SUI Y J,et al.Response surface methodology for optimizing the formulation of cryoprotectants for Bifidobacterium lactis Z -1 [J].Dairy Science and Technology,2020,43(3):6-11.