皮克林乳液(Pickering emulsions,PEs)是由固体颗粒(包括纳米颗粒、微粒)稳定的乳液。颗粒类型主要包括淀粉颗粒、蛋白质颗粒、壳聚糖颗粒、黏土、二氧化硅、二氧化钛等。皮克林乳液的主要优势在于能够抵抗分散相液滴/颗粒的聚结,保质期长,稳定性好等[1]。在实际生产中,皮克林乳液常被用来包埋活性成分(姜黄素、β-胡萝卜素、儿茶素、维生素和益生菌等),在食品、医药以及化妆品等领域应用广泛。
近年来随着消费者健康意识的增强,食品行业逐渐倾向于使用安全性更高的皮克林乳液[2]。目前食品级皮克林颗粒主要包括多糖颗粒、蛋白质颗粒、黄酮类颗粒、食品级蜡和脂肪晶体、复合颗粒[3]。其中,蛋白基颗粒具有亲疏水平衡性好,制备简单,成本低,环境友好等优点[4]。迄今为止,已有较多关于植物蛋白颗粒[5](如玉米醇溶蛋白、大豆蛋白等)和动物蛋白颗粒(如乳蛋白、酪蛋白、蛋清蛋白、肉蛋白等)用于制备皮克林乳液的研究报道。和植物蛋白相比,动物蛋白的分子结构对热和酸碱更敏感,液滴黏度更高[6],通常需要交联、热变性和与其它颗粒结合等方式来提高皮克林乳液的稳定性。此外,提取和纯化动物蛋白颗粒的成本相对较高。这些问题是制约基于动物蛋白的皮克林乳液在食品工业中应用的主要因素[2]。
本文介绍影响蛋白基皮克林乳液稳定性的主要因素,综述可形成皮克林乳液的动物蛋白(乳蛋白、肉蛋白、蛋类蛋白)及其在食品中的应用情况。本综述对拓展动物蛋白形成稳定的皮克林乳液在食品中的应用提高参考。
1 蛋白基皮克林乳液稳定性的主要影响因素
皮克林乳液蛋白颗粒的湿润性、浓度、粒径、形态、表面电荷、界面张力及吸附作用等都会对乳液的稳定性产生影响。
1.1 颗粒湿润性
具有双重润湿性的颗粒能作为Pickering 乳液的潜在稳定剂[3]。蛋白颗粒具有蛋白质的两亲特性,其表面疏水性影响了颗粒在油水界面的吸附效果,体现为油水界面的三相接触角(θ)[7]。当θ<90°时,颗粒呈现为亲水性,倾向于形成水包油乳液;当θ>90°时,颗粒呈现为亲脂性,倾向于形成油包水乳液。θ 在30~150°范围内可以形成皮克林乳液[3],但当θ 在90°附近时形成的皮克林乳液的稳定性更高。蛋白基颗粒的润湿性可以通过调节溶液环境的酸碱度或离子强度来改善[8]。
1.2 颗粒粒径
蛋白质颗粒的粒径是影响皮克林乳液稳定性的重要因素,决定了乳液液滴尺寸以及乳液的外观、流变性、稳定性[8]。皮克林乳液液滴通常在0.1~10 μm 范围内,其液滴粒径比颗粒的粒径大一个数量级。适当大小的颗粒能较好的吸附在油水界面上,形成保护层进而稳定乳液[5]。一般认为,颗粒粒径越小,稳定乳液的比表面积越大,乳液越稳定。如果颗粒粒径太大,颗粒聚集下沉,导致乳液分层,稳定性也会降低[9-10]。但也有研究指出,如果成功形成了大尺寸(毫米级)的液滴,乳液也能长时间稳定聚结[8]。
1.3 颗粒浓度
颗粒浓度会影响乳化效率和液滴的尺寸,进而影响乳液的稳定性[11]。颗粒浓度过低,不能完全覆盖在液滴表面形成稳定的界面膜,会破坏乳液的稳定性。颗粒浓度增大,颗粒完全包裹液滴表面,形成单分子或多分子层的界面膜,增强液滴之间的静电斥力或空间排阻作用,从而增强体系的稳定性[10]。一般情况下,颗粒浓度增大,乳液粒径降低[12]。但是当颗粒浓度太大时,颗粒会发生聚集和沉降,不能形成稳定的乳液。
1.4 颗粒形态
颗粒形态可以决定颗粒在油水界面上吸附排列,进而决定乳液的稳定性[13-16]。颗粒形状包括球形、纤维状、多边形、椭圆形和棒状等几类[17](图1)。另外,高纵横比的颗粒能够同时湿润两相,更有利于皮克林乳液的稳定。由球形明胶颗粒形成的皮克林乳液在14 天的储存中具有优异的稳定性[18],高纵横比的卵转铁蛋白纤维具有较高的乳化效率[19]。椭球状和棒状纤维素纳米晶体(CNCs)都可用于皮克林乳剂的制备,但棒状CNCs 的乳化效率更高[20]。
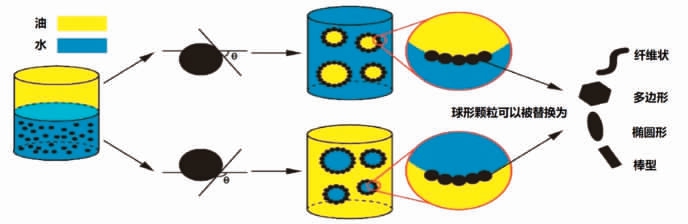
图1 皮克林稳定乳液的不同颗粒形状[3]
Fig.1 Different particle shapes of Pickering stabilized emulsion[3]
1.5 表面电荷
皮克林乳液的稳定性很大程度上取决于颗粒的表面电动力学。颗粒表面电荷太小,静电排斥和ζ 电势最小化,促进颗粒聚集,导致乳液不稳定[8]。表面电荷太大时,颗粒趋向于相互排斥,而不是稳定地吸附在o/w 界面上[21]。当固体颗粒的表面电荷在合适的低电荷区时,固体颗粒发生聚集,进一步加强了连续相中的颗粒网络,从而提高乳液的稳定性[9]。Pickering 颗粒的表面电荷可以通过调节pH 值、离子强度以及修饰蛋白质分子的表面基团来改善[8]。酸碱度通过控制静电和空间相互作用影响连续相,从而影响液滴聚集和乳液稳定。而离子强度通过调节液滴之间的絮凝程度来改变界面膜的性质,进而控制乳液的稳定性[10]。通常认为采用pH 值调节表面电荷比离子强度更有效[22]。
1.6 吸附作用
皮克林乳液的稳定性也可以通过形成连续相的三维颗粒网络来增强。当体系中存在一定量未吸附的蛋白质颗粒时,相邻蛋白质颗粒在静电斥力和空间位阻的作用下相互吸附,进一步形成网络结构,提高乳液稳定性。但若吸附性较弱,蛋白质颗粒间不会相互聚集;若吸附性太强,蛋白质颗粒将大量聚集,不能形成颗粒网络来稳定乳液。因此,可以先在蛋白质颗粒不强烈聚集的条件下形成皮克林乳液,然后改变条件以促进颗粒吸附[5],进而稳定乳液。吸附作用可以通过控制酸碱度、离子强度、溶剂质量、酶活性或温度来实现。
2 可形成皮克林乳液的动物蛋白种类
近十年来,关于蛋白形成皮克林乳液的报道约有200 篇,涉及的动物蛋白大致可分为乳、肉、蛋类,表1 总结了部分由动物蛋白稳定的皮克林乳液的研究报道。
表1 由动物蛋白稳定的乳液的概述
Table 1 An overview of emulsion stabilized by animal protein
2.1 乳蛋白
2.1.1 乳清蛋白(Whey protein)乳清蛋白是奶酪制作过程中获得的副产品,主要由β-乳球蛋白和α-乳清蛋白组成[36]。天然的乳清蛋白需经过加热处理、添加盐或与其它物质复合才能形成稳定高内相皮克林乳液的颗粒。
通过热处理(90 ℃)制备的乳清蛋白分离物颗粒可作为皮克林乳液的稳定剂,增加颗粒浓度或降低溶液pH 值可以改善乳液的稳定性[37]。Zamani等[38]研究发现,在等电点附近(pH 5.8~6.0)热处理(85 ℃)后喷雾干燥制备的乳清蛋白微凝胶颗粒(直径在80~600 nm),可形成对液滴絮凝和聚结具有更好的抵抗力的高内相皮克林乳液。使用高静水压(600 MPa,30 min)制备的乳清蛋白分离物微凝胶颗粒,也可用作皮克林乳液的有效颗粒稳定剂[26],为负载的姜黄素提供保护。
β-乳球蛋白是乳清蛋白的重要组成。通过高温加热(80 ℃)和磁力搅拌制备的β-乳球蛋白原纤维可形成皮克林乳液(液滴粒径分布在11~19 μm),物理稳定性高,在长期储存过程中不会聚结[39]。与乳清蛋白分离物制备的微胶囊相比,由高压均质(19 000 r/min)和喷雾干燥制备的β-乳球蛋白原纤维乳液具有更好的乳化活性和抗氧化稳定性[40]。
2.1.2 酪蛋白(Casein)酪蛋白是一种含磷钙的乳结合蛋白,来源广泛、价格低廉、过敏性低,具有许多生理功效[41]。酪蛋白颗粒具有优异的两亲性,是制备皮克林乳液的优质原料。
采用戊二醛交联法制备的酪蛋白纳米凝胶(CSN)可以在不添加任何添加剂的情况下作为皮克林乳液的有效稳定剂。当CSN 在合适的浓度(0.5%)、pH(2 和4)和离子强度(>0.6 mol/L)时可以有效地吸附在油水界面上,形成稳定的皮克林高内相乳液[42]。等电点沉淀(pI=4.8)是制备酪蛋白颗粒的有效方法[43],结合超声波处理可促进酪蛋白颗粒的破碎和分散[44],形成稳定的o/w 皮克林高内相乳液。采用超声波制备的酪蛋白皮克林乳液具有凝胶状性质,超声功率是影响乳液机械强度的重要因素,功率越高,机械强度大,乳液越稳定[41]。通过均质(8 000 r/min)制备的酪蛋白、果胶与香精油混合物可形成水包油高内相乳液,应用于3D 打印中[45]。
2.2 肉蛋白
2.2.1 明胶(Gelatin)明胶是一种具有生物相容性和可降解性的两亲性聚合物,来源于动物(如皮肤、结缔组织和骨骼)的水解胶原蛋白。明胶蛋白颗粒可以直接作为皮克林稳定剂,对生物活性化合物进行包封,在储存期间对生物活性化合物有显著的保护作用[3]。采用两步去溶剂化方法开发的明胶纳米颗粒可以形成具有光滑孔隙和纹理结构的高内相皮克林乳液。由这些乳液制备的多孔支架具有良好的细胞黏附性和增殖能力,在组织工程中有很大的应用潜力[46]。用京尼平交联制备食品级明胶纳米颗粒(GNPs)来稳定皮克林乳液时,颗粒浓度对皮克林乳液的黏弹性和稳定性有很大的影响[47]。当GNPs 浓度较低时,乳液黏度低;随浓度升高,乳液的黏弹性和稳定性均变好(图2)。
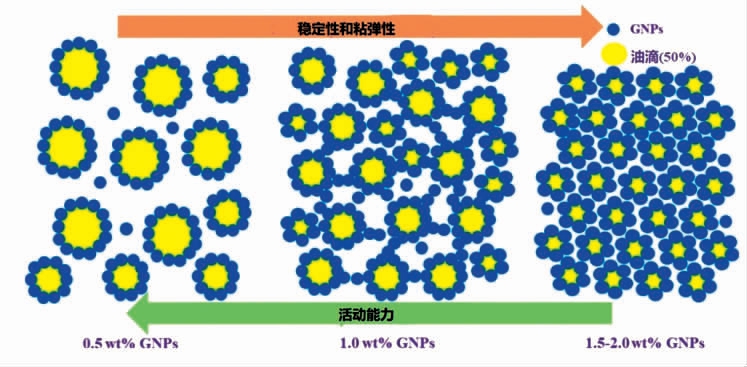
图2 不同颗粒浓度下GNPs 乳液的微观结构[47]
Fig.2 Microstructure of GNPs emulsions with different particle concentrations[47]
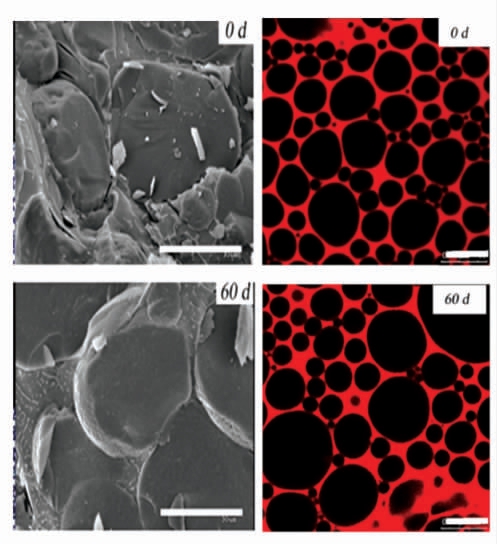
图3 由冷冻扫描电子显微镜和激光共聚焦电子显微镜捕获的猪肉蛋白颗粒稳定的乳液在储藏、加热、未加热和冻融条件下的微观结构图像[49]
Fig.3 Microstructure images of pork protein particle stabilized emulsion captured by cryo-scanning electron microscopy and laser confocal electron microscopy under storage,heated,unheated and freeze-thawed conditions[49]
2.2.2 肌肉蛋白(Mytolin)肌肉蛋白分子质量大、稳定性不高,因而用于皮克林稳定剂的研究较少,但其副产物可以用来制备乳液。目前研究较多的是以肌原纤维蛋白来制备皮克林乳液。Wu 等[30]将鳕鱼肌原纤维蛋白通过水解、酸解后,与大豆油或正己烷混合均质(5 000 r/min),制备了油相为90%的高内相乳液,具有高韧性、强吸附性、高压缩恢复性和成型性,可用于3D 打印。Liu 等[48]研究表明,通过冷冻干燥和超细粉碎工艺制备的鲢鱼肌原纤维蛋白颗粒,在蛋白浓度为4%,油相比为0.7 或0.8 时,可以形成皮克林乳液且具有长期的稳定性。猪肉蛋白颗粒也可用来制备皮克林乳液。Li 等[49]将新鲜猪肉绞碎,离心后的沉淀与橄榄油均质制备皮克林乳液,在pH 3~11 时均能保持稳定。在此条件下形成的高内相乳液保持稳定且具有热和冻融稳定性。
2.3 蛋类蛋白
2.3.1 蛋黄蛋白(Egg yolk protein)蛋黄颗粒具有较低的磷脂和胆固醇含量[50],是制备健康食品乳液的重要生产原料[51]。采用两亲性蛋黄肽自组装形成的球形胶束纳米粒子,具有较小的粒径、中等的润湿性、高表面活性等特点,能够形成平均直径低于200 nm 和聚合物分散性指数小于0.2 的稳定皮克林纳米微滴,在长期储存中具有优越的稳定性[52]。另外,利用酶解脱脂蛋黄粉制备的蛋黄蛋白肽颗粒,水溶性良好且生物活性高,可负载富含ω-3 不饱和脂肪酸的海藻油形成纳米皮克林乳液,有效降低由海藻油氧化酸败所产生的不良风味[53]。
2.3.2 蛋清蛋白(Egg white protein)蛋清蛋白具有优异的营养价值和凝胶特性,是形成皮克林乳液合适的蛋白质[54]。使用加热(90 ℃,45 min)和均质的方法调节溶液参数(酸碱度、蛋白质浓度、盐添加量),可以形成具有纤维状或粒状结构的蛋清蛋白微粒,进而形成稳定的皮克林乳液(图4)。纤维状和粒状蛋清蛋白粒子都表现出亲脂性,能够吸附在油滴表面。与粒状颗粒相比,纤维状颗粒乳化能力更高,可作为稳定剂和脂肪替代品用于沙拉、蛋黄酱和冰淇淋等乳液体系中[4]。蛋清蛋白与黄原胶(10%)混合物在高速均质条件下可形成皮克林乳液,在新型功能性食品配方的应用中有优异潜力[55]。
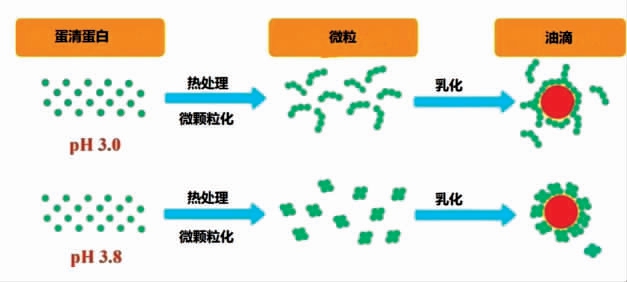
图4 由不同颗粒形态的蛋清蛋白微粒稳定的皮克林乳液[4]
Fig.4 Pickering emulsion stabilized by egg white protein particles with different particle morphology[4]
2.3.3 卵清蛋白(Ovalbumin protein)卵清蛋白是鸡蛋中的一种主要蛋白质,占蛋清总蛋白的54%。通过水解、酸解制备卵清蛋白颗粒,与适量的油混合后可制备具有良好抗氧化性和长期稳定性的皮克林乳液[56]。另外,卵清蛋白在等电点(pH=4.7)附近不稳定,与多糖或多酚复合可以改善乳液的稳定性。将卵清蛋白和单宁酸通过水解、磁力搅拌形成络合物来制备皮克林乳液,乳清蛋白与单宁酸复合物颗粒形成的乳液通过增加络合物之间的静电斥力来获得更小的液滴,提高乳液在卵清蛋白等电点附近的稳定性[57](图5)。卵清蛋白在等电点与羧甲基纤维素(CMC)混合后加热形成络合物,制备的乳液稳定性大大提高[31]。当卵清蛋白与海藻酸钠(w/w=1.5∶1)混合时,可制备出pH 值、热、机械和冻融稳定的皮克林乳液[58]。
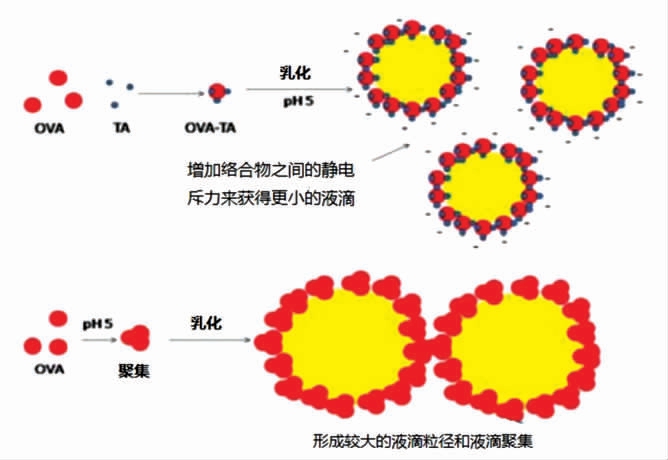
图5 卵清蛋白(OVA)和卵清蛋白-单宁酸复合物(OVA-TA)稳定的乳液[57]
Fig.5 Ovalbumin(OVA)and ovalbumin -tannic acid complex(OVA-TA)stabilized emulsions[57]
2.3.4 卵转铁蛋白(Ovotransferrin)卵转铁蛋白是一种铁结合糖蛋白,占蛋清蛋白的12%,具有多种生物活性,如抗真菌、抗病毒和抗菌活性。将卵转铁蛋白进行水解、过滤和搅拌加热,可以制备相对较短且柔韧的卵转铁蛋白原纤维[59],用于食品配送系统的构建。卵转铁蛋白原纤维可用于制备具有不同离子强度(0~1 000 mmol/L)和pH(2~7)的皮克林乳液,在50 ℃下储存10 d 时乳液仍能保持稳定[59]。另外,卵转铁蛋白与溶酶菌复合颗粒可与三酰基甘油通过均质(10 000 r/min,2 min)形成食品级高内相乳液[27]。在各种颗粒浓度和油组分下,卵转铁蛋白与溶酶菌复合颗粒形成的皮克林乳液可在室温下储存30 d(图6),并且可以提高脂解程度(39%)和姜黄素的生物可及性(22%)。
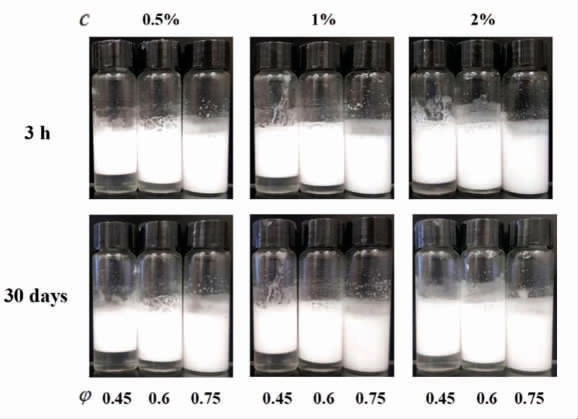
图6 颗粒浓度、油相比和储藏时间对卵转铁蛋白与溶酶菌复合物形成的乳液稳定的影响[27]
Fig.6 Effects of particle concentration,oil ratio and storage time on emulsion stability formed by Ovotransferrin and lysozyme complex[27]
2.4 其它蛋白
采用去溶剂化制备的牛血清白蛋白颗粒(BSA)在颗粒质量分数为2.5wt%时,能够与己烷结合形成高内相皮克林乳液[60];与天然牛血清白蛋白相比,半乳糖糖化的牛血清白蛋白具有更强的结构稳定性和更好的乳化性,可作为水包油皮克林乳液的优异稳定剂[61]。
3 动物蛋白形成皮克林乳液在食品中的应用
3.1 防止脂质氧化
含有较高含量不饱和脂肪酸的食品在加工和储存过程中特别容易发生脂质氧化,产生潜在的致癌物质[62]。许多乳化食品中脂质氧化的主要原因是脂质氢过氧化物和液滴表面附近的过渡金属离子之间的相互作用。由乳清蛋白微凝胶颗粒稳定的皮克林乳液,可以在油滴表面形成物理屏障,阻碍油滴中的脂质氢过氧化物和水相中的过渡金属离子之间的接触,从而有效抑制油滴的氧化[5]。由壳聚糖-酪蛋白复合物制备的高内相皮克林乳液在60 ℃储藏10 h 后,氧化产物的含量远低于散装油[32],对脂质氧化有良好的抑制作用。
3.2 脂肪替代品
皮克林乳液可作为脂肪的替代品来生产各种食品。利用皮克林乳液代替黄油制作蛋糕,可以在不改变颜色和质地的情况下减少热量摄入,延长货架期[63]。另外,皮克林乳液在油脂消化和脂质抗氧化方面具有优势。由卵转铁蛋白原纤维稳定的基于油凝胶的皮克林乳液的消化率和脂解度均高于普通油凝胶[3]。Li 等[49]制备了基于肉蛋白颗粒的不含反式脂肪的高内相皮克林乳液,作为部分氢化油的替代物,形成的乳液在加热和冻融过程中表现出优异的稳定性。
3.3 生物活性物质的包封和递送
与表面活性剂稳定的乳液相比,皮克林乳液在活性物质的包封和递送方面具有优势[17]。Tan等[46,64] 研究了明胶颗粒稳定的高内相皮克林乳液封装β-胡萝卜素的体外消化,发现随着颗粒浓度的增高,β-胡萝卜素的释放时间和释放量均降低,且在储存27 d 后,乳液中β-胡萝卜素保留率与散装油相比有显著的提高。另外,没食子酸与卵转铁蛋白结合形成的皮克林乳液也可显著降低紫外线对姜黄素的降解[65]。乳清蛋白分离物制备的微凝胶可以形成高内相皮克林乳液,对植物乳杆菌进行包封来保护其在巴氏杀菌过程的安全[66],添加微凝胶后,植物乳杆菌的活性显著提高(4 CFU/mL)。
3.4 乳制品的稳定
乳制品在储存或利用过程中容易发生相分离,可以通过添加食品级的皮克林乳化剂来保持其稳定性。牛奶在高温杀菌过程中易发生蛋白质的聚集,添加β-乳球蛋白-葡聚糖颗粒可以提高乳液的热稳定性[67]。酸奶和奶酪产品在pH 值4.5~5.0 范围内储存时容易发生颗粒的聚集和沉淀,添加蛋白质-果胶偶联物可以改善低pH 值下乳液的稳定性[68]。另外,由β-乳球蛋白形成的聚集体对乳制品中泡沫的稳定性也有积极的影响。
3.5 其它应用
皮克林乳液可将液态油转化为黏弹性的固体状凝胶,作为磷的有效替代品用于面包、蛋糕生产中[69];可用于制备功能性食品和营养保健品、响应乳剂、微胶囊。另外,在纹理修饰、3D 打印中也有应用。
4 结语
动物蛋白稳定的皮克林乳液具有绿色环保和可食用等优点,具有巨大的应用潜力。然而,仍有一些挑战需要解决。首先,简单和低成本的制备方法仍然需要探索。其次,在实际的加工和储存过程中,皮克林乳液与食物基质中的成分如电解质、表面活性剂和胶体会发生反应,可能会对皮克林乳液及其产品的稳定性产生不利影响。再次,尽管动物蛋白稳定的皮克林乳液已被广泛研究,但主要是实验室的小规模生产,还不足以用于商业应用,实现大规模工业化生产。因此,仍需要进一步研究皮克林乳液在食品体系中的稳定及应用机制,扩大其应用范围。
[1]ABDULLAH,WEISS J,AHMAD T,et al.A review of recent progress on high internal-phase Pickering emulsions in food science[J].Trends in Food Science &Technology,2020,106:91-103.
[2]SHI A M,FENG X Y,WANG Q,et al.Pickering and high internal phase Pickering emulsions stabilized by protein-based particles:A review of synthesis,application and prospective[J].Food Hydrocolloids,2020,109:106117.
[3]XIA T H,XUE C H,WEI Z H.Physicochemical characteristics,applications and research trends of edible Pickering emulsions[J].Trends in Food Science &Technology,2021,107:1-15.
[4]CHANG C H,NIU F G,GU L P,et al.Formation of fibrous or granular egg white protein microparticles and properties of the integrated emulsions[J].Food Hydrocolloids,2016,61:477-486.
[5]YAN X J,MA C C,CUI F Z,et al.Protein-stabilized Pickering emulsions:Formation,stability,properties,and applications in foods[J].Trends in Food Science &Technology,2020,103:293-303.
[6]LINKE C,DRUSCH S.Pickering emulsions in foods-opportunities and limitations[J].Critical Reviews in Food Science and Nutrition,2018,58(12):1971-1985.
[7]ORTIZ D,POCHAT-BOHATIER C,CAMBEDOUZOU J,et al.Current trends in Pickering emulsions:particle morphology and applications[J].Engineering,2020,6(4):468-482.
[8]NIROULA A,GAMOT T,WEI O,et al.Biomolecule-based pickering food emulsions:Intrinsic components of food matrix,recent trends and prospects[J].Food Hydrocolloids,2021,112:106303.
[9]LOW L,SIVA S,HO Y,et al.Recent advances of characterization techniques for the formation,physical properties and stability of Pickering emulsion[J].Advances in Colloid and Interface Science,2020,277(C):102117.
[10]朱雨晴,刘伟,陈兴,等.食品级皮克林乳液的稳定机制及稳定性研究进展[J].食品工业科技,2018,39(7):315-322.ZHU Y Q,LIU W,CHEN X,et al.Research progress on stability mechanism and stability of food-grade Pickering emulsion[J].Science and Technology of Food Industry,2018,39(7):315-322.
[11]LEVINE S,BOWEN B,PARTRIDGE S.Stabilization of emulsions by fine particles II.capillary and van der Waals forces between particles[J].Colloids and surfaces,1989,38(2):345-364.
[12]GUILLOT S,BERGAYA F,DE AZEVEDO C,et al.Internally structured pickering emulsions stabilized by clay mineral particles[J].Journal of Colloid and Interface Science,2009,333(2):563-569.
[13]OTERO J,MEEKER S,CLEGG P.Compositional ripening of particle-stabilized drops in a three-liquid system[J].Soft Matter,2018,14(19):3783-3790.
[14]STYLE R,ISA L,DUFRESNE E.Adsorption of soft particles at fluid interfaces [J].Soft Matter,2015,11(37):7412-7419.
[15]ZHANG N N,ZHANG L,SUN D J.Influence of emulsification process on the properties of Pickering emulsions stabilized by layered double hydroxide particles[J].Langmuir:the ACS Journal of Surfaces and Colloids,2015,31(16):4619-4126.
[16]ALISON L,RU?HS P,TERVOORT E,et al.Pickering and network stabilization of biocompatible emulsions using chitosan-modified silica nanoparticles[J].Langmuir,2016,32(50):13446-13457.
[17]MWANGI W,LIM H,LOW L,et al.Food-grade Pickering emulsions for encapsulation and delivery of bioactives[J].Trends in Food Science &Technology,2020,100:320-332.
[18]LI X M,XIE Q T,ZHU J,et al.Chitosan hydrochloride/carboxymethyl starch complex nanogels as novel Pickering stabilizers:Physical stability and rheological properties[J].Food Hydrocolloids,2019,93:215-225.
[19]WEI Z H,HUANG Q.Developing organogel-based Pickering emulsions with improved freeze-thaw stability and hesperidin bioaccessibility[J].Food Hydrocolloids,2019,93:68-77.
[20]LI X,LI J,GONG J,et al.Cellulose nanocrystals(CNCs)with different crystalline allomorph for oil in water Pickering emulsions[J].Carbohydrate Polymers,2018,183:303-310.
[21]田怀香,卢卓彦,胡静.食品级皮克林乳液制备及应用研究进展[J].中国食品学报,2018,18(1):225-232.TIAN H X,LU Z Y,HU J.Progress in preparation and application of food-grade Pickering emulsion[J].Journal of Chinese Institute of Food Science and Technology,2018,18(1):225-232.
[22]RIDEL L,BOLZINGER M,GILON-DELEPINE N,et al.Pickering emulsions stabilized by charged nanoparticles[J].Soft Matter,2016,12(36):7564-7576.
[23]ZHU Q M,LI Y H,LI S Z,et al.Fabrication and characterization of acid soluble collagen stabilized Pickering emulsions [J].Food Hydrocolloids,2020,106:105875.
[24]DING M Z,LIU L J,ZHANG T,et al.Effect of interfacial layer number on the storage stability and in vitro digestion of fish oil-loaded multilayer emulsions consisting of gelatin particle and polysaccharides[J].Food Chemistry,2021,336:127686.
[25]LACA A,SÁENZ M,PAREDES B,et al.Rheological properties,stability and sensory evaluation of low-cholesterol mayonnaises prepared using egg yolk granules as emulsifying agent[J].Journal of Food Engineering,2010,97(2):243-252.
[26]LV P F,WANG D,DAI L,et al.Pickering emulsion gels stabilized by high hydrostatic pressure-induced whey protein isolate gel particles:Characterization and encapsulation of curcumin[J].Food Research International,2020,132:109032.
[27]WEI Z H,CHENG Y J,HUANG Q R.Heteroprotein complex formation of ovotransferrin and lysozyme:Fabrication of food-grade particles to stabilize Pickering emulsions[J].Food Hydrocolloids,2019,96:190-200.
[28]LI Z F,XIAO M D,WANG J F,et al.Pure protein scaffolds from pickering high internal phase emulsion template[J].Macromolecular Rapid Communications,2013,34(2):169-174.
[29]GUO Y,WU C,DU M,et al.In-situ dispersion of casein to form nanoparticles for Pickering high internal phase emulsions[J].LWT,2021,139:110538.
[30]WU C,NA X K,MA W C,et al.Strong,elastic,and tough high internal phase emulsions stabilized solely by cod myofibers for multidisciplinary applications[J].Chemical Engineering Journal,2021,412:128724.
[31]LI Z S,KUANG H R,YANG J C,et al.Improving emulsion stability based on ovalbumin -carboxymethyl cellulose complexes with thermal treatment near ovalbumin isoelectric point[J].Scientific Reports,2020,10(1):3456.
[32]HUANG X N,ZHOU F Z,YANG T,et al.Fabrication and characterization of Pickering High Internal Phase Emulsions(HIPEs)stabilized by chitosan-caseinophosphopeptides nanocomplexes as oral delivery vehicles[J].Food Hydrocolloids,2019,93:34-45.
[33]ZHU X F,ZHENG J,LIU F,et al.Freeze-thaw stability of Pickering emulsions stabilized by soy protein nanoparticles.Influence of ionic strength before or after emulsification[J].Food Hydrocolloids,2018,74:37-45.
[34]WIJAYA W,VAN DER MEEREN P,WIJAYA C,et al.High internal phase emulsions stabilized solely by whey protein isolate-low methoxyl pectin complexes:effect of pH and polymer concentration[J].Food &function,2017,8(2):584-594.
[35]ZHU Y,HUAN S Q,BAI L,et al.High internal phase oil-in-water pickering emulsions stabilized by chitin nanofibrils:3D structuring and solid foam[J].ACS Applied Materials &Interfaces,2020,12(9):11240-11251.
[36]MANTOVANI R,DE FIGUEIREDO FURTADO G,NETTO F,et al.Assessing the potential of whey protein fibril as emulsifier [J].Journal of Food Engineering,2018,223:99-108.
[37]MURRAY B,PHISARNCHANANAN N.Whey protein microgel particles as stabilizers of waxy corn starch+locust bean gum water-in-water emulsions[J].Food Hydrocolloids,2016,56:161-169.
[38]ZAMANI S,MALCHIONE N,SELIG M,et al.Formation of shelf stable Pickering high internal phase emulsions(HIPE)through the inclusion of whey protein microgels[J].Food &Function,2018,9(2):982-990.
[39]GAO Z M,ZHAO J J,HUANG Y,et al.Edible Pickering emulsion stabilized by protein fibrils.Part 1:Effects of pH and fibrils concentration[J].LWTFood Science and Technology,2017,76:1-8.
[40]SERFERT Y,LAMPRECHT C,TAN C P,et al.Characterisation and use of β-lactoglobulin fibrils for microencapsulation of lipophilic ingredients and oxidative stability thereof[J].Journal of Food Engineering,2014,143:53-61.
[41]BI A Q,XU X B,GUO Y,et al.Ultrasound prefractured casein and in-situ formation of high internal phase emulsions[J].Ultrasonics Sonochemistry,2020,64:104916.
[42]CHEN S,ZHANG L M.Casein nanogels as effective stabilizers for Pickering high internal phase emulsions[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2019,579:123662.
[43]COHEN -ADDAD S,HÖHLER R.Rheology of foams and highly concentrated emulsions[J].Current Opinion in Colloid &Interface Science,2014,19(6):536-548.
[44]DESHMUKH O S,VAN DEN ENDE D,STUART M C,et al.Hard and soft colloids at fluid interfaces:Adsorption,interactions,assembly &rheology[J].Advances in Colloid and Interface Science,2015,222:215-227.
[45]BI A Q,XU X B,GUO Y,et al.Fabrication of flavour oil high internal phase emulsions by casein/pectin hybrid particles:3D printing performance[J].Food Chemistry,2022,371:131349.
[46]TAN H,TU Z,JIA H,et al.Hierarchical porous protein scaffold templated from high internal phase emulsion costabilized by gelatin and gelatin nanoparticles[J].Langmuir,2018,34(16):4820-4829.
[47]FENG X,DAI H,MA L,et al.Properties of Pickering emulsion stabilized by food-grade gelatin nanoparticles:Influence of the nanoparticles concentration[J].Colloids and Surfaces B:Biointerfaces,2020,196:111294.
[48]LIU C,FAN L,YANG Y,et al.Characterization of surimi particles stabilized novel pickering emulsions:Effect of particles concentration,pH and Na-Cl levels[J].Food Hydrocolloids,2021,117:106731.
[49]LI R,HE Q,GUO M,et al.Universal and simple method for facile fabrication of sustainable high internal phase emulsions solely using meat protein particles with various pH values[J].Food Hydrocolloids,2020,100:105444.
[50]ERCELEBI E A,IBANOGLU E.Stability and rheological properties of egg yolk granule stabilized emulsions with pectin and guar gum[J].International Journal of Food Properties,2010,13(3):618-630.
[51]RAYNER M,MARKU D,ERIKSSON M,et al.Biomass-based particles for the formulation of Pickering type emulsions in food and topical applications[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2014,458:48-62.
[52]DU Z,LI Q,LI J,et al.Self-assembled egg yolk peptide micellar nanoparticles as a versatile emulsifier for food-grade oil-in-water Pickering nanoemulsions[J].Journal of Agricultural and Food Chemistry,2019,67(42):11728-11740.
[53]万芝力,苏恩谊,杜振亚,等.由蛋黄蛋白肽颗粒稳定的海藻油纳米皮克林乳液与油粉及其制备方法与应用:CN110101084A,2019-08-09[P].2023-02-10.WAN Z L,SU E Y,DU Z Y,et al.Preparation method and Application of Seaweed Oil Nano-Pickering emulsion and oil powder stabilized by egg yolk protein peptide particles:CN110101084A,2019 -08-09[P].2023-02-10.
[54]MINE Y.Recent advances in the understanding of egg white protein functionality[J].Trends in Food Science &Technology,1995,6(7):225-232.
[55]DRAKOS A,KIOSSEOGLOU V.Stability of acidic egg white protein emulsions containing xanthan gum[J].Journal of Agricultural and Food Chemistry,2006,54(26):10164-10169.
[56]XU Y T,TANG C H,LIU T X,et al.Ovalbumin as an outstanding Pickering nanostabilizer for high internal phase emulsions[J].Journal of Agricultural and Food Chemistry,2018,66(33):8795-8804.
[57]CHEN Y,HU J,YI X,et al.Interactions and emulsifying properties of ovalbumin with tannic acid[J].Lwt,2018,95:282-288.
[58]ZHANG Z K,XIAO J X,HUANG G Q.Pickering emulsions stabilized by ovalbumin-sodium alginate coacervates[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2020,595:124712.
[59]WEI Z,CHENG J,HUANG Q.Food-grade Pickering emulsions stabilized by ovotransferrin fibrils[J].Food Hydrocolloids,2019,94:592-602.
[60]TANG C H.Globular proteins as soft particles for stabilizing emulsions:Concepts and strategies [J].Food Hydrocolloids,2020,103:105664.
[61]XU Y T,TANG C H,BINKS B P.High internal phase emulsions stabilized solely by a globular protein glycated to form soft particles[J].Food Hydrocolloids,2020,98:105254.
[62]DUTHIE G,CAMPBELL F,BESTWICK C,et al.Antioxidant effectiveness of vegetable powders on the lipid and protein oxidative stability of cooked turkey meat patties:Implications for health[J].Nutrients,2013,5(4):1241-1252.
[63]FENG X,SUN Y,YANG Y,et al.Zein nanoparticle stabilized Pickering emulsion enriched with cinnamon oil and its effects on pound cakes [J].LWT,2020,122:109025.
[64]TAN H,SUN G,LIN W,et al.Gelatin particlestabilized high internal phase emulsions as nutraceutical containers[J].ACS Applied Materials &Interfaces,2014,6(16):13977-13984.
[65]WEI Z,ZHANG H,HUANG Q.Curcumin-loaded Pickering emulsion stabilized by insoluble complexes involving ovotransferrin -gallic acid conjugates and carboxymethyldextran[J].Food &Function,2019,10(8):4911-4923.
[66]SU J,WANG X,LI W,et al.Enhancing the viability of lactobacillus plantarum as probiotics through encapsulation with high internal phase emulsions stabilized with whey protein isolate microgels [J].Journal of Agricultural and Food Chemistry,2018,66(46):12335-12343.
[67]JIMÉNEZ -CASTAÑO L,LÓPEZ -FANDIÑO R,OLANO A,et al.Study on β-lactoglobulin glycosylation with dextran:effect on solubility and heat stability[J].Food Chemistry,2005,93(4):689-695.
[68]NEIRYNCK N,VAN DER MEEREN P,GORBE S B,et al.Improved emulsion stabilizing properties of whey protein isolate by conjugation with pectins[J].Food Hydrocolloids,2004,18(6):949-957.
[69]ZENG T,WU Z,ZHU J Y,et al.Development of antioxidant Pickering high internal phase emulsions(HIPEs)stabilized by protein/polysaccharide hybrid particles as potential alternative for PHOs[J].Food Chemistry,2017,231:122-130.