豆粕为一种植物源蛋白,具有高浓度的蛋白质和适宜的氨基酸比例,有着很高的开发利用价值[1-2]。目前,豆粕主要作为饲料直接喂养动物,其中的大豆抗原蛋白和抗营养因子,大大限制了动物对豆粕蛋白的消化吸收[3]。酶解豆粕克服了豆粕本身的缺陷,提高了蛋白质的消化率,降低其过敏性,并能生产出功能特性更好的大豆小肽。大豆小肽主要由3~6 个氨基酸组成,分子质量约1 000 u,主要分布在300~700 u 范围,除易吸收外[4],还具有调节血压[5],抑制慢性肾病[6],免疫调节[7],抗癌活性[8],抗菌、抗病毒[9],改善肠道微生物活性[10],降低胆固醇和抗糖尿病[11]等生物活性。
酶解蛋白质已被广泛利用,与酸解和碱解等方式相比,酶解不仅反应温和,而且具有很强的特异性[12]。现有研究主要以液态酶解豆粕肽为主,对半固态酶解豆粕的工艺鲜有报道。半固态酶解豆粕通过加入适当的水,使豆粕以固态存在,通过调节温度、时间、加酶量等条件优化酶解工艺[13]。半固态酶解相对于液态酶解来说,半固态酶解豆粕易于烘干,有利于豆粕饲料的规模性生产。酶水解程度通常以水解度来量化,它表示被切割的肽键与初始肽键数的百分比。然而,水解度并不能完全反映酶水解情况,需以小肽含量和肽段长度共同判断[14-15]。
本试验以豆粕为原料,以豆粕水解度、豆粕肽含量、小肽分子质量和疏水值为半固态酶解的重要指标,筛选适合半固态酶解的蛋白酶,优化酶水解条件,旨在为豆粕的工业化生产提供理论参考。
1 材料与方法
1.1 材料与试剂
豆粕,中粮佳悦(天津)有限公司;碱性蛋白酶(200 U/mg)、中性蛋白酶(100 U/mg)、胰蛋白酶(250 U/mg)、角蛋白酶(70 U/mg)、木瓜蛋白酶(800 U/mg),源叶生物科技有限公司;L-甘氨酸、杆菌肽,北京索莱宝科技有限公司;Gly-Gly-Gly、Gly-Gly-Try-Arg,Sigma 公司;胰岛素(猪胰腺),上海阿拉丁试剂有限公司;其它试剂均为AR 级。
1.2 仪器与设备
AL104 电子天平,瑞士Mettler Toledo 公司;电热恒温鼓风干燥箱,上海新苗医疗器械制造有限公司;紫外可见分光光度计,北京普析通用仪器有限公司;多功能酶标仪,美国赛默飞世尔科技公司;Agilent Technologies 1290 infinity 高效液相色谱仪(配有DAD 检测器),安捷伦科技(中国)有限公司。
1.3 试验方法
1.3.1 半固态酶解方法 将豆粕粉碎过60 目筛,准确称取适量的豆粕于反应器中,根据酶活力单位准确称取适量的蛋白酶加入反应器中,搅拌均匀后加入适量的蒸馏水,搅拌至水在豆粕中均匀分散,封上保鲜膜在恒温箱中反应。反应到预定时间,取出放置于105 ℃烘箱中,灭酶15 min。冷却,放到烘箱中35 ℃低温烘干,得到半固态酶解的豆粕。
1.3.2 半固态酶解豆粕中多肽液提取 称取半固态酶解豆粕0.5000 g,溶于50 mL 的离心管中恒温振荡6 h,将振荡后的豆粕酶解液置于冰箱中4℃冷藏过夜。冷藏后的豆粕酶解液4 000 r/min 离心15 min,收集上清液。
1.3.3 水解度的测定
1)豆粕完全水解液制备 称取7.5 g 豆粕于烧杯中,加入75 mL 6 mol/L HCI 密封后放入110~120 ℃烘箱中水解24 h,取出后冷却。用滤纸过滤,滤液用蒸馏水定容75 mL。吸取适量豆粕完全酶解液,用40%和2%的NaOH 调pH 值中性(pH=6),定容。取完全水解液2 mL 于25 mL 比色管中,加入1 mL 茚三酮溶液混匀,沸水浴加热15 min,然后快速冷却,加入5 mL 40%乙醇溶液反应15 min,570 nm 测吸光度。
2)工作曲线的绘制 取100 mg 甘氨酸溶于蒸馏水后定容至100 mL 作为标准溶液,取相应体积标准溶液,按上述方法测定吸光度。以甘氨酸的浓度与吸光度制作工作曲线,取线性部分做标准曲线。
3)水解液水解度的测定 取多肽提取液,稀释至可测浓度,取水解液2 mL 于25 mL 比色管中,加入1 mL 茚三酮溶液混匀,沸水浴加热15 min,冷却,加入5 mL 40%乙醇溶液反应15 min,于波长570 nm 处测吸光度,根据吸光度计算蛋白质含量[16]。按下式计算水解度:
式中,A——蛋白质质量(mg);M——样品质量(g);V1——水解液的总体积(mL);V2——显色时所用的稀释液的体积(mL)。
1.3.4 小肽含量的测定 参考余勃等[17]的方法。取等体积的三氯乙酸(0.4 mol/L)加入酶解液中,混匀反应30 min,反应结束以10 000 r/min 离心10 min,取上清液1 mL 加入4 mL 双缩脲试剂,混匀室温放置30 min,于波长540 nm 处测吸光度。
1.3.5 酶解液分子质量测定 参考文献[18]和[19]的方法。采用Agilent Technologies 1290 infinity高效液相色谱仪(配置Agilent Technologies 1200 series DAD 检测器)对制备的豆粕酶解液进行分子质量分布的测定。色谱柱:TSKgeL2000 SWXL(300 mm×7.8 mm);流动相:水(0.1%三氟乙酸);检测波长:214 nm;流速:0.6 mL/min;柱温:30 ℃;进样量:10 μL。
1.3.6 疏水值的测定 参考文献[20]和[21]的方法。用0.01 mol/L pH 6.5 的磷酸缓冲液将豆粕酶解液稀释至质量分数0.02%,0.04%,0.06%,0.08%,0.10%,并配制8.0 mmol/L ANS 溶液。取2 mL 上述配制稀释液,加入10 μL ANS 立即混匀。在荧光分光光度计中于激发波长390 nm、发射波长470 nm 检测荧光强度,激发和发射夹缝宽均为5 mm。以荧光强度为纵坐标,豆粕质量分数为横坐标进行线性回归,以线性回归斜率为疏水值指数。
1.3.7 蛋白酶的筛选 以豆粕肽的得率、水解度、分子质量分布和疏水值为指标,考察胰蛋白酶、角蛋白酶、木瓜蛋白酶、碱性蛋白酶、中性蛋白酶5种蛋白酶在适宜的条件下酶的水解特性,确定最佳蛋白酶的类型。
表1 5 种蛋白酶酶解条件
Table 1 Enzymatic hydrolysis conditions of 5 proteases

1.3.8 单因素实验 在豆粕质量30 g,酶解温度50 ℃,酶解时间36 h,液固比为1 mL/g 的条件下,考察加酶量(10,20,30,40,50,60 mg/g)对水解度的影响。
在豆粕质量30 g,酶解温度50 ℃,酶解时间36 h,加酶量40 mg/g 的条件下,考察液固比(0.5,1,1.5,2,2.5 mL/g)对水解度的影响。
在豆粕质量30 g,酶解温度50 ℃,液固比为1 mL/g,加酶量40 mg/g 的条件下,考察酶解时间(12,24,36,48,60,72 h)对水解度的影响。
在豆粕质量30 g,酶解时间36 h,液固比为1 mL/g,加酶量40 mg/g 的条件下,考察温度(30,40,50,60,70,80 ℃)对水解度的影响。
在酶解温度50 ℃,酶解时间36 h,液固比为1 mL/g,加酶量40 mg/g 的条件下,豆粕质量(10,20,30,40,50,60 g)对水解度的影响。
1.3.9 响应面优化试验 在单因素实验基础上,应用Box-Behnken Design 进行响应面优化试验。选择试验中可优化因素(豆粕质量、酶解温度和液固比)进行优化,因素与水平见表2。
表2 响应面设计因素水平表
Table 2 Level table of response surface design factors
2 结果与分析
2.1 蛋白酶的筛选
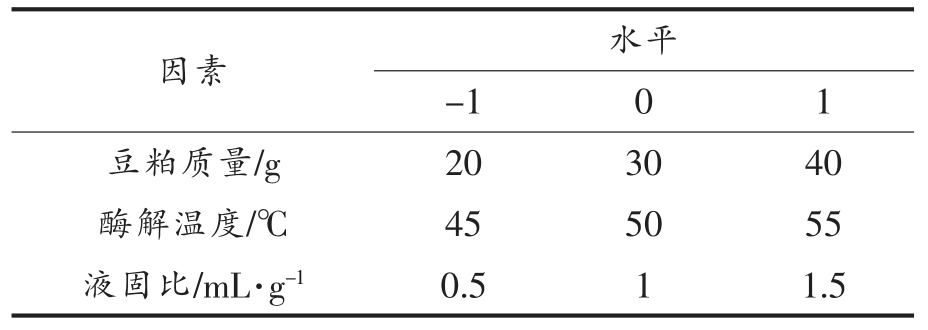
2.1.1 不同蛋白酶对水解度的影响 由图1 可知,木瓜蛋白酶和角蛋白酶随着加酶量的增大,水解度先增大后降低,在酶添加量为30 mg/g 时达到顶点,木瓜蛋白酶的水解效率最高,角蛋白酶水解效率偏低。胰蛋白酶、碱性蛋白酶、中性蛋白酶均随加酶量的增大,水解度持续增大,到达一定值后,水解度上升趋于平缓,可能是由于水解产物中氨基酸和小肽的不断增加,酶被底物完全饱和。蛋白酶浓度增加,豆粕中的蛋白质会被高度水解,当酶浓度超过最佳浓度时,酶活性会显著减弱,过量的蛋白酶聚集导致底物扩散抑制增加,反应速率饱和,进而导致水解度降低[20-22]。由图1 可以看出,木瓜蛋白酶的水解效果最好,豆粕大部分被酶解成游离的氨基酸和不同链长的多肽,胰蛋白酶和碱性蛋白酶的水解度比木瓜蛋白酶低,而呈现上升的趋势,胰蛋白酶水解度上升趋势明显,随着加酶量升高,水解度高于碱性蛋白酶,与木瓜蛋白酶相接近。
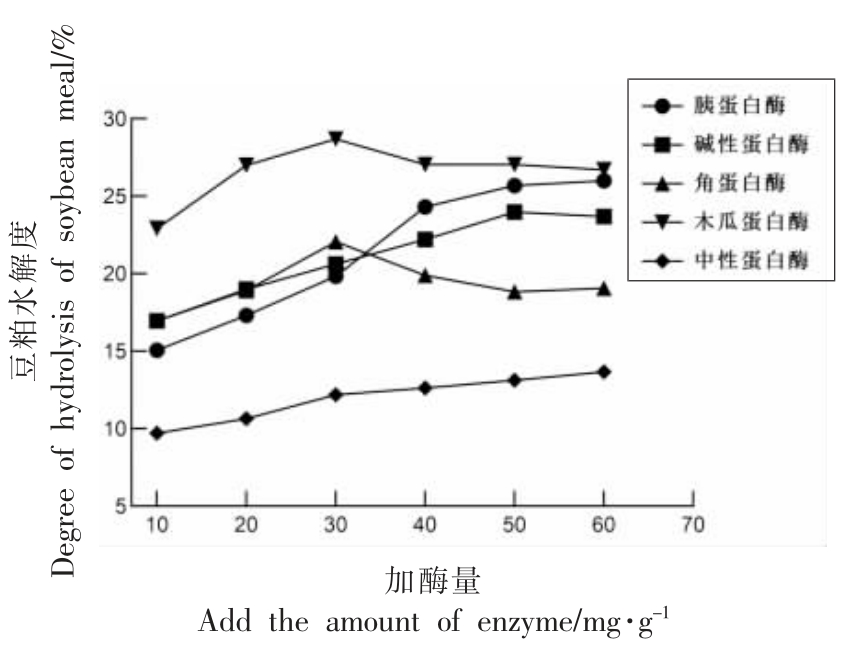
图1 5 种蛋白酶对豆粕水解度的影响
Fig.1 Effects of 5 proteases on hydrolysis degree of soybean meal
2.1.2 不同蛋白酶对豆粕肽得率的影响 由图2可知,随着加酶量的增大,胰蛋白酶、碱性蛋白酶、木瓜蛋白酶、中性蛋白酶均随着加酶量的增多,豆粕肽得率呈递增趋势。图1、图2 结果显示木瓜蛋白酶的水解度较高,呈现先增后减的趋势,豆粕肽得率最低且持续增长,这可能主要是由于木瓜蛋白酶在酶解过程中,前期豆粕蛋白主要被酶解为长链肽。然而随着加酶量增多,底物抑制增强,形成长链肽的速率降低,短链肽形成速率增加,总体酶解速率降低。通过对豆粕肽得率的研究发现,胰蛋白酶、碱性蛋白酶、角蛋白酶酶解产物的豆粕肽得率较高,木瓜蛋白酶酶解产物中多肽浓度处于较低水平。
图2 5 种蛋白酶对豆粕肽得率的影响
Fig.2 Effects of 5 proteases on peptide yield of soybean meal
2.1.3 分子质量的测定 从表3 可知,角蛋白酶酶解产物中分子质量>1 000 u 的肽占比较高,说明角蛋白酶酶解产物中含有大量的长链肽,其它蛋白酶酶解产物中分子质量<1 000 u 的低分子肽含量较高,其中胰蛋白酶、中性蛋白酶的酶解产物中,分子质量在150~500 u 的肽含量较高,主要为二肽和三肽的小肽,研究表明,短链的大豆肽具有特定的生物活性,其中二肽和三肽比完整蛋白或者游离氨基酸更容易消化,因此被认为是人类营养合适的蛋白质来源[23]。木瓜蛋白酶的酶解产物中分子质量<150 u 的肽含量较高。结果表明,胰蛋白酶和中性蛋白酶的酶解产物中小肽含量高,可以有效增加产品品质,促进消化吸收。角蛋白酶酶解后大分子肽含量高,木瓜蛋白酶酶解产物主要以游离氨基酸为主,在制备豆粕肽的工艺中效果欠佳。
表3 5 种蛋白酶最适条件下分子质量分布表
Table 3 Molecular weight distribution of 5 proteases in optimal conditions
2.1.4 疏水值测定 ANS 荧光探针法测得的疏水性指数,可以在一定程度上反映肽链上疏水氨基酸的含量。表面疏水值越高,说明肽链中的疏水性氨基酸残基越多,所产生的苦味就越强[24]。从表4可以看出,角蛋白酶的酶解产物表面疏水值为60.47,是所有蛋白酶酶解产物中的最低水平。碱性蛋白酶作为一种内切酶,与疏水性和碱性残基C 末端结合的特异性较差[25],疏水性指数在5 种蛋白酶中最高。胰蛋白酶主要作用于精氨酸和赖氨酸残基,具有很强的特异性,疏水性指数变化不大,中性蛋白酶是一种外源性蛋白酶,对肽键的专一性不强,疏水值变化明显。因此角蛋白酶的酶解产物苦味较淡,易于接受。胰蛋白酶和中性蛋白酶酶解产物的苦味适中,中性蛋白酶酶解产物受反应条件影响,口味差异大。碱性蛋白酶在水解过程中,非极性基团在蛋白质三级结构中暴露出来,酶解的产物苦味较重。
表4 5 种蛋白酶最适条件下的疏水值
Table 4 Hydrophobic values of 5 proteases under optimal conditions

综合考虑蛋白酶酶解产物以上几种因素,胰蛋白酶的水解度较高,豆粕肽得率达到18.06%,是几种蛋白酶中肽得率最高的,而且豆粕肽主要为二肽、三肽,品质较优,苦味偏淡,故选择胰蛋白酶作为最优的水解酶。
2.2 单因素实验结果
2.2.1 加酶量对酶解的影响 由图3a 可知,当加酶量达到40 mg/g 时,豆粕的水解度和豆粕肽得率的变化趋势都逐渐变缓。表明随着酶添加量的不断增多,豆粕蛋白转化为豆粕多肽的数量增加。然而,当酶添加量到达一定值时,酶与酶之间会产生竞争性抑制,随着酶添加量增加,酶解反应速率不会产生显著性变化。在图3b 中随加酶量增加,分子质量>1 000 u 和分子质量在500~1 000 u 之间的豆粕肽占比逐渐减小,分子质量在150~500 u之间的占比逐渐增加。结合图3a 的豆粕肽得率可以看出,随加酶量逐渐增加,酶解产生的长链肽增量逐渐减少,一方面,豆粕蛋白大分子大部分被酶催化,另一方面,酶的浓度过大,一部分酶转移方向,开始酶解长链的豆粕肽。当酶添加量超过40 mg/g 时,豆粕肽得率处于近乎停滞的状态,豆粕肽的分子质量分布也没有明显变化,从经济成本和效率综合考虑,胰蛋白酶的加酶量确定为40 mg/g。
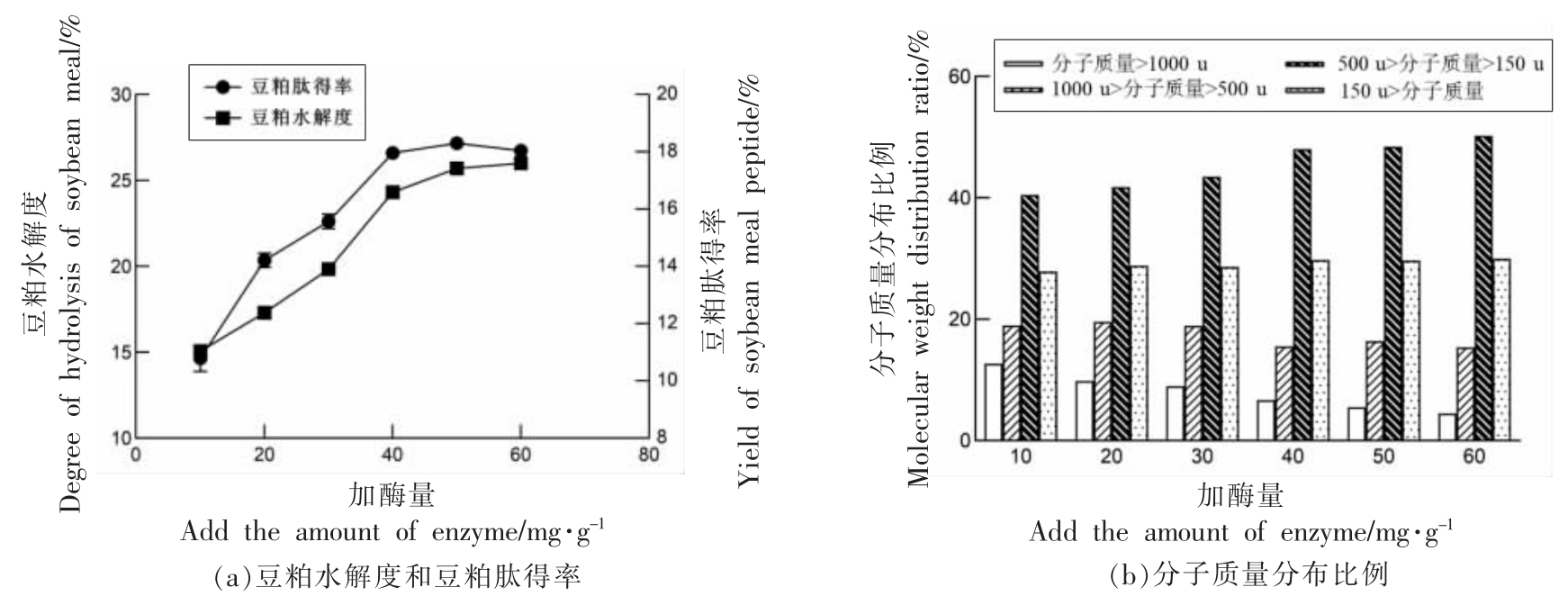
图3 加酶量对酶解的影响
Fig.3 Effect of enzyme dosage on enzymatic hydrolysis
2.2.2 酶解时间对酶解的影响 如图4a 所示,当酶解时间达到36 h 时,豆粕的水解度和肽得率随酶解时间的延长,增长趋势明显。超过36 h 后,一方面反应时间延长,参加酶促反应的底物减少,另一方面胰蛋白酶可能受到多肽和氨基酸的抑制,豆粕的水解度和肽得率增长趋于平缓甚至降低。从图4b 可以看出,豆粕肽分子质量在150~1 000 u 之间的占比处于一个相对稳定的状态,随酶解时间的延长,只会产生更多氨基酸。这是由于胰蛋白酶具有广泛的特异性,主要切割精氨酸或赖氨酸的肽键,因此在36 h 内,胰蛋白酶的酶解程度增加速率不断上升,酶解物主要与酶切位点的偏好有关。酶解时间超过36 h,豆粕肽的得率逐渐减少,水解度上升,这是因为水解反应一直在进行,反应生成的豆粕肽一部分被降解成游离的氨基酸[26],故酶解36 h 是最优的酶解时间。

图4 酶解时间对酶解的影响
Fig.4 Influence of enzymatic hydrolysis time on enzymatic hydrolysis
2.2.3 豆粕量对酶解的影响 如图5a 所示,当豆粕添加量达到30 g 时,豆粕的水解度和肽得率达到最高。在底面积相同的容器中,随着豆粕量的增加,豆粕的表面积和内部面积发生变化,表面易干燥内部水分迁移较弱,表面温度与内部温度不同等问题都会影响豆粕的酶解。当酶添加量超过30 g 时,豆粕的水解度和肽得率降低,长链的豆粕肽占比不断增大,说明豆粕添加量的变化会对胰蛋白酶的作用产生影响,豆粕添加量为40 g 时,小分子肽占比略高于豆粕添加量为30 g,而肽得率明显下降。故确定豆粕量为30 g。

图5 豆粕量对酶解的影响
Fig.5 Influence of soybean meal content on enzymatic hydrolysis
2.2.4 酶解温度对酶解的影响 如图6a 所示,随着温度的升高,豆粕的水解度和肽得率不断上升,当温度达到50 ℃时,豆粕的水解度和肽得率效果最好,分别达到14.8%和16.13%。升高温度,蛋白的活化能和酶的活性都会升高,豆粕的水解度和肽得率也会提高。然而随温度的进一步升高会导致酶失活,酶解的速度降低。在酶解温度为50 ℃的条件下,豆粕肽的二肽、三肽含量最高,说明适宜的温度有助于蛋白的解离,蛋白酶更容易到达适宜的酶切位点,酶解产物多为豆粕肽。当温度超过50 ℃,解聚的蛋白亚基会重新聚集成团,不利于豆粕的酶解,而且酶解多发生在折叠的豆粕蛋白表面,产物中多为游离氨基酸,因此选择酶解温度50 ℃为最适温度。
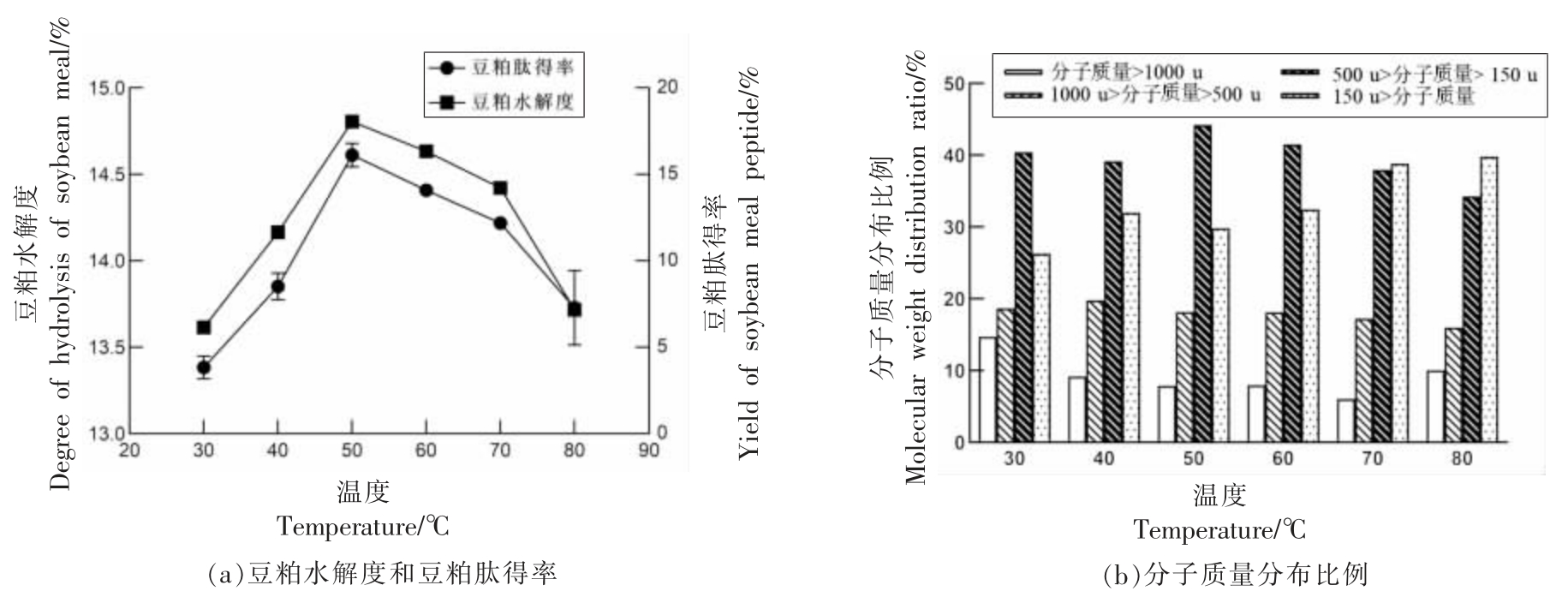
图6 酶解温度对酶解的影响
Fig.6 Influence of enzymatic hydrolysis temperature on enzymatic hydrolysis
2.2.5 液固比对酶解的影响 如图7a 所示,当液固比为1 mL/g 时,豆粕的水解度、肽得率,还有二肽、三肽的含量占比均最高,胰蛋白酶来自动物的胰脏,其酶解特性更加接近于生物,当液固比不断增大,水解度和肽得率都会随之降低,豆粕被直接酶解成游离的氨基酸,适宜的液固比,更容易得到酶解的中间产物豆粕肽。从生产成本角度而言,液固比越高,后续的干燥成本就越高,故液固比确定为1 mL/g。
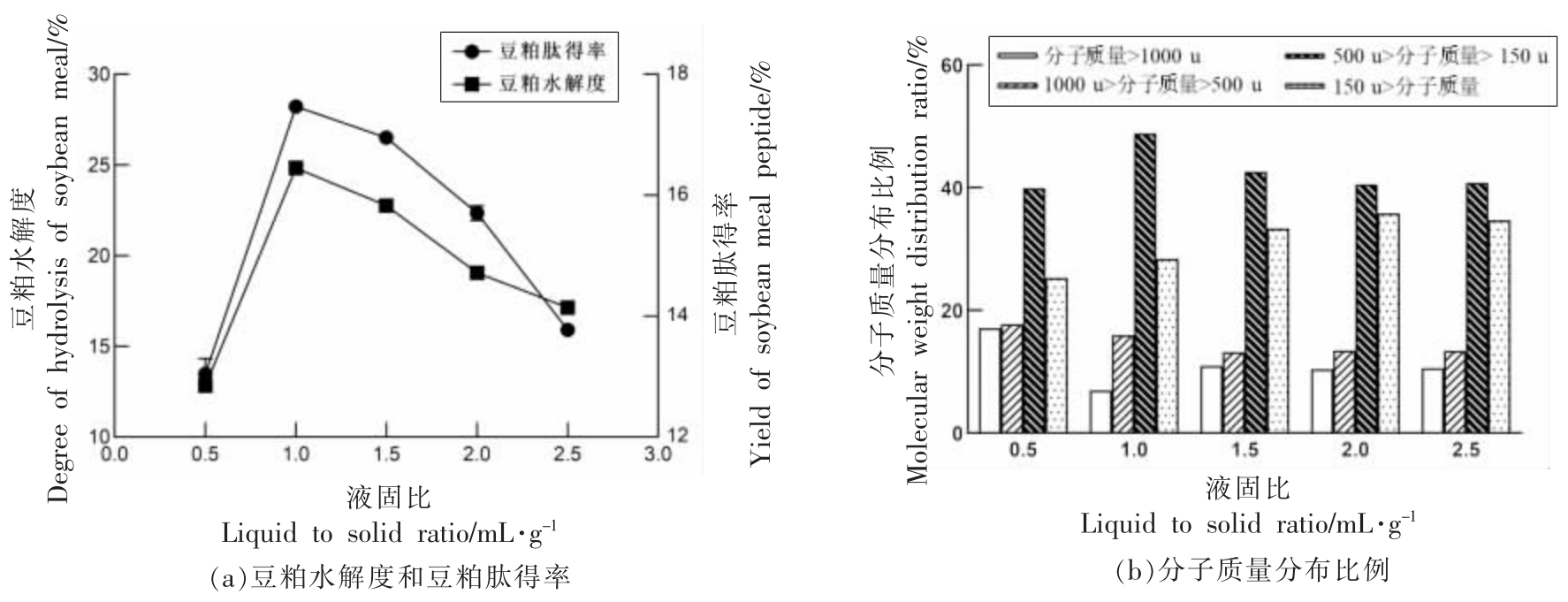
图7 液固比对酶解的影响
Fig.7 Influence of liquid-solid ratio on enzymatic hydrolysis
2.3 响应面优化试验结果
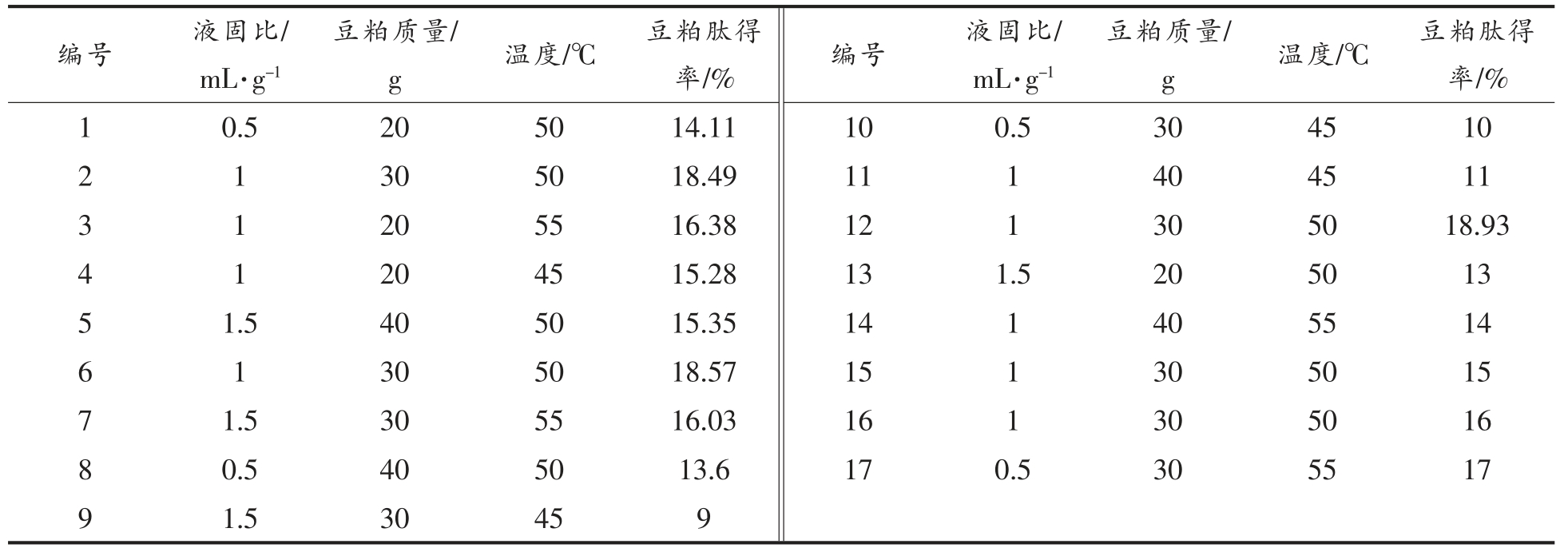
2.3.1 响应面试验设计及回归模型的建立 以单因素实验结果为基础,以液固比(A)、豆粕量(B)、温度(C)3 个因素为相应变量,以肽得率(Y)为响应值,设计3 因素3 水平试验17 组,结果见表5。
表5 试验方案和结果
Table 5 Experimental scheme and results
采用Design-Expert 8.0.6 软件程序对以上试验数据进行二次多元回归拟合,分析结果得出胰蛋白酶酶解豆粕制备豆粕肽的回归方程为:
由表6 可知,回归模型P<0.001,说明胰蛋白酶酶解豆粕制备豆粕肽的模型极显著,同时失拟值P 为0.4909>0.05 不明显,说明该模型合理,数据可信,且模型的R2=0.9881 说明该模型与实际试验拟合较好,自变量与响应值之间的线性关系显著,可以进行分析与预测。
表6 回归模型方差分析及回归方程系数显著性检验
Table 6 Regression model variance analysis and regression equation coefficient significance test
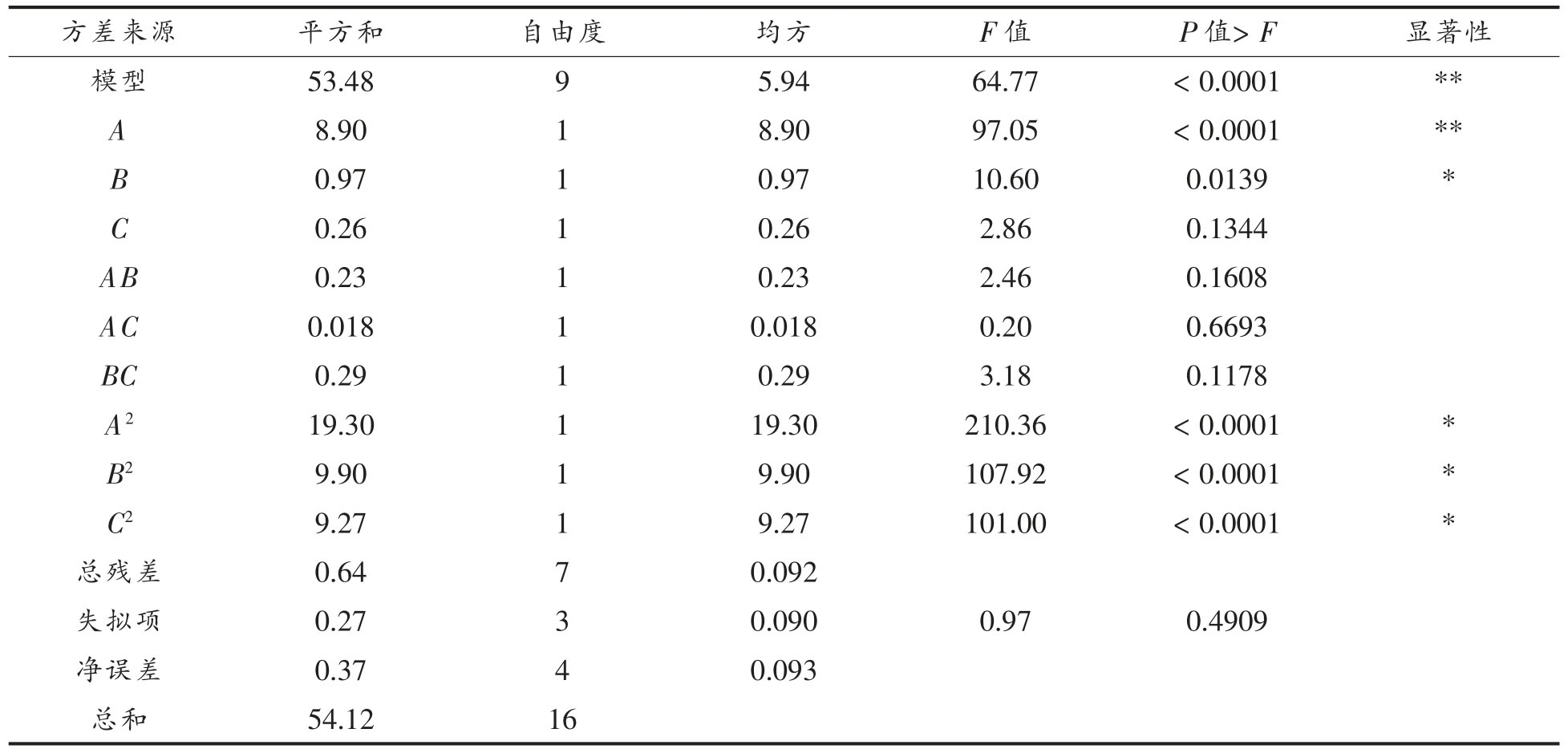
注:*.表示差异显著(0.001<P<0.05),**.表示差异极显著(P<0.001)。
从回归分析的结果可以得出,一次项中A 影响极显著,B 影响显著,C 影响不显著,说明单因素中液固比在豆粕肽得率的影响更加显著。根据F 值的大小,可以判断3 个因素对豆粕肽得率的影响是液固比(A)>酶解温度(C)>豆粕量(B)。
2.3.2 响应曲面分析图示 由图8 可知,设计的3 个因素中对豆粕肽得率影响最大的是液固比,其次是酶解温度,最后是豆粕量,与表中方差分析的显著性结果一致。


图8 各因子交互作用的等高线图和曲面图
Fig.8 Contour diagram and surface diagram of interaction of various factors
2.3.3 最佳酶解工艺确定 采用Design-Expert 8.0.6 软件对上述回归方程进行分析,确定最佳酶解工艺:液固比为1.13 mL/g,豆粕质量为28.61 g,温度为50.34 ℃,豆粕肽得率预测值为18.81%。
2.3.4 试验可行性 考虑到试验的可行性和实际操作方便,修正酶解工艺条件为:液固比1 mL/g,豆粕量30 g,温度50 ℃。在此条件下经过3 次平行试验,测得豆粕肽得率为18.87%,与理论值基本吻合,证明响应面分析法对豆粕酶解制备豆粕肽的条件优化是可行的。
3 结论
随着酶制剂的发展逐步成熟,通过酶解手段提取豆粕肽将成为一种主流,半固态酶解工艺相较于液态酶解操作简易,生产成本低,更容易被市场接受。曹梦笛等[27]通过半固态酶解制备全谷物多肽,其抗氧化、ACE 抑制活性显著高于液态酶解产物,说明半固态酶解工艺具有可行性。碱性蛋白酶的水解能力较强[28],然而在本次试验中,豆粕肽得率和水解度都低于胰蛋白酶,主要原因可能是碱性蛋白酶具有一定的耐碱性,可以在碱性水解液中酶解,碱性水解液使碱性蛋白酶更容易接近蛋白分子内部的催化位点,然而在固态酶解中碱性蛋白酶失去优势。胰蛋白酶作为一种内肽酶,对蛋白质的肽键具有专一性,酶解产物主要以多肽、小肽的形式存在,风味趋于稳定。通过疏水值的测定,反映出胰蛋白酶酶解产物具有较低的苦味,适宜作为一种低苦味肽进行生产。在此基础上,本试验通过单因素实验中,对豆粕肽分子质量分布的测定,可以更加直观的看出各种因素对酶解产物的影响。在响应面优化试验中,温度对酶解的影响不显著,与液态酶解有差异[29],主要是因为固态酶解主要在烘箱中反应,设置的温度差与酶解物感受到的温度差有一定差距。
本试验采用半固态酶解豆粕工艺,通过豆粕肽得率、豆粕水解度、豆粕肽分子质量和荧光探针法确定的苦味值,综合考虑选出酶解效果较佳的胰蛋白酶进行酶解。通过单因素实验选取对酶解影响较大的3 个因素,然后通过响应面分析优化豆粕肽得率,得到最优的酶解条件:液固比为1 mL/g,豆粕质量为30 g,温度为50 ℃。本试验工艺简单,豆粕肽得率高,小分子肽占比高,操作成本低,在规模化生产中起着重要作用,为豆粕资源的合理开发利用提供理论参考。
[1] HRCKOVA M,RUSNAKOVA M,ZEMANOVIC J.Enzymatic hydrolysis of defatted soy flour by three different proteases and their effect on the functional properties of resulting protein hydrolysates[J].Czech Journal of Food Sciences,2002,20(1):7-14.
[2] 孟阳,香红星,雷晓青.酶解豆粕制备鲜味肽的研究进展[J].饲料研究,2021,44(1):157-160.MENG Y,XIANG H X,LEI X Q.Research progress on preparation of umami peptides from soybean meal by enzymatic hydrolysis[J].Feed Research,2021,44(1):157-160.
[3] 张晓峰,杨建平,潘春梅,等.双酶法酶解豆粕蛋白最佳工艺条件研究[J].黑龙江畜牧兽医,2017(18):184-186.ZHANG X F,YANG J P,PAN C M,et al.Study on the optimal technological conditions of double enzymatic hydrolysis of soybean meal protein[J].Heilongjiang Animal Science and Veterinary Medicine,2017(18):184-186.
[4] TAVANO O L.Protein hydrolysis using proteases:An important tool for food biotechnology[J].Journal of Molecular Catalysis B:Enzymatic,2013,90:1-11.
[5] PEIGHAMBARDOUST S H,KARAMI Z,PATEIRO M,et al.A review on health-promoting,biological,and functional aspects of bioactive peptides in food applications[J].Biomolecules,2021,11(5):631.
[6] MAFRA D,BORGES N,ALVARENGA L,et al.Dietary components that may influence the disturbed gut microbiota in chronic kidney disease[J].Nutrients,2019,11(3):496.
[7] TSURUKI T,KISHI K,TAKAHASHI M,et al.Soymetide,an immunostimulating peptide derived from soybean β-conglycinin,is an fMLP agonist[J].FEBS Letters,2003,540(1/2/3):206-210.
[8] KOJIMA-YUASA A,HUANG X,MATSUI-YUASA I.Synergistic anticancer activities of natural substances in human hepatocellular carcinoma[J].Diseases,2015,3(4):260-281.
[9] DHAYAKARAN R,NEETHIRAJAN S,WENG X.Investigation of the antimicrobial activity of soy peptides by developing a high throughput drug screening assay[J].Biochemistry and Biophysics Reports,2016,6:149-157.
[10] BAI G,TSURUTA T,NISHINO N.Dietary soy,meat,and fish proteins modulate the effects of prebiotic raffinose on composition and fermentation of gut microbiota in rats[J].Int J Food Sci Nutr,2018,69(4):480-487.
[11] NAGAOKA S,TAKEUCHI A,BANNO A.Plantderived peptides improving lipid and glucose metabolism[J].Peptides,2021,142:170577.
[12] CLEMENTE A.Enzymatic protein hydrolysates in human nutrition[J].Trends in Food Science & Technology,2000,11(7):254-262.
[13] 刘静波,王子秦,于一丁,等.响应面法优化豆粕肽制备工艺[J].中国食品学报,2021,21(8):216-223.LIU J B,WANG Z Q,YU Y D,et al.Optimization of soybean meal peptide preparation process by response surface methodology[J].Journal of Chinese Institute of Food Science and Technology,2021,21(8):216-223.
[14] BEAUBIER S,FRAMBOISIER X,IOANNOU I,et al.Simultaneous quantification of the degree of hydrolysis,protein conversion rate and mean molar weight of peptides released in the course of enzymatic proteolysis[J].Journal of Chromatography B,2018,1105(15):1-9.
[15] 闫凯,周玉岩,陈子龙,等.豆粕固态发酵及酶解制备小分子肽的研究[J].广东饲料,2020,29(6):29-32.YAN K,ZHOU Y Y,CHEN Z L,et al.Research on preparation of small peptides from soybean meal by solid-state fermentation and enzymatic hydrolysis[J].Guangdong Feed,2020,29(6):29-32.
[16] 郭兴凤.蛋白质水解度的测定[J].中国油脂,2000,25(6):176-177.GUO X F.Determination of the degree of protein hydrolysis[J].China Oils and Fats,2000,25(6):176-177.
[17] 余勃,陆兆新.发酵豆粕生产大豆多肽研究[J].食品科学,2007,28(2):189-192.YU B,LU Z X.Research on fermented soybean meal to produce soybean peptides[J].Food Science,2007,28(2):189-192.
[18] LEE K D,WARTHESEN J J.Mobile phases in reverse-phase HPLC for the determination of bitter peptides in cheese [J].Journal of Food Science,1996,61(2):291-294.
[19] LIN X,LU Y,ZHANG T,et al.Accuracy and precision comparison for molecular weight distribution assay of fish collagen peptides:A methodology study between two gel permeation chromatography columns[J].Food Analytical Methods,2019,12(1):246-257.
[20] HASKARD C A,LI-CHAN E C Y.Hydrophobicity of bovine serum albumin and ovalbumin determined using uncharged(PRODAN)and anionic(ANS-)fluorescent probes [J].Journal of Agricultural and Food Chemistry,1998,46(7):2671-2677.
[21] 高梅娟,刘平,兰小红,等.双酶酶解豆粕蛋白制备低苦味肽[J].食品工业科技,2010,31(2):193-197.GAO M J,LIU P,LAN X H,et al.Preparation of low-bitter peptides by double enzymatic hydrolysis of soybean meal protein[J].Food Industry Science and Technology,2010,31(2):193-197.
[22] SERRANO M P,REBOLLAR P G,SUEIRO S,et al.Influence of duration of storage on protein quality traits of soybean meals [J].Journal of Applied Poultry Research,2013,22(3):423-429.
[23] SUN X D.Enzymatic hydrolysis of soy proteins and the hydrolysates utilisation[J].International Journal of Food Science & Technology,2011,46(12):2447-2459.
[24] 何慧,王进,裴凡,等.蛋白质水解物与苦味的构效关系及脱苦研究[J].食品科学,2006,27(10):571-574.HE H,WANG J,PEI F,et al.Study on the structure -activity relationship between protein hydrolysate and bitterness and debittering[J].Food Science,2006,27(10):571-574.
[25] 范彦令,张士辉.酶解豆粕和发酵豆粕的研究进展[J].今日畜牧兽医,2007(7):55-57.FAN Y L,ZHANG S H.Research progress of enzymatic hydrolysis of soybean meal and fermented soybean meal[J].Today Animal Husbandry and Veterinary Medicine,2007(7):55-57.
[26] 许晶,江连洲,李杨,等.脱脂豆粕酶水解物抗氧化活性的研究[J].食品工业科技,2009,30(9):208-211.XU J,JIANG L Z,LI Y,et al.Antioxidant activity of enzyme hydrolysate of defatted soybean meal[J].Food Industry Science and Technology,2009,30(9):208-211.
[27] 曹梦笛,周浩纯,李赫,等.半固态酶解法制备全谷物多肽及其抗氧化、ACE 抑制活性的研究[J].食品工业科技,2021,42(15):9-16.CAO M D,ZHOU H C,LI H,et al.Preparation of whole grain peptides by semi-solid enzymatic hydrolysis and their antioxidant and ACE inhibitory activities[J].Science and Technology of Food Industry,2021,42(15):9-16.
[28] TANG C,WANG X S,YANG X Q.Enzymatic hydrolysis of hemp(Cannabis sativa L.)protein isolate by various proteases and antioxidant properties of the resulting hydrolysates[J].Food Chemistry,2009,4(114):1484-1490.
[29] ZHENG Z,HUANG Y,WU R,et al.Response surface optimization of enzymatic hydrolysis of duck blood corpuscle using commercial proteases[J].Poultry Science,2014,10(93):2641-2650.