2019 年底新型冠状病毒肺炎(COVID-19)疫情在全球爆发,在疫情影响下,免疫系统是被广泛谈论的话题。研究表明,机体免疫功能下降是新冠肺炎发病的重要原因之一[1]。因此,增强机体免疫力,提高抗病毒能力,避免自身出现基础疾病尤为重要。我国益生菌市场发展前景巨大,益生菌具有增强机体免疫力的作用已被广泛认同,因其具有安全、可靠、性能优良等特点,而在临床使用中受到越来越多的关注[2-3]。目前最常见的益生菌主要来自于双歧杆菌属(Bifidobacterium)和乳杆菌属(Lactobacillus),其中乳双歧杆菌XLTG11(Bifidobacterium lactis XLTG11,B.lactis XLTG11)、植物乳杆菌P8(Lactobacillus plantarum P8,L.casei P8)、干酪乳杆菌Zhang(Lactobacillus casei Zhang,L.casei Zhang)皆具有良好的耐酸性,对人工胃液耐受性强,属国内外目前用于开发的具有增强机体免疫功能的重要乳杆菌属菌株[4-6]。研究表明,乳双歧杆菌V9、干酪乳杆菌Zhang、植物乳杆菌P8 组成的复合制剂可增强小鼠免疫功能[7],然而含有乳双歧杆菌XLTG11、干酪乳杆菌Zhang 和植物乳杆菌P8 的复合益生菌制剂增强免疫功能的研究未见报道。本实验研究不同剂量的复合益生菌制剂对环磷酰胺(Cyclophosphamide,CTX)诱导的小鼠免疫功能的影响,为复合益生菌微生态制剂产品开发和应用提供科学依据。
1 材料与方法
1.1 实验菌种
复合益生菌制剂,本实验所用益生菌制剂是乳双歧杆菌XLTG11(1×1011 CFU)、干酪乳杆菌Zhang(1×1011 CFU)和植物乳杆菌P8(1×1011 CFU)以4∶3∶3 质量比复配混合制成,由金华银河生物科技有限公司提供。
1.2 实验动物
SPF 级BALB/c 小鼠,6~8 周龄,雄性,体质量18~22 g,清洁级动物房中饲养,温度20~23 ℃,12 h 明暗交替,期间自由饮水、摄食。
1.3 试剂与仪器
CTX 冻干粉,江苏恒瑞医药股份有限公司;盐酸左旋咪唑(Levamisole hydrochloride,LEV),山西太原药业有限公司;绵羊红细胞(SRBC),玉环市南方试剂有限公司;小鼠荧光单抗CD3-FITC、CD4-PE-Cy7、CD8a-APC 和NK-1.1-PE,安诺伦(北京)生物科技有限公司;小鼠血清ELISA 试剂盒IgA、IgG、IL-2、IL-12,IL-1β、TNF-α,江苏酶免实业有限公司。
游标卡尺(精密度0.02 mm),哈尔滨量具刃具集团有限责任公司;微量注射器(50 μL),上海安亭微量进样器厂;MLS-3751L-PC 高压蒸汽灭菌器、MDF-382E-80 ℃冰箱,日本Panasonic 公司;SORVALL ST8/8R 低温离心机,美国TOMOS 公司;NovoCyte3110 流式细胞仪,美国Agilent 公司。
1.4 实验方法
1.4.1 动物实验设计 BALB/c 小鼠随机分为6组,空白组和模型组灌服生理盐水、阳性对照组灌服LEV(10 mg/kg)、复合益生菌粉低(2.5×106 CFU)、中(5×106 CFU)、高(1×107 CFU)剂量组灌服益生菌制剂,每组8 只,持续给予28 d。参照文献[8],在处死前6 d,向模型组、益生菌组和阳性对照组小鼠腹腔注射CTX(40 mg/kg),连续2 d,空白组小鼠腹腔注射生理盐水,复制免疫功能低下小鼠模型。
1.4.2 免疫器官指数测定 实验第28 天,记录小鼠末次给药30 min 后的体质量,处死并在无菌环境下摘除胸腺和脾脏,洗去血液,沥干水分,称重,计算胸腺或脾脏质量(mg)与体质量(g)的比值。
1.4.3 迟发型变态应测定(Delayed type hypersensitivity,DTH)采用足跖增厚法测定小鼠迟发型变态应程度。实验第23 天,每只小鼠腹腔注射2%(体积分数)SRBC 0.2 mL 致敏。4 d 后,对小鼠左后足趾厚度进行测量,并在测量部位皮下注射20%(体积分数)SRBC,每只小鼠20 μL(约1×108 个SRBC),于24 h 后再次对小鼠左后足趾部位厚度进行测量,同一部位测量3 次取平均值,以注射前、后的足趾厚度差值来表示DTH 的反应程度。
1.4.4 血清溶血素水平测定(血凝法)实验第24 天,每只小鼠腹腔注射0.2 mL 2%(体积分数)SRBC 进行免疫,免疫后4~5 d 眼球取血,置于离心管内,放置约1 h,将凝固血与管壁剥离,使血清充分析出,2 000 r/min 离心10 min,收集血清。使用生理盐水将血清倍比稀释后转移至微量血凝板内,再加入0.5%(体积分数)SRBC 混匀,37 ℃温箱孵育3 h,统计血球凝集度,计算相应抗体积数。
1.4.5 脾淋巴细胞亚群百分比检测 实验第28天,小鼠末次给药30 min 后处死,无菌环境摘取脾脏并放入组织保存液中待用。将小鼠脾脏剪碎研磨过滤,收集小鼠脾细胞,加入PBS,重悬沉淀,用100 μL PBS 重悬细胞沉淀后染色,置于流式细胞管中。将anti-CD3、anti-CD4、anti-CD8 和anti-NK 抗体按稀释比例加入至细胞悬液中,4 ℃避光孵育30 min,洗涤后加入500 μL PBS 重悬细胞沉淀。结果以CD3+、CD4+CD8-、CD4-CD8+T 淋巴细胞和NK 细胞的百分比表示复合益生菌对小鼠脾淋巴细胞亚群的影响。
1.4.6 血清IgA、IgG、IL-2、IL-12、TNF-α 水平测定 实验第28 天,小鼠末次给药30 min 后,眼球取血,3 000 r/min 离心10 min,取血清待用。分别采用小鼠血清IgA、IgG、IL-2、IL-12、IL-1β、TNFα 试剂盒检测,操作步骤按说明书进行。
1.5 统计学分析
采用SPSS 26.0 统计软件进行统计学分析,实验数据以平均值±标准差(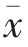 ±s)表示,多组间样本采用单因素方差分析进行数据处理,LSD 法进行两两比较,P<0.05 具有显著性差异。
±s)表示,多组间样本采用单因素方差分析进行数据处理,LSD 法进行两两比较,P<0.05 具有显著性差异。
2 结果与分析
2.1 复合益生菌对小鼠免疫器官指数的影响
胸腺指数和脾指数的高低可以间接反应机体整体免疫水平,在保健品免疫功能评价中具有重要意义[9]。由表1 可知,与空白组比较,模型组胸腺指数和脾指数具有显著性差异(P<0.01),与模型组比较,阳性对照组胸腺指数具明显增加(P<0.01),复合益生菌低、中、高剂量组均明显增加(P<0.01),其中高剂量组差异显著(P<0.001)。
表1 复合益生菌对CTX 诱导小鼠胸腺和脾指数的影响(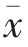 ±s,n=8)
±s,n=8)
Table 1 Effects of compound probiotics on thymus and spleen index in CTX induced mice(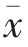 ±s,n=8)
±s,n=8)
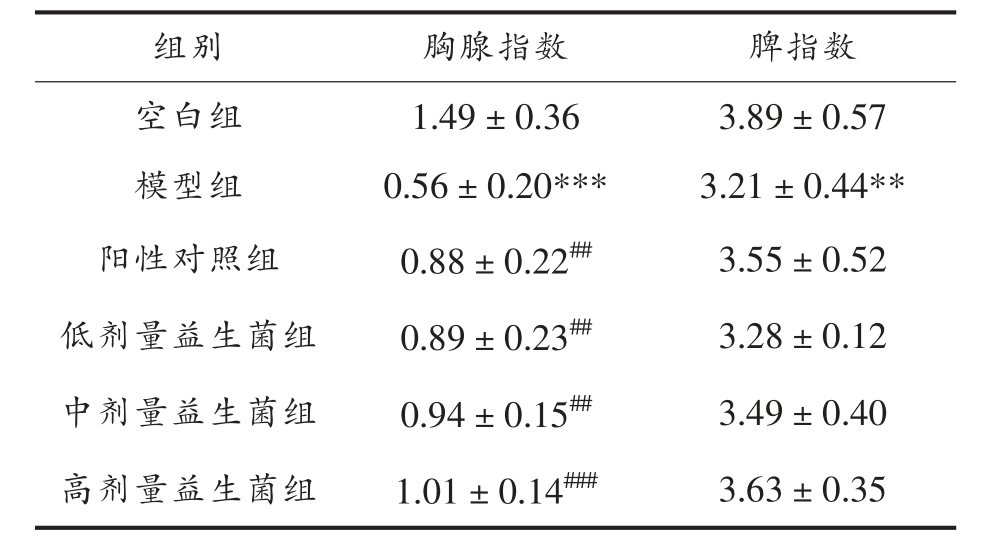
注:**.P<0.01,***.P<0.001,与空白组比较;#.P<0.05,##.P<0.01,###.P<0.001,与模型组比较。
2.2 复合益生菌对小鼠迟发型变态反应的影响
SRBC 可刺激T 淋巴细胞增殖成致敏淋巴细胞,引起迟发型变态反应,是细胞免疫的体内检测法。由表2 可知,与空白组比较,模型组足跖厚度明显降低(P<0.01),与模型组比较,阳性对照组足跖厚度显著增加(P<0.001),复合益生菌低、中、高剂量组均显著增加(P<0.05)。
表2 复合益生菌对CTX 诱导小鼠迟发型变态反应和血清溶血素的影响(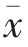 ±s,n=8)
±s,n=8)
Table 2 Effects of compound probiotics on DTH and serum hemolysin content in CTX induced mice(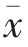 ±s,n=8)
±s,n=8)
注:**.P<0.01,***.P<0.001,与空白组比较;#.P<0.05,##.P<0.01,###.P<0.001,与模型组比较。
2.3 复合益生菌对小鼠血清溶血素的影响
腹腔注射SRBC 后,小鼠体内会产生溶血素,溶血素可以凝集SRBC,以凝集程度检测溶血素水平,反应体液免疫功能。由表2 可知,与空白组比较,模型组抗体积数显著降低(P<0.001),与模型组比较,阳性对照组抗体积数明显增加(P<0.01),复合益生菌低、中、高剂量组均显著增加(P<0.05)。
2.4 复合益生菌对小鼠脾淋巴细胞亚群百分比的影响
由表3 和图1、图2 可知,与空白组比较,模型组脾淋巴细胞CD3+、CD4+CD8-、CD4-CD8+和NK细胞百分比均降低(P<0.05)。与模型组比较,阳性对照组脾淋巴细胞CD3+、CD4+CD8-、CD4-CD8+和NK 细胞百分比均增加(P<0.05),复合益生菌低、中、高剂量组脾淋巴细胞CD3+、CD4+CD8-和CD4-CD8+百分比增加(P<0.05),中剂量组和高剂量组差异显著(P<0.01),高剂量组NK 细胞百分比明显增加(P<0.01)。
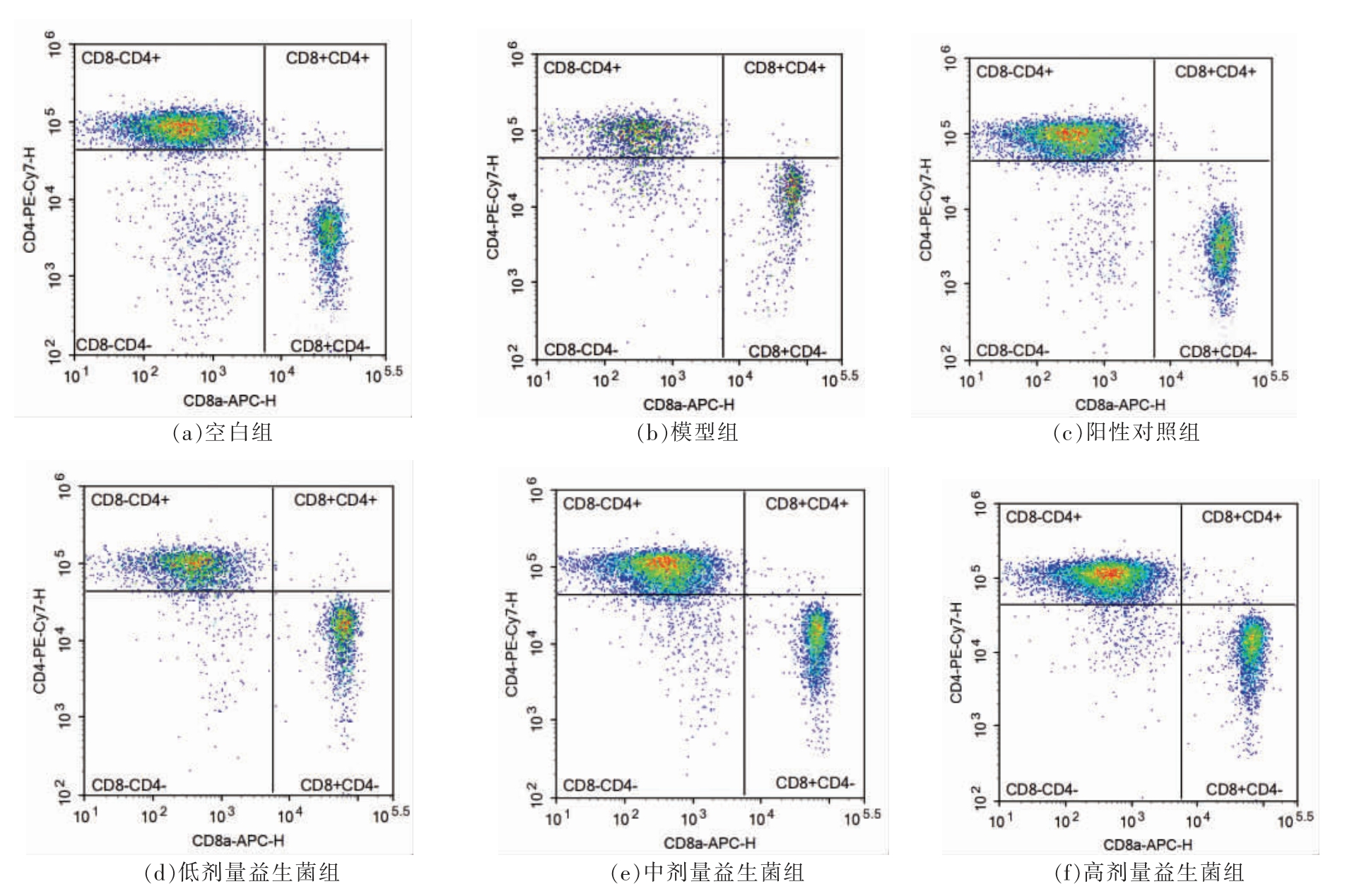
图1 CTX 诱导小鼠脾淋巴细胞CD4+CD8-、CD4-CD8+百分比
Fig.1 Percentage of splenic lymphocyte CD4+CD8-、CD4-CD8+of CTX induced mice

图2 CTX 诱导小鼠脾淋巴细胞CD3+和NK 百分比
Fig.2 Percentage of splenic lymphocyte CD3+and NK of CTX induced mice
表3 CTX 诱导小鼠脾淋巴细胞亚群百分比(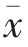 ±s,n=8)
±s,n=8)
Table 3 Percentage of splenic lymphocyte subsets of CTX induced mice(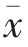 ±s,n=8)
±s,n=8)
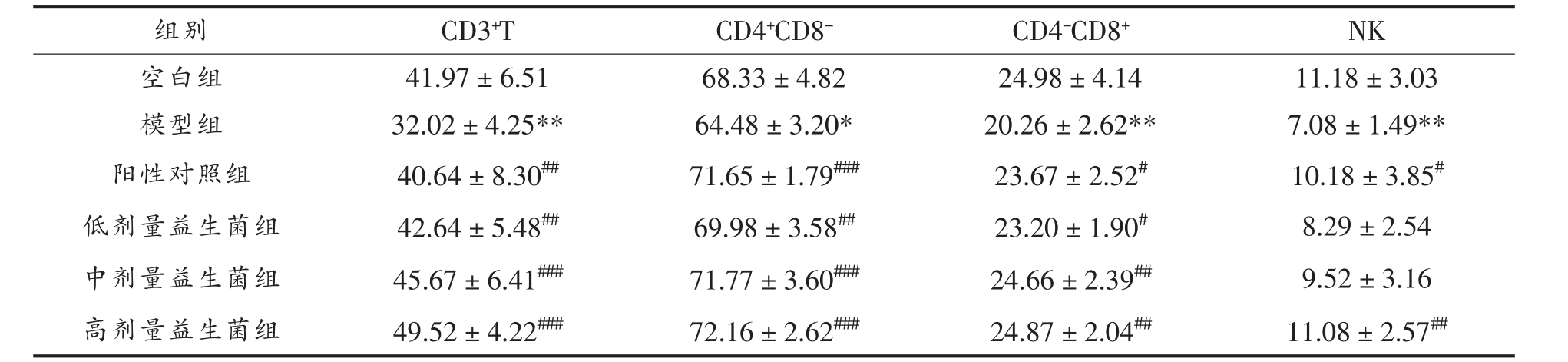
注:*.P<0.05,**.P<0.01,与空白组比较;#.P<0.05,##.P<0.01,###.P<0.001,与模型组比较。
2.5 复合益生菌对小鼠血清IgA、IgG、IL-2、IL-12、TNF-α 水平的影响
由表4 可知,与空白组比较,模型组血清IgA、IgG、IL-2、TNF-α 水平均降低(P<0.05),IL-12 水平显著降低(P<0.001)。与模型组比较,阳性对照组血清IgA、IL-2、IL-12、TNF-α 水平均增加(P<0.05),IgG 水平增加明显(P<0.01),复合益生菌低剂量组IgA、IgG、IL-2、TNF-α 水平增加(P<0.05),复合益生菌中剂量组血清IgA、IL-2、IL-12、TNFα 水平增加(P<0.05),IgG 水平增加显 著(P<0.001),复合益生菌高剂量组IL-2、IL-12 水平增加明显(P<0.01),IgA、IgG、TNF-α 水平增加显著(P<0.001)。
表4 各组小鼠血清IgA、IgG、IL-2、IL-12、TNF-α 水平(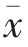 ±s,n=8)
±s,n=8)
Table 4 Levels of serum IgA,IgG,IL-2,IL-12,TNF-α of mile in various groups(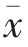 ±s,n=8)
±s,n=8)
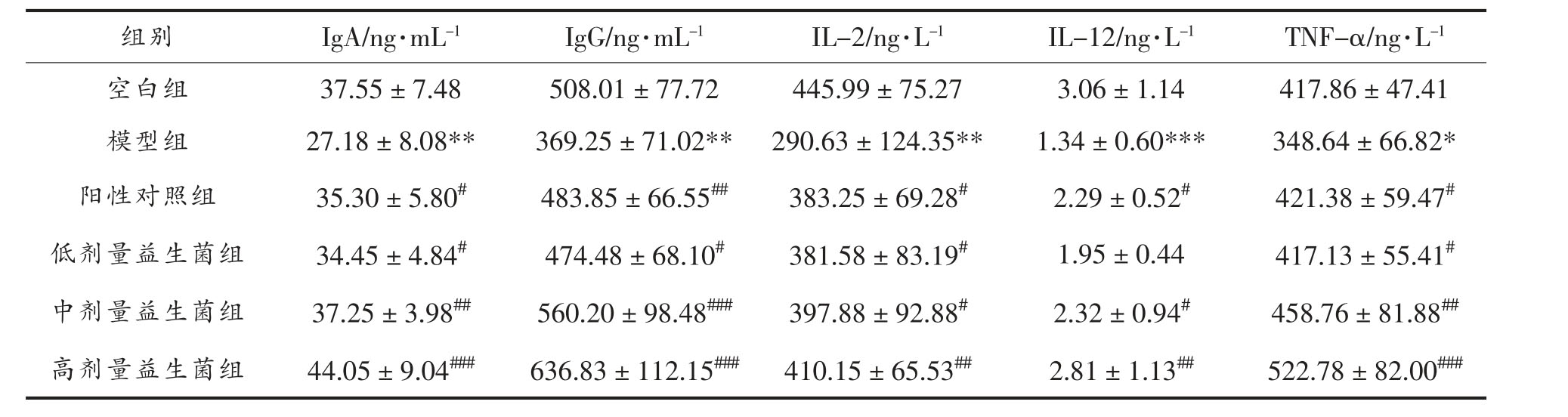
注:*.P<0.05,**.P<0.01,***.P<0.001,与空白组比较;#.P<0.05,##.P<0.01,###.P<0.001,与模型组比较。
3 结论与讨论
益生菌是一种活性微生物制剂,对宿主肠内菌群生态平衡有益,可以刺激宿主免疫系统,增强宿主免疫应答反应,对人体健康水平提升极为重要[10]。每年全球益生菌市场规模以15%~20%的速度增长,而我国处于“大健康”时代,益生菌产业发展更为迅速,预计在2022 年将达到空前的市场规模[11]。我国科学技术部在“十三五”期间部署多项重点相关项目,加强益生菌的基础研究并促进产业化升级,其中学术研究领域的重点方向即益生菌与人体健康和疾病防治的关系等研究[12]。因此,益生菌增强机体免疫力相关研究及其保健食品的开发具有重要意义。
不同种类的益生菌菌株发挥不同的免疫调节作用,对免疫细胞及免疫力影响也有所差异[13]。复合益生菌由多种益生菌组成,每种益生菌具有不同的功效,因此复合益生菌是各菌的主要作用与辅助作用相结合,其作用效果优于单一菌种。例如唯一一种被视为医疗食品的复合益生菌VSL#3[14]包含了8 种活菌菌株,其中4 株乳酸杆菌、3 株双歧杆菌和1 株链球菌。本实验所用的复合益生菌粉由乳双歧杆菌XLTG11、干酪乳杆菌Zhang、植物乳杆菌P8 以4∶3∶3 质量比复合而成。持续28 d 对CTX 致免疫功能低下小鼠灌胃给予低、中、高剂量复合益生菌粉(2.5×106,5×106,1×107 CFU),通过检测小鼠的免疫器官指数、细胞免疫功能、体液免疫功能、脾淋巴细胞亚群百分比和血清免疫球蛋白及细胞因子水平,研究复合益生菌对CTX 致免疫低下小鼠免疫功能的影响。实验结果表明,模型组小鼠连续注射CTX 【40 mg/(kg·d)】2 d 后,免疫系统损伤,免疫功能低下。在灌胃给予复合益生菌粉28 d 后,各剂量组小鼠胸腺指数明显增加(P<0.01),DTH 程度、血清溶血素水平均增加(P<0.05),以中剂量和高剂量组增加更为显著(P<0.01),小鼠脾淋巴细胞CD3+、CD4+CD8-和CD4-CD8+百分比均增加(P<0.05),高剂量组NK 细胞比例明显增加(P<0.01),血清免疫球蛋白IgA、IgG、IL-2、TNF-α 水平均升高(P<0.05),高剂量组血清IL-12 水平明显升高(P<0.01)。实验结果显示,复合益生菌在细胞免疫和体液免疫功能测定中均为阳性,该复合益生菌具有增强机体免疫力的作用。此外,实验结果表明,随着复合益生菌剂量的增大,各项检测指标显著性差异增加,提示该复合益生菌具有剂量依赖性。
研究表明,乳双歧杆菌XLTG11、干酪乳杆菌Zhang、植物乳杆菌P8 具有增强机体免疫力的作用。乳双歧杆菌XLTG11 分离自健康婴儿肠道具有优良益生特性,可以增加小鼠血液白细胞数目,增强机体非特异性免疫功能,提高血清溶血素含量,介入体液免疫反应,刺激T 淋巴细胞增殖分化,提高小鼠脾脏T 淋巴细胞CD3+、CD19+、CD4+CD8-和CD4-CD8+百分比,进而发挥增强机体免疫力功效[4],这与本文的实验结果相一致。植物乳杆菌P8 是具有较强耐酸、耐胆盐、抗菌活性等优良特性的乳杆菌,其通过人工胃液后,进入人工肠液消化24 h,活菌数量不会发生变化,是目前研究与应用较为成熟的一株益生菌[15]。研究表明,植物乳杆菌P8 可以在宿主肠道内存活,使肠道菌群群落结构得到改善,有害菌黏附、侵染、定殖减少,且会促进有益菌的生长,从而使肠道菌群屏障功能得到增强[16]。此外,植物乳杆菌P8 可以调节机体体液免疫、细胞免疫和肠道相关淋巴组织免疫[17]。Toll 样受体(Toll-like receptors,TLR)是一类重要蛋白质分子,参与非特异性免疫,TLRs 会激活下游信号通路NF-κB,NF-κB 的程序性表达不仅影响T 细胞的活化、分化和增殖,还会促进B 细胞增殖、分化及成熟[18]。干酪乳杆菌Zhang 是一株分离自传统发酵的马奶且性能优异的乳杆菌。研究表明,干酪乳杆菌Zhang 可增强Toll 样受体转录与NF-κB 信号通路激活,通过在T 细胞免疫反应中增加T 细胞CD4+活化,从而增加Th1(CD4+辅助细胞的一种亚型)和调节性T 细胞(Regulatory cells,Treg)比例,促进细胞因子TNF-α、IFN-γ 和TNF-β 表达,在B 细胞免疫反应中促使被激活的B 细胞进行抗体类别转换,从而表达和产生IgG、IgA 或IgE 来发挥免疫调节作用[19-20]。本实验研究结果中,复合益生菌增加了T 细胞CD4+CD8-百分比,升高细胞因子TNF-α 和免疫球蛋白IgA、IgG水平,提示干酪乳杆菌Zhang 发挥了主要免疫调节作用。此外,复合益生菌在T 细胞的增殖分化及细胞因子水平检测中具有显著效果,而T 细胞增殖分化与细胞因子紧密相关。IL-12 对T 细胞增殖具有促进作用,IL-2 和TNF-α 水平与CD4+CD8-和CD4-CD8+T 细胞表答呈正相关关系[21],因此,复合益生菌在增加T 细胞CD4+CD8-和CD4-CD8+表达的同时升高了细胞因子IL-2、IL-12 和TNF-α 水平,通过细胞因子介导机体免疫反应,从而发挥增强机体免疫作用。
综上所述,该实验条件下的复合益生菌制剂未对实验小鼠产生负面影响,且具有良好的肠道耐受性与高安全性、稳定性、并通过增强T 细胞增殖分化能力,升高血 清IgA、IgG、IL-2、IL-12、TNF-α 水平,从而调节细胞免疫和体液免疫,发挥增强小鼠机体免疫功能的作用。本研究为乳双歧杆菌XLTG11、干酪乳杆菌Zhang、植物乳杆菌P8组成的复合微生物制剂增强免疫力功能提供了理论支持,也为其进一步的开发和利用提供药理学基础。
[1] 王忆勤,郝一鸣.从调节免疫力谈中医药防治新型冠状病毒肺炎[J].上海中医药杂志,2020,54(5):1-5.WANG Y Q,HAO Y M.Discussion on prevention and treatment of COVID-19 with traditional Chinese medicine from immunoregulation[J].Shanghai Journal of Traditional Chinese Medicine,2020,54(5):1-5.
[2] 张娟,陈坚.益生菌功能开发及其应用性能强化[J].科学通报,2019,64(3):246-259.ZHANG J,CHEN J.Functional development and performance enhancement of probiotics[J].Chinese Science Bulletin,2019,64(3):246-259.
[3] 朱韶娟,张立彦.复合乳酸菌粉冲剂增强免疫力作用的研究[J].现代食品科技,2013,29(1):77-80,145.ZHU S J,ZHANG L Y.Study on enhancement of complex probiotics granules on children immunity[J].Modern Food Science and Technology,2013,29(1):77-80,145.
[4] 马微微,李玟玟,黄莉莉,等.乳双歧杆菌XLTG11对小鼠免疫功能的影响[J].食品与发酵工业,2022,48(13):103-107.MA W W,LI W W,HUANG L L,et al.Effects of Bifidobacterium lactis XLTG11 on immune function in mice[J].Food and Fermentation Industries,2022,48(13):103-107.
[5] 白梅,黄天,郭帅,等.益生菌干酪乳杆菌Zhang和乳双歧杆菌V9 发酵乳胞外多糖含量对流变学特性、质构和稳定性的影响[J].中国食品学报,2021,21(4):193-202.BAI M,HUANG T,GUO S,et al.Effects of extracellular polysaccharide in yogurt produced by the probiotic bacteria,Lactobacillus casei Zhang and Bifidobacterium animalis subsp.lactis V9 on rheological properties texture and stability[J].Journal of Chinese Institute of Food Science and Technology,2021,21(4):193-202.
[6] TONG D,CHEN H Y,LI T,et al.Influence of Lactobacillus plantarum P-8 on fermented milk flavor and storage stability[J].Front Microbiol,2019,9(1):3133.
[7] 苏硕楠,侯林中.三种益生菌与低聚果糖复合粉对小鼠免疫功能的影响[J].食品工业科技,2022,43(11):363-368.SU S N,HOU L Z.Immunomodulatory effect of triple probiotics and fructo-oligosaccharide in mice[J].Science and Technology of Food Industry,2022,43(11):363-368.
[8] 钟金凤,方热军.环磷酰胺免疫抑制机制及在动物模型上的应用[J].中国免疫学杂志,2016,32(10):1541-1546.ZHONG J F,FANG R J.Immunosuppressive mechanism of cyclophosphamide and its application in animal models[J].Chinese Journal of Immunology,2016,32(10):1541-1546.
[9] 刘灵,王萌,宋自娟,等.大豆异黄酮复合软胶囊的免疫增强作用及安全性评价[J].现代食品科技,2022,38(2):56-63.LIU L,WANG M,SONG Z J,et al.Immune function and food safety evaluation of soybean isoflavone composite capsule[J].Modern Food Science and Technology,2022,38(2):56-63.
[10] 王帅,马达,张勇,等.益生菌干酪乳杆菌Zhang对大鼠空间学习记忆能力的影响[J].中国食品学报,2021,21(6):101-106.WANG S,MA D,ZHANG Y,et al.Effects of probiotic Lacticaseibacillus casei Zhang on spatial learning and memory of rats[J].Journal of Chinese Institute of Food Science and Technology,2021,21(6):101-106.
[11] 曾繁莹.益生菌成健康新风口[J].食品界,2022(5):56-58.ZENG F Y.Probiotics for a healthy new mouth[J].Food Industry,2022(5):56-58.
[12] 陆悦.我国益生菌产业蓬勃发展[N].中国医药报,2017-06-08(5).LU Y.Probiotics industry in China is booming[N].Chin Med News,2017-06-08(5).
[13] 王淑梅,邸维,妥彦峰,等.益生菌的免疫调控作用研究进展[J].粮食与油脂,2021,34(5):23-26.WANG S M,DI W,TUO Y F,et al.Research progress on immune regulation of probiotics[J].Cereals & Oils,2021,34(5):23-26.
[14] CHENG F S,PAN D,CHANG B,et al.Probiotic mixture VSL#3:An overview of basic and clinical studies in chronic diseases world[J].World Journal of Clinical,2021,9(20):5752-5753.
[15] 王水泉.益生植物乳杆菌P8 在豆乳及牛乳中发酵特性的研究[D].呼和浩特:内蒙古农业大学,2011.WANG S Q.Study on fermentation characteristics of probiotic Lactobacillus plantarum P8 in soybean milk and milk[D].Hohhot:Inner Mongolia Agricultural University,2011.
[16] WANG L F,ZHANG J C,GUO Z,et al.Effect of oral consumption of probiotic Lactobacillus planatarum P8 on fecal microbiota,SIgA,SCFAs,and TBAs of adults of different ages[J].Nutrition,2014,30(7/8):776-783.
[17] 马晨.植物乳杆菌P8 对肠道菌群的调控及其机制[J].科学通报,2019,64(3):298-306.MA C.The regulation mechanism of Lactobacillus plantarum P8 on intestinal microflora [J].Chinese Science Bulletin,2019,64(3):298-306.
[18] 孙静静,邵军军,常惠芸.NF-κB 免疫生物学作用的研究进展[J].生物技术通报,2011(11):63-69.SUN J J,SHAO J J,CHANG H Y.Advances of NF-κB in immunobiology[J].Biotechnology Bulletin,2011(11):63-69.
[19] WANG Y Z,XIE J M,WANG N,et al.Lactobacillus casei Zhang modulate cytokine and toll-like receptor expression and beneficially regulate poly I:C -Induced immune responses in RAW264.7 macrophages[J].Microbiol Immunol,2013,57(1):54-62.
[20] FU L L,XIE M H,WANG C,et al.Lactobacillus casei Zhang alleviates shrimp tropomyosin-induced food allergy by switching antibody isotypes through the NF-κB-dependent immune tolerance[J].Mol Nutr Food Res,2020,64(10):1900496.
[21] OVERGAARD N H,JUNG J W,STEPTOE R J,et al.CD4+/CD8+ double-positive T cells:More than just a developmental stage?[J].Journal of Leukocyte Biology,2014,97(1):31-38.