肉葡萄球菌(Staphylococcus carnosus)是一种不产任何毒素、溶血素、凝固酶或聚集因子,被完全确认的食品级菌株[1]。肉葡萄球菌常存在于腌制型的发酵肉制品中,特别是发酵香肠中,由于它们能耐受高浓度的盐,安全无毒,无致病性,与其它微生物相比它们对亚硝酸盐、烟熏和干制等有较强的抗性,因此可以作为肉类发酵剂的微生物资源[2]。除此之外,肉葡萄球菌也是赋予发酵食品不同感官特性,改善品质的关键菌种[3]。
风味是决定发酵制品品质的一个重要指标,国内外学者已经发现多种肉葡萄球菌具有脂肪酶和蛋白酶活性,这些酶参与和形成各种芳香物质和有机酸,赋予发酵制品不同的感官特性,促进风味物质的形成[4]。天然发酵香肠中有丰富的肉葡萄球菌,这些细菌可以产生硝酸还原酶,从而将硝酸盐还原为亚硝酸盐,有助于亚硝基肌球蛋白的形成,并使产品呈现出特有的粉红色[4]。史智佳等[5]研究发现可以通过接种肉葡萄球菌并添加少量硝酸盐的方法使香肠发色。此外,肉葡萄球还可通过产过氧化氢酶清除产品中的强氧化剂——过氧化氢,促进发色,发挥护色功效[3]。生物胺是一类具有生物活性的含氮低分子质量有机化合物,摄入量过多可能会使人体产生许多不良反应。钮成拓等[1]研究发现肉葡萄球菌M43 是一种无害菌,且可以显著降解发酵豆酱中常见的生物胺,如酪胺、亚精胺、腐胺和尸胺等。Casaburi 等[6]报道称肉葡萄球菌SC28、SC31、SC54、SC55 均不能形成生物胺,可作为食品发酵过程中控制生物胺含量的优势菌株。
大多数肉葡萄球菌的功能较为单一,尚不能将其应用到工业化生产中来提高发酵制品的整体感官品质。随着基因工程与分子生物学技术的发展,将不同菌株中起产香、发色和降生物胺等功能的基因拼接到一起,构建集多重功能于一身的优良菌种成为国内外研究的热点[7]。此外,虽然有关葡萄球菌的菌株筛选、益生特性和安全性等的研究报道很多,但是关于葡萄球菌在发酵制品中生长的代谢机理并不完全清楚。由于肉葡萄球菌具有很低的胞外蛋白水解能力,因此该菌可作为食品级基因克隆载体广泛用于分子遗传学方面,来进行葡萄球菌属相关代谢途径的研究[8]。
厚且致密的刚性细胞壁[9]和RM 系统的存在[10]也是限制肉葡萄球菌遗传操作的主要因素。为了选择合适菌株促进新型发酵剂的开发和加深对葡萄球菌相关功能的了解,需要开发一系列改进技术,允许对难以转化的菌株进行基因操作。电穿孔技术因操作简便、理论转化效率高而广泛应用在基因编辑中[8]。然而,电转化效率又受到多种因素的影响,包括感受态细胞制备方法[9]、电转化参数[11]、外源基因类型[10]、宿主RM 屏障[12]等,亟待建立一个更为稳定高效的适合肉葡萄球菌的电转化方法。
本研究首先优化电击缓冲液、电压、质粒质量浓度,初步确定较优条件,然后利用金黄色葡萄球菌RN4220[13]和大肠杆菌DC10B[14]对质粒进行修饰,采用高温热处理法暂时灭活宿主的RM 系统以提高肉葡萄球菌的电转效率。本研究旨在开发一种适用于多种葡萄球菌的通用方案,为后续革兰氏阳性细菌的研究奠定电转化方法学的基础。
1 材料与方法
1.1 材料与试剂
大肠杆菌DH5α、肉葡萄球菌pCA44 株由本实验室保存;大肠杆菌DC10B、金黄色葡萄球菌RN4220 购于明舟生物科技有限公司;穿梭质粒pKORl 质粒,购于Addgene 公司。
溶葡萄球菌素、氯霉素、氨苄青霉素、牛肉浸粉、胰蛋白胨、甘油、蔗糖、甘露醇、葡萄糖等均购于上海生工有限公司;质粒提取试剂盒购于Qiagen 公司;引物合成和测序工作均由上海生工生物工程股份有限公司完成。
1.2 仪器与设备
电转化仪、电转杯(间距2 mm)、PCR 仪,德国艾本德公司;生物安全柜1386、超低温冰箱,美国赛默飞世尔科技公司;生化培养箱,上海博迅医疗仪器有限公司;水平电泳仪、凝胶成像仪,美国伯乐公司;高压蒸汽灭菌锅,日本Hirayama 公司;制冰机,常熟市雪科电器有限公司;高速冷冻离心机,美国贝克曼库尔特公司。
1.3 相关溶液的配制
1.3.1 TSB 液体培养基 准确称取30.0 g TSB 粉末,加去离子水完全溶解,调pH 值至7.2±0.1,定容至1 L,121 ℃、1×105 Pa 灭菌15 min,用于肉葡萄球菌和金黄色葡萄球菌的生长。
1.3.2 TSA 固体培养基 在TSB 液体培养基的基础上添加1.5%~2.0%琼脂粉,121℃、1×105 Pa 灭菌15 min。
1.3.3 LB 肉汤培养基 氯化钠10 g/L,酵母浸出粉5 g/L,胰蛋白胨10 g/L,去离子水完全溶解后调节pH 值至7.2±0.1,121 ℃、1×105 Pa 灭菌15 min,用于大肠杆菌的生长。
1.3.4 RGM1 复苏培养基 在LB 肉汤培养基的基础上添加10%甘油,121 ℃、1×105 Pa 灭菌15 min。
1.3.5 RGM2 复苏培养基 在LB 肉汤培养基的基础上添加0.5 mol/L 甘露醇,121 ℃、1×105 Pa 灭菌15 min。
1.3.6 RGM3 复苏培养基 在LB 肉汤培养基的基础上添加0.5 mol/L 蔗糖,121 ℃、1×105 Pa 灭菌15 min。
1.3.7 RGM4 复苏培养基 在LB 肉汤培养基的基础上添加0.5 mol/L 葡萄糖,121 ℃、1×105 Pa 灭菌15 min。
1.3.8 Glc 电击缓冲液 吸取10 mL 甘油加入适量去离子水溶解,定容至100 mL,得到体积分数为10%的甘油,调节pH 值至7.2±0.1,121 ℃、1×105 Pa 灭菌15 min。
1.3.9 GM 电击缓冲液 0.5 mol/L 甘露醇,10%甘油,去离子水配制,调节pH 值至7.2±0.1,121 ℃、1×105 Pa 灭菌15 min。
1.3.10 GG 电击缓冲液 0.5 mol/L 葡萄糖,10%甘油,去离子水配制,调节pH 值至7.2±0.1,121℃、1×105 Pa 灭菌15 min。
1.3.11 GS 电击缓冲液 0.5 mol/L 蔗糖,10%甘油,去离子水配制,调节pH 值至7.2±0.1,121 ℃、1×105 Pa 灭菌15 min。
1.3.12 氯霉素(Cm)准确称取0.01 g 氯霉素加入1 mL 乙醇,充分混匀,过0.22 μm 滤膜,于-20℃保存,工作质量浓度为10 μg/mL,用于选择携带pKOR1 金黄色葡萄球菌和肉葡萄球菌[15]。
1.3.13 氨苄青霉素(Amp)准确称取0.10 g 氨苄青霉素加入1 mL 无菌水,充分混匀,0.22 μm 滤膜,于-20 ℃保存,工作质量浓度分别为100 μg/mL,用于选择携带pKOR1 的大肠杆菌。
1.4 方法
1.4.1 制备纯化质粒 采用QIAGEN-tip 20 中等量质粒提取试剂盒提取大肠杆菌DH5α,大肠杆菌DC10B 以及提取金黄色葡萄球菌RN4220中的pKOR1 质粒。具体步骤如下:
1)在3 000~5 000×g 转速条件下离心5~10 min,使细菌从培养液中沉淀。丢弃上清,确保所有液体完全除去;
2)向步骤1 中加入1 mL 缓冲液B1(含200 μg/mL 的RNase A),涡旋振荡以重悬的细菌颗粒;
3)向步骤2 中加入20 μL 溶菌酶原液,45 μL QIAGEN 蛋白酶K,在37 ℃下孵育至少30 min;
4)向步骤3 中加入0.35 mL 缓冲液B2,倒置管几次或旋涡几秒钟使溶液充分混合,在50 ℃下孵育30 min;
5)随后用1 mL 缓冲液QBT 缓冲液平衡QIAGEN genomics -tip 20/G,并 使QIAGEN genomics -tip 通过重力流清空;
6)将步骤4 的样品以最高速度涡旋10 s,并将其应用于平衡的QIAGEN genomics-tip。让它通过重力流入树脂;
7)随后加入1 mL 缓冲液QC 洗涤步骤6 的QIAGEN genomics-tip 3 次;
8)将QIAGEN genomics -tip 置于清洁的10 mL 收集管上,用1 mL 缓冲液QF(预热到50 ℃)洗脱基因组DNA 两次;
9)在洗脱的DNA 中加入1.4 mL 室温(15~25 ℃)下的异丙醇以沉淀DNA,混合并立即在4℃条件下,5 000×g 离心至少15 min,小心地除去上清;
10)用1 mL 70%的冷乙醇洗涤离心后的DNA 微球,短暂涡旋并在4 ℃条件下,5 000×g 离心至少10 min,小心地除去上清,不要碰到颗粒。风干5~10 min,将DNA 重悬在0.1~2 mL 的TE 缓冲液中,将DNA 在摇床上溶解一夜或在55 ℃下溶解1~2 h。
1.4.2 感受态细胞制备 将肉葡萄球菌pCA44/金黄色葡萄球菌RN4220 划线在TSA 培养皿中,37 ℃过夜培养,用一个无菌环挑选一个单菌落,接种于1 mL TSB 培养基中,37 ℃摇床过夜培养。将培养物以1%的接种量接种到100 mL TSB 培养基中,剧烈摇晃细胞约2.5~3 h,培养至OD600nm 为0.6。将培养物转移到两个50 mL 无菌离心管中,5 000×g 离心15 min。倒掉上清,将细胞沉淀悬浮于20 mL 用去离子水配制的GM 电击缓冲液中并转移到预冷的50 mL 无菌离心管中(从这里开始,将含有细胞的试管置于冰上),4 ℃、5 000×g 离心10 min。重复上一步,最后将细胞悬浮在1 mL 冰冷的GM 电击缓冲液中。最后,分装于1.5 mL 灭菌离心管中,每管100 μL,放于-80 ℃保存。
1.4.3 电击转化 从-80 ℃超低温冰箱中取出感受态细胞,放在冰上解冻5 min,然后室温下放置30 min。加入500 ng 质粒,充分混匀后将全部液体转移到2 mm 电极间距的电转杯中,置于冰上30 min。之后在电击强度为10 kV/cm 条件下,使用Eppendorf 电转仪进行电击转化。电击结束后在电转杯中立即加入预热的1 mL 复苏培养基RGM2,将全部液体转到1.5 mL 离心管中,30 ℃、150 r/min 摇床复苏培养2 h。将培养液稀释至适当梯度,并吸取100 μL 涂布在TSA10cm 培养基平板上,30 ℃过夜培养,直至出现转化子。其因素与水平设置详见表1。
表1 影响电转化效率的因素及水平
Table 1 Factors and levels affecting electric conversion efficiency

1.4.4 计算转化效率 统计在平板上生长的菌落,并计算每种条件的转化效率,计算方法如下所示。
每个平板上的DNA 量:将1 μL 4 μg/μL 新鲜制备的原液质粒DNA 加入100 μL 感受态细胞中。转化后加入900 μL 的TSB 中。10 μL 原液质粒DNA(相当于40 ng 的DNA)用990 μL 的TSB肉汤稀释,吸取100 μL(相当于4 ng 的DNA)涂布在平板上。
当在平板上计数100 个菌落时,转化效率为:100 个转化 子/4×10 -3μg=2.5×104 个转化 子/μg DNA。按照式(1)计算转化效率[16]。

1.4.5 引物设计 为了验证阳性转化子,设计引物pKOR1-F、pKOR1-R,通过PCR 扩增质粒片段的氯霉素抗性基因。引物合成由上海生工生物有限工司进行。引物序列为pKOR1-F:CCTGCCCCGTTAGTTGAAG,pKOR1-R:CAGTGAGCGCAACGCAAT。
1.4.6 琼脂糖凝胶电泳 称取0.4 g 琼脂粉,溶于20 mL 的1×TAE 缓冲液,放入微波炉间隔性加热,琼脂粉充分溶解后,待温度降至50 ℃左右,加入1 μL 的EB 溶液(终质量浓度为0.5 μg/mL),摇匀后倒入制胶模,插上梳子,室温下冷却凝固。小心拔去梳子,向槽内加入适量1×TAE 电泳缓冲液,然后将凝胶放置于电泳槽内,取10 μL PCR 产物加入胶孔中,同时加DNA Marker。盖上电泳槽盖,调节电压至200 V,电泳25 min 左右。小心取出凝胶,放置于凝胶成像系统中观察结果,并拍照保存。
2 结果与分析
2.1 电击缓冲液对转化效率的影响
在感受态细胞的制备过程中,电击缓冲液洗涤细胞以去除离子成分,以免在电穿孔过程中击穿感受态细胞导致细胞死亡,不同的电击缓冲液洗涤细胞的效果各有差异[8]。为探究最适电击缓冲液,本试验使用从大肠杆菌DH5α 中提取的质粒pKOR1,在肉葡萄球菌pCA44 菌体生长到OD600nm=0.6 时,收集菌体,使用不同电击缓冲液Glc、GM、GS、GG 洗涤细胞,制备肉葡萄球菌感受态细胞。在
电场强度为10 kV/cm 的条件下,电击感受态细胞和质粒的混合物,电击后立即加入复苏培养基,统计转化效率,结果如图1 所示。
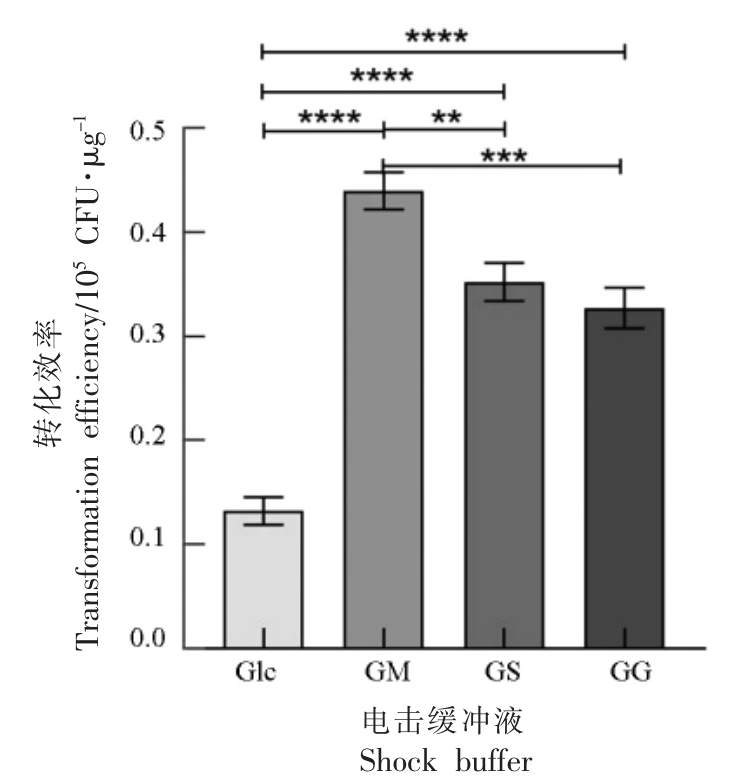
图1 电击缓冲液对转化效率的影响
Fig.1 Effects of shock buffer on transformation efficiency
注:** 表示较显著(P ≤0.01),*** 表示极显著(P ≤0.001),**** 表示非常显著(P ≤0.0001),下同。
由图1 知,使用含有10%甘油的电击缓冲液时,转化效率最低;当在电击缓冲液中加入甘露醇、蔗糖、葡萄糖时,转化效率大幅度提高;使用GM 电击缓冲液时转化效率最高,转化率达到4.40×104 CFU/μg,显示了甘露醇和甘油在细胞洗涤过程中发挥了较好的保护作用。因此,确定电击缓冲液的最佳组成成分为10%甘油与0.5 mol/L甘露醇。
2.2 电场强度对转化效率的影响
细菌对电场强度有一定的敏感性,当电场强度达到一定阈值时,锐利的电脉冲可在细胞膜造成小凹陷,并由此形成小至2 nm 大至数纳米的疏水性孔洞。随着电场强度的增加,细胞膜通透性越高,产生的疏水孔洞也越多,外源DNA 越容易进入到细胞,然而随着电场强度的不断增加,细胞的死亡率也会急剧增加[17]。为探究最适电场强度,本试验使用从大肠杆菌DH5α 中提取的质粒pKOR1,在肉葡萄球菌pCA44 菌体生长到OD600nm=0.6 时,收集菌体,使用10%甘油与0.5 mol/L 甘露醇洗涤细胞,制备肉葡萄球菌感受态细胞。将感受态细胞与质粒混合均匀后分别在9.0,9.5,10.0,10.5,11.0,11.5,12.0,12.5 kV/cm 电场强度下进行电击转化,电击后立即加入复苏培养基。统计转化效率,结果如图2 所示。
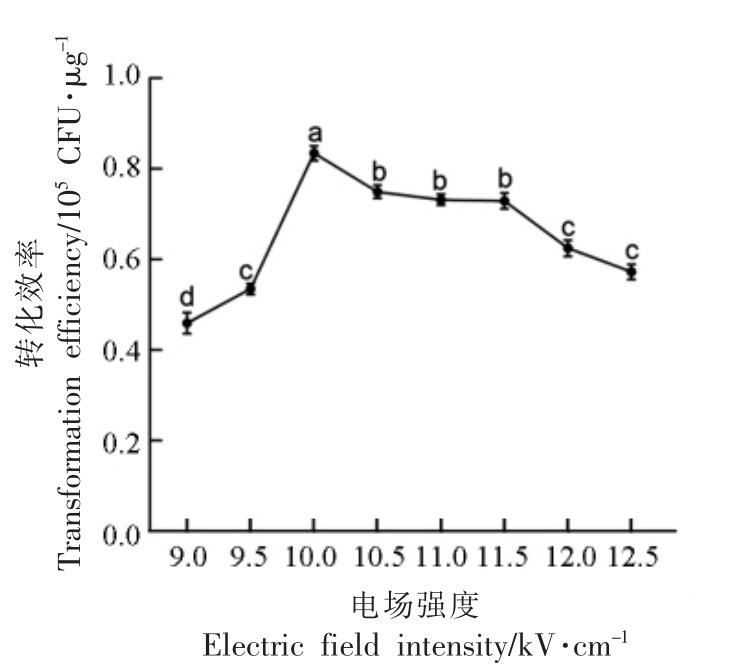
图2 电场强度对转化效率的影响
Fig.2 Effects of electric field intensity on transformation efficiency
注:不同字母表示不同显著性差异水平(P<0.01)。
由图2 可知,在9.0~11.5 kV/cm 范围内,转化效率先上升然后逐渐趋于平稳,由此推测出,随着电场强度的增加,肉葡萄球菌pCA44 细胞膜通透性增加,产生的疏水孔洞也越多,质粒DNA 越容易进入到细胞,当电场强度为10 kV/cm 时,得到最高转化率,为8.35×104 CFU/μg。然而,当电场强度大于11.5 kV/cm 时,细胞开始死亡,导致转化效率与电场强度出现负相关。综上所述,电转化肉葡萄球菌pCA44 的最佳电场强度为10 kV/cm。
2.3 质粒质量浓度对转化效率的影响
在电击转化过程中,为了研究质粒质量浓度对肉葡萄球菌pCA44 电转化效率的影响,试验在肉葡萄球菌pCA44 菌体生长到OD600nm=0.6 时,收集菌体,使用10%甘油与0.5 mol/L 甘露醇洗涤细胞,制备肉葡萄球菌感受态细胞。选用从大肠杆菌DH5α 中提取的质粒pKOR1,在100 μL 感受态细胞中分别加入10,50,100,500,1 000,2 000 ng 的质粒,混和均匀后在10 kV/cm 电场强度下电击转化,结束后立即加入复苏培养基。统计转化效率来探究最适质粒质量浓度,结果如图3 所示。
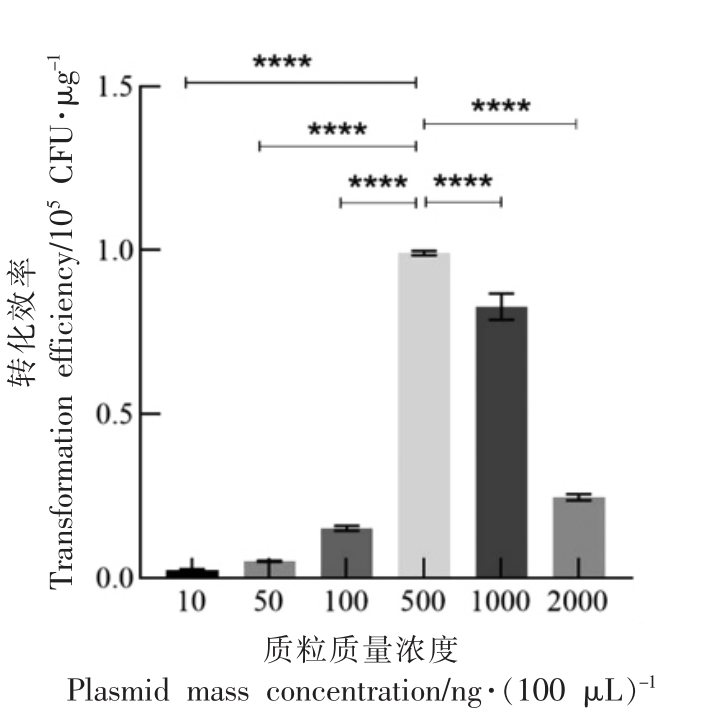
图3 质粒质量浓度对转化效率的影响
Fig.3 Effects of plasmid mass concentration on transformation efficiency
由图3 可知,质粒DNA 的质量浓度可显著影响转化效率。在10~100 ng/100 μL 的质粒质量浓度范围内,转化效率较低;质粒质量浓度在500 ng/100 μL 时达到最高,为9.97×104 CFU/μg;之后再升高质粒质量浓度,转化率却下降;当质量浓度为2 000 ng/100 μL 时,转化率下降至1.43×104 CFU/μg。由此推测,质粒转化感受态细胞时,只需要一定量的质粒完成转化即可。质粒是环状的,浓度越高其间缠绕越复杂,会使得发生断裂聚集等,降低了质粒与感受态细胞表面的接触。浓度过高溶液比较黏稠,不利于扩散[18],因此出现转化效率与质粒质量浓度呈负相关的现象。综上所述,电转化肉葡萄球菌pCA44 的最佳质粒质量浓度为500 ng/100 μL。
2.4 复苏培养基对转化效率的影响
如果电击后不立即加入新鲜培养基恢复细胞,许多细胞会死亡。另外,不同复苏培养基的复苏效果也各有差异。为探究最适复苏培养基,本试验使用从大肠杆菌DH5α 中提取的质粒pKOR1,在肉葡萄球菌pCA44 菌体生长到OD600nm=0.6 时,收集菌体,使用10%甘油与0.5 mol/L 甘露醇洗涤细胞,制备肉葡萄球菌感受态细胞。将感受态细胞与质粒混合均匀后,混合均匀后在10 kV/cm 电场强度下进行电转化,电击结束后迅速加入1 mL 不同的复苏培养基RGM1、RGM2、RGM3、RGM4。统计转化效率,结果如图4 所示。
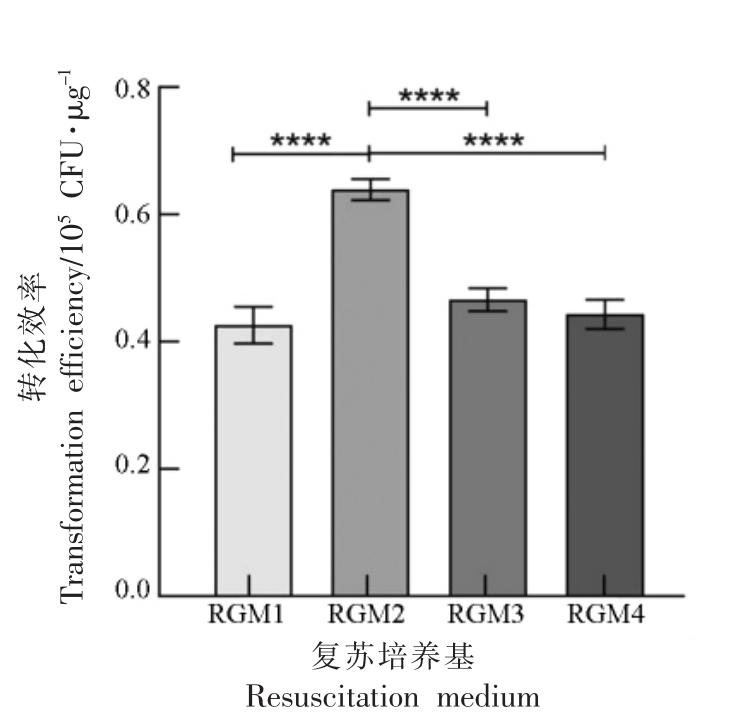
图4 复苏培养基对转化效率的影响
Fig.4 Effects of resuscitation medium on transformation efficiency
由图4 知,电击后加入含10%甘油的复苏培养基时,转化效率最低;当使用含有蔗糖、甘露醇、葡萄糖的复苏培养基时,转化效率大幅度提高,由此猜测适当在复苏培养基中添加高渗溶液可以有效保护细胞。其中使用含有0.5 mol/L 甘露醇的RGM2 复苏培养基时的转化率最高,达到6.40×104 CFU/μg。综上所述,确定电转化肉葡萄球 菌pCA44 的最佳复苏培养基为RGM2。
2.5 质粒修饰对转化效率的影响
缺乏RM 系统的金黄色葡萄球菌RN4220(rm+基因型)可以作为中间宿主接受来自大肠杆菌的质粒并复制传代[19],质粒通过该菌株后可以高效地引入葡萄球菌中。另外,从突变菌株大肠杆菌DC10B(甲基化酶缺陷型)中分离出来的质粒缺乏胞嘧啶甲基化,能够绕过RM 系统[10],提高质粒电转效率。基于此,通过电击将质粒pKOR1 转化至修饰型菌株金黄色葡萄球菌RN4220 中传代,并在30 ℃时将转化子置于TSA10cm 上进行筛选,提取阳性RN4220 菌株的质粒pKOR1-R;另外通过热击将质粒pKOR1 转化至另一修饰型菌株大肠杆菌DC10B 中,提取阳性DC10B 菌株的质粒pKOR1-D。这两种修饰型质粒与未修饰型质粒pKOR1 同时按照1.4.3 节的方法进行电转化至肉葡萄球菌pCA44 感受态细胞。在这一组试验中,在OD600nm=0.6 时收集肉葡萄球菌pCA44 来制备感受态细胞,转化时的质粒添加量为500 ng,电场强度为10 kV/cm,电击缓冲液为GM,复苏培养基为RGM2。探究质粒修饰对肉葡萄球菌pCA44 转化效率的影响,结果如图5 所示。
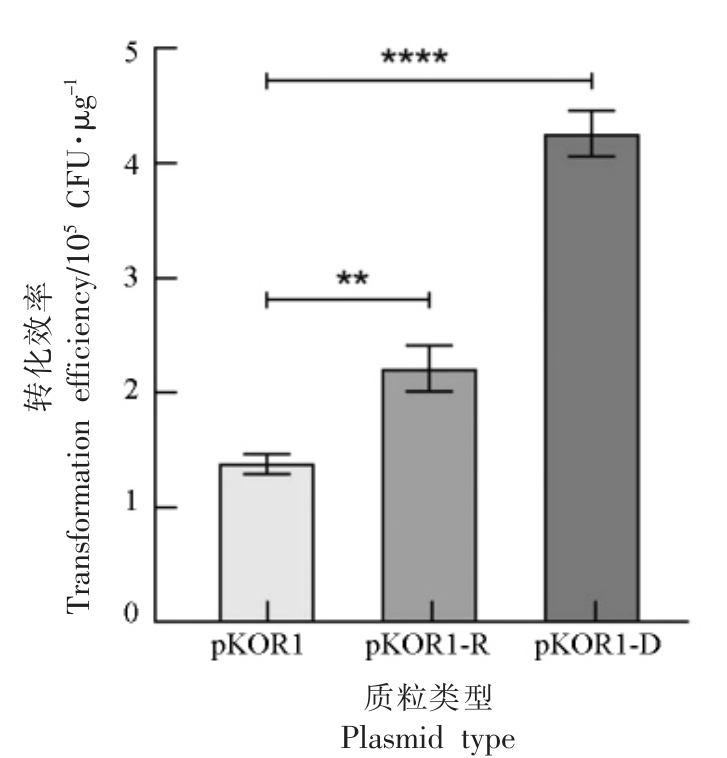
图5 质粒修饰对转化效率的影响
Fig.5 Effects of plasmid modification on transformation efficiency
由图5 可知,使用未修饰质粒电转化至肉葡萄球菌pCA44 只能获得1.38×105 CFU/μg 的转化效率,而使用修饰型质粒pKOR1-R 和pKOR1-D转化效率分别上升到2.21×105,4.26×105 CFU/μg,表明这两种方法能够都能提高外源质粒电转进肉葡萄球菌pCA44 的效率,且经大肠杆菌DC10B 修饰的质粒转化效果更明显。由此可以推测肉葡萄球菌pCA44 自身可能存在很强的RM 系统。宿主的RM 系统对质粒DNA 的切割是依赖于序列的,可以通过DNA 甲基化状态来阻止[20]。由于大肠杆菌DC10B 缺乏胞嘧啶甲基化酶,所以使得修饰后的质粒能够绕过肉葡萄球菌pCA44 中存在的RM系统;金黄色葡萄球菌RN4220 在基因sau1 hsdR(能够识别胞嘧啶甲基化基序)上有突变[10],因此可以接受外源质粒来进一步修饰。然而可能是由于经菌株RN4220 修饰的质粒再进行电击转化时存在菌株近缘性限制,所以转化至同种近缘金黄色葡萄球菌时有显著促进效果[12],而转化至肉葡萄球菌pCA44 菌株时促进效果不明显。
2.6 高温热处理对转化效率的影响
先前的研究报道表明高温热处理可使得宿主的RM 系统暂时性失活,从而提高质粒DNA 电转化效率[21]。为了验证这一方法在肉葡萄球菌电转优化中的可行性,本试验在电转化之前,先于56℃水浴2 min 热处理肉葡萄球菌pCA44 感受态细胞,加热后立即加入GM 电击缓冲液。5 000×g 离心15 min,重悬于100 μL 电击缓冲液中,之后按照1.4.3 节步骤进行电转化。未热处理的感受态细胞作为对照,评估热处理对转化效率的影响,结果如图6 所示。
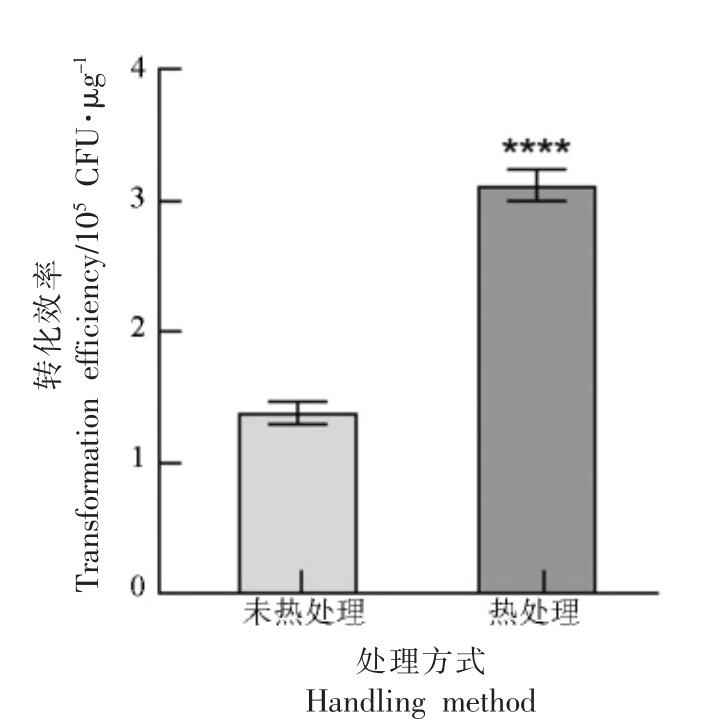
图6 高温热处理对转化效率的影响
Fig.6 Effects of high temperature heat treatment on transformation efficiency
由图6 可知,高温热处理后质粒转化进肉葡萄球菌的效率提高,经过方差分析,可以看出未热处理组与热处理组存在显著差异。对于热处理细胞,转化率为3.12×105 CFU/μg,是未热处理细胞的2.12 倍。综上所述,高温热处理法能显著提高质粒转化效率。
2.7 质粒修饰和高温处理对转化效率的影响
2.5节及2.6节中分别探讨了修饰型质粒(P水平)和高温热处理细胞(C 水平)对电击转化效率的影响,而电转效率的高、低取决于质粒和细胞这两个水平。为了探究更加高效的电击转化效率,本试验采用2 种方式同时干预的方法,即在高温热处理的基础上,电击转化修饰型质粒,得到组合法1(PC1)和组合法2(PC2),并与单水平的处理方法比较。统计转化效率,结果如图7 所示。
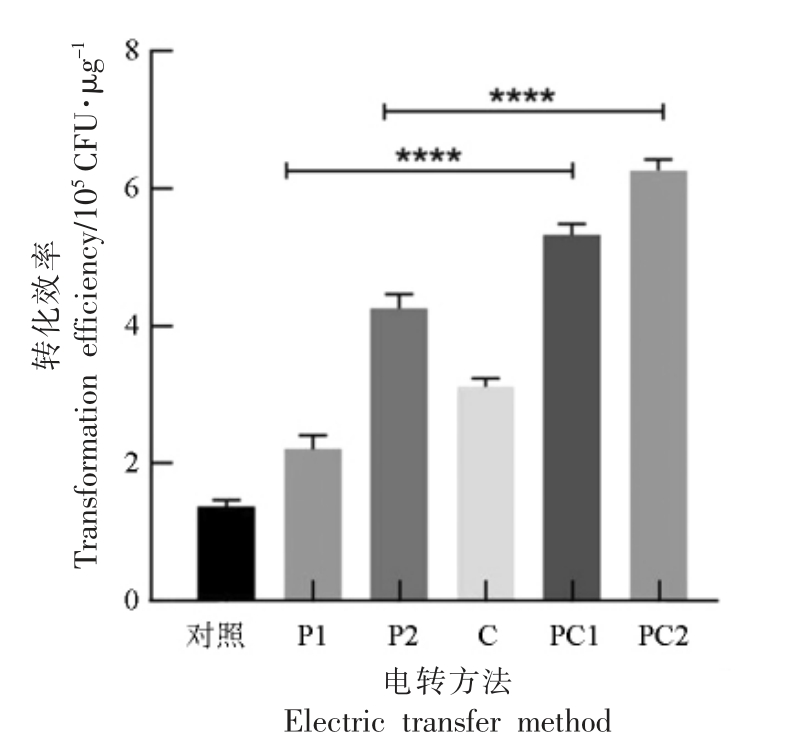
图7 电转方法对转化效率的影响
Fig.7 Influence of conversion methods on transformation efficiency
注:对照是指电击转化时使用未修饰型质粒pKOR1,也未进行高温热处理肉葡萄球菌pCA44 感受态细胞;C 是指电击转化时虽使用未修饰型质粒pKOR1,但进行了高温热处理肉葡萄球菌pCA44 感受态细胞;P1 是指电击转化时使用修饰型质粒pKOR1-R;P2 是指电击转化时使用修饰型质粒pKOR1-D;PC1 是指在高温热处理肉葡萄球菌pCA44 感受态细胞的基础上,电击转化修饰型质粒pKOR1-R;PC2 法是指在高温热处理肉葡萄球菌pCA44 感受态细胞的基础上,电击转化修饰型质粒pKOR1-D。
由图7 可以看出,电转化效率从高到底依次是PC2>PC1>P2>C>P1>对照,PC1 和PC2 得到的转化子数量分别达到5.32×105,6.26×105 CFU/μg,其中PC2 转化效率最高。另外,与P1 相比,PC1 能显著提高转化效率。由此推测,高温热处理可能打破了来自金黄色葡萄球菌RN4220 修饰型质粒转化时的近缘性限制,扩大了可转化菌株种类,所以其转化效率得到了明显的提升。与P2 相比,PC2法也提高了转化效率。推测出大肠杆菌DC10B 在质粒水平上进行了去甲基化修饰,高温热处理在细胞水平上使得肉葡萄球菌pCA44 的RM 系统暂时性失活,有效避免了宿主识别外源核酸甲基化位点,从而提高了转化效率。由此可以得出解除质粒与宿主细胞的双重限制性屏障,可以大大提高电转化效率。综上所述,在高温热处理肉葡萄球菌pCA44 感受态细胞的基础上,使用通过大肠杆菌DC10B 修饰的质粒pKOR1-D 得到的电击转化效率最高,且使用质粒与细胞两种干预方式提高电击转化效率的方法是可行的。
2.8 转化子的验证
为验证电转后的金黄色葡萄球菌RN4220 和肉葡萄球菌pCA44 是否为阳性转化子,随机选择3 个转化子,接种到含有10 μg/mL 氯霉素的液体TSB 培养基中,30 ℃过夜培养。取过夜培养的菌液用溶菌酶裂解,以裂解后的菌液为模板,以pKOR1-F、pKOR1-R 为引物,进行PCR 验证,并用2%的琼脂糖凝胶电泳检测分析。结果如图8 所示。
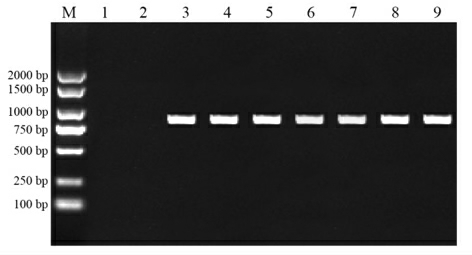
图8 转化子的PCR 验证
Fig.8 PCR validation of inverters
注:M.marker DL2000;1.金黄色葡萄球菌RN4220 阴性对照;2.肉葡萄球菌pCA44 阴性对照;3.阳性对照pKOR1;4~6.3 个金黄色葡萄球菌RN4220 随机挑取的转化子提取的质粒;7~9.3 个肉葡萄球菌pCA44 随机挑取的转化子提取的质粒。
pKOR1 作为阳性对照,对各转化子质粒的PCR 验证均在870 bp 左右出现目的条带,且与阳性对照结果一致,证明质粒pKOR1 成功地转化到金黄色葡萄球菌RN4220 和肉葡萄球菌pCA44 宿主中。
3 结论
本研究对影响肉葡萄球菌pCA44 电转化效率的有关因素进行了优化,分析比较了3 种已报道出较为高效的克服葡萄球菌RM 屏障的电转化方法差异,并在前人的基础上探索新型更为高效的电转方法。研究结果表明,在制备感受态细胞条件上,使用10%甘油和0.5 mol/L 甘露醇配成的洗涤缓冲液对细胞进行洗涤效果最好;在电转化条件上,当电场强度为10 kV/cm 时,电转化效率最高;此外,对质粒因素的研究发现,当质粒质量浓度为500 ng/100 μL 时,电转化效率最高;最后,电击结束后,通过对复苏培养基的调整,发现使用含有0.5 mL/L 甘露醇的复苏培养基时转化效率最高。通过优化以上电转化参数,找到了最适合肉葡萄球菌pCA44 电转化的条件,得到了稳定的转化效果。在最优条件的基础上使用修饰型质粒或(和)高温热处理法对肉葡萄球菌pCA44 进行电转化试验,发现使用金黄色葡萄球菌RN4220、大肠杆菌DC10B 修饰质粒,高温热处理感受态细胞可使得肉葡萄球菌pCA44 的转化子数量分别达到2.21×105,4.26×105,3.12×105 CFU/μg。进一步优化试验方案,在高温热处理的基础上,电击转化修饰型质粒pKOR1-R 和pKOR1-D,发现肉葡萄球菌pCA44 的转化子数量分别达到5.32×105,6.26×105 CFU/μg。综上所述,在高温热处理肉葡萄球菌pCA44 感受态细胞的基础上,使用通过大肠杆菌DC10B 修饰的质粒pKOR1-D 得到的电击转化效率最高。
综上所述,本研究得到的最优电转化方法使得肉葡萄球菌pCA44 转化效率达到6.26×105 CFU/μg DNA,比张变强等[8]以前报道的转化效率提高了2 个数量级。因此,使用质粒修饰与高温热处理细胞两种方式提高电击转化效率的方法是可行的。有效解决了肉葡萄球菌转化效率低、重复性差的问题,也为打破其它菌株的RM 系统屏障,提高电转化效率奠定了理论与应用的基础。同时促进了多功能新型发酵剂的开发及其在发酵制品中生长代谢机理的了解,对于制备安全、健康,品质独特的发酵产品具有重要的应用价值。
[1] 钮成拓,赵佳迪,李崎,等.一株降低生物胺的肉葡萄球菌及其应用:CN110846260A[P].2020-02-28[2022-01-23].NIU C T,ZHAO J D,LI Q,et al.A strain of Staphylococcus carnosus with reduced bioamines and its application:CN110846260A[P].2020-02-28[2022-01-23].
[2] 李宗军.中国传统酸肉中葡萄球菌的分离鉴定与应用研究[J].生物技术通报,2006(3):77-80.LI Z J.Isolation and identification of Staphylococci in Chinese traditional cured meat and its application[J].Biotechnology Bulletin,2006(3):77-80.
[3] 周慧敏,张顺亮,赵冰,等.木糖葡萄球菌和肉葡萄球菌混合发酵剂对腊肉品质的影响[J].食品科学,2018,39(22):32-38.ZHOU H M,ZHANG S L,ZHAO B,et al.Effect of starter culture mixture of Staphylococcus xylosus and Staphylococcus carnosus on the quality of drycured meat[J].Food Science,2018,39(22):32-38.
[4] SEMEDO-LEMSADDEK T,CARVALHO L,TEMPERA C,et al.Characterization and technological features of autochthonous coagulase-negative Staphylococci as potential starters for portuguese dry fermented sausages[J].Journal of Food Science,2016,81(5):M1197-M1202.
[5] 史智佳,臧明武,吕玉中.肉葡萄球菌对香肠发色的影响[J].肉类研究,2012,26(2):4-7.SHI Z J,ZANG M W,LÜ Y Z.Effect of Staphylococcus carnosus powder on the color of sausage[J].Meat Research,2012,26(2):4-7.
[6] CASABURI A,BLAIOTTA G,MAURIELLO G,et al.Technological activities of Staphylococcus carnosus and Staphylococcus simulans strains isolated from fermented sausages[J].Meat Science,2005,71(4):643-650.
[7] 陈亚杰,张香美,卢涵,等.有益葡萄球菌对发酵肉制品品质影响[J].肉类工业,2019(2):40-43.CHEN Y J,ZHANG X M,LU H,et al.The effect of beneficial staphylococcus on the quality of fermented meat product[J].Meat Industry,2019(2):40-43.
[8] 张变强,唐巧巧,柯灵超,等.肉葡萄球菌电转条件的优化[J].天津科技大学学报,2019,34(3):8-14.ZHANG B Q,TANG Q Q,KE L C,et al.Optimization of electroporation conditions for Staphylococcus carnosus[J].Journal of Tianjin University of Science & Technology,2019,34(3):8-14.
[9] LOFBLOM J,KRONQVIST N,UHLEN M,et al.Optimization of electroporation-mediated transformation:Staphylococcus carnosus as model organism[J].J Appl Microbiol,2007,102(3):736-747.
[10] MONK I,FOSTER T.Genetic manipulation of Staphylococci-Breaking through the barrier[J].Frontiers in Cellular and Infection Microbiology,2012,2(49):1-9.
[11] 蒋华波.大肠埃希菌TG_1 电穿孔法转化条件优化研究[J].生物技术进展,2017,7(1):72-76.JIANG H B.Optimization of electroporation conditions for Escherichia coli Strain TG_1[J].Current Biotechnology,2017,7(1):72-76.
[12] MONK I R,TREE J J,HOWDEN B P,et al.Complete bypass of restriction systems for major Staphylococcus aureus lineages[J].mBio,2015,6(3):e00308-15.
[13] CUI B,SMOOKER P M,ROUCH D A,et al.Enhancing DNA electro-transformation efficiency on a clinical Staphylococcus capitis isolate[J].Journal of Microbiol Methods,2015,109(2015):25-30.
[14] MONK I R,SHAH I M,XU M,et al.Transforming the untransformable:Application of direct transformation to manipulate genetically Staphylococcus aureus and Staphylococcus epidermidis [J].mBio,2012,3(2):e00277-11.
[15] SCHNEEWIND O,MISSIAKAS D.Genetic manipu lation of Staphylococcus aureus[J].Current Protocols in Microbiology,2014,32(1):1-19.
[16] HISATSUNE J,SATO'O Y,YU L,et al.Efficient transformation of Staphylococcus aureus using multipulse electroporation [J].Journal of Microbiological Methods,2016,130(2016):69-72.
[17] 肖冲,王春风.乳酸菌电转化的原理与转化条件的优化[J].吉林畜牧兽医,2010,31(7):17-18.XIAO C,WANG C F.Advancement on onditions of electrotransformation of lactic acid bacteria[J].Jilin Animal Husbandry and Veterinary Medicine,2010,31(7):17-18.
[18] 杨小盼,董立厚,万德有,等.毕赤酵母电转化方法的探索[J].生物技术通报,2013(12):156-161.YANG X P,DONG L H,WAN D Y,et al.Exploration of Pichia pastoris electroporation method[J].Biotechnology Bulletin,2013(12):156-161.
[19] 马国涵.大菱鲆肠道中广谱拮抗活性乳酸菌的筛选及其细菌素鉴定[J].食品科学,2019,40(6):159-165.MA G H.Screening for broad-spectrum antagonistic lactic acid bacteria from intestine of turbot and identification of bacteriocin produced by it[J].Food Science,2019,40(6):159-165.
[20] STOBBERINGH E E,SCHIPHOF R,SUSSENBACH J S.Occurrence of a class II restriction endonuclease in Staphylococcus aureus[J].Journal of Bacteriology,1977,131(2):645-649.
[21] VEIGA H,PINHO M G.Inactivation of the SauI type I restriction-modification system is not sufficient to generate Staphylococcus aureus strains capable of efficiently accepting foreign DNA[J].Applied and Environmental Microbiology,2009,75(10):3034-3038.