小青菜(Brassica chinensis L.)又名不结球白菜、小白菜,是一类种植范围广泛、营养价值较高的绿叶蔬菜[1]。采后小青菜水分含量高,叶片脆嫩,且生理代谢速度快,在贮藏过程中极易发生黄化褪绿、失水萎蔫等变化。小青菜这类天然绿色蔬菜含有超过52 种促进人体健康的成分[2],其中叶绿素被认为是潜在预防癌症的活性成分[3]。然而,伴随着小青菜的衰老,叶绿素降解,导致小青菜的营养价值和经济价值下降。研究贮藏中小青菜叶绿素的降解作用具有重要意义。
人工气调(Controlled atmosphere,CA)通过控制贮藏环境中的氧气和二氧化碳的比例,降低果蔬呼吸速率,从而保持果蔬品质[4]。目前气调保鲜已被应用到火龙果[4]、苹果[5]、西兰花[6]等果蔬中。高春霞等[7]研究发现4% O2 和5% CO2 的气调贮藏条件可以延缓小白菜中抗坏血酸、可溶性糖、可溶性固形物的降解,有效保持小白菜贮藏品质。也有研究发现气调环境为2% O2、5% CO2 和93%相对湿度时,可有效延长大白菜的贮藏期,降低腐烂率[8]。
目前,有关人工气调贮藏对小青菜的影响研究主要是生理、生化品质方面的,而对于叶绿素降解作用的研究鲜有报道。本文研究不同人工气调条件下小青菜叶绿素的降解作用,为小青菜的气调贮藏提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料 小青菜,购自浙江秋梅食品有限公司。挑选大小均一、无病虫害的小青菜进行采摘,并于当天运回实验室。
1.1.2 试剂 叶绿素a(纯度≥85%)、叶绿素b(纯度≥90%)、甲醇、乙酸乙酯,均为色谱级,购自阿拉丁试剂公司;丙酮、氢氧化钾、氯化钠、无水硫酸钠,均为分析纯级,购自上海凌峰化学试剂公司。
1.2 仪器与设备
e2695-2998 型高效液相色谱仪,美国WATERS 公司;Thermo MR23i 型高速低温冷冻离心机,法国捷安特集团股份有限公司;JA260SB 型电子精密天平,上海精科天美科学仪器有限公司;WFZ UV-9000 型紫外-可见分光光度计,上海Metash 公司;CR-400 型颜色分析仪,日本柯尼卡美能达公司。
1.3 方法
挑选无机械损伤、无病虫害和成熟度一致的小青菜,于10 ℃预冷2 h。然后取出随机分装,每组约7 kg。人工气调箱参数设置如表1 所示。
表1 气调箱参数设置
Table 1 CA parameter settings

1.3.1 色泽的测定 使用手持式色差仪测定小青菜的L*、a*、b*值[1]。选取小青菜外层的4 片叶子进行测定,测定时需要避开叶片中叶茎、叶脉,每组选择4 颗小青菜。
1.3.2 黄化率的测定 黄化率的测定参考卢瑞雪等[1]的方法并稍作修改。根据青菜外4 层叶片黄化面积划分为5 级。0 级,无黄化;1 级,0<S≤10%;2级,10%<S≤25%;3 级,25%<S≤40%;4 级,S>40%(S 表示黄化面积)。每次由3 名同学观分别记录10 颗小青菜的黄化情况,黄化指数按照以下公式计算。
1.3.3 失重率的测定 在每个贮藏时间取样点称取小青菜的质量,计算小青菜减少的质量占初始质量的百分比(%)。
1.3.4 叶绿素a/b 及其代谢产物含量的测定 小青菜中叶绿素a/b 及其代谢产物含量的测定参考孙凤杰[9]的方法并稍作修改。称取小青菜样品1 g,待叶绿素及代谢产物提取完成后,氮吹至干,加入2 mL 丙酮复溶,过0.22 μm 有机滤膜等待上机检测。叶绿素a/b 及其代谢产物的含量均以μg/g FW 表示。
色谱条件:检测波长430 nm,柱温35 ℃,进样量10 μL;流动相A 为V甲醇∶V水=3∶1,流动相B 为乙酸乙酯,洗脱梯度见表2。
表2 HPLC 梯度洗脱表
Table 2 HPLC gradient elution table
1.3.5 叶绿素降解相关酶活性的测定 叶绿素酶(Chlase)、脱镁螯合酶(MD)、脱镁叶绿素酶(PPH)的测定参考孙凤杰[9]的方法并稍作修改。称取小青菜样品1 g,经丙酮浸提至组织变化,离心保留残渣。再加入5 mL 5 mmol/L 磷酸缓冲液(pH 7.0,内含50 mmol/L KCl 和2.4 g/L TritonX-100)于4℃下提取1 h,离心后保留上清液。叶绿素降解过氧化物酶(Chl-POX)的测定参考Xu 等[10]的方法进行测定,以每克小青菜样品每小时吸光度变化值变化0.1 为1 个酶活性单位U,结果以U/g FW表示。
1.4 数据处理
采用Excel 2017 和SPSS 20 进行数据统计分析和差异性显著水平分析(P<0.05 表示具有显著性差异),使用Origin 2019 绘图。
2 结果与分析
2.1 人工气调贮藏对小青菜表观色泽的影响
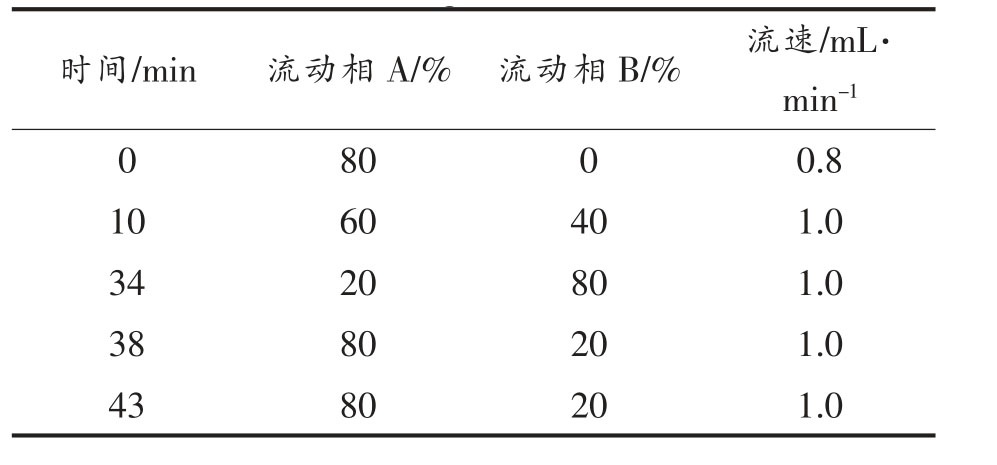
从图1 可以看到,对照组的表观颜色在贮藏第4 天出现黄绿色,气调处理后的小青菜仍能较好地保持绿色。贮藏至12 d,对照组的叶片大部分变成深黄色,还有一部分腐烂变成褐色;4% CO2处理组的叶片边缘出现淡黄色,叶片的颜色、饱满度明显优于其它各组。由图2a~2c 可知,小青菜的L*、a*、b*值随着贮藏时间的延长不断增大。贮藏第4~6 天,对照组中小青菜的L*、b*值显著高于气调处理组(P<0.05),而各组的a* 值差异不显著(P>0.05)。小青菜在贮藏第8 天后,对照组的L*、a*、b*值显著高于气调处理组(P<0.05),说明气调处理能够有效延缓小青菜的色泽变化。小青菜的黄化指数如图2d 所示,对照组在贮藏第4 天的黄化指数迅速升高,显著高于气调处理组(P<0.05)。贮藏第12 天,4% CO2 处理组的黄化指数显著低于8% CO2 和12% CO2 处理组(P<0.05),以上说明人工气调贮藏可以有效维持小青菜的绿色状态,相比之下4% CO2 处理的效果较优。

图1 小青菜在人工气调贮藏中的变化
Fig.1 Changes of Brassica chinensis L.in CA
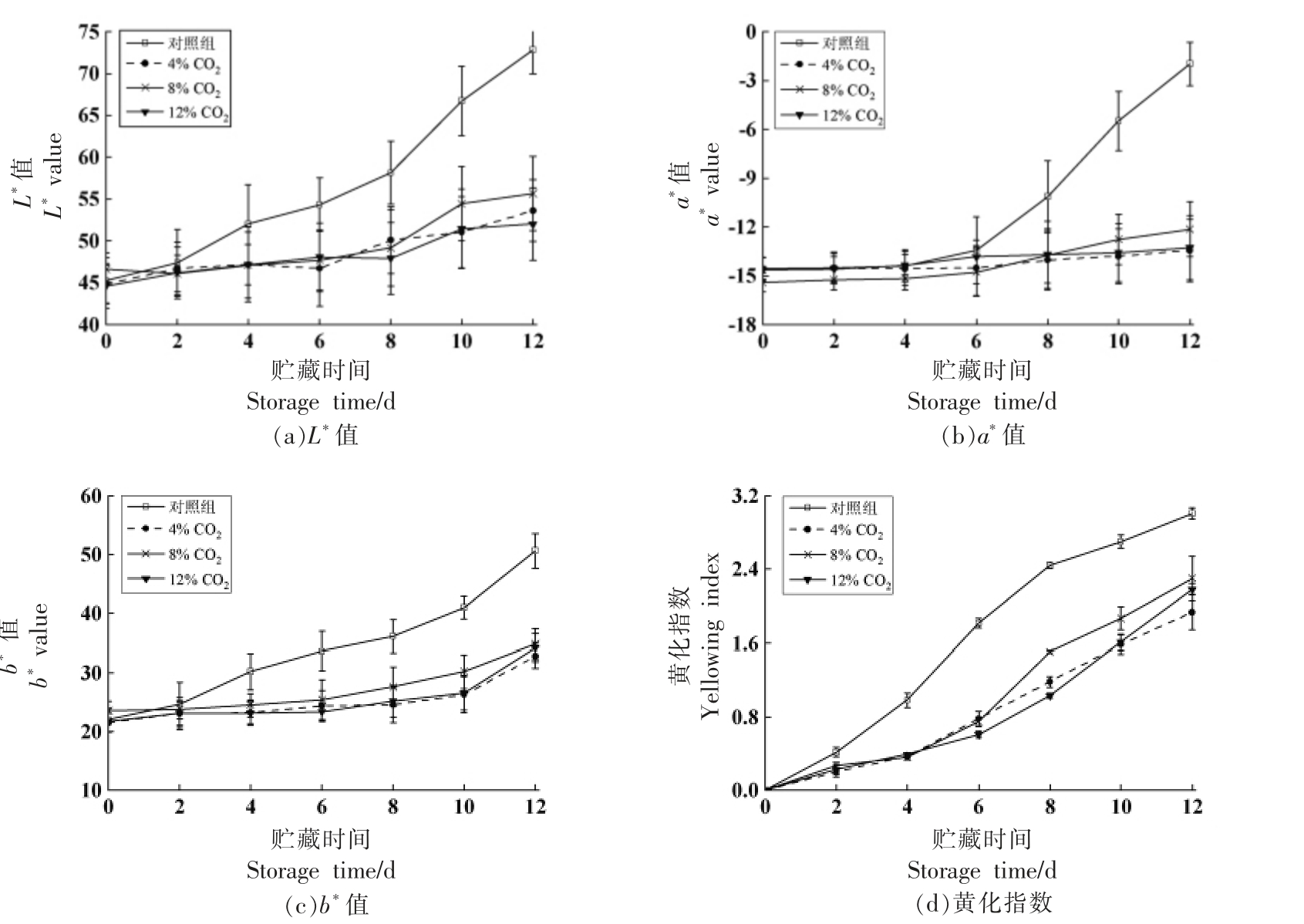
图2 人工气调对小青菜L*值、a*值、b*值和黄化指数的影响
Fig.2 Effects of CA on the L* value、a* value、b* value and yellowing index of Brassica chinensis L.
2.2 人工气调贮藏对小青菜失重率的影响
小青菜在贮藏过程中的失重率持续升高(如图3 所示),对照组的失重率从贮藏第4 天开始显著高于气调处理组(P<0.05)。贮藏至12 d,对照组、8% CO2 处理组和12% CO2 处理组的失重率分别高于4% CO2 处理组51.33%,23.94%和14.27%(P<0.05),说明气调处理可以明显减小贮藏中小青菜的重量损失,其中4% CO2 条件贮藏较好。这可能是由于人工气调处理降低了小青菜的呼吸速率[11],同时减小了叶片的气孔导度使得蒸腾速率也减小[12]。

图3 人工气调对小青菜失重率的影响
Fig.3 Effects of CA on the weight loss of Brassica chinensis L.
2.3 人工气调贮藏对小青菜叶绿素a/b 含量的影响
从图4 可以看出,小青菜在人工气调贮藏下,叶绿素a/b 含量的下降速度较为缓慢。对照组在贮藏第4 天后,叶绿素a/b 含量明显低于气调处理组(P<0.05)。贮藏第12 天,对照组中叶绿素a/b含量分别较第0 天下降了88.93%,98.83%,4%CO2 处理组中叶绿素a/b 含量分别为48.20,40.45 μg/g FW,说明人工气调处理可以有效延缓叶绿素a/b 的降解,使得小青菜持绿效果较好。
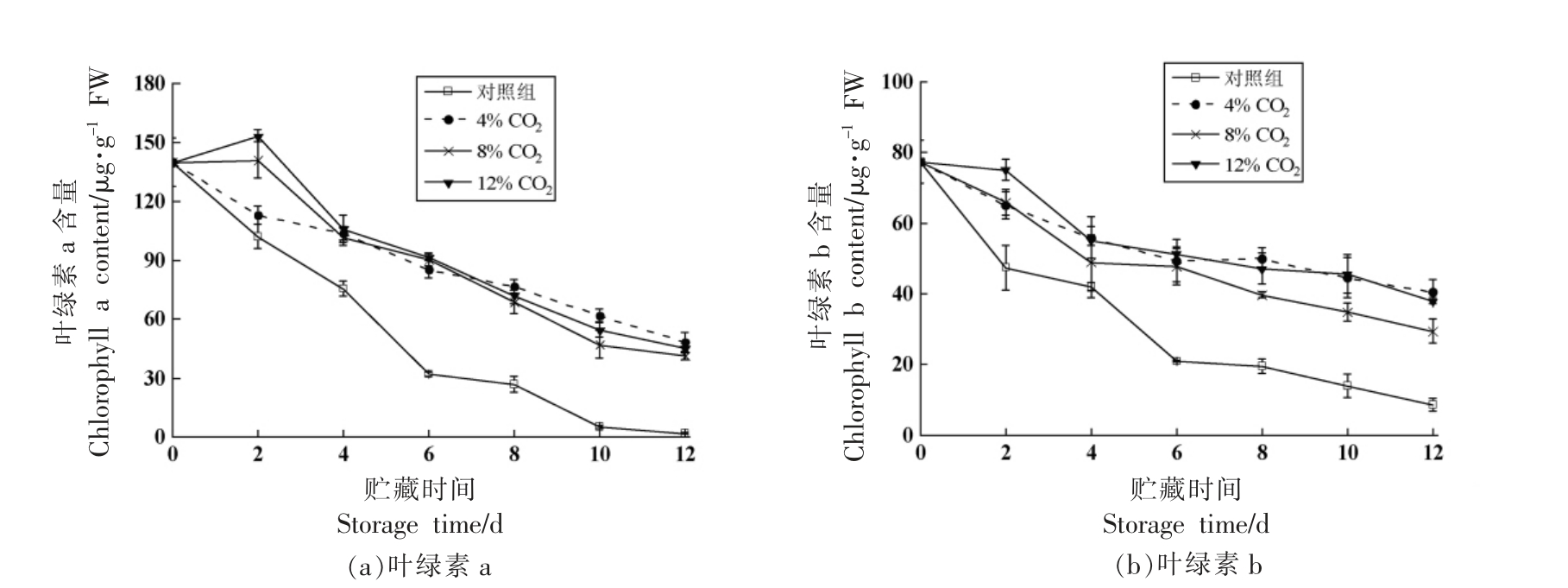
图4 人工气调对小青菜叶绿素a/b 含量的影响
Fig.4 Effects of CA on the content of chlorophyll a/b of Brassica chinensis L.
2.4 人工气调贮藏对小青菜叶绿素代谢产物含量的影响
小青菜中脱植基叶绿素a/b 含量的变化如图5a 和5b 所示。小青菜中脱植基叶绿素a 在贮藏第2 天迅速升高,4% CO2 处理组的脱植基叶绿素a含量为9.27 μg/g FW,显著低于其它组(P<0.05)。脱植基叶绿素b 的含量虽呈现起伏变化,但是波动较小。贮藏至10 d,12% CO2 处理组的脱植基叶绿素a/b 含量较高,分别为6.33,4.56 μg/g FW;继续贮藏,脱植基叶绿素a/b 含量降低。4% CO2处理组的脱植基叶绿素a 在贮藏第12 天为6.70 μg/g FW,显著高于对照组(P<0.05),说明4%CO2 处理可以在贮藏前期延缓小青菜中脱植基叶绿素a/b,在贮藏后期也可以使得脱植基叶绿素a得到较好地保持。
图5 人工气调对小青菜脱植基叶绿素a/b、脱镁叶绿素a/b、脱镁叶绿酸a 含量的影响
Fig.5 Effects of CA on the content of chlorophyll a/b,pheophytin a/b and demagnesified chlorophyllin a of Brassica chinensis L.
图5c 和5d 分别表明了小青菜中脱镁叶绿素a/b 含量的变化情况。贮藏0~4 d,对照组和4%CO2 处理组中的脱镁叶绿素a/b 含量都呈现先下降再上升的变化,而8% CO2 处理组和12% CO2处理组的脱镁叶绿素a/b 含量变化较小。贮藏第8天,4% CO2 处理组和12% CO2 处理组中的脱镁叶绿素a 含量分别为15.72,15.80 μg/g FW,显著高于对照组和8% CO2 处理组(P<0.05)。继续贮藏,12% CO2 处理组中的脱镁叶绿素b 达到峰值2.57 μg/g FW,之后开始下降。4% CO2 处理组中的脱镁叶绿素b 含量在贮藏后期持续升高,并在贮藏第12 天达到2.55 μg/g FW;此时该组脱镁叶绿素a 含量为19.06 μg/g FW,而对照组较4%CO2 处理组降低了78.50%,说明小青菜在贮藏后期,4% CO2 处理和12% CO2 处理可以延缓脱镁叶绿素a 含量的下降。
从图5e 可知,小青菜中脱镁叶绿酸a 含量变化总体上先上升再下降。贮藏第2 天,12% CO2 处理组中的脱镁叶绿酸a 含量升高至7.64 μg/g FW,是4% CO2 处理组的1.83 倍(P<0.05)。对照组中的脱镁叶绿酸a 含量在10~12 d 下降较快,显著低于气调处理组(P<0.05),表明人工气调贮藏可以延缓小青菜中脱镁叶绿酸a 的降解。
2.5 人工气调贮藏对小青菜叶绿素代谢相关酶活力的影响
小青菜中叶绿素酶活力的变化如图6a 所示,对照组的叶绿素酶活力在贮藏第2 天升高到35.02 U/g FW,而气调处理组较第0 天明显下降(P<0.05)。小青菜贮藏至6 d 后,叶绿素酶活力开始快速下降。贮藏第12 天,对照组中的叶绿素酶活力显著低于各气调贮藏组(P<0.05)。说明气调处理可以抑制小青菜中叶绿素酶活力的上升。

图6 人工气调对小青菜叶绿素酶、脱镁螯合酶、脱镁叶绿素酶、叶绿素过氧化物酶活力的影响
Fig.6 Effects of CA on the activity of chlase,MD,PPH and Chl-POX of Brassica chinensis L.
如图6b 所示,贮藏第2 天,对照组中的脱镁螯合酶活力上升到6.61 U/g FW,显著高于气调处理组(P<0.05),其中4% CO2 处理组的脱镁螯合酶活力较对照组降低了43.03%,说明气调处理能够在贮藏前4 d 有效延缓小青菜中脱镁螯合酶活力的上升。
在整个贮藏期中,小青菜中脱镁叶绿素酶活力在总体呈上升趋势(图6c)。贮藏前4 d,对照组和气调处理组的脱镁叶绿素酶活力没有差异(P>0.05)。贮藏第6 天,12% CO2 处理组的脱镁叶绿素酶活力较第4 天升高了97.36%。未气调贮藏的小青菜从贮藏第8 天开始,其脱镁叶绿素酶活力迅速升高,显著高于气调处理组(P<0.05)。贮藏至12 d,对照组中的脱镁叶绿素酶较4% CO2 处理组升高了88.17%,说明小青菜在4% CO2 气调贮藏下,脱镁叶绿素酶活力被明显抑制。
由图6d 可以看出,小青菜中的叶绿素过氧化物酶活力在贮藏中呈波动变化。12% CO2 处理组在贮藏第6 天达到最高值2.83 U/g FW。贮藏第8天,4% CO2 的叶绿素过氧化物酶活力下降了18.32%,显著低于其它各组(P<0.05)。对照组的叶绿素过氧化物酶活力在第4 天后持续升高,在贮藏第12 天显著高于4% CO2 处理组和8% CO2处理组(P<0.05),说明4% CO2 处理能够在小青菜贮藏后期有效延缓叶绿素过氧化物酶活力。
3 讨论与结论
小青菜在贮藏过程中叶片颜色由绿色到黄色,这主要是由衰老过程中叶绿素的降解所致。环境因素(如光、温度、氧气等)和保鲜处理对果蔬衰老影响较大[13-14]。卢瑞雪等[1]发现褪黑素处理可以延缓小青菜叶绿素的降解,保持较好的外观品质。王向阳等[15]使用胆固醇浸泡处理青菜,可以延缓青菜在贮藏过程中抗坏血酸和叶绿素的降解。也有研究发现1-MCP(1-甲基环丙烯)可以提高青菜的抗氧化酶活性,有效缓解叶绿素降解[16]。茶多酚和1-MCP 复合处理能够推迟黄心猕猴桃呼吸高峰和乙烯释放峰的出现,延缓叶绿素的降解[17]。保鲜剂可以延缓果蔬衰老,保持果蔬贮藏品质,然而保鲜剂的使用存在一定的安全风险,且成本较高。杨冲等[18]发现10% O2+10% CO2+80% N2 的气调包装有利于空心菜净菜中叶绿素和VC 含量的保持。芦笋在初始气调条件为50 mL/L O2、100 mL/L CO2 的环境中能够保持较低的呼吸速率,有效抑制了叶绿素的降解[19]。由于自发气调容易受到果蔬的呼吸速率、贮藏温度等因素制约,果蔬贮藏环境中的气体浓度难以控制。相比之下,人工气调可以稳定控制贮藏环境的气体浓度、温度和湿度,使用方便,成本也较低,更适合叶类蔬菜的贮藏保鲜。
小青菜中叶绿素包括叶绿素a 和叶绿素b 两种,它们仅在吡咯环Ⅱ上的基团存在差异。叶绿素b 首先在叶绿素a 还原酶的催化下转化为叶绿素a[20]。一般认为叶绿素a 经过脱植基去Mg2+生成脱镁叶绿酸a 有2 条途径:一条是以脱植基叶绿素a为中间产物的途径,另一条途径是以脱镁叶绿素a为中间产物。在第一条途径中,叶绿素a 在叶绿素酶的作用下脱植基形成脱植基叶绿素a,然后脱镁螯合酶作用于脱植基叶绿素a 除去Mg2+生成脱镁叶绿酸a。贮藏第12 天,对照组中叶绿素a/b 的含量较第0 天分别下降了98.26%,88.93%(图4),对照组和气调处理组中叶绿素酶活力在贮藏前6 d呈现相反趋势的变化,对照组的叶绿素酶活力迅速升高至峰值,而气调处理显著抑制了叶绿素酶活力的上升(图6a)。图6b 表明气调处理显著抑制了小青菜在贮藏前4 d 中脱镁螯合酶的活力,说明小青菜中叶绿素酶和脱镁螯合酶的活力会影响叶绿素a/b 的降解,人工气调处理可以延缓这两种酶活力的上升,从而抑制叶绿素a/b 的降解。Zhang 等[21]观察到菜心在衰老过程中叶绿素的降解会伴随着脱镁螯合酶活力升高。樊艳燕等[22]发现青花菜中叶绿素含量的变化主要通过Bo CLH2(叶绿素酶2)、Bo PPH(脱镁叶绿素酶)、Bo PaO(脱镁叶绿酸a 加氧酶)以及Bo RCCR(红色叶绿素代谢产物还原酶)的表达量变化来调节,Bo CLH1 主要在青花菜初始衰老中起降解叶绿素的作用。Aiamla 等[23]提出UV-B 处理通过抑制西兰花中调控叶绿素b 转化为叶绿素a 的Bo SGR 和Bo NYC1 基因的表达,延缓西兰花变黄。叶绿素酶也可以作用于叶绿素b 形成脱植基叶绿素b[24]。可以看到脱植基叶绿素a 在贮藏前8 d 起伏变化较大,而脱植基叶绿素b 的含量呈现缓慢波动变化。这可能是由于叶绿素b 与叶绿素a 具有反馈调节作用,而叶绿素b 的降解效率不如叶绿素a[25]。在另一条途径中,叶绿素a 在金属螯合物MCS 的作用下除去Mg2+,生成脱镁叶绿素a,脱镁叶绿素a 在脱镁叶绿素酶的作用下脱植基生成脱镁叶绿酸a[24]。从图6c 可知,12% CO2 处理组的脱镁叶绿素a 含量变化较平缓,4% CO2 处理组在贮藏6 d 后脱镁叶绿素a 含量上升,显著高于对照组(P<0.05),可能是由于4% CO2 处理抑制了小青菜中脱镁叶绿素酶活性的上升(图4c),使得脱镁叶绿素a 的生成和降解速率变化导致累积。最近的研究发现菜心[21]、青菜[26]、西兰花[27]中脱镁叶绿素酶在叶绿素降解中比叶绿素酶发挥了更大的作用。小青菜在贮藏第12 天,对照组和4% CO2中叶绿素酶活性分别较第0 天变化了43.18%,30.22%,脱镁叶绿素酶活力变化了315.30%,120.70%,脱镁叶绿素酶的活力变化远大于叶绿素酶活力;此时对照组和4% CO2 处理组中脱植基叶绿素a 含量分别为4.67,6.70 μg/g FW,脱镁叶绿素a 含量分别为4.10,19.06 μg/g FW。对比可以发现人工气调对小青菜中脱镁叶绿素酶活力的影响大于叶绿素酶,以脱镁叶绿素a 为中间产物的途径对气调贮藏中小青菜叶绿素降解更为重要。也有研究指出,绿色蔬菜的褪绿是一种氧化衰老现象,叶绿素过氧化物酶可以将叶绿素a 降解为132-羟基叶绿素[28]。图4d 显示小青菜中叶绿素过氧化物酶在前4 d 保持在较低水平,随后迅速上升。这与Torales 等[29]研究结果相似,芝麻菜中Chl-POX 活力在贮藏第9 天显著升高,叶绿素过氧化酶和叶绿素酶活性的增加会引起叶绿素的降解,从而导致空气贮藏环境下的芝麻菜黄化。Song等[16]提出叶绿素过氧化物酶的活性和白菜中叶绿素的含量呈反比关系,1-MCP 处理可以显著抑制叶绿素过氧化物酶活性的上升,延缓小青菜中叶绿素的降解。也有研究提出气调贮藏可能下调了与叶绿素过氧化物酶活性相关基因Bo POX 的表达[27],从而抑制了叶绿素过氧化物酶活力的上升。
综上所述,小青菜中叶绿素的降解主要是通过生成叶绿酸a 的2 条途径和叶绿素过氧化物酶参与的氧化途径进行的,小青菜中叶绿素含量与色泽有密切的关系,人工气调可以延缓小青菜黄化,减小失重率的增加,有效维持小青菜的外观颜色。进一步研究发现,小青菜经气调贮藏后叶绿素a/b含量明显高于对照组;相比之下,4% O2+4% CO2气调环境对小青菜中叶绿素酶、脱镁螯合酶、脱镁叶绿素酶和叶绿素过氧化物酶活力的抑制效果更好,有效延缓了小青菜中叶绿素及其代谢产物的降解,从而更好地保持小青菜的营养价值和外观品质。
[1] 卢瑞雪,韩延超,陈杭君,等.褪黑素处理对小青菜贮藏品质的影响[J].中国食品学报,2022,22(1):198-205.LU R X,HAN Y C,CHEN H J,et al.Effect of melatonin treatment on storage quality of Brassica chinensis L.[J].Journal of Chinese Institute of Food Science and Technology,2022,22(1):198-205.
[2] ÅHLBERG M K.A profound explanation of why eating green(wild)edible plants promote health and longevity[J].Food Frontiers,2021,2(3):240-267.
[3] LUKITASARI D M,PRIHASTYANTI M N U,CHANDRA R D.Effects of pH,high pressure processing,and ultraviolet light on carotenoids,chlorophylls,and anthocyanins of fresh fruit and vegetable juices[J].eFood,2021,2(3):2666-3066.
[4] HO P L,TRAN D T,HERTOG M L A T M,et al.Effect of controlled atmosphere storage on the quality attributes and volatile organic compounds profile of dragon fruit(Hylocereus undatus)[J].Postharvest Biology and Technology,2021,173:111406.
[5] DU M J,LIU Z T,ZHANG X T,et al.Effect of pulsed controlled atmosphere with CO2 on the quality of watercored apple during storage [J].Scientia Horticulturae,2021,278:109854.
[6] 孙志文,吕凤艳,郭衍银,等.O2/CO2 气调中CO2对西兰花叶绿素降解及保鲜作用[J].食品科学,2016,37(18):313-317.SUN Z W,LÜ F Y,GUO Y Y,et al.Effect of CO2 concentration in O2/CO2 controlled atmosphere on chlorophyll degradation and quality preservation in chilled broccoli[J].Food Science,2016,37(18):313-317.
[7] 高春霞,乔勇进,甄凤元,等.气调贮藏对小白菜品质及生理生化特性的影响[J].食品与发酵科技,2017,53(1):1-5,73.GAO C X,QIAO Y J,ZHEN F Y,et al.Physiobiochemical characteristics and quality of pakchoi during controlled atmosphere storage[J].Food and Fermentation Sciences & Technology,2017,53(1):1-5,73.
[8] CHOI E J,LEE J H,KIM H K,et al.Development of multi-pallet unit load storage system with controlled atmosphere and humidity for storage life extension of winter kimchi cabbage(Brassica rapa L.ssp.pekinensis)[J].Scientia Horticulturae,2020,264:109171.
[9] 孙凤杰.CPPU 处理对莲子采后品质及莲皮叶绿素代谢的影响[D].沈阳:沈阳农业大学,2018.SUN F J.Effect of CPPU treatment on postharvest quality of lotus seeds and chlorophyll metabolism of lotus peel[D].Shenyang:Shenyang Agricultural University,2018.
[10] XU D Y,SHI M,JIA B,et al.Effect of ozone on the activity of antioxidant and chlorophyll‐degrading enzymes during postharvest storage of coriander(Coriandrum sativum L.)[J].Journal of Food Processing and Preservation,2019,43(8):e14020.
[11] 王利斌,姜丽,石韵,等.气调贮藏对四季豆生理生化特性的影响[J].食品科学,2013,34(8):289-293.WANG L B,JIANG L,SHI Y,et al.Physiobiochemical characteristics of Phaseolus vulgaris L.during controlled atmosphere storage[J].Food Science,2013,34(8):289-293.
[12] HOU L,SHANG M,CHEN Y,et al.Physiological and molecular mechanisms of elevated CO2 in promoting the growth of pak choi(Brassica rapa ssp.chinensis)[J].Scientia Horticulturae,2021,288:110318.
[13] LI F W,ZHOU L,CAO J R,et al.Aggregation induced by the synergy of sodium chloride and high-pressure improves chlorophyll stability[J].Food Chem,2022,366:130577.
[14] SONG L L,GAO H Y,CHEN H J,et al.Effects of short-term anoxic treatment on antioxidant ability and membrane integrity of postharvest kiwifruit during storage [J].Food Chemistry,2009,114(4):1216-1221.
[15] 王向阳,方勇刚,李楠,等.胆固醇处理对采后青菜低温贮藏品质和抗氧化的影响[J].中国食品学报,2021,21(1):192-198.WANG X Y,FANG Y G,LI N,et al.Effects of exogenous cholesterol on quality and antioxidant activity of postharvest pak choy during low temperature storage [J].Journal of Chinese Institute of Food Science and Technology,2021,21(1):192-198.
[16] SONG L L,YI R X,LUO H B,et al.Postharvest 1-methylcyclopropene application delays leaf yellowing of pak choi(Brassica rapa subsp.chinensis)by improving chloroplast antioxidant capacity and maintaining chloroplast structural integrity during storage at 20 ℃[J].Scientia Horticulturae,2020,270:109466.
[17] 代雨菲,郜海燕,曹爱玲,等.复合保鲜对黄心猕猴桃常温贮藏品质的影响[J].中国食品学报,2020,20(11):201-207.DAI Y F,GAO H Y,CAO A L,et al.Effect of compound preservation on the quality of kiwifruit during normal temperature storage[J].Journal of Chinese Institute of Food Science and Technology,2020,20(11):201-207.
[18] 杨冲,谢晶.气调包装对空心菜净菜冷藏品质的影响[J].食品与发酵工业,2019,45(9):165-170.YANG C,XIE J.Effects of modified atmosphere packaging on preserving cleaned Ipomoea aquatica during refrigerated storage[J].Food and Fermentation Industries,2019,45(9):165-170.
[19] LI T H,ZHANG M.Effects of modified atmosphere package(MAP)with a silicon gum film window on the quality of stored green asparagus(Asparagus officinalis L.)spears[J].LWT -Food Science and Technology,2015,60(2):1046-1053.
[20] 陈俊毅,朱晓宇,蒯本科.绿色器官衰老进程中叶绿素降解代谢及其调控的研究进展[J].植物生理学报,2014,50(9):1315-1321.CHEN J Y,ZHU X Y,KUAI B K.Recent progresses in the elucidation of chlorophyll catabolism and its regulation during green organ senescence[J].Plant Physiology Journal,2014,50(9):1315-1321.
[21] ZHANG X L,ZHANG Z Q,LI J,et al.Correlation of leaf senescence and gene expression/activities of chlorophyll degradation enzymes in harvested Chinese flowering cabbage(Brassica rapa var.parachinensis)[J].J Plant Physiology,2011,168(17):2081-2087.
[22] 樊艳燕,刘玉梅,李占省,等.青花菜衰老过程中叶绿素降解相关基因的表达分析[J].园艺学报,2015,42(7):1338-1346.FAN Y Y,LIU Y M,LI Z S,et al.Analysis of the expression of chlorophyll degrading genes during senescence of broccoli[J].Acta Horticulturae Sinica,2015,42(7):1338-1346.
[23] AIAMLA-OR S,SHIGYO M,YAMAUCHI N.UVB treatment controls chlorophyll degradation and related gene expression in broccoli(Brassica oleracea L.Italica Group)florets during storage[J].Scientia Horticulturae,2019,243:524-527.
[24] BARRY C S.The stay-green revolution:Recent progress in deciphering the mechanisms of chlorophyll degradation in higher plants[J].Plant Science,2009,176(3):325-333.
[25] SATO T,SHIMODA Y,MATSUDA K,et al.Mgdechelation of chlorophyll a by stay-green activates chlorophyll b degradation through expressing nonyellow coloring 1 in Arabidopsis thaliana[J].J Plant Physiology,2018,222:94-102.
[26] SONG L L,LUO H B,JIANG L,et al.Integrative analysis of transcriptome and metabolome reveals the possible mechanism of leaf yellowing in pak choi(Brassica rapa subsp.chinensis)with 1-methylcyclopropene treatment during storage at 20 ℃[J].Postharvest Biology and Technology,2020,169:111300.
[27] ZHANG Y X,MA Y L,GUO Y Y,et al.Comprehensive insight into the chlorophyll degradation mechanism of postharvest broccoli heads under elevated O2 controlled atmosphere [J].Scientia Horticulturae,2021,288:110395.
[28] HYNNINEN P H,KAARTINEN V,KOLEHMAINEN E.Horseradish peroxidase -catalyzed oxidation of chlorophyll a with hydrogen peroxide:Characterization of the products and mechanism of the reaction[J].Biochimica et Biophysica Acta,2010,1797(5):531-542.
[29] TORALES A C,GUTIÉRREZ D R,RODRÍGUEZ S D C.Influence of passive and active modified atmosphere packaging on yellowing and chlorophyll degrading enzymes activity in fresh-cut rocket leaves[J].Food Packaging and Shelf Life,2020,26:100569.