帕金森病(Parkinson's disease,PD)是一种典型的神经退行性疾病,目前尚无有效的治疗和控制方法,已成为世界范围内主要的社会和医疗问题之一。PD 发病与环境和遗传等多种因素有关,其典型症状表现为运动“开关”异常,且伴随静止性震颤、僵硬、运动迟缓和步态障碍[1]。此外,还多发神经行为障碍、认知障碍和自主神经功能障碍等[2-3]。随着临床研究的深入,研究者发现PD 患者通常在表现出行为异常前,便已出现明显的便秘等胃肠功能异常等症状。近年来,“肠-脑”轴病理性变化与运动、认知功能损害之间的关系受到广泛关注。研究证实,肠道菌群可诱导肠神经系统(ENS)中α-突触核蛋白(α-SYN)的积累,并通过迷走神经传递到大脑,进而诱发PD[4-5],而调节肠道菌群微环境可有效改善PD 相关症状,肠道菌群或将成为防治PD 的重要靶点[6]。
南极磷虾油(Kill oil,KO)富含虾青素(Astaxanthin,AST)、生育酚及二十碳五烯酸(Eicosapentaenoic acid,EPA)、二十二碳六烯酸(Docosahexaenoic acid,DHA)等ω-3 不饱和脂肪酸等生物活性物质,且ω-3 不饱和脂肪酸多存在于磷脂中[7]。目前研究表明,KO 具有改善空间记忆能力、全身炎症和抑郁症状等多种功能[8],对血脂异常、冠心病、肠道炎症等疾病亦有明显的改善作用[9-11]。为探究KO 对帕金森病小鼠脑黑质多巴胺能神经元及肠道菌群的影响,本研究采用神经毒性药物1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-Methyl -4 -phenyl -1,2,3,6 -tetrahydropyridine,MPTP)对小鼠实施为期7 d 的腹腔注射,构建经典PD 亚急性模型,并以KO 对PD 小鼠进行干预,采用免疫组化技术及16S rDNA 高通量测序技术评价KO 对PD 模型小鼠多巴胺能神经元损伤的改善作用,并探究KO 对PD 模型小鼠肠道菌群的影响。本研究首先明确KO 防治PD 的功效,并从肠道微生态平衡的角度揭示KO 防治PD 的作用机制,为以KO 为基础的PD 防治药物的研发提供重要的参考依据。
1 材料与仪器
1.1 试验材料
南极磷虾油,实验室自制;E.Z.N.A.R Stool DNA Kit,美国Omega 公司;组织固定液、PBS 缓冲液、抗原修复液、苏木素染液、盐酸分化液、氨水水溶液返蓝液,北京索莱宝科技有限公司;TBE,上海阿拉丁生化科技股份有限公司;GelRed,美国Biotium 公司;TH 一抗、通用二抗,德国Sigma 公司;DNA marker,日本TaKaRa Bio 公司;Phusion Hot start flex 2X Master Mix,美国NEB 公司。
1.2 仪器及设备
显微镜NIKON ECLIPSE E100,日本株式会社尼康;PCR 仪、电泳仪,美国BioRad 公司;超低温冰箱,海尔智家股份有限公司;冷冻离心机,株式会社日立制作所;KD-P 组织摊片机51A011,浙江金华科迪仪器设备有限公司;生物组织石蜡包埋设备,湖北贝诺医疗科技有限公司;切片机HistoCoreBIOCUT,徕卡显微系统上海有限公司。
2 实验方法
2.1 实验动物
C57BL/6 雄性小鼠(40 只,6 周龄),购自浙江省医科院动物实验中心,于浙江省医科院动物实验中心SPF 屏障环境中饲养,保持相对湿度50%~60%和环境温度(25±1)℃,日光灯模拟光照/黑暗12 h/12 h,不限制进食和饮水。1 周后,随机选择5只小鼠合笼混养并分组编号。
2.2 实验分组
实验分组:对照组(Control)、PD 模型组(PD)、KO 干预组(KO_PD)、KO 对照组(KO),每组10 只小鼠。PD 模型小鼠参照Vernice 等[12]的方法。具体分组处理如下:对照组和PD 组灌胃无菌生理盐水,KO_PD 组和KO 组灌胃KO,剂量为1 g/kg,每日1 次,连续8 周。PD 组和KO_PD 组于最后1 周给予MPTP 腹腔注射,给药剂量为30 mg/kg,每日1 次,连续7 d。最后一次注射MPTP,隔日,灌注取脑,并无菌收集各组小鼠粪便。
2.3 组织固定取材
参考Wu 等[13]的方法,小鼠经戊巴比妥钠麻醉后,四肢固定,腹部向上,小心开胸移除多余组织,暴露心脏。头皮针刺入左心室,并用止血钳固定,在无菌PBS 灌注的同时剪开右心耳,待完全失血后换成4%多聚甲醛继续灌注。灌注结束后取结肠组织和脑组织,浸入固定液中过夜。每组随机选取3 只。
2.4 HE 染色
取出固定液中的小鼠结肠组织,经脱水、浸蜡、凝固后修整蜡块,并连续环状横切,切片厚度为4 μm。切片经样本脱蜡、水化、苏木素染色、分化与返蓝、伊红染色与脱水、风干封片等操作后,于显微镜下观察并拍照。
2.5 TH 免疫组化染色
取出固定液中的小鼠脑组织,经脱水、浸蜡、凝固后修整蜡块。根据小鼠脑定位图谱定位至黑质区后进行连续切片,切片厚度为4 μm。将薄片在40 ℃温水中展平,取出载玻片,放在60 ℃烘箱中烘烤。切片用二甲苯浸泡脱蜡,经无水乙醇、95%乙醇、85%乙醇和75%乙醇水化后进行抗原修复、封闭过氧化氢酶、抗体杂交、显色、复染、脱水、透明和封片等操作。最后于显微镜下镜检,采集图像。
2.6 16S rDNA 测序
2.6.1 细菌总DNA 提取 采用E.Z.N.A.R Stool DNA Kit 试剂盒提取小鼠粪便细菌的总DNA,采用琼脂糖凝胶电泳和紫外分光光度计对DNA 进行评估和定量[14]。
2.6.2 V3+V4 区PCR 扩增 引物序列:341F(5’-CCTACGGGNGGCWGCAG-3’)和805R(5’-GACT ACHVGGGTATCTAATCC-3’)。
反应体系:模板DNA(25 ng)+Phusion Hot start flex 2X Master Mix(12.5 μL)+正向引物(2.5 μL)+反向引物(2.5 μL)+PCR 级纯水(加至总体积25 μL)。
PCR 扩增程序:98 ℃30 s,(98 ℃10 s,54 ℃30 s,72 ℃45 s)循环35 次,72 ℃10 min,4 ℃保存。采用2%琼脂糖凝胶电泳对PCR 扩增产物进行验证。
2.6.3 平台测序及生信分析 根据LC-Bio 提供的方法,样品按照制造商的建议在Illumina NovaSeq 平台测序。使用fqtrim(v0.94)对原始数据进行质量过滤,使用Vsearch(v2.3.4)对嵌合序列进行过滤。用DADA2 进行解调,得到特征表和特征序列。通过归一化到相同的随机序列来计算α 多样性和β 多样性,再用SILVA(release 132)分类器,根据每个样本的相对丰度对特征丰度进行归一化。采用QIIME2 计算α 多样性和β 多样性,采用Blast 对序列进行比对,采用SILVA 数据库对特征序列进行注释,采用PICRUSt2 进行基因序列的功能预测。每组随机选取5 只小鼠的粪便用于16S rDNA 测序[14]。
2.7 统计分析
采用SPSS 21.0 对数据进行显著性分析,所有试验数据均以“平均值±标准偏差”表示。统计学分析通过MetaboAnalyst 3.0 以及联川在线分析平台(https://www.omicstudio.cn/index)实现。
3 结果与分析
3.1 一般情况观察
首次注射MPTP 后,多数小鼠于10 min 左右出现严重颤抖,步态不稳,竖毛,翘尾等现象,1 h左右症状有所减轻。随着给药次数的增加,症状持续的时间越长,自发活动能力越弱,步态不稳和间歇震颤的现象越明显。最后一次注射时,PD 组小鼠出现剧烈颤抖、毛发直立、弓背直立和流涎现象,急性症状缓和后,小鼠几乎停止活动。而KO_PD 组症状较PD 组有所减轻。对实验周期内各组小鼠的体重变化进行监测,如图2 所示。
由图2 可知,在MPTP 造模之前,各组小鼠体质量均呈增加趋势,而灌胃KO 的小鼠体质量增长率小于灌胃生理盐水的小鼠,这可能与KO 有助于降低血脂水平,从而限制体质量快速增加有关。而MPTP 造模期间,接受MPTP 腹腔注射的小鼠体质量增长减缓。可能是由于长时间注射MPTP导致小鼠的生理机能出现持续性损害,PD 症状的显现影响小鼠的饮食行为和消化道功能,从而导致体质量增长缓慢。
3.2 南极磷虾油对小鼠黑质区多巴胺能神经元的保护作用
小鼠黑质区TH 免疫组化染色结果见图3。结果显示:对照组和KO 组小鼠黑质区TH 阳性细胞数量较多且排列较为紧密,神经纤维长且丰富;而PD 组黑质区TH 阳性细胞大量丢失,神经纤维染色边界不清,提示PD 组小鼠黑质多巴胺能神经元受损。KO_PD 组小鼠黑质区TH 阳性细胞数量、神经纤维数量及长度较PD 组均显著增加,提示KO 干预有助于缓解帕金森脑部黑质多巴胺能神经元损伤及神经元丢失。
3.3 南极磷虾油对小鼠结肠组织结构的影响
小鼠结肠组织的HE 染色情况见图4。相较于对照组而言,PD 组肠黏膜固有层肠腺稍稀疏,腺上皮杯状细胞减少,化生为立方上皮样细胞,提示PD 组小鼠结肠部位固有结构受损病变。KO 组与对照组HE 染色结果无明显差异。而与PD 组相比,KO_PD 组的肠腺稀疏和上皮杯状细胞数量减少等现象均有所改善,表明KO 有助于改善PD 小鼠结肠组织结构的改变。
3.4 南极磷虾油对肠道菌群测序分类的影响
比较各实验组feature 的差异,并绘制Venn图5。图5 显示,对照组共有3 360 个OUTs,其特有OUTs 数量最多,为2 063 个;PD 组含有2 903个OUTs,其中1 870 个为特有;KO_PD 组含有2 276 个OUTs,其特有OUTs 数量最少,为1 170个;KO 组含有3 260 个OUTs,其中1 968 个为特有。4 组间共同存在的OUTs 为396 个,而PD 组、KO_PD 组和KO 组与对照组共有的OUTs 数量依次为722,773 和955 个。由此可知,相较于PD组,经KO 干预的KO_PD 组小鼠肠道菌群种类与对照组更为接近。
3.5 南极磷虾油对肠道菌群多样性指数的影响
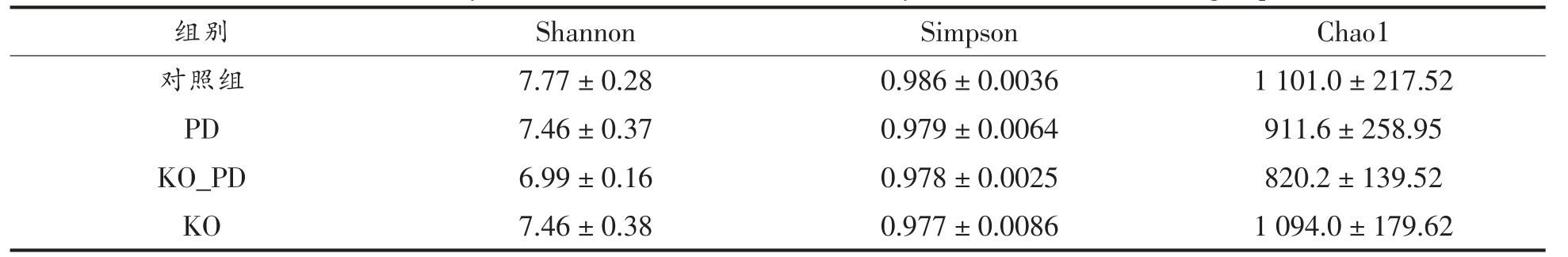
3.5.1 α 多样性分析 α 多样性指数是表征菌群丰富度和均匀度的综合指标,Chao1 反映样本中的物种总数,而不考虑每个物种的均匀度;Shannon 和Simpson 反映物种的多样性,前者与物种多样性呈正相关,后者与物种多样性呈负相关[15]。肠道菌群多样性分析结果显示样本测序覆盖度在99%以上,表明样本测序覆盖度较好,符合后续分析要求。各组小鼠肠道菌群的α 多样性分析结果见表1。PD 组和KO_PD 组小鼠肠道菌群α 多样性指数较对照组有所下降,表明MPTP 腹腔注射改变小鼠肠道菌群的多样性和丰富度。
表1 各组小鼠肠道菌群α 多样性指数分析
Table 1 Analysis of intestinal microflora diversity index of rats in each group
3.5.2 β 多样性分析 与α 多样性分析不同,β 多样性分析主要反映不同样本间菌群组成的相似程度。采用主成分分析(Principal component analysis,PCA)不同实验组小鼠肠道微生物群落结构,结果见图6。主成分1(PC1)对样品差异的贡献值为52.05%,主成分2(PC2)对样品差异的贡献值为14.65%,两者合计66.70%。4 组样本组内聚类良好,其中,KO 组、KO_PD 组和PD 组之间相距较远,表明3 组小鼠肠道菌群组成存在显著差异。
3.6 各个分类水平上菌群丰度分析
3.6.1 门水平菌群丰度分析 由各组小鼠在门水平上肠道菌群种类及丰度可知,小鼠肠道菌群主要由拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)等构成。各组小鼠肠道菌群中相对丰度存在显著性差异的菌门见图7。由图7 可知,相较于对照组,PD 组的拟杆菌门相对丰度(51.40%)显著降低(P <0.05),厚壁菌门(44.06%),变形菌门(1.62%)和Epsilonbacteraeota(1.40%)相对丰度显著升高(P <0.05);与PD 组相比,KO_PD组小鼠肠道菌群中拟杆菌门的相对丰度(72.59%)显著增加(P <0.05),而厚壁菌门(23.12%)和Epsilonbacteraeota(0.35%)相对丰度显著减少(P <0.05)。
研究表明,厚壁菌门和变形菌门丰度改变与炎症反应有关,变形菌门的增加提示肠道菌群失调和局部炎症[16]。本研究中PD 组小鼠肠道菌群的厚壁菌门/拟杆菌门(F/B)比值为0.86,显著高于对照组(0.69,P <0.05);PD 组小鼠肠道菌群中变形菌门/拟杆菌门(P/B)比值为0.031,显著高于对照组(0.0161,P <0.05),而KO_PD 组F/B 和P/B比值较PD 组显著回调,表明MPTP 腹腔注射引起PD 小鼠的肠道损伤,而KO 干预有助于改善这一现象。
3.6.2 科水平菌群丰度分析 科水平上,PD 组小鼠中Muribaculaceae 相对丰度(33.42%)显著低于对照组(50.80%,P <0.05),而毛螺菌科(Lachnospiraceae)、普雷沃氏菌科(Prevotellaceae)、螺旋杆菌科(Helicobacteraceae)和理研菌科(Rikenellaceae)相对丰度显著高于对照组(P <0.05)。此外,丹毒丝菌科(Erysipelotrichaceae)和链球菌科(Streptococcaceae)相对丰度明显低于对照组,而差异不具有统计学意义。KO_PD 组小鼠中Muribaculaceae(64.69%)、丹毒丝菌科和链球菌科相对丰度较PD 组显著升高(P <0.05),而毛螺菌科、理研菌科、梭菌科(Clostridiaceae)和螺旋杆菌科的相对丰度较PD 组显著下降(P <0.05)。KO 组中链球菌科、毛螺菌科相对丰度较对照组显著下降(P <0.05),而普雷沃氏菌科、酵母菌科(Saccharimonadaceae)、厌氧原体科(Anaeroplasmataceae)和坦纳菌科(Tannerellaceae)相对丰度显著增加(P <0.05)。各组小鼠肠道菌群的科水平差异分析结果见图8。
3.6.3 属水平菌群丰度分析 分析不同实验条件下小鼠肠道菌群在属水平上的变化情况,并根据各实验组小鼠肠道菌群分布的相似性进行属水平聚类,如图9 所示。KO 组与KO_PD 组小鼠肠道菌群结构较为接近,首先聚为一类,后与对照组聚为一大类,而PD 组小鼠因肠道菌群组成与其它组存在较大差异,单独聚为一类。具体而言,PD 中另枝菌属(Alistipes)、毛螺菌科_ 未知菌属(Lachnospiraceae_unclassified)、厌氧棒菌属(Anaerotignum)、螺杆菌属(Helicobacter)、瘤胃梭菌属(Ruminiclostridium)、梭菌目未知菌属(Clostridiales_unclassified)、罗宾氏菌属(Robinsoniella)、丁酸球菌属(Butyricicoccus)、肠杆菌属(Enterorhabdus)和普雷沃氏菌属 _UCG -001(Prevotellaceae_UCG-001)等菌属相对丰度显著高于对照组(P <0.05),而杜氏杆菌属(Dubosiella)、Muribaculaceae_unclassified 和链球菌属(Streptococcus)等菌属相对丰度显著低于对照组(P <0.05)。与PD组相比,KO_PD 组中Muribaculaceae_unclassified、另枝菌属、链球菌属、杜氏杆菌属、Paramuribaculum、毛螺菌科_ 未知菌属、梭菌目未知菌属、厌氧棒菌属和螺杆菌属等菌属相对丰度显著回调(P <0.05)。
上述不同分类层次的分析结果表明,MPTP 腹腔注射诱发小鼠脑黑质多巴胺能神经元病变和肠道组织结构改变,同时还引起小鼠肠道菌群结构的紊乱,而KO 干预可显著改善小鼠脑黑质多巴胺能神经元损伤,并维持小鼠肠道组织结构和肠道微生态平衡。
3.7 PICRUSt2 功能预测
对各组肠道菌群进行PICRUSt2 功能预测,结果见图10。KO 的干预可能对其肠道内草酰乙酸脱羧酶(Oxaloacetate decarboxylase)、UDP-N-乙酰壁酰五肽赖氨酸N(6)-丙氨酸转移酶[UDP-Nacetylmuramoylpentapeptide-lysine N(6)-alanyltransferase]、十一碳烯醇激酶(Undecaprenol kinase)、三酰甘油脂肪酶(Triacylglycerol lipase)、三磷酸核糖去磷酸辅酶A 合酶(Triphosphoribosyldephospho-CoA synthase)、二酰甘油激酶(ATP)[Diacylglycerol kinase(ATP)]、短链酰基辅酶A 脱氢酶(Short-chain acyl-CoA dehydrogenase)、5'-磷酸合成酶(5'-phosphate synthase)、[柠檬酸(pro-3S)-裂解酶]连接酶〔[Citrate(pro-3S)-lyase]ligase〕、γ-D-谷氨酸介导二氨基新戊酸肽酶(Gamma-D-glutamyl-meso-diaminopimelate peptidase)、3-羟基丁基-CoA 脱氢酶(3-Hydroxybutyryl-CoA dehydrogenase)、柠檬酸裂解酶-[酰基载体蛋白] 合酶(Citrate lyase holo-[acyl-carrier protein] synthase)、6-磷酸果糖激酶(6-phosphofructokinase)、DNA 拓扑异构酶(ATP 水解)[DNA topoisomerase(ATP-hydrolyzing)]等酶的功能产生显著影响。
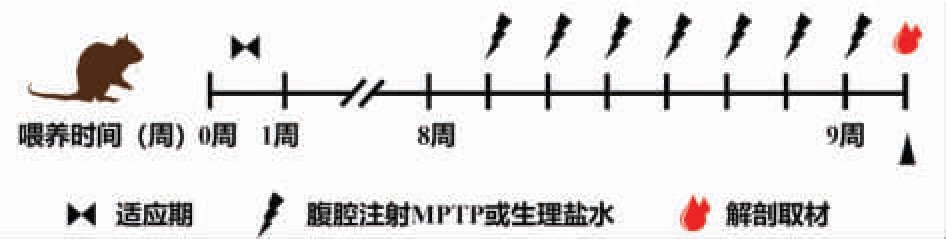
图1 实验周期示意图
Fig. 1 Schematic diagram of the experimental period
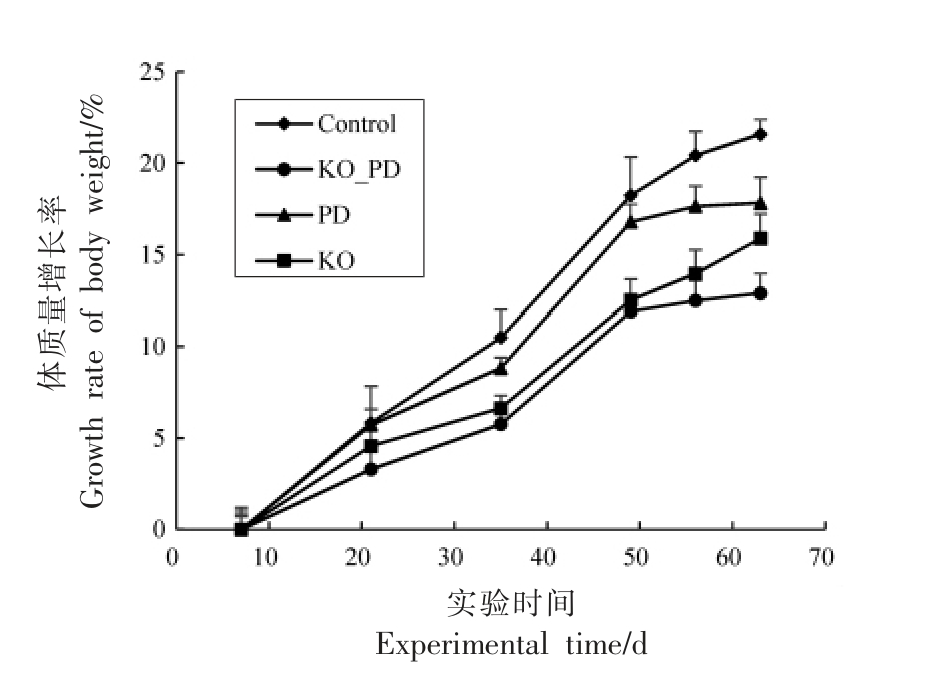
图2 各组小鼠体质量增长率变化情况
Fig. 2 The changes in body weight growth rate of mice in each group

图3 各组小鼠黑质区TH 免疫组化染色结果
Fig. 3 Immunohistochemical staining results of TH in the substantia nigra of mice in each group
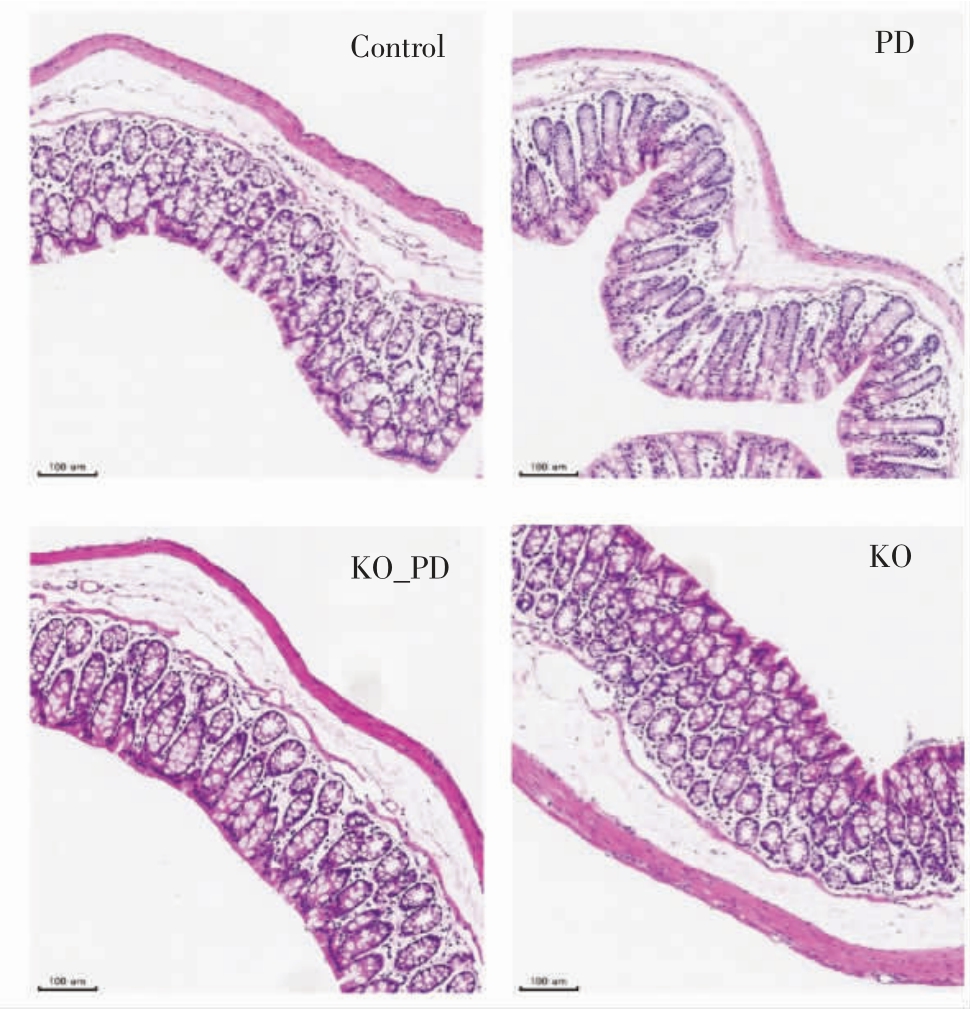
图4 南极磷虾油对小鼠结肠组织结构的影响
Fig. 4 Effect of Antarctic krill oil on the structure of colon tissue in mice
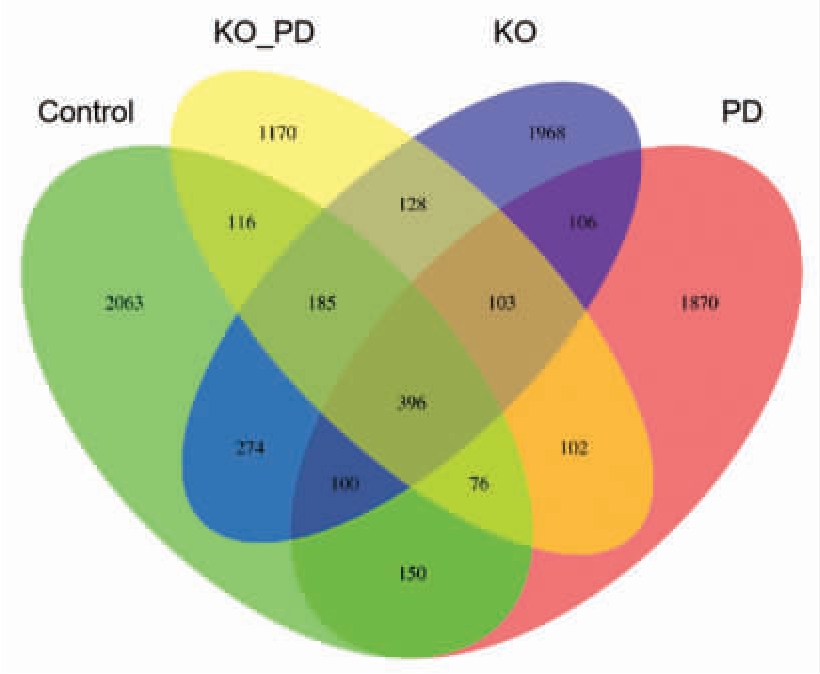
图5 各组的Venn 图分析
Fig. 5 Venn diagram comparison of all groups
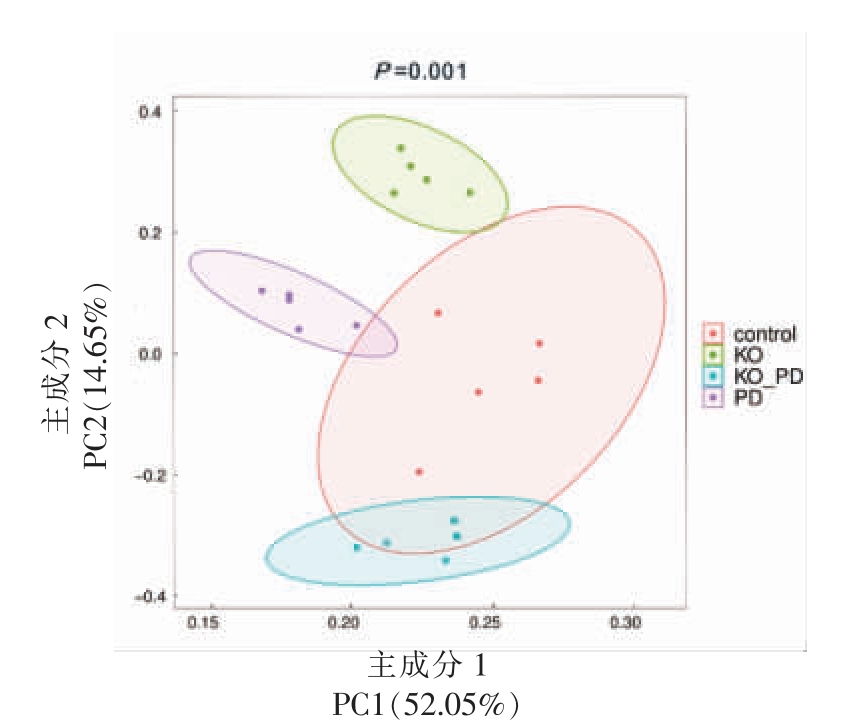
图6 肠道菌群的主成分分析
Fig. 6 Principal component analysis of gut microbiome
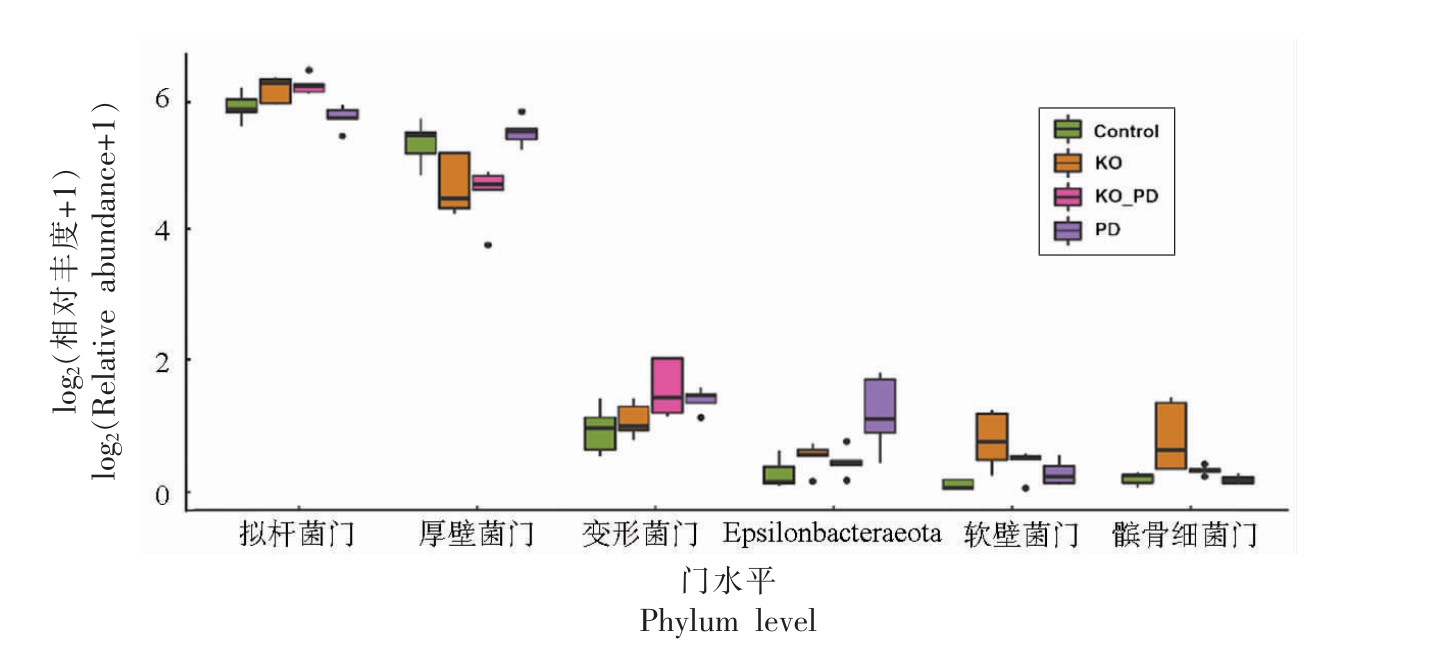
图7 基于门水平的肠道菌群组成
Fig. 7 Composition of gut microbiome based on the phylum level
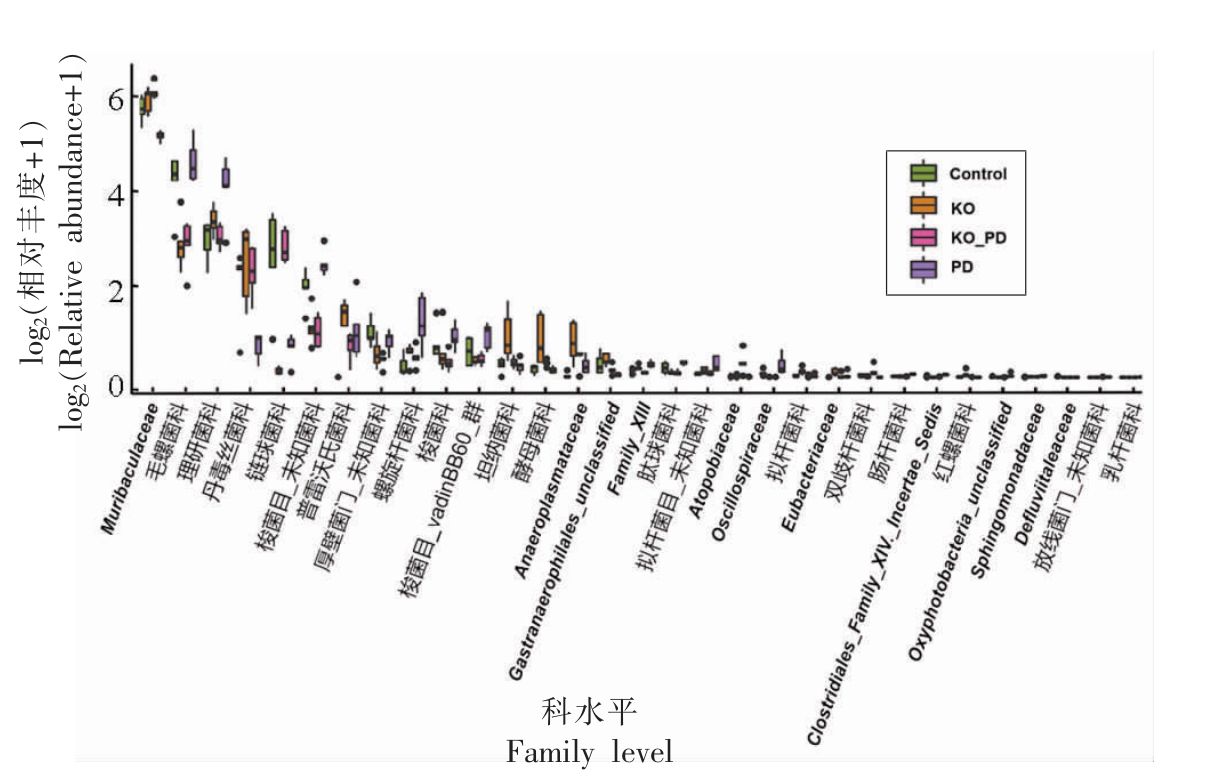
图8 基于科水平的肠道菌群组成
Fig. 8 Composition of gut microbiome based on family level
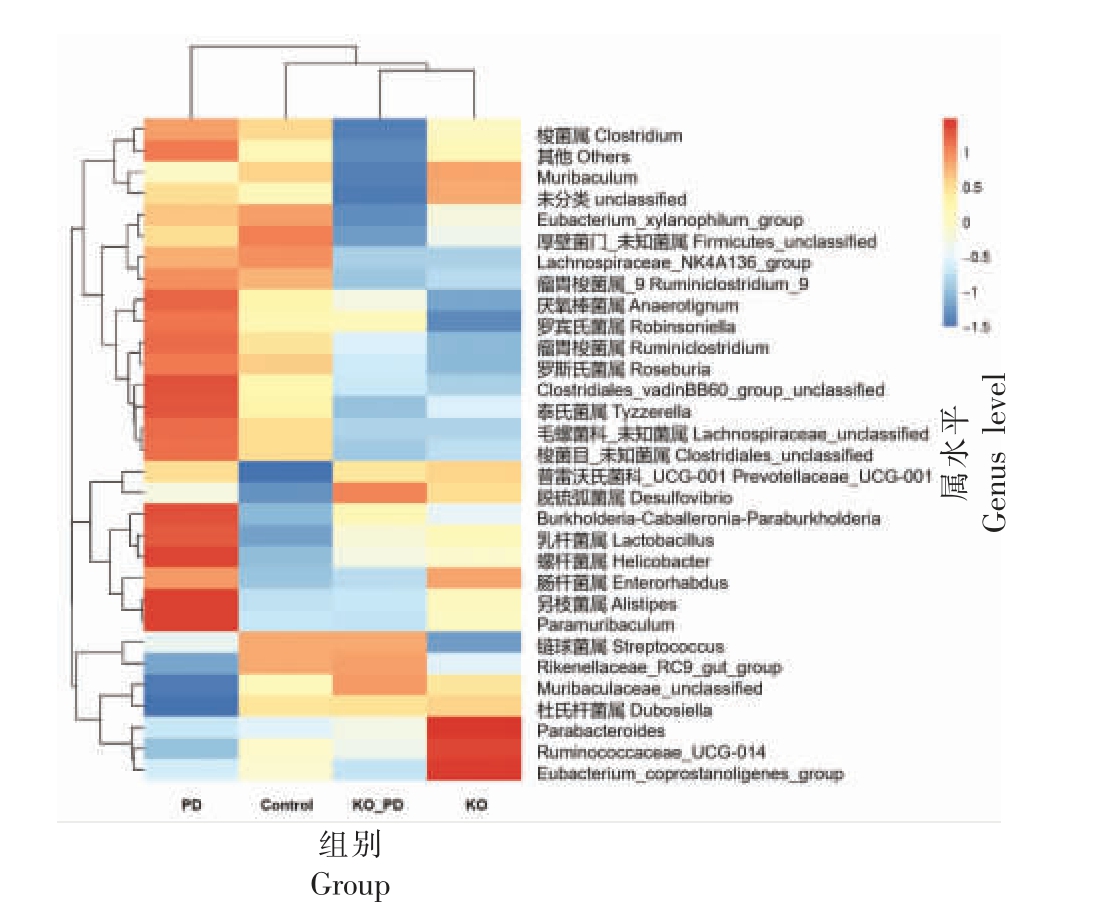
图9 各组小鼠肠道菌群热图(基于属水平)
Fig. 9 Heatmap of gut microbiome of mice in each groups(based on genus level)

图10 KO_PD 组和PD 组功能预测差异分析
Fig. 10 Functional differences between KO_PD group and PD group
4 讨论
肠道微生物群由胃肠道中多样化的细菌群落组成,其寄生在肠道内,维持着肠道微生态的平衡,且与个体健康密切相关。现有研究表明,肠道微生物群的组成和丰度的生态失调可能影响肠道神经系统(ENS)和中枢神经系统(CNS),从而诱发或加重中枢神经系统疾病[17]。而肠道和大脑之间的相互作用理论被称为“肠-脑”轴(GBA)理论[18],相关研究的陆续开展揭示了肠道菌群与大脑功能的种种关联。多项研究表明,PD 患者肠道微生态存在失调,表现为肠道微生物群组成结构以及菌群代谢产物的改变。如临床研究发现,约80%的PD 患者存在肠道菌群失调,表现出严重的胃肠症状,并已在肠神经中观察到α-SYN 的积累[19]。目前,关于PD 肠道菌群多样性的研究仍存争议,患者患病阶段、饮食习惯和样本取样方式等的不同均可能导致结果的差异。如Barichella 等[20]临床研究表明意大利PD 患者的肠道菌群具有更高的α多样性;Petrov 等[21]报道PD 患者肠道菌群Chao1指数偏低;而Cirstea 等[22]研究表明加拿大地区的PD 患者与健康人群的肠道菌群α 多样性不具备统计学差异。本研究显示,PD 小鼠肠道菌群α 多样性较对照组下降,而差异不具有显著性。β 多样性分析结果表明,PD 组与对照组小鼠存在显著差异。由此可知,MPTP 腹腔注射对小鼠肠道菌群α多样性的影响较小,而对β 多样性的影响更为显著。
另有报道显示,肠道微生物的结构变化可促使小胶质细胞活化和肠道通透性改变,造成α-SYN 在肠道内的聚积和磷酸化,并引发中枢神经系统的炎症反应,进而诱发PD[23]。这一观点得到病理生理学证据的支持,如α-SYN 内含物可出现在ENS 的早期,并可通过舌咽和迷走神经到达大脑[24]。然而,肠道菌群变化与疾病发生之间孰为因果尚无定论,肠道微生态失调不仅是导致肠道炎症的原因,也可能是肠道炎症的后果[25]。尽管如此,通过调节氧化应激损伤、炎症反应和肠道菌群失调减少α-SYN 的积累已被认为是治疗PD 的潜在方法。南极磷虾是一种新型海洋生物资源,其生物蕴藏量庞大,且富含EPA、DHA 等ω-3 不饱和脂肪酸、虾青素、生育酚、磷脂等多种生物活性物质,因而具有丰富的营养价值和巨大的开发潜力。据报道,南极磷虾油具有护肝明目,调节血脂和血压,改善痛经,抗炎消炎,活化血管和延缓衰老等功效[26-27]。然而,KO 是否具有改善PD 的功效,以及其发挥功效的具体途径及机制尚未明确。本研究通过采用腹腔注射1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)构建PD 模型小鼠,并采用KO 对PD 小鼠进行干预,通过免疫组化实验明确KO 对多巴胺能神经元的保护作用。
鉴于肠道功能障碍是PD 患者的常见病症,而肠道屏障损伤是引起功能障碍的重要原因之一[28],对结肠组织进行切片观察。结果表明,给予KO 灌胃处理的小鼠可以有效改善PD 诱导的结肠上皮组织结构变异和肠腺稀疏,同时上皮杯状细胞数量的下降幅度减弱。上述结果表明,KO 具有改善PD 小鼠肠道屏障通透性和完整性的功能。从肠道微生态平衡的角度探究KO 干预对PD小鼠肠道菌群的影响,结果显示,在门水平,PD 小鼠的肠道菌群与正常小鼠相比发生显著变化,而KO 干预显著改善了PD 小鼠肠道菌群的异常变化。临床研究表明,PD 患者粪便中的细菌总数较健康人群低,其中PD 患者粪便中拟杆菌门丰度显著下降[29]。安云英[30]的研究表明,PD 组小鼠肠道菌群中拟杆菌门的相对丰度较对照组显著降低,而厚壁菌门和脱铁杆菌门(Deferribacteres)的相对丰度显著升高,与本研究结果一致。拟杆菌门和厚壁菌门是小鼠肠道的主要菌群类别,研究表明拟杆菌门可将多糖分解代谢成低聚糖或短链脂肪酸(SCFA),其可加速肠黏膜中血管生成,提高宿主免疫力,并维持肠道微生态平衡[31]。此外,研究显示拟杆菌门和厚壁菌门的比值与机体代谢水平相关,而拟杆菌门下降和厚壁菌门升高均有助于促进肥胖[32]。本研究表明,PD 小鼠肠道菌群中拟杆菌门的相对丰度较对照组显著下降,而厚壁菌门显著增加,导致PD 组小鼠肠道菌群中F/B 的比值显著升高。而KO 干预使F/B 值发生显著回调。
各实验组小鼠肠道菌群在属水平上也发生明显的变化。Muribaculaceae 是小鼠肠道优势菌之一,研究表明,Muribaculaceae 具有抗氧化和抗应激特性的能力[33],其通过免疫调节和肠道稳态调节,促进肠道代谢[34]。Wan 等[35]发现杜氏杆菌属与结肠组织中Nrf-2,HO-1,Gpx1,Gpx2 和IL-10 的mRNA 表达高度相关,表明杜氏杆菌属可能具有抗氧化和抗炎的作用。本研究显示,PD 小鼠肠道菌群中杜氏杆菌属和Muribaculaceae_unclassified属相对丰度均显著低于对照组,通过KO 干预,PD小鼠肠道菌群属水平失调现象得到显著改善。PICRUSt2 功能预测分析显示,KO 可能通过影响肠道菌群执行糖代谢、氨基酸代谢、脂质代谢等生命功能发挥肠道及神经保护作用。
综上所述,KO 有助于改善MPTP 诱导的小鼠中脑黑质多巴胺能神经元损伤和肠道组织结构损伤,并有助于在各分类水平上维持小鼠肠道菌群的稳态。本研究为以KO 为基础开发抗PD 新型保健品及临床治疗药物提供了参考依据,同时为日常膳食干预预防神经退行性疾病提供了理论依据。后续将进一步研究KO 干预下肠道菌群和中脑黑质多巴胺能神经元的互作机制,以全面揭示KO 抗PD 的内在机制。
[1] SUN Y M,YU H L,ZHOU X Y,et al.Disease progression in patients with parkin-related Parkinson's disease in a longitudinal cohort [J].Movement Disorders,2020,36(2):442-448.
[2] BLOEM B R,OKUN M S,KLEIN C.Parkinson's disease[J].The Lancet,2021,397(10291):2284-2303.
[3] RUIZ-LOPEZ M,FREITAS M E,OLIVEIRA L M,et al.Diagnostic delay in Parkinson's disease caused by PRKN mutations[J].Parkinsonism &Related Disorders,2019,63:217-220.
[4] 陈雪秋,白秀兰,田晓曼,等.帕金森病病人肠道菌群紊乱的非药物干预研究进展[J].全科护理,2023,21(6):803-807.CHEN X Q,BAI X L,TIAN X M,et al.Research progress on non pharmacological intervention of intestinal microbiota disorders in Parkinson's disease patients[J].Chinese General Practice Nursing,2023,21(6):803-807.
[5] RIETDIJK C D,PEREZ-PARDO P,GARSSEN J,et al.Exploring Braak's hypothesis of Parkinson's disease[J].Frontiers in Neurology,2017,8:37.
[6] ALI S A,YIN N,REHMAN A,et al.Parkinson disease-mediated gastrointestinal disorders and rational for combinatorial therapies[J].Medical Sciences,2016,4(1):1.
[7] 孙雪纯.南极磷虾油通过抑制TGF-β1 纤维化信号通路预防糖尿病肾病[D].济南:山东大学,2022.SUN X C.Krill oil turns off TGF-β1 profibrotic signaling in prevention of diabetic nephropathy[D].Jinan:Shandong University,2022.
[8] ANDRAKA J M,SHARMA N,MARCHALANT Y.Can krill oil be of use for counteracting neuroinflammatory processes induced by high fat diet and aging?[J].Neuroscience Research,2020,157:1-14.
[9] YANG G,LEE J Y,LEE S S,et al.Krill oil supplementation improves dyslipidemia and lowers body weight in mice fed a high-fat diet through activation of AMP-activated protein kinase [J].Journal of Medicinal Food,2016,19(12):1120-1129.
[10] WEN C F,JIANG M,HUANG W X,et al.Antarctic krill oil attenuates oxidative Stress via the KEAP1-NRF2 signaling in patients with coronary heart disease[J].Evidence-Based Complementary and Alternative Medicine,2020,2020(Pt.16):1-13.
[11] LIU F,SMITH A D,SOLANO-AGUILAR G,et al.Mechanistic insights into the attenuation of intestinal inflammation and modulation of the gut microbiome by krill oil using in vitro and in vivo models[J].Microbiome,2020,8(1):83.
[12] VERNICE J L,SERGE P.Protocol for the MPTP mouse model of Parkinson's disease[J].Nature Protocols,2007,2(1):141-151.
[13] WU J Y,CAI Y Q,WU X Y,et al.Transcardiac perfusion of the mouse for brain tissue dissection and fixation[J].Bio-Protocol,2021,11(5):3988.
[14] 薛静.EPA/DHA 型磷脂酰胆碱的制备及其预防帕金森病的机理研究[D].杭州:浙江工商大学,2022.XUE J.Study on the preparation of EPA/DHA-rich phosphatidylcholine and its preventive effect on Parkinson's disease[D].Hangzhou:Zhejiang Gongshang University,2022.
[15] 房永坤.结直肠癌患者肠道菌群多样性及其与临床病理特征关系的研究[D].大连:大连医科大学,2022.FANG Y K.Study on the diversity of intestinal flora in colorectal cancer patients and its relationship with clinicopathological characteristics[D].Dalian:Dalian Medical University,2022.
[16] RIZZATTI G,LOPETUSO L R,GIBIINO G,et al.Proteobacteria:A common factor in human diseases[J].Biomed Research International,2017,2017:1-7.
[17] SUN M F,SHEN Y Q.Dysbiosis of gut microbiota and microbial metabolites in Parkinson's disease[J].Ageing Research Reviews,2018,45:53-61.
[18] CRYAN J F,DINAN T G.Mind-altering microorganisms:The impact of the gut microbiota on brain and behaviour [J].Nature Reviews Neuroscience,2012,13(10):701-712.
[19] CAPUTI V,GIRON M C.Microbiome-gut-brain axis and Toll-like receptors in Parkinson's disease[J].International Journal of Molecular Sciences,2018,19(6):1689.
[20] BARICHELLA M,SEVERGNINI M,CILIA R,et al.Unraveling gut microbiota in Parkinson's disease and atypical parkinsonism[J].Movement Disorders,2018,34(3):396-405.
[21] PETROV V A,SALTYKOVA I V,ZHUKOVA I A,et al.Analysis of gut microbiota in patients with Parkinson's disease[J].Bulletin of Experimental Biology and Medicine,2017,162(6):734-737.
[22] CIRSTEA M S,YU A C,GOLZ E,et al.Microbiota composition and metabolism are associated with gut function in Parkinson's disease [J].Movement Disorders,2020,35(7):1208-1217.
[23] 李渊泉,张璐,郭倩雯,等.肠道菌群在帕金森病发病过程中作用的研究进展[J].解剖学杂志,2022,45(4):369-373.LI Y Q,ZHANG L,GUO Q W,et al.Research progress on the role of gut microbiota in the pathogenesis of Parkinson's disease[J].Journal of Anatomy,2022,45(4):369-373.
[24] SHANNON K M,KESHAVARZIAN A,DODIYA H B,et al.Is alpha -synuclein in the colon a biomarker for premotor Parkinson's disease? Evidence from 3 cases[J].Movement Disorders,2012,27(6):716-719.
[25] STECHER B.The roles of inflammation,nutrient availability and the commensal microbiota in enteric pathogen infection[J].Microbiology Spectrum,2015,3(3):298-320.
[26] 郑振霄,朱凯,戴志远.南极磷虾油对脂多糖诱导RAW264.7 细胞炎症反应的抑制作用[J].中国食品学报,2023,23(1):23-31.ZHENG Z X,ZHU K,DAI Z Y.lnhibitory effect of Antarctic krill oil on LPS induced inflammatory response in RAW246.7 cells[J].Journal of Chinese Institute of Food Science and Technology,2023,23(1):23-31.
[27] 郭培玉.南极磷虾油调节胆汁酸代谢及肠道菌群改善酒精暴露大鼠肝脏损伤的研究[D].青岛:青岛大学,2022.GUO P Y.Antarctic krill oil ameliorates liver injury in rats exposed to alcohol by regulating bile acids metabolism and gut microbiota[D].Qingdao:Qingdao University,2022.
[28] 张博枰,赵丽萍,石芸,等.隔日禁食对帕金森病模型小鼠肠道屏障的保护作用及机制[J].微生物学通报,2020,47(11):3789-3800.ZHANG B P,ZHAO L P,SHI Y,et al.Protective effect and mechanisms of alternate day fasting on intestinal barrier function in Parkinson's disease model mice [J].Microbiology China,2020,47(11):3789-3800.
[29] UNGER M M,SPIEGEL J,DILLMANN K U,et al.Short chain fatty acids and gut microbiota differ between patients with Parkinson's disease and agematched controls[J].Parkinsonism and Related Disorders,2016,32:66-72.
[30] 安云英.白藜芦醇改善帕金森病小鼠相关症状及其对肠道菌群的影响[D].新乡:新乡医学院,2019.AN Y Y.Resveratrol ameliorates the symptoms of Parkinson's disease mouse and its effect on gut microbiota[D].Xinxiang:Xinxiang Medical University,2019.
[31] CHENG J B,HU J L,GENG F,et al.Bacteroides utilization for dietary polysaccharides and their beneficial effects on gut health[J].Food Science and Human Wellness,2022,11(5):1101-1110.
[32] 陈说,张帆,范艳飞,等.膳食胆酸对营养性肥胖大鼠肠道炎症的改善及对肠道菌群中拟杆菌门与厚壁菌门比例的影响[J].胃肠病学和肝病学杂志,2022,31(10):1126-1131.CHEN S,ZHANG F,FAN Y F,et al.Dietary bile acid improves intestinal inflammation in nutritionally obese rats and its effect on the ratio of Bacteroides and Firmicutes in the intestinal flora[J].Chinese Journal of Gastroenterology and Hepatology,2022,31(10):1126-1131.
[33] ORMEROD K L,WOOD D L A,LACHNER N,et al,Genomic characterization of the uncultured Bacteroidales family S24 -7 inhabiting the guts of homeothermic animals[J].Microbiome,2016,4(1):36.
[34] ZHAO H Y,LYU Y J,ZHAI R Q,et al.Metformin mitigates sepsis-related neuroinflammation via modulating gut microbiota and metabolites[J].Frontiers in Immunology,2022,13:797312.
[35] WAN F,ZHONG R Q,WANG M Y,et al.Caffeic acid supplement alleviates colonic inflammation and oxidative stress potentially through improved gut microbiota community in mice[J].Frontiers in Microbiology,2021,12:784211.