牛乳是人们饮食中的重要组成之一,主要由脂肪(约3.8%)、蛋白质(约3%)、乳糖(约4.7%)及无机盐(约0.7%)等营养素组成[1-2]。牛乳是日常饮食中重要的蛋白质来源,牛乳中的蛋白质主要包括酪蛋白和乳清蛋白,其中酪蛋白约占牛乳总蛋白含量的80%,是无色、无味的两性分子。由于空间结构及氨基酸组成的不同,因此酪蛋白存在多种变体,包括αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白和κ-酪蛋白[3]。其中,β-酪蛋白由209 个氨基酸残基构成[4],分子质量为25.38 ku,占牛乳总蛋白含量的26%左右[5],仅次于αs1-酪蛋白[6],在婴幼儿神经及骨骼发育方面具有重要作用[7]。作为非常重要的生物活性物质,β-酪蛋白既可为人体提供必需氨基酸,又可作为疏水性载体与维生素D3、抗癌药物结合提高其生物活性[8],增加治疗癌症的可能性[9]。对于天然消化性良好的β-酪蛋白进行深入研究,将有助于增加牛乳的应用价值。
β-酪蛋白具有遗传多态性。根据β-酪蛋白分子结构及氨基酸组成的不同,目前共发现13 种蛋白质变异体,包括A1、A2、A3、A4、B、C、D、E、F、G、H1、H2 型及I 型[10]。A1 型β-酪蛋白和A2 型β-酪蛋白与人类健康密切相关,两者结构最相近,且在牛奶及其制品中广泛存在[11]。牛种属的原始变体是A2 型基因,由于发生基因突变,逐渐出现A1型,并随着时间的推移,A1 基因型所占比重越来越重[12]。这2 种基因型主要不同的是蛋白一级结构第67 位氨基酸的差异(A2 型β-酪蛋白是脯氨酸,而A1 型β-酪蛋白是组氨酸)[13]。目前,按照酪蛋白类型可以分为2 种牛奶:由纯种A2 基因型奶牛产生的只含A2 型β-酪蛋白的A2 牛奶和主要含有A1 型β-酪蛋白的A1 牛奶。研究发现,β-酪蛋白氨基酸结构的微小差异都会造成其消化产物特性的不同。赵煊影[14]的研究表明,水牛乳经体外消化后A 等位基因更利于β-酪蛋白在肠道的消化。Sheng 等[15]研究了κ-酪蛋白的不同表型:AA、BB、AB 以及不同表型组成的酪蛋白牛奶的消化特性,结果表明,与BB 型和AB 型牛奶相比,AA型牛奶在胃阶段的消化速度更快,而在肠消化阶段仅有很小的差异。综上,β-酪蛋白基因型的差异会导致其消化产物的差异,并通过消化吸收上的差异影响人体健康。关于β-酪蛋白的体外消化特性虽有较多的研究,但A2 型β-酪蛋白经人体消化后,其消化产物组成的变化鲜见报道。
本研究选择A2 型β-酪蛋白为对象,对其进行提取纯化,比较其与A1 型β-酪蛋白在体外消化上的差异,分析二者消化产物的结构特征,探究A2 型牛奶对人体胃肠道的积极作用,为A2 型β-酪蛋白乳制品在胃肠中的耐受性及以其为原料开发高品质的营养型乳制品提供理论依据和参考价值。
1 材料与方法
1.1 材料与试剂
A2 牛奶源自纯种A2 基因型奶牛,A1 牛奶源自商场超市的普通牛奶。
三氟乙酸、PBS 缓冲液、胰蛋白酶、胃蛋白酶、磺基水杨酸、邻苯二甲醛、四硼酸钠、尼罗蓝、胎牛血清、二甲基亚砜,北京索莱宝生物科技有限公司;十二烷基硫酸钠、考马斯亮蓝R-250,美国Sigma 公司;蛋白预染Marker、5×蛋白上样缓冲液,赛默飞世尔科技有限公司;其它化学试剂均为分析纯级。
1.2 仪器与设备
高速冷冻离心机CF1524R,德国Sigma 有限公司;制备型冷冻干燥机,北京博医康实验仪器有限公司/中国;PP-1105 电泳仪、MP-8120 转移电泳仪槽、MP-3030 垂直电泳槽,北京凯元信瑞仪器有限公司;GE AKTA Pure 蛋白质纯化仪,伯乐生命医学产品(上海)有限公司;Nano ZS 马尔文纳米粒度分析仪,英国马尔文仪器有限公司;氨基酸分析仪,日本日立公司;紫外-可见分光光度计、酶标仪,美国Molecular Devices 公司;傅里叶红外光谱仪,德国Bruker 光谱仪器公司;气相色谱分析仪,美国安捷伦公司。
1.3 方法
1.3.1 A1 型和A2 型β-酪蛋白的分离纯化
1.3.1.1 A1 型和A2 型β-酪蛋白的粗提取 取100 mL 奶样,均质1 min,4 ℃温度下离心5 000×g,20 min,除去乳中大部分脂肪,然后利用盐酸调节乳中pH 值至β-酪蛋白的等电点(4.6~4.7),静置30 min。使用蒸馏水将沉淀的酪蛋白冲洗至中性,选择规格8 000~14 000 u 的透析袋,在4 ℃低温下用去离子水进行透析,持续48 h。透析液每6~8 h 更换一次。透析后,利用小型冻干机对蛋白溶液冷冻干燥,于-20 ℃冻存。
1.3.1.2 A1 型和A2 型β-酪蛋白的离子交换色谱分离 采用DEAE Bestarose Fast Flow 阴离子交换色谱柱的方法,利用GE AKTA Pure 蛋白质纯化仪对粗提取的酪蛋白中的β-酪蛋白进行分离纯化。取出冻干的酪蛋白,用流动相A 溶解形成20 mg/mL 的样品溶液,选择0.22 μm 滤膜过滤除菌。其中,流动相A 由4 mol/L 尿素、20 mmol/L Tris 和0.5%巯基乙醇组成,流动相B 由1 mol/L氯化钠溶于流动相A 组成。梯度洗脱条件:柱子体积为5 mL,上样量为5 mL,流速为1 mL/min,检测波长为280 nm,离心管收集4 mL 的蛋白纯化液。梯度洗脱程序见表1。
表1 A1 型和A2 型β-酪蛋白梯度洗脱程序
Table 1 A1 and A2 β-casein gradient elution procedure

1.3.1.3 色谱分离峰的SDS-PAGE 鉴定 采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)的方法对上述收集液进行检测鉴定,鉴定蛋白的类型及纯度。参照Gruener 等[16]的方法并略作修改。首先,配制染色液、脱色液和电极缓冲液,然后按照SDS-PAGE 试剂盒说明书制胶,选择体积分数是15%的分离胶和5%的浓缩胶进行配制并加入电极槽,插上梳子,等浓缩胶凝固后,将电泳缓冲液倒入槽内,拔去梳子并加样。加样前分别将收集液和β-酪蛋白标准溶液与5×蛋白上样缓冲液混合,沸水浴加热1~5 min,12 000 r/min 条件离心1 min 后上样,上样体积为10 μL,连接电源调节电泳电压至80 V,约1 h 溴酚蓝指示线到达分离胶后调节至120 V。最后进行1 h 染色,之后根据凝胶本身的脱色情况决定脱色时间。采用Bio-Rad GS800 光密度扫描分析系统对凝胶拍照并对纯度进行分析。
1.3.1.4 分离产物的脱盐及浓度测定 对收集液进行脱盐处理,用8 000~14 000 u 规格的透析袋置换出收集液中的盐离子后,使用冻干机将冻干的样品储存在-20 ℃,并作为后续试验样品。同时,为进一步研究蛋白的浓度,将A1 型和A2 型β-酪蛋白溶解在PBS 缓冲液中,最终质量浓度为1 mg/mL,利用BCA 蛋白浓度试剂盒测定蛋白浓度。
1.3.2 A1 型和A2 型β-酪蛋白消化产物特性
1.3.2.1 消化产物的制备 参照Pan 等[17]的方法并进行调整,采用静态体外消化体系。以A1 型和A2 型β-酪蛋白为原料,进行体外模拟胃肠部消化。配制4%的β-酪蛋白溶液,同时配制唾液、胃液和肠液。试验具体的操作方法如下:
1)口相 将10 mL 体积分数4%的A1 型和A2 型β-酪蛋白溶液分别与1 mL 模拟唾液混合,调节混合物的pH 值至6.8,并将反应体系置于培养箱中,设置培养箱温度37 ℃,转速130 r/min,时间10 min。
2)胃相 将0.2 g 氯化钠和0.7 mL 盐酸混合,定容至100 mL,得到人工胃液。10 mL 口腔样品消化液与10 mL 胃液等体积混合,并加入0.064 g 胃蛋白酶(3 000 U/mg)混合,调节混合物的pH值为2.5 后,继续置于培养箱中,以37 ℃、130 r/min 反应2.0 h。分别在消化的0.5,1.0,1.5,2.0 h 4个时间节点取出,调节消化液的pH 值至7.0,煮沸冷却后-20 ℃冻存备用。
3)肠相配 制36.7 mg/mL 氯化钙、219.1 mg/mL 氯化钠。从胃相取20 mL 消化液与20 mL小肠相混合,加入1.5 mL 氯化钙和氯化钠,并加入1.8 g 胆盐模拟肠环境,调节消化液的pH 值至7.0,加入1.2 g 胰蛋白酶(10 000 U/mg)。与胃液同等条件置于培养箱内反应3.0 h,分别在消化的2.5,3.0,3.5,4.0,5.0 h 这5 个时间节点取出,调节消化液的pH 值至7.0,煮沸冷却后放置在-20 ℃冻存备用。
1.3.2.2 消化率的测定 取出消化液,用1 mol/L盐酸调节消化液pH 值至4.6,1 000 r/min 条件下离心,分离沉淀物,用PBS 缓冲液将沉淀物溶解,利用BCA 蛋白浓度试剂盒测定总蛋白质质量浓度(mg/mL)。按照式(1)计算β-酪蛋白体外消化率。
式中:P1 为模拟消化前蛋白质样品中蛋白质质量浓度,mg/mL;P0 为消化后蛋白质样品中蛋白质质量浓度,mg/mL。
1.3.2.3 粒径的测定 本研究采用Nano ZS 马尔文纳米粒度分析仪对β-酪蛋白的体外消化物的粒径变化情况进行分析。参照何思宇[18]的方法,取1 mL 消化液置于比色皿中,静置2 min,粒径测定采用的是动态光散射模式。参数设定:温度为25℃,光源:4 mW He-Ne 激光,散射角:90°,样品池:10 mm 路径长度石英比色皿。
1.3.2.4 游离氨基酸测定 参照张兆云[19]的方法,取不同消化时间冻存备用的消化液,加入适量体积的1%磺基水杨酸溶液,静置0.5 h,在4 ℃、6 000 r/min 条件离5 min,上清液过滤膜,标记样品后吸取20 μL 滤液,利用氨基酸自动分析仪进行含量测定。
1.3.2.5 水解度变化 邻苯二甲醛(OPA)方法被用来测定蛋白消化物的水解度。参照江连洲等[20]的方法,首先制备OPA 试剂,与消化液混合后在紫外分光光度计下测定吸光度,通过公式计算水解度。具体操作方法如下:
1)OPA 试剂配制 取2 mL 无水乙醇以溶解80 mg 邻苯二甲醛OPA,然后转移至75 mL 去离子水中,再加入88 mg 二硫苏糖醇并定容至100 mL 制成OPA 试剂,现用现配。
2)水解度的测定 将200 μL 的蛋白消化液与1.5 mL 新鲜制备的OPA 试剂混合,室温下静置反应2 min,测量波长340 nm 处的吸光度值。去离子水作为空白对照,以丝氨酸标准溶液(0.9516 meqv/L)作为参考。按照式(2)和式(3)计算水解度。

式中:Serine NH2 是每克蛋白质丝氨酸氨基的含量,mmol/g;β 和α 分别为常数0.4 和1;htot 是酪蛋白肽键总数,为8.2;N 为稀释倍数;V 是上清液体积,L;m 是样品质量,g;P 是样品 中蛋白 含量,%。
1.3.2.6 傅里叶红外光谱的测定(FT-IR)参照蛋白与溴化钾压片法[21-22],首先将色谱级的溴化钾粉末烘干以去除水分,完成后采用蛋白与溴化钾压片法,取1.0 mg 待测消化物冻干样品与200 mg溴化钾粉末充分研磨混匀后压片,利用傅里叶红外光谱仪测定。测量波长选择400~4 000 cm-1,扫描分辨率为4 cm-1,64 次的扫描次数,波数精度0.01 cm-1,最终结果以透过率对波长的关系作图。采用Origin Pro 8.5 软件采集谱图,并标记特征峰,使用Peakfit Version 4.12 软件在相应光谱波段范围内基线校正,进行函数平滑、去卷积化处理,最后对二阶导数曲线多次拟合。根据各二级结构单元的峰面积计算蛋白消化物中各二级结构的含量。
1.4 数据分析
采用SPSS 27.0.1 软件进行数据单因素方差分析,采用PeakFit v4.12、Excel 2018 和GraphPad Prism 8.02 进行统计学并绘图分析。每个试验重复3 次,结果以平均值±标准差( )表示测定数据。差异具有统计学意义,P<0.05 表示结果具有显著差异,P<0.01 表示极显著。
)表示测定数据。差异具有统计学意义,P<0.05 表示结果具有显著差异,P<0.01 表示极显著。
2 结果与分析
2.1 A1 型和A2 型β-酪蛋白的分离纯化
2.1.1 β-酪蛋白的离子交换色谱分离 通过等电点沉淀法粗提,得到酪蛋白并对其进行了分离纯化。利用DEAE Bestarose Fast Flow 阴离子交换色谱柱进行蛋白梯度洗脱。结果如图1 所示,由于不同蛋白质在缓冲液中的结合力不同,出峰时间不同。根据标准品的出峰时间以及赵烜影等[23]和Li 等[24]研究的出峰时间,初步判断2 个主要峰是α-酪蛋白和β-酪蛋白,κ-酪蛋白的峰不明显,主要原因可能是在提取过程中造成了κ-酪蛋白流失。为进一步鉴定β-酪蛋白,收集对应峰值的洗脱液进行SDS-PAGE 鉴定。
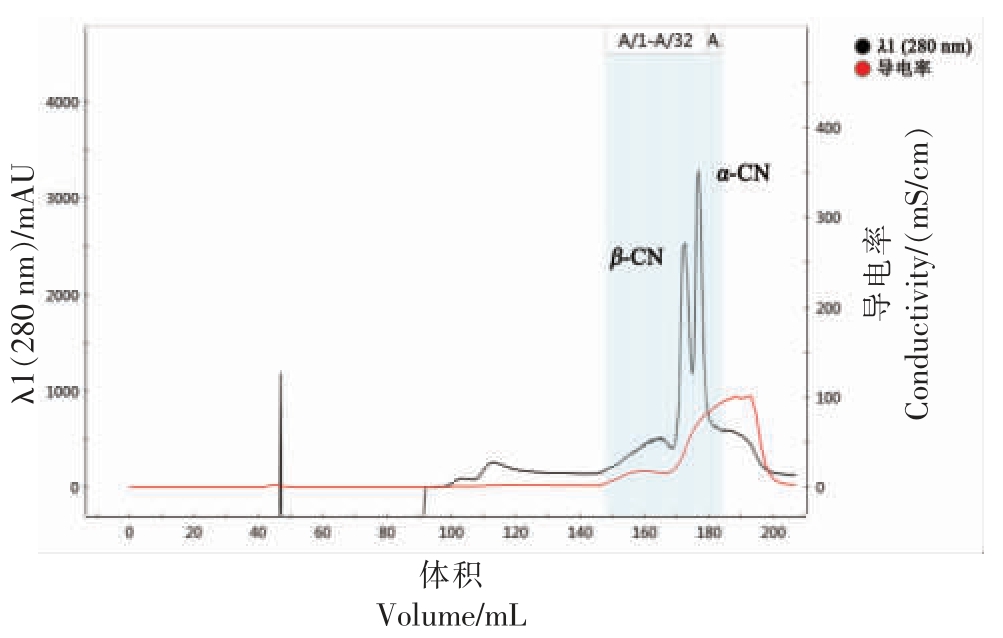
图1 阴离子交换色谱柱分离β-酪蛋白的层析图
Fig. 1 Chromatogram of Separation of β-casein by anion exchange chromatography
注:α-CN 代表α-酪蛋白,β-CN 代表β-酪蛋白,图4~7 同上。
2.1.2 色谱分离峰的SDS-PAGE 鉴定 β-酪蛋白分离峰的SDS-PAGE 电泳结果如图2 所示,泳道1 和2 为标准蛋白分子Marker,泳道3 和4 为β-酪蛋白标准品条带,泳道5 为A1 型β-酪蛋白条带,泳道6 为A2 型β-酪蛋白条带。光密度扫描结果显示条带灰度纯度高于95%,且根据标准蛋白分子Marker 和β-酪蛋白标准品可知,β-酪蛋白条带较清晰,纯度较高。然而A1 型β-酪蛋白和A2 型β-酪蛋白分子质量没有明显区别,这主要是由于β-酪蛋白不同基因型分子质量差距较小所致。
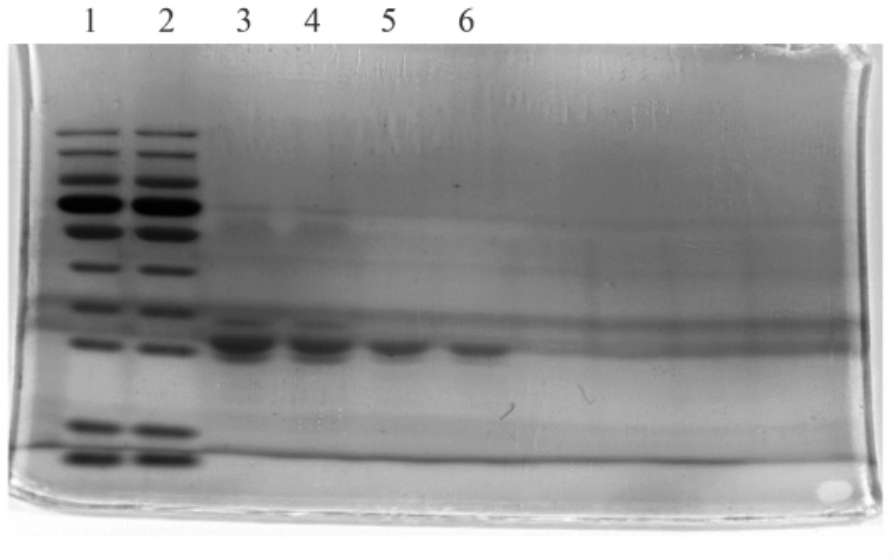
图2 洗脱峰收集液中SDS-PAGE 分析图
Fig. 2 SDS-PAGE analysis of eluting peak collection solution
注:1、2 为Marker,3、4 为β-酪蛋白标准品,5 为A1 型β-酪蛋白,6 为A2 型β-酪蛋白。
2.1.3 A1 型和A2 型β-酪蛋白脱盐纯度及质量浓度分析 根据BCA 蛋白质质量浓度试剂盒的操作方法得到蛋白质量浓度的标准曲线如图3 所示。按照试剂盒的方法计算,得出A1 型和A2 型β-酪蛋白的质量浓度分别是0.58 mg/mL 和0.64 mg/mL,根据Quantity One 软件推算A1 型和A2型β-酪蛋白的纯度分别为92.45%和94.21%。由此可知,利用透析的方法对蛋白进行离子置换并浓缩,能够对分离出的A1 型和A2 型β-酪蛋白进行有效的脱盐纯化,且纯度较高。

图3 蛋白质量浓度标准曲线
Fig. 3 Protein mass concentration standard curve
2.2 β-酪蛋白消化特性研究
2.2.1 消化率测定 本研究通过体外模拟唾液、胃液、肠液内的消化酶、pH 值、消化温度和时间,分析2 种基因型β-酪蛋白的消化特性。蛋白质的消化率可以直观地表明β-酪蛋白的胃肠消化情况。消化结果如图4 所示,随着A1 型和A2 型β-酪蛋白在胃肠液中消化时间的延长,消化率呈现显著增加的趋势,表明β-酪蛋白在胃肠液中逐渐被消化。在0~2.0 h 的胃消化阶段,β-酪蛋白在胃蛋白酶作用下迅速酶解,A1 型β-酪蛋白消化率由0%增加到65.12%,A2 型β-酪蛋白消化率由0%增加到71.17%,说明胃蛋白酶对于大物质酶解起着重要作用。在2.0~5.0 h 的肠消化阶段,β-酪蛋白在胰蛋白酶作用下其消化率进一步提高,在胃肠总消化4.0 h 时,A2 型β-酪蛋白消化率已达到94%,消化5.0 h 时,A1 型β-酪蛋白消化率达93.47%,A2 型β-酪蛋白消化率达96.81%,基本完成消化,说明β-酪蛋白在肠液中消化完全,且A2 型β-酪蛋白较A1 型β-酪蛋白消化快,进而表明A2 型β-酪蛋白有利于人体对多肽以及必需氨基酸的消化。
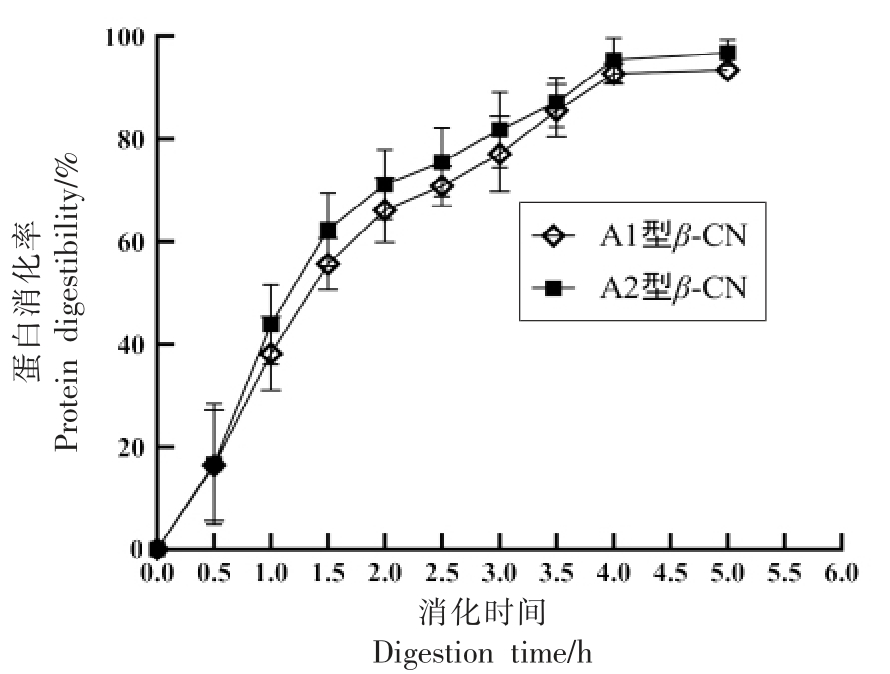
图4 A1 型和A2 型β-酪蛋白体外消化率
Fig. 4 In vitro digestibility of A1 and A2 β-casein
2.2.2 消化物粒径 粒径大小是衡量蛋白消化产物变化的一个重要理化指标。牛奶中α-酪蛋白、β-酪蛋白和κ-酪蛋白以α-螺旋、β-折叠和β-转角等结构形成胶束状的空间结构[25],这种胶束疏松且多孔,粒径大小均匀。经体外消化,β-酪蛋白及其消化产物的粒径分布曲线如图5 所示,β-酪蛋白粒径主要集中在200~800 nm 之间,粒径分布符合不正规的正态分布。随着消化时间延长,β-酪蛋白的粒径逐渐减小,在酶的消化作用下逐渐被水解为多肽和氨基酸。在0~2.0 h 的胃消化期间,粒径分布曲线顺次向左推移,蛋白粒径逐渐减小,主要集中在100~500 nm。这说明在胃蛋白酶作用下,β-酪蛋白被轻度酶解,这可能是由于β-酪蛋白疏水性较强,酶切位点存在分子结构内部,不易被酶切为更小的肽段,而随着酶解时间的增加,酶切位点逐渐暴露,被分解为更短的肽段。A2 型β-酪蛋白在3.0 h 到5.0 h 的肠消化阶段,粒度分布曲线出现2 个峰值,分别在100 nm 和350 nm 附近,峰值顺次向左推移,并且随着酶解时间的增加,350 nm 附近的峰值不断减少,100 nm 附近的峰值逐渐增加,而A1 型β-酪蛋白出现的2 个峰值的现象并不明显,粒径仍集中在100~500 nm。上述结果说明A2 型β-酪蛋白在肠消化阶段被酶解为更小的肽段,其大颗粒物质在胃肠消化液中逐渐被酶解,粒径逐渐变小。这从侧面验证了蛋白消化率的结果,小粒径的颗粒更易被人体消化。

图5 A1 型(a)和A2 型(b)β-酪蛋白体外消化粒径变化
Fig. 5 Changes in partical size of A1(a)and A2(b)β-casein digested in vitro
2.2.3 游离氨基酸测定 体外模拟消化结束后,采用氨基酸自动分析仪测定了A1 型和A2 型β-酪蛋白消化液中游离氨基酸的含量,结果见表2。经体外模拟胃肠消化后,在胃蛋白酶和胰蛋白酶的酶解作用下,大分子质量的β-酪蛋白被降解为小分子的肽类,水解出更多的游离氨基酸。肠消化结束后,在消化液检测到17 种氨基酸,其中包括8 种必需氨基酸(苏氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸、赖氨酸和组氨酸)。A2 型β-酪蛋白消化后总的游离氨基酸含量为158.52 μg/mL,A1 型β-酪蛋白消化后总的游离氨基酸含量为142.23 μg/mL。A2 型β-酪蛋白消化后必需氨基酸含量(59.27 μg/mL)比A1 型β-酪蛋白的必需氨基酸含量(52.73 μg/mL)略高。除了缬氨酸外,A1 型β-酪蛋白中多数的必需氨基酸含量均低于A2 型β-酪蛋白必需氨基酸含量。A2 型β-酪蛋白在消化酶作用下释放出的酪氨酸(23.35 μg/mL)、赖氨酸(17.52 μg/mL)和谷氨酰胺(15.12 μg/mL)含量较丰富。这些氨基酸能促进生长发育、促进脑垂体分泌生长素、增强免疫功能,有助于身体组织吸收钙,防止骨质流失。这可能说明A2 牛奶饮食可以改善人体营养和健康。相比较而言,2 种基因型β-酪蛋白消化液释放的游离氨基酸种类和总量相似,无明显差异。
表2 消化5 h 后蛋白游离氨基酸含量分析(μg/mL)
Table 2 Analysis of free amino acid content of protein after digestion for 5 h(μg/mL)
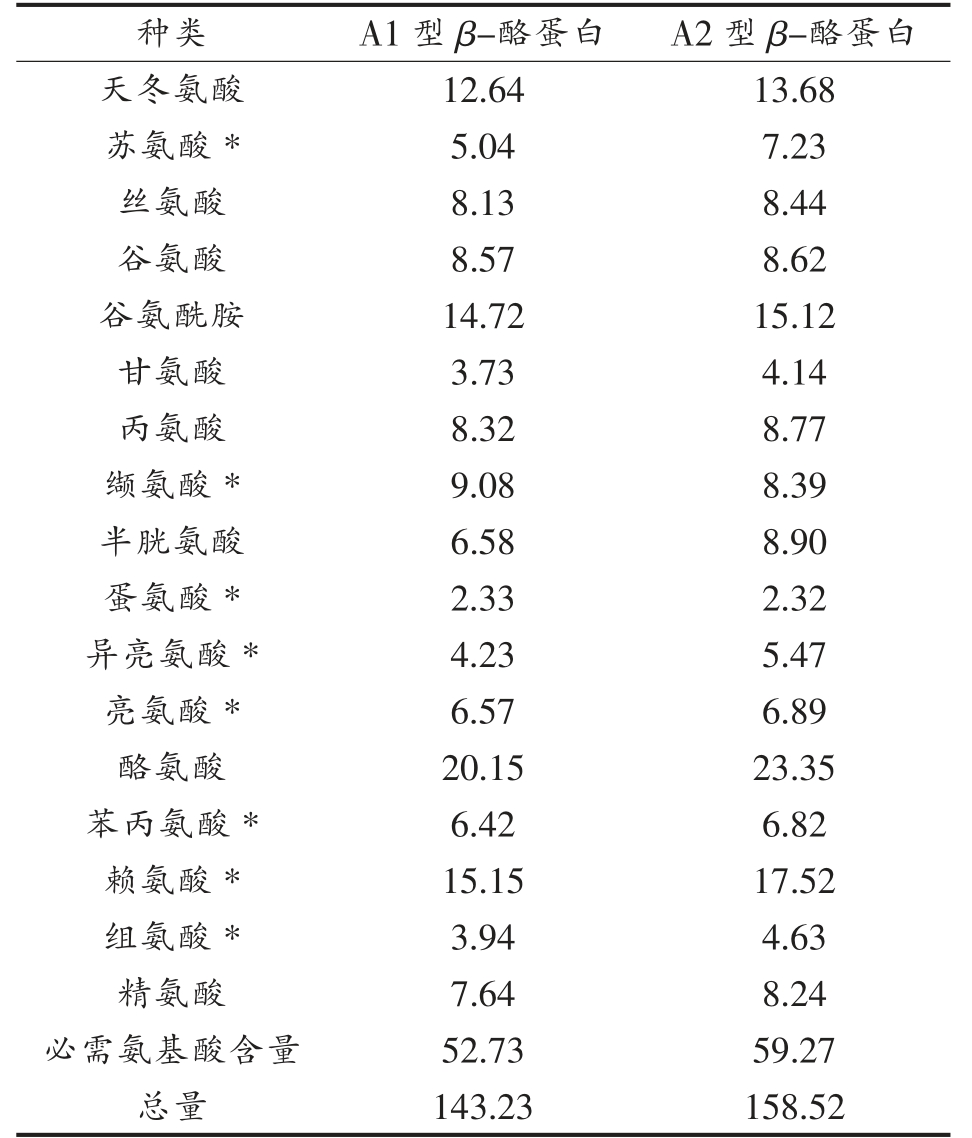
注:* 代表必需氨基酸。
2.2.4 水解度变化 水解度是评估蛋白体外消化的重要指标,表示消化过程中肽键断裂程度。本研究在体外模拟胃肠连续消化条件下,以时间对水解度的关系做水解曲线并计算得出A1 型和A2型β-酪蛋白消化物水解度变化情况,结果如图6所示。在模拟胃肠消化的条件下,β-酪蛋白由于受到胃蛋白酶和胰蛋白酶的作用而发生水解。在胃消化阶段(0~2.0 h),A1 型和A2 型β-酪蛋白的水解度均随着消化时间的延长而增加,且没有明显差距,消化到2.0 h 时,水解度均达到(10.75 ±0.35)%。在胃肠连续消化4.0 h 时,水解速度加快,A2 型β-酪蛋白的水解度达到(20.85±0.17)%,高于A1 型β-酪蛋白的(18.75±0.21)%。以上结果表明β-酪蛋白主要在小肠中发生完全水解,可能是胃液中胃蛋白酶及低酸性环境利于蛋白质发生变性并解链,转化为低分子质量的多肽给肠液中胰蛋白酶的消化提供有利条件,从而更有利于β-酪蛋白的消化。王麟艳[26]对酪蛋白进行体外消化模拟也得到了类似的结果,β-酪蛋白在模拟胃消化中水解度较低,说明β-酪蛋白不易被胃蛋白酶水解,而易被胰蛋白酶水解。可能原因是胃液的低酸性环境利于蛋白质空间结构变化,转化为低分子质量的多肽更有利于胰蛋白酶水解蛋白。
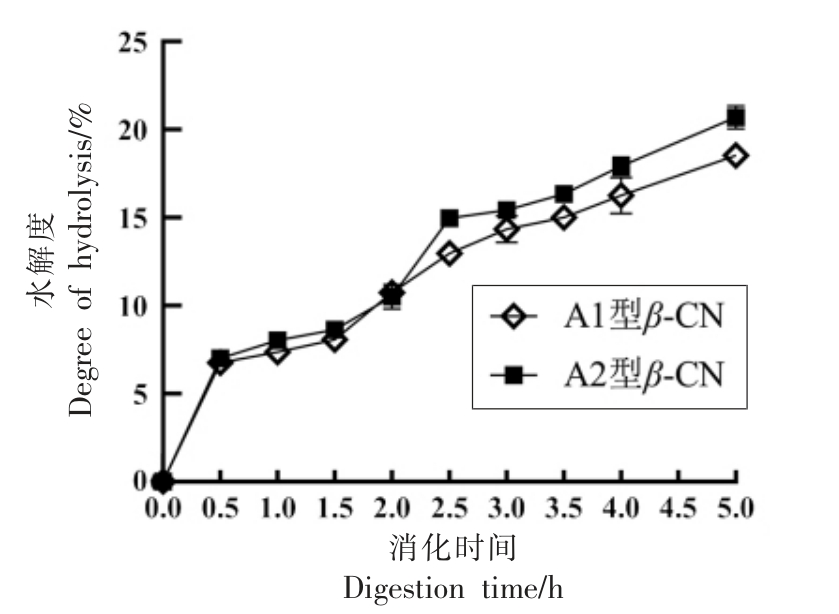
图6 A1 型和A2 型β-酪蛋白体外水解度变化
Fig. 6 Changes of in vitro hydrolysis degree of A1 and A2 β-casein
2.2.5 FT-IR 测定 蛋白质是由氨基酸肽键连接并具有特定结构的生物大分子[27],二级结构在波数1 600~1 700 cm-1 区间,与酰胺I 带重叠[28]。β-酪蛋白经消化后的FT-IR 测定结果见图7。采用PeakFit 软件对所得曲线经二阶导数IR 去卷积、光谱拟合处理,得到β-酪蛋白及消化产物的酰胺Ⅰ带图谱(选取消化末期时间节点),如图8 所示。根据去卷积处理后得到的子峰峰位,计算其积分面积,从而进行二级结构成分分析,得到蛋白质二级结构的定量信息,即α-螺旋位于1 646~1 664 cm-1 波段,β-折叠位于1 615~1 637 cm-1 和1 682~1 700 cm-1 2 个波段,β-转角位于1 665~1 681 cm-1波段,无规卷曲位于1 638~1 645 cm-1 波段。
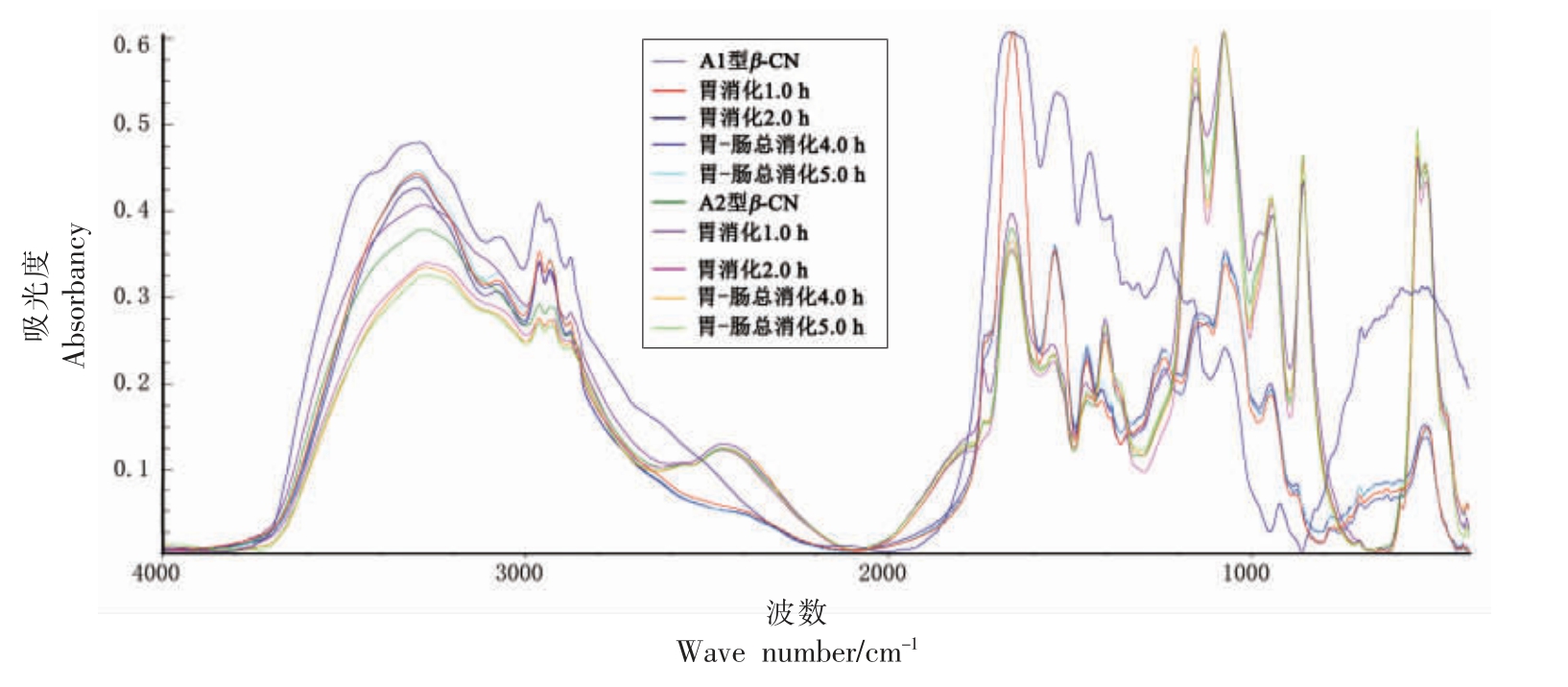
图7 A1 型和A2 型β-酪蛋白消化产物的FT-IR 光谱图
Fig. 7 FT-IR spectra of β-casein digestive products of type A1 and A2
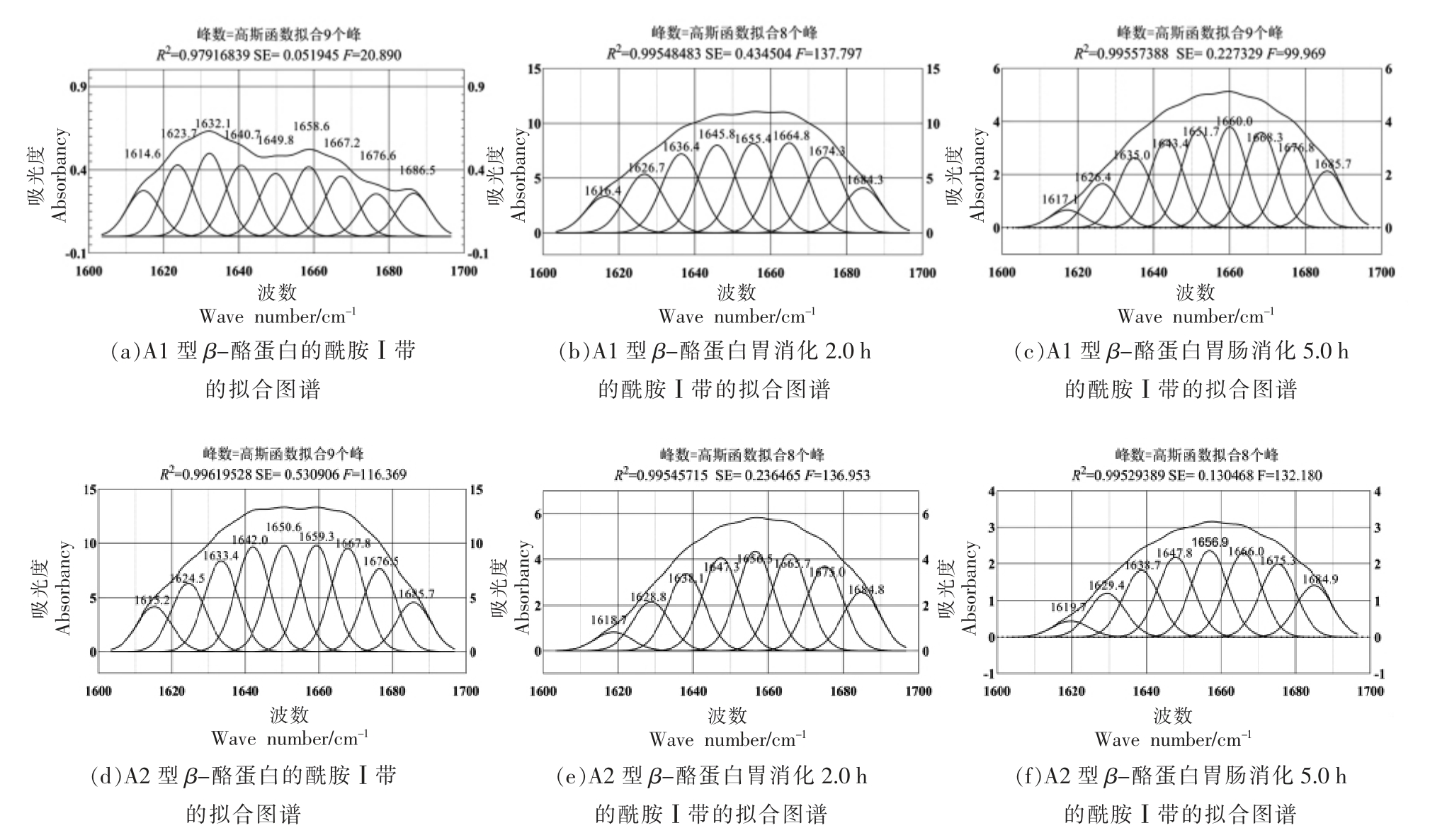
图8 A1 型和A2 型β-酪蛋白消化物的酰胺Ⅰ带的拟合图谱
Fig. 8 Fitting map of amide Ⅰreigon of A1 and A2 β-casein digestive products
由表3 可知,β-酪蛋白二级结构主要以β-折叠和α-螺旋为主,A1 型β-酪蛋白二级结构中β-折叠和α-螺旋的相对含量分别为38.47%和30.30%,A2 型β-酪蛋白二级结构中β-折叠和α-螺旋的相对含量分别为34.22%和28.45%。在胃肠液中由于胃蛋白酶和胰蛋白酶的酶解作用,稳定蛋白二级结构的氢键和静电作用发生变化,同时蛋白质氨基酸种类和肽链结构发生变化,从而影响蛋白质空间构象,使得β-酪蛋白消化产物的二级结构再次发生变化,从而提高β-酪蛋白消化产物的稳定性,消化产物中β-折叠含量降低(P<0.05),多肽链反转180°形成β-转角,且无规卷曲含量增加(P<0.05),苏银杰[29]使用胰蛋白酶对酪蛋白进行水解得到了类似的结果,经过酶解的酪蛋白的二级结构β-折叠含量减少并且β-转角含量增多。由于酶与肽键相互作用,β-酪蛋白的二级结构被破坏,使得无序结构增多,二级结构含量随之发生变化。总体来说,A1 型和A2 型β-酪蛋白二级结构没有明显差异。
表3 A1 型和A2 型β-酪蛋白及其消化物的二级结构
Table 3 Secondary structure of A1 and A2 β-casein and their digestive products
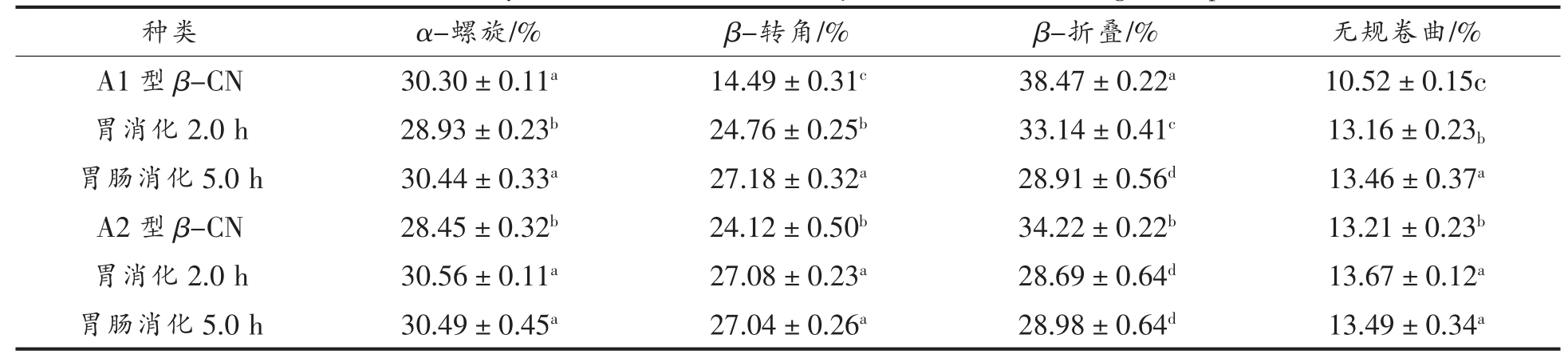
注:采用Duncan's 多重比较,同一列数据的不同字母表示分析结果差异显著(P<0.05)。
3 结论
本研究首先从A1 普通牛奶和A2 牛奶中分离、纯化和鉴定A1 型和A2 型β-酪蛋白。结果显示,分离纯化后A1 型和A2 型β-酪蛋白的质量浓度分别为0.58 mg/mL 和0.64 mg/mL,纯度分别为92.45%和94.21%。其次通过构建体外胃肠消化模型,确定模拟胃肠道消化A1 型和A2 型β-酪蛋白后的蛋白质消化率、粒径、分子质量、游离氨基酸种类及含量、水解度和蛋白质二级结构的变化。结果表明,经消化酶解,β-酪蛋白体外消化率随时间延长逐渐上升,消化末期已基本消化完全,且A2型β-酪蛋白较A1 型β-酪蛋白消化快。随着胃肠消化时间增加,蛋白粒径逐渐降低,A2 型β-酪蛋白在肠消化阶段能被酶解为更小的肽段。游离氨基酸测定结果显示,A2 型β-酪蛋白消化产物中必需氨基酸的含量比A1 型β-酪蛋白略高。在进入肠消化阶段β-酪蛋白的水解度迅速上升,在消化末期A2 型β-酪蛋白比A1 型β-酪蛋白水解度略高。消化结束后蛋白质二级结构中β-折叠结构含量降低,β-转角和无序结构增多。虽然A1 型和A2型β-酪蛋白消化产物的二级结构没有明显差异,但A2 型β-酪蛋白比A1 型β-酪蛋白消化更快,消化后的肽段更小,游离必需氨基酸含量更高。有研究表明,A1 牛奶消化释放的β-酪啡肽-7(β-Casomorphin-7,BCM-7)是对人类健康造成潜在危害的原因,然而,A2 型β-酪蛋白在第67 位氨基酸是脯氨酸,其水解后几乎不会产生BCM-7。因此,未来可以从消化后产生的生物活性肽方面探究A1 与A2 β-酪蛋白消化特性的差异。本研究根据A2 型β-酪蛋白的体外消化产物理化特性研究发现,对于胃肠道摄入营养物质,A2 型β-酪蛋白表现出积极作用,进一步说明了A2 基因型的β-酪蛋白更有利于人体胃肠道消化,为A2 型β-酪蛋白乳制品消化特性研究提供一定的理论基础。
[1] 梁杰,耿晓晖,刘延平,等.牛乳β-酪蛋白多态性及其对人体健康影响的研究进展[J].乳业科学与技术,2019,42(2):45-49.LIANG J,GENG X H,LIU Y P,et al.Progress of polymorphism of β-casein in milk and its relationship with human health[J].Journal of Dairy Science and Technology,2019,42(2):45-49.
[2] PANG L D,PI X W,YANG X Y,et al.Nucleic acid amplification-based strategy to detect foodborne pathogens in milk:A review[J].Critical Reviews in Food Science and Nutrition,2022,64(16):11-16.
[3] WALSTRA P,JENNESS R.Dairy chemistry and physics[EB/OL].(1984-04-03)[2021-09-27].https://www.semanticscholar.org/paper/Dairy-chemistry-and -physics -Walstra -Jenness/684ba93476fe0f2978a671a 6014eb34597956d30.
[4] SWAISGOOD H E.Chemistry of the caseins[M]//FOX P F,MCSWEENEY P L H,ed.Advanced Dairy Chemistry -1 Proteins.Boston:Springer,2003:139-201.
[5] ZHONG W L,HUI L,YONG X Y,et al.Changes in metabolites from bovine milk with β-casein variants revealed by metabolomics[J].Animals,2020,10(6):954.
[6] RAIES U H M,RAJEEV K,ROHIT S,et al.Comparative evaluation of cow β -casein variants(A1/A2)consumption on Th2-mediated inflammatory response in mouse gut[J].European Journal of Nutrition,2013,53(4):1039-1049.
[7] HANSEN M,SANDSTRÖM B,LÖNNERDAL B.The Effect of casein phosphopetides on zinc and calcium absorption from high phytate infant diets assessed in rat pups and Caco-2 Cells[J].Pediatric Research,1996,40(4):547-552.
[8] FORREST S A,YADA R Y,ROUSSEAU D,et al.Interactions of vitamin D3 with bovine β-lactoglobulin A and β-casein[J].Journal of Agricultural and Food Chemistry,2005,53(20):8003-8009.
[9] SHAPIRA A,MARKMAN G,ASSARAF Y G,et al.β-Casein-based nanovehicles for oral delivery of chemotherapeutic drugs:Drug -protein interactions and mitoxantrone loading capacity[J].Nanomedicine,2010,6(4):547-555.
[10] EHLING S,WANG M,WEBER L.Determination of total and A1-type β-caseinin milk and milk-derived ingredients by liquid chromatography -mass spectrometry using characteristic tryptic peptides[J].Journal of AOAC International,2021,104(6):1559-1566.
[11] 王丹,王青云,王慧敏,等.牛乳β-酪蛋白遗传多态性及A2 型乳制品研究进展[J].中国奶牛,2021,37(3):40-43.WANG D,WANG Y Q,WANG H M,et al.Research progress on genetic polymorphism of β-casein in milk and A2 dairy products[J].China Dairy Cattle,2021,37(3):40-43.
[12] 袁兆丰,杨秀梅,王丹.乳制品中A1 β-酪蛋白、A2 β-酪蛋白含量的测定[J].中国乳业,2022,244(4):77-81.YUANG Z F,YANG X M,WANG D.Determination of A1 β-casein and A2 β-casein in dairy products[J].China Dairy,2022,244(4):77-81.
[13] CAROLI A,CHESSA S,BOLLA P,et al.Genetic structure of milk protein polymorphisms and effects on milk production traits in local dairy cattle[J].Journal of Animal Breeding and Genetics,2004,121(2):119-127.
[14] 赵烜影.水牛β-酪蛋白亚型结构表征及体外消化和抗氧化性能分析[D].哈尔滨:东北农业大学,2018.ZHAO X Y.Structure characterization,digestion in vitro and antioxidation of β-casein phenotypes in buffalo[D].Harbin:Northeast Agricultural University,2018.
[15] SHENG B,NIELSEN S D,POULSEN N A,et al.Differential in vitro digestion rates in gastric phase of bovine milk with different κ-casein phenotypes[J].Journal of Dairy Science,2021,104(10):10462-10472.
[16] GRUENER L,ISMOND M A H.Effects of acetylation and succinylation on the functional properties of the canola 12S globulin[J].Food Chemistry,1997,60(4):513-520.
[17] PAN Y,XIE Q T,ZHU J,et al.Study on the fabrication and in vitro digestion behavior of curcumin-loaded emulsions stabilized by succinylated whey protein hydrolysates[J].Food Chemistry,2019,287:76-84.
[18] 何思宇.叶绿素-酪蛋白纳米分散体系的构建及初步评价[D].上海:上海交通大学,2019.HE S Y.Preparation and preliminary evaluation of chlorophylls -casein nanodispersion [D].Shanghai:Shanghai Jiao Tong University,2019.
[19] 张兆云.“陇藜1 号”藜麦清蛋白分离提取及性质研究[D].兰州:甘肃农业大学,2021.ZHANG Z Y.Research on extraction and properties of quinoa albumin from 'Longli 1'[D].Lanzhou:Gansu Agricultural University,2021.
[20] 江连洲,胡继莹,张潇元,等.不同品种大豆分离蛋白体外消化产物的结构特性[J].中国食品学报,2019,19(9):21-36.JIANG L Z,HU J Y,ZHANG X Y,et al.Structural characteristics of in vitro digested products of different soybean protein lsolates[J].Journal of Chinese Institute of Food Science and Technology,2019,19(9):21-36.
[21] WANG J S,SU Y J,FENG J,et al.Characterization of casein hydrolysates derived from enzymatic hydrolysis[J].Chemistry Central Journal.,2013,7(1):62.
[22] FARRELL H M J,WICKHAM E D,UNRUH J J,et al.Secondary structural studies of bovine caseins:Temperature dependence of β-casein structure as analyzed by circular dichroism and FTIR spectroscopy and correlation with micellization[J].Food Hydrocolloids,2001,15(4):341-354.
[23] 赵烜影,郭鸰,任大喜,等.水牛乳β-酪蛋白基因多态性与消化性能及抗氧化性能的关联研究[J].中国奶牛,2022,381(1):12-16.ZHAO X Y,GUO L,REN D X,et al.Study on the association of Chinese buffalo milk β -casein gene polymorphism with digestive performance and antioxidant performance[J].China Dairy Cattle,2022,381(1):12-16.
[24] LI S S,HU Q,CHEN C,et al.Formation of bioactive peptides during simulated gastrointestinal digestion is affected by αs1-casein polymorphism in buffalo milk[J].Food Chemistry,2020,313:126159.
[25] FILER L J.Safe foods for infants -The regulation of milk,infant formula and other infant foods[J].The Journal of Nutrition,1993,123(2):285-288.
[26] 王麟艳.牛乳β-酪蛋白消化产物的制备及其功能性评价[D].哈尔滨:东北农业大学,2018.WANG L Y.The preparation and functional assessment of the digests of β-casein from bovine milk[D].Harbin:Northeast Agricultural University,2018.
[27] 宋相中.近红外光谱定量分析中3 种新型波长选择方法研究[D].北京:中国农业大学,2017.SONG X Z.Research of three new wavelength selection methods innear infrared spectroscopy quantitative analysis area[D].Beijing:China Agricultural University,2017.
[28] 陶健,蒋炜丽,丁太春,等.基于水平衰减全反射傅里叶变换红外光谱的食品中反式脂肪酸的测定[J].中国食品学报,2011,11(8):154-158.TAO J,JIANG W L,DING T C,et al.Determination of trans fatty acids in foods by horizontal attenuated total reflection fourier transform infrared spectroscopy[J].Journal of Chinese Institute of Food Science and Technology,2011,11(8):154-158.
[29] 苏银杰.酪蛋白酶解特性的研究[D].郑州:河南工业大学,2013.SU Y J.Study on the casein enzymatic characteriza tion [D].Zhengzhou:Henan University of Technology,2013.