白酒,拥有数千年的深厚历史底蕴,其中浓香型白酒因独特的风味而受到大众的喜爱,其市场份额占白酒总体的70%以上[1-3]。在浓香型白酒中有数百种微量成分被发现,其中酯类物质不仅种类繁多,而且含量最为丰富。酯类物质与酸、醇等物质共同影响白酒的风味[4-6]。己酸乙酯为白酒发酵过程中最重要的酯类物质之一,它不仅是构成浓香型白酒独特风味的关键呈味成分,其含量还影响酒体风味的丰富度和层次感[7]。对白酒中己酸乙酯含量进行精确控制,可使浓香型白酒在口感和品质上都有很好的提高。
产香酵母菌在生长代谢过程中可使白酒产生多种特殊风味的关键化合物[8],所产生的香气物质以酯类为主[9]。郭燕等[10]在浓香型白酒发酵过程中添加酿酒酵母和窖泥酯化细菌,从而提高了己酸乙酯含量。张建敏等[11]从多粮浓香型发酵糟醅中筛选鉴定出1 株假丝酵母,其代谢风味物质包括己酸乙酯、苯乙醇等。Li 等[12]将酿酒酵母(Saccharomyces cerevisiae)、伯顿丝 孢毕赤酵母(Hyphopichia burtonii)和葡萄牙棒孢酵母(Clavispora lusitaniae)加入大曲中混合发酵,提高己酸乙酯含量。He 等[13]通过强化大曲发酵提高己酸菌和产甲烷菌的丰度,提高了浓香型白酒中己酸、己酸乙酯和己酸酯的含量。产酯酵母可改善白酒的风味,提高白酒的质量。准确筛选和鉴定出高产己酸乙酯的酵母菌株,不仅可为白酒酿造行业提供性能优良的发酵菌种,还可丰富浓香型白酒的口感。
本研究从浓香型大曲中筛选鉴定出1 株具有产己酸乙酯能力的酵母菌,通过单因素实验确定该菌株的最优发酵条件。同时,采用实验室规模发酵试验对菌株Y4 的代谢产物进行检测,为进一步优化其在白酒酿造中的应用提供数据支持。
1 材料与方法
1.1 材料与试剂
浓香型大曲,取自河北凤来仪酒业有限公司。
色谱纯级正己烷,百灵威公司;己酸乙酯,Sigma 公司;耐高温淀粉酶、糖化酶,上海源叶生物科技有限公司;高粱,市售;其它试剂均为分析纯级试剂。
YPD 液体培养基配方如下:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,自然pH 值,121 ℃条件下灭菌20 min。
高粱酶解液配制方法如下:粉碎250 g 高粱,加入1 L 蒸馏水进行糊化,加入200 μL 耐高温淀粉酶,在90 ℃条件下液化1 h,之后将其冷却至60℃,加入0.125 g 糖化酶,糖化2 h。趁热将其过滤,离心10 min,转速为10 000 r/min,调节糖度为8°Bx,将其分装于三角瓶中(20 mL/100 mL),115 ℃灭菌20 min[14]。
1.2 设备和仪器
YXQ-LS-50SII 立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;TU-19 紫外-可见分光光度计,北京普析通用仪器有限责任公司;CKX41-F32FL 倒置荧光显微镜,日本OLYMPUS公 司;Tprofessional 型PCR 仪,Biometra 公 司;TSQTM8000 evo 三重四级杆气质联用仪,美国Thermo Fisher Scientific 公司。
1.3 方法
1.3.1 酵母菌株的分离 称取10 g 浓香型大曲,加入无菌水90 mL,充分混合后培养30 min,摇床条件为30 ℃、180 r/min。在超净工作台中,将其稀释为不同浓度,并分别涂布于YPD 固体培养基上,在30 ℃恒温培养箱中培养2 d,将具有酵母菌形态、颜色等特征的菌株进行纯化,并通过显微镜观察其形态特征。
1.3.2 产己酸乙酯菌株的筛选 将分离后的酵母菌株于YPD 培养基中培养24 h,条件为:30 ℃、180 r/min,然后将其接入高粱酶解液培养基中,接种量为0.3%(体积分数)。继续培养24 h 后,向培养基中添加无水乙醇和己酸,添加量分别为4%和0.04%(体积分数)再发酵36 h。
1.3.3 产己酸乙酯菌株的鉴定
1.3.3.1 形态学观察 将筛选出的具有产己酸乙酯性能的菌株于YPD 固体培养基上进行培养,培养条件为30 ℃,培养2 d 后通过显微镜观察并记录菌株单菌落形态。
1.3.3.2 分子生物学鉴定 提取酵母菌总DNA是使用真菌DNA 抽提试剂盒的方法。利用通用PCR 引物(ITS1 和ITS4)进行扩增。PCR 反应体系(总体积为20 μL):10 μL 的MIX 酶,上游引物和下游引物各添加0.6 μL,0.4 μL 的模板DNA,剩余体积用ddH2O 补满。扩增程序如下:将反应体系加热至94 ℃持续5 min,30 个扩增循环,94 ℃变性30 s,55 ℃条件下退火30 s,72 ℃条件下进行1 min 延伸,最后72 ℃进行10 min 延伸。将琼脂糖凝胶电泳(1%)检测合格的PCR 产物送至北京六合华大基因科技股份有限公司进行测序,得到的序列可通过NCBI 数据库进行比对,对同源性较高的菌株进行筛选后使用MEGA 11 软件分析测序菌株并构建系统发育树。
1.3.4 己酸乙酯含量测定 向发酵后的菌液中加入3 mL 正己烷(已添加内标油酸乙酯),涡旋振荡30 s 然后进行萃取,于4 ℃、12 000 r/min 条件下离心5 min,用2 mL 注射器吸取上层有机相,后利用有机滤膜过滤。初始温度40 ℃持续5 min;升温到170 ℃,速率为8 ℃/min,持续10 min;之后再升温到240 ℃,速率为8 ℃/min,持续5 min;总时长为45 min。测定所用柱子为Agilent19091N213I。
设置质量浓度梯度为0.01,0.05,0.1,0.5,1.5 g/L 己酸乙酯,经水相体系萃取后通过GC 测定己酸乙酯的质量浓度,绘制标准曲线,回归系数R2=0.9998。
1.3.5 菌株的耐受特性 检测菌株Y4 的在不同条件下的耐受特性,温度条件为:20,25,30,35,40,45,50 ℃;pH 值条件为:1,2,3,4,5,6,7,8,9,10,11,12;葡萄糖质量浓度为:100,200,300,400,500,600,700,800,900 g/L;NaCl 质量浓度为:0,50,100,150,200,250,300 g/L;己酸体积分数为:0%,0.02%,0.04%,0.06%,0.08%,0.01%,0.12%;乙醇体积分数为:0%,2%,4%,6%,8%,10%,12%,14%,16%。
1.3.6 菌株产酯条件优化 采用单因素考察不同环境条件对菌株Y4 合成己酸乙酯的影响,包括:糖度(6,8,10,12,14°Bx)、pH 值(3,4,5,6,7,8)、温度(18,20,22,25,28,30 ℃)、转速(0,120,150,180,210,240 r/min)、乙醇添加量(0%,2%,4%,6%,8%,10%)、己酸添加量(0.00%,0.02%,0.04%,0.06%,0.08%,0.10%)和发酵时间(0,12,24,36,48,60,72 h)。
1.3.7 菌株应用试验 将培养好的菌液进行离心以收集菌泥,条件为:10 000 r/min,10 min,加入无菌水得到1×106 CFU/mL 的酵母菌悬液。粉碎高粱至整粒与碎粒质量比为8∶2,加入85 ℃热水,充分混匀,浸泡24 h。向浸泡后的高粱中加入稻壳,将其混匀,蒸梁1.5 h。将粮食取出,平铺、摊凉。待温度降为30 ℃左右时,后加入20%大曲。添加10%菌液。按照浓香型白酒生产操作规程入坛发酵30 d。分别于0,10,20,30 d 进行取样,每组重复3次。
1.3.8 模拟发酵酒醅风味物质检测 取发酵酒醅(2 g)于顶空瓶中,加入饱和氯化钠(5 mL),充分振荡后,加入质量浓度为0.5 g/L 的4-辛醇,作为内标物质(5 μL),然后超声10 min。
1.3.9 数据分析方法 试验数据使用Excel、Origin 2021 和IBM SPSS Statistics 25 软件分析。
2 结果与讨论
2.1 产己酸乙酯菌株的筛选
从用于浓香型白酒生产的大曲中,通过筛选分离得到了10 株酵母菌。通过进行液态发酵试验来评估这些酵母菌合成己酸乙酯的能力,并测定了它们产生己酸乙酯的量,结果如图1 所示,菌株Y4 产己酸乙酯的量最高,因此,后续的试验选取菌株Y4。
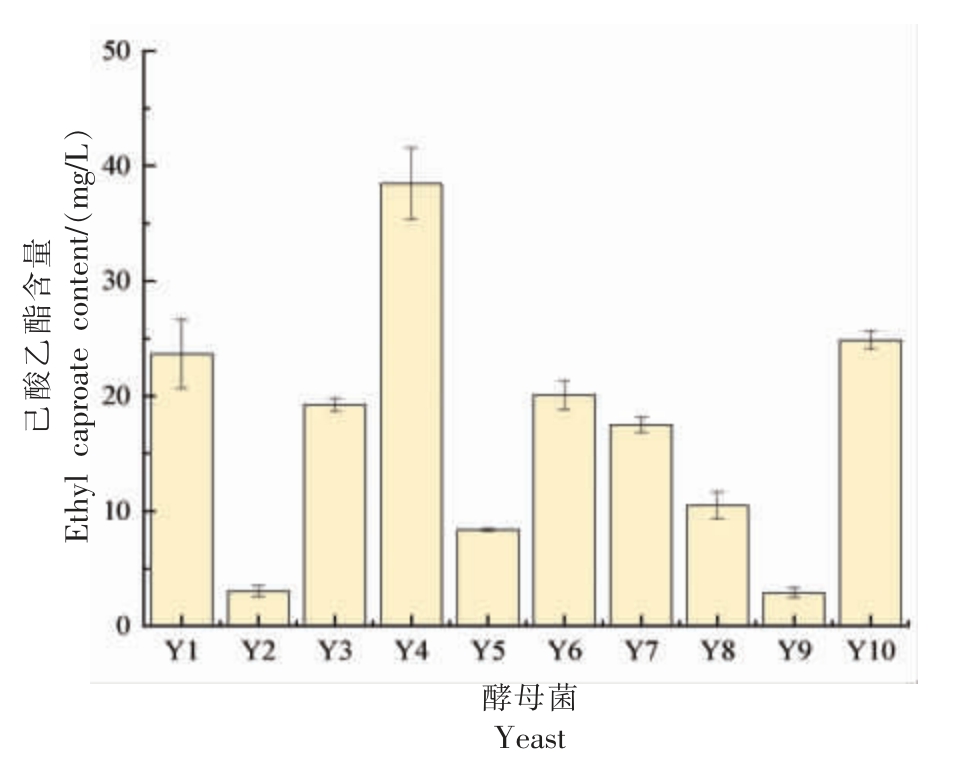
图1 10 株酵母菌合成己酸乙酯的量
Fig. 1 The amount of ethyl caproate synthesized by 10 strains of yeast
2.2 产己酸乙酯菌株鉴定
2.2.1 形态学鉴定 根据2a 可知,菌株Y4 呈现出乳白色的圆形菌落形态,并且具有明显的凸起特征;如图2b 所示,显微镜下细胞为椭圆形;如图2c 所示,通过扫描电镜可以看出细胞表面圆润饱满、光滑无褶皱,由此确定,菌株Y4 为酵母菌。

图2 菌株Y4 的形态学鉴定结果
Fig. 2 Morphological identification results of strain Y4
2.2.2 分子生物学鉴定 基于序列对比结果,利用MEGA11 软件对相似度较高的菌株与目标菌株构建系统发育树(如图3 所示)。通过对菌株Y4的菌落形态和细胞形态的观察以及分子生物学鉴定确定该酵母为酿酒酵母(Saccharomyces cerevisiae)。

图3 菌株Y4 的系统发育树
Fig. 3 Phylogenetic tree of yeast strain Y4
2.3 生物学特性分析
白酒酿造环境比较复杂,在发酵过程中渗透压的改变会影响微生物的生长代谢,渗透胁迫会导致酵母细胞的形状和特征发生变化[15]。为此,探究了氯化钠和葡萄糖对菌株Y4 生长的影响。如图4a 和4b 所示,当培养基中添加NaCl 的质量浓度低于为150 g/L 时,菌株Y4 菌可生长;在培养基中添加葡萄糖质量浓度达到800 g/L 时,菌株仍具有生长能力,表明菌株Y4 具有较好的葡萄糖耐受性。
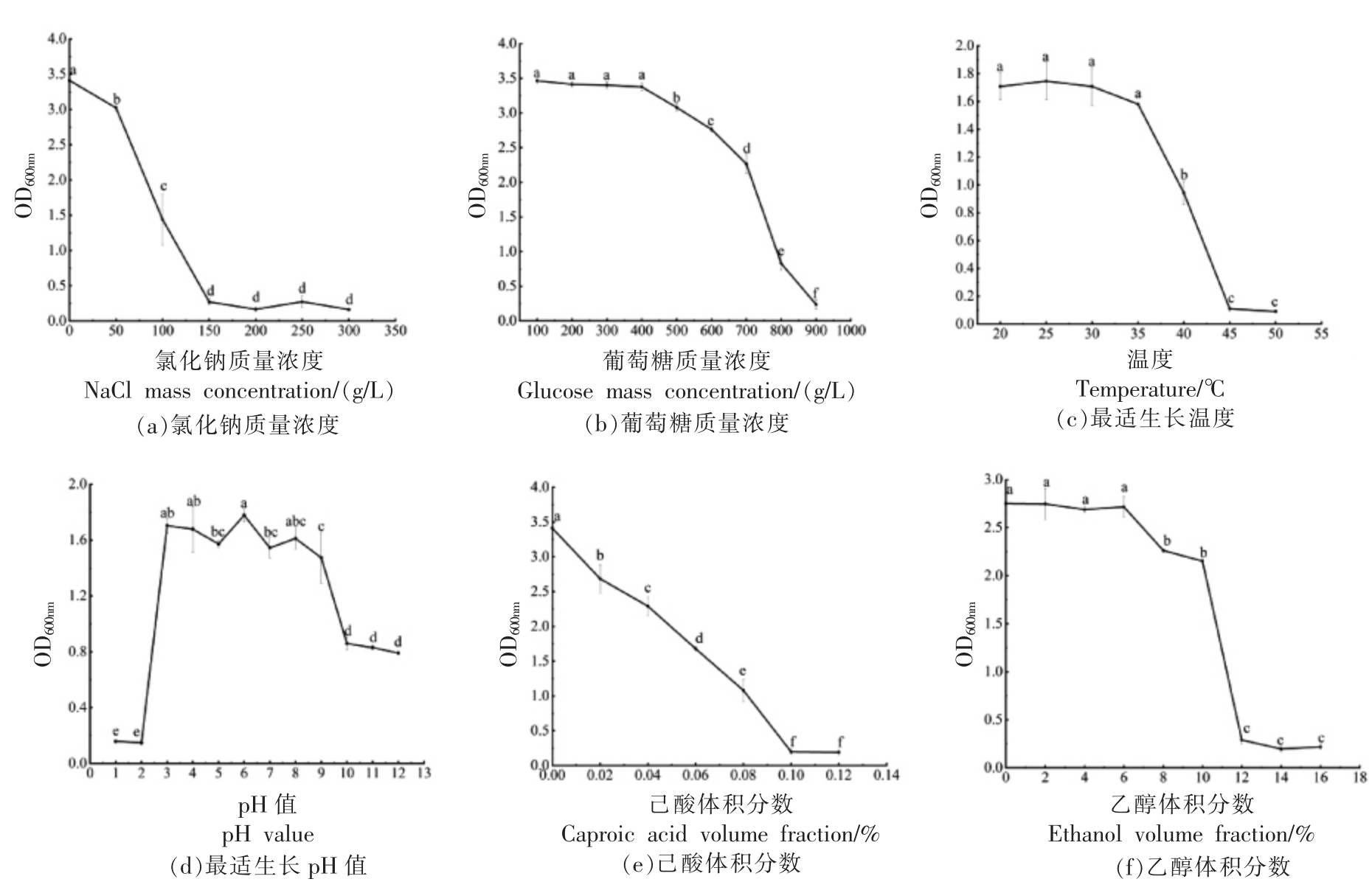
图4 菌株Y4 生物学特性分析
Fig. 4 Analysis of biological characteristics of strain Y4
注:不同小写字母表示具有显著性差异(P<0.05)。
温度对微生物的生长代谢具有重要影响,因此在白酒发酵过程中精确控制温度是至关重要的[16]。由图4c 可知,培养温度升高到45 ℃时,菌株Y4 不生长,其OD600nm 值几乎为0;温度为25 ℃时,菌株Y4 生长的最好。
在白酒发酵过程中,随着产酸菌株数量的增加,会产生更多的有机酸,致使发酵环境的pH 值降低,它不仅影响营养物质的状态,还通过改变微生物细胞膜电位和代谢酶的活性来影响微生物的代谢[17],从而影响微生物生长。由图4d 和4e 可知,菌株Y4 最适生长pH 值为6。其次,在培养基中添加0.08%己酸时菌株Y4 仍能够生长,具有较好的己酸耐受性。
酵母菌在白酒发酵过程中会面临乙醇胁迫,尤其是在白酒发酵的中后期,高浓度乙醇会抑制酿酒酵母的生长并降低细胞活力甚至会导致酵母细胞死亡[18]。由图4f 可知,在培养基中添加10%乙醇时菌株Y4 仍能够生长,菌株Y4 具有中等水平的乙醇耐受特性,可以使其在白酒发酵过程中维持正常的生长代谢。
2.4 发酵条件优化
2.4.1 温度变化对菌株Y4 产己酸乙酯能力的影响 如图5 所示,随着发酵温度的不断升高,己酸乙酯的含量先平缓增加,在达到最大值后逐渐降低,产己酸乙酯的最佳温度为25 ℃,产己酸乙酯含量为41.0 mg/L,温度过低或过高,都会影响酵母合成己酸乙酯。合成己酸乙酯的最佳温度与Y4 的最适生长温度范围一致。
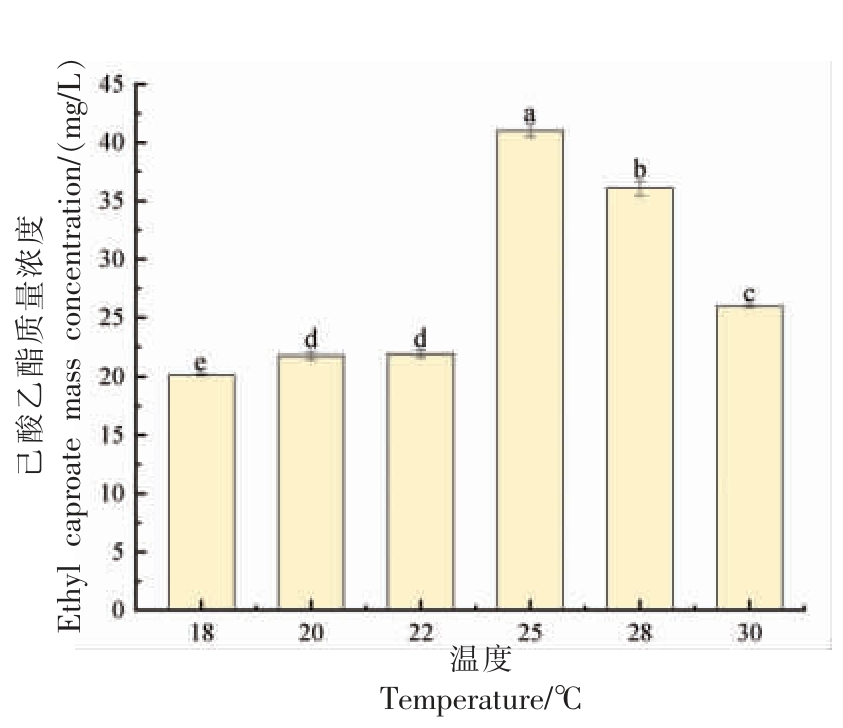
图5 菌株Y4 产己酸乙酯能力与温度的关系
Fig. 5 Relationship between ethyl caproate production capacity of strain Y4 and temperature
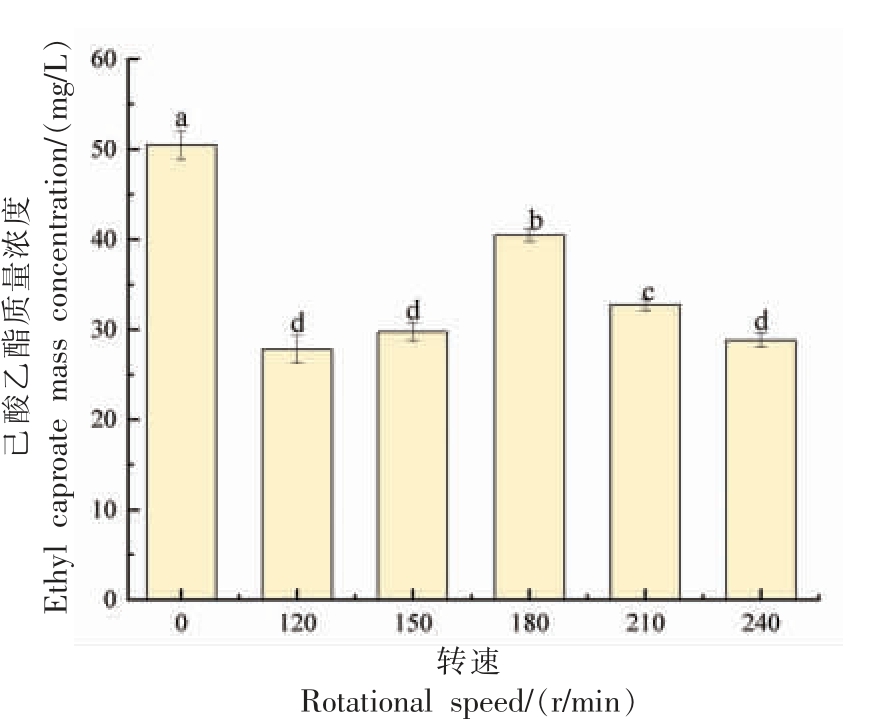
图6 菌株Y4 产己酸乙酯能力与转速的关系
Fig. 6 Relationship between ethyl caproate production capacity of strain Y4 and rotational speed
2.4.2 转速对菌株Y4 产己酸乙酯能力的影响酵母是兼性厌氧微生物,在不同环境条件下它们的代谢途径有所不同。溶解氧的数量会影响微生物的代谢途径,从而影响其产物的含量[19]。因此,通过改变振荡速度来调节溶解氧水平,探讨其对Y4 合成己酸乙酯的影响。如图所示,在静止状态下,菌株Y4 产己酸乙酯的含量最高,为50.5 mg/L,这与之前的报道相符[19-20]。浓香型白酒的发酵过程是一个相对缺氧的环境,较低的溶解氧水平有利于菌株Y4 合成己酸乙酯,表明该酵母适合应用于白酒发酵过程。
2.4.3 乙醇添加量对菌株Y4 产己酸乙酯能力的影响 乙醇和己酸能够在酯化酶的作用下合成己酸乙酯,乙醇是酵母合成己酸乙酯的重要前体物质[21-22]。因此,向培养基中添加乙醇从而观察其对己酸乙酯合成的影响。如图7 所示,当培养基中乙醇添加量为6%时,菌株合成己酸乙酯的量最高,为49.6 mg/L。当不添加乙醇时,仍然能够产生少量的己酸乙酯,这表明菌株Y4 在高粱酶解液中会产生少量的乙醇。该结果与刘朋肖等[23]的研究结果一致。
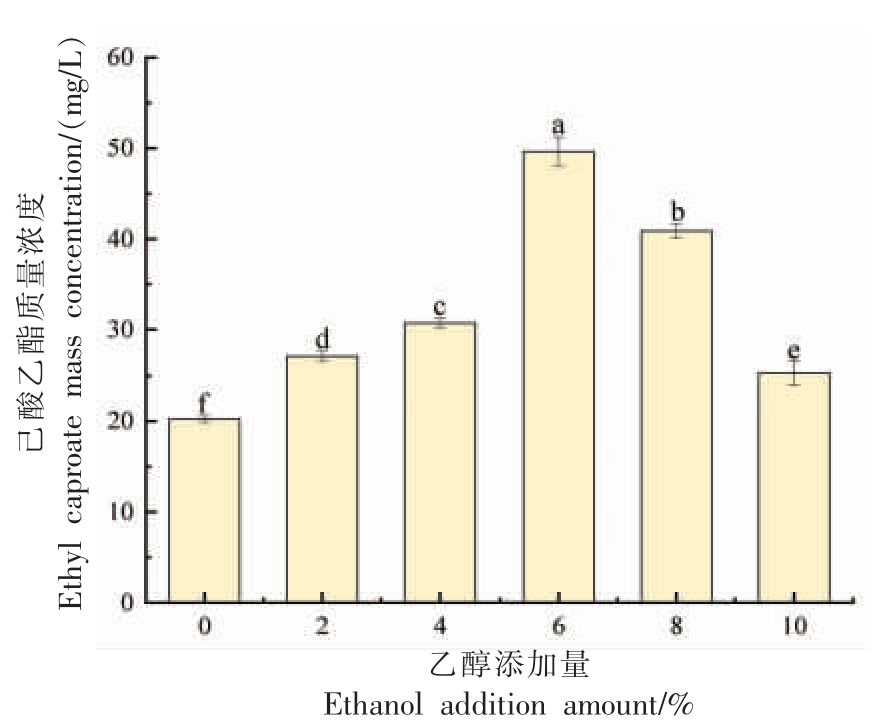
图7 菌株Y4 产己酸乙酯能力与乙醇添加量的关系
Fig. 7 Relationship between ethyl caproate production capacity of strain Y4 and ethanol addition amount
2.4.4 己酸添加量对菌株Y4 产己酸乙酯能力的影响 己酸作为合成己酸乙酯的重要前体物质之一[24],当培养基中的己酸浓度逐渐升高时,菌株Y4 合成己酸乙酯的能力初现增势,达到了一个产量高峰,随后则出现了下降的趋势(图8)。当己酸添加量为0.04%时,菌株Y4 合成己酸乙酯的含量达到峰值,即52.2 mg/L。当培养基中不添加己酸时,则不产生己酸乙酯,由此可以表明,己酸对菌株Y4 合成己酸乙酯的重要性。当培养基中己酸浓度过低或过高时,己酸乙酯的产量较低,可能是由于缺少前体物质或者过量的己酸抑制了酵母的生长。
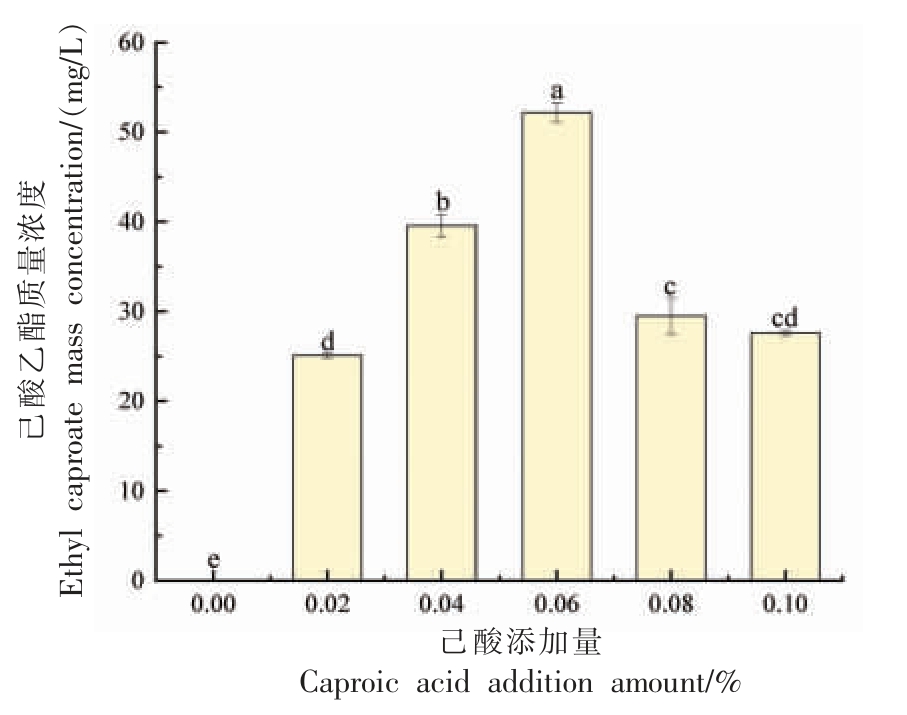
图8 菌株Y4 产己酸乙酯能力与己酸含量的关系
Fig. 8 Relationship between ethyl caproate production capacity of strain Y4 and caproic acid addition amount
2.4.5 高粱酶解液糖度对菌株Y4 产己酸乙酯能力的影响 鉴于高粱等粮谷是酿造浓香型白酒的主要原料,因此选用了高粱酶解液作为发酵培养基,以研究菌株Y4 合成己酸乙酯的能力。结果如图9 所示,随着培养基中糖度的不断增加,己酸乙酯的质量浓度呈现出增加的趋势,当含糖量为10~14°Bx 时,己酸乙酯含量最高,这可能是由于酵母Y4 具有较好葡萄糖耐受性。
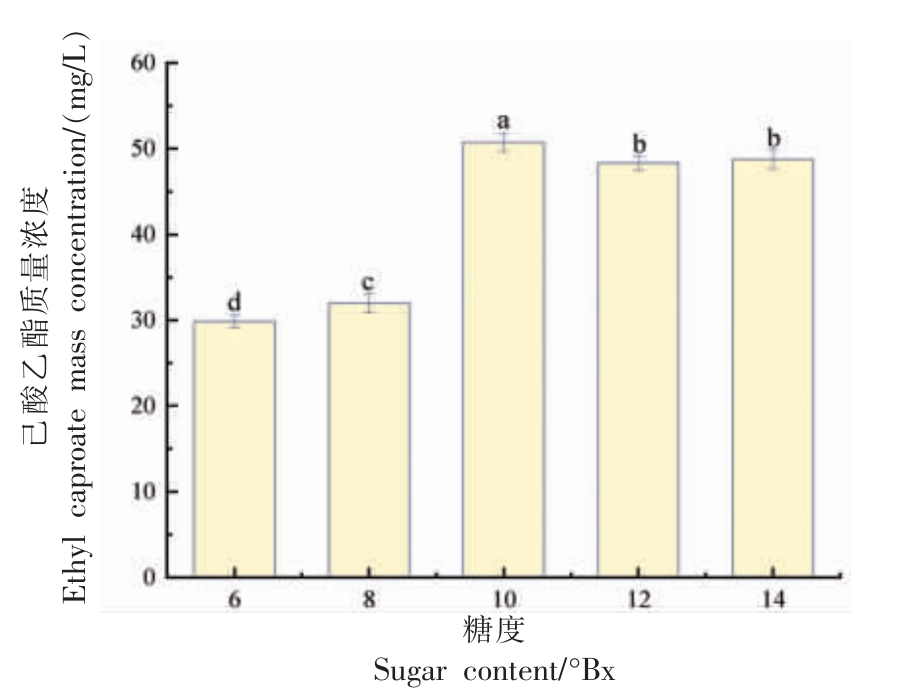
图9 菌株Y4 产己酸乙酯能力与高粱酶解液糖度的关系
Fig. 9 Relationship between ethyl caproate production capacity of strain Y4 and sugar content of sorghum enzymatic solution
2.4.6 高粱酶解液pH 值对菌株Y4 产己酸乙酯能力的影响 pH 值会抑制微生物中部分酶的活性。pH 值不同,酵母细胞的生长以及代谢过程也有所不同[25]。由图10 可知,在初始pH 值为7.0时,菌株Y4 合成己酸乙酯的量达到峰值,即40.9 mg/L。该菌株在此pH 值下生长良好,这表明己酸乙酯的合成可以通过调节发酵过程中的pH 值来调节。
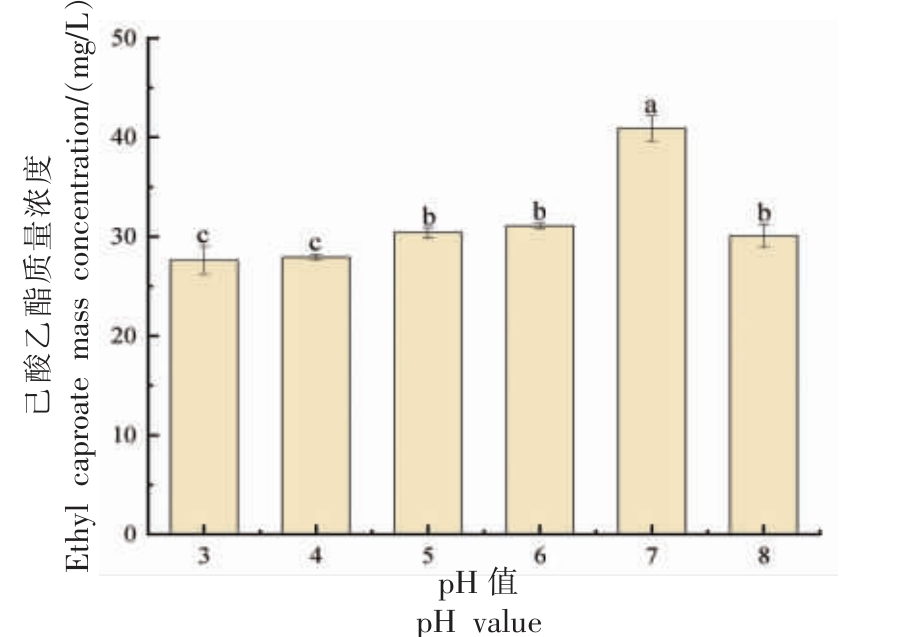
图10 菌株Y4 产己酸乙酯能力与高粱酶解液pH 值的关系
Fig. 10 Relationship between ethyl caproate production capacity of strain Y4 and pH value of sorghum enzymatic solution
2.4.7 发酵时间对菌株Y4 产己酸乙酯能力的影响 如图11 所示,菌株Y4 在培养0~24 h 时,没有己酸乙酯生成,这是由于没有添加无水乙醇和己酸,这表明菌株Y4 在没有前体物质时不能合成己酸乙酯,这与先前的研究结果一致。在培养基中添加乙醇和己酸后,菌株Y4 开始合成己酸乙酯。在培养48 h 时,菌株Y4 合成己酸乙酯的能力最强,其含量为39.6 mg/L。培养48 h 后,己酸乙酯的含量明显降低,可能是由于前体物质被不断消耗,或者酵母通过其它代谢途径将部分己酸乙酯转化为其它物质。
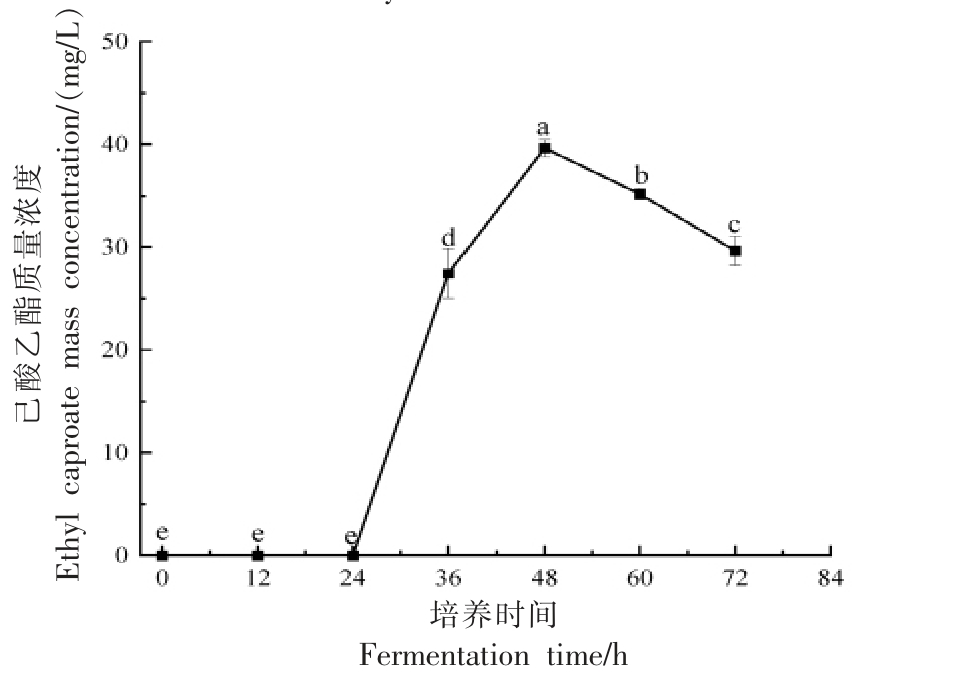
图11 菌株Y4 产己酸乙酯能力与发酵时间的关系
Fig. 11 Relationship between ethyl caproate production capacity of strain Y4 and fermentation time
2.5 菌株代谢产物的GC-MS 分析
白酒的风味由酯类、醇类、有机酸、吡嗪类和其它芳香族化合物等多种挥发性物质共同构成,这些物质在白酒中的比例和含量对风味的形成尤为重要[25]。为了深入分析菌株Y4 在不同发酵阶段产生的风味代谢物质,本研究采用了顶空固相微萃取结合气质-质谱联用分析方法,对发酵不同时间(0,10,20,30 d)的样品的风味成分进行了测定。酯类物质的形成依赖于酵母菌的代谢作用[26],如图12a 所示,在发酵初期(0 d),对照组和试验组中的总酯含量差异不显著;随着发酵时间的延长至10,20,30 d 时,试验组酒醅的总酯含量均高于对照组,可能是发酵过程中酿酒酵母的加入,使发酵过程中的乙醇含量增加,乙醇正是合成酯类物质的前体物质,从而生成了较多的酯类物质。醇类物质是酵母菌产生酒精时的代谢产物,它使酒体呈微甜味,从而协调白酒风味[27],由图12b可知,与对照组相比,试验组的总醇含量均有明显提升,可能是在此期间酿酒酵母发挥了重要作用,产生乙醇。酸类物质是白酒中重要的呈味物质[28],从图12c 可以看出,试验组酒醅在发酵过程中总酸的含量整体呈现上升趋势。在发酵初期,可以观察到对照组酒醅的总酸含量相对较高。这一现象可能归因于试验组在发酵过程中引入了酿酒酵母,使乙醇含量增加,从而增加了酸和醇的酯化反应,这与总酯含量结果相符。在发酵后期试验组酒醅的总酸相对较高,可能是试验组酒醅在发酵后期酵母菌丰度下降,产酸菌大量繁殖。如图12d 所示,试验组酒醅中检测到的其它风味物质含量普遍比对照组高,这一趋势可能源于酿酒酵母的加入可能改变了微生物之间的相互作用,对酒醅中微生物群落结构产生了影响,促进了部分风味物质的生成,从而提高了酒醅中风味物质的丰富度。
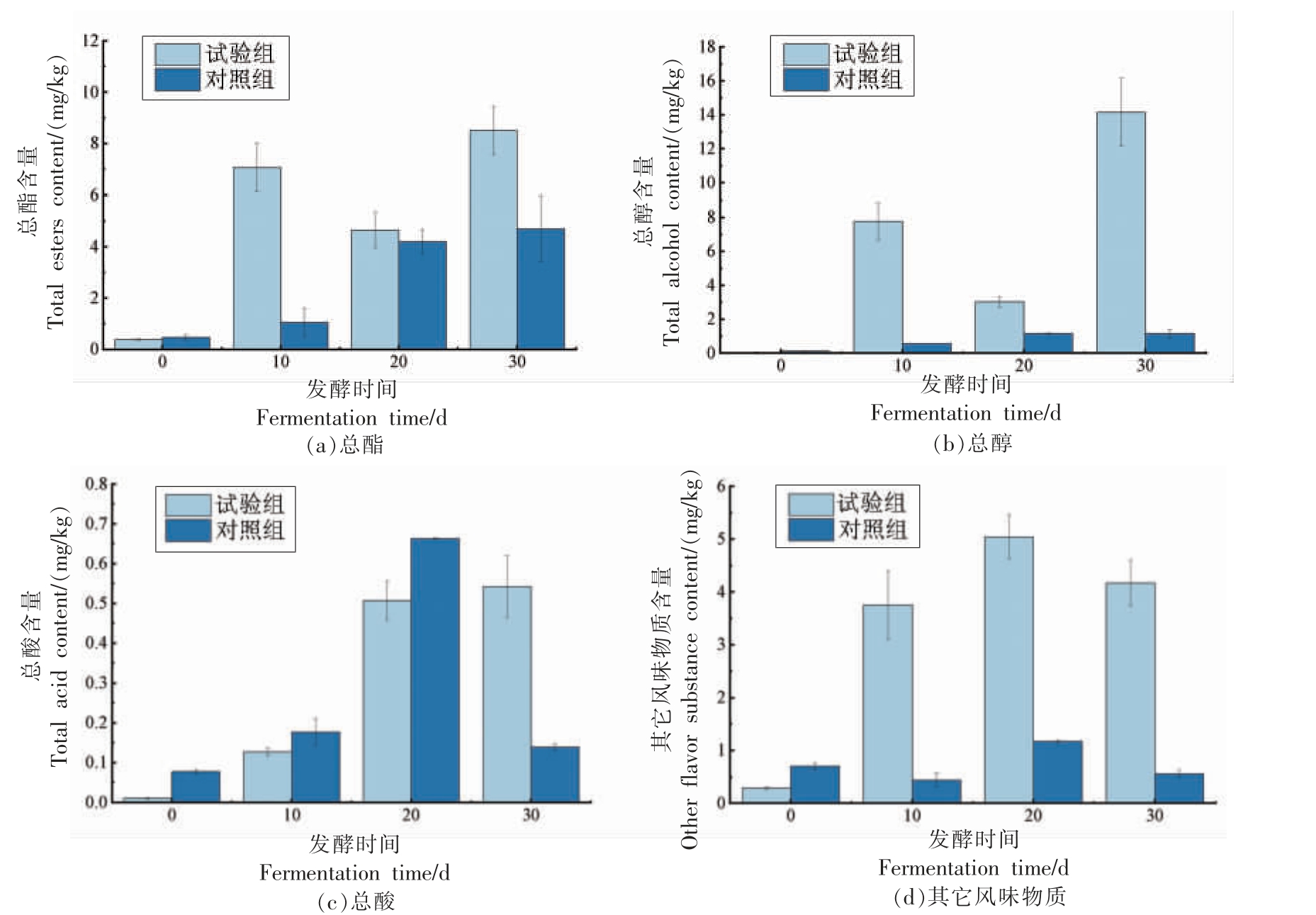
图12 对照组及试验组酒醅总酯、总醇、总酸及其它风味物质含量变化
Fig. 12 Changes of total esters,total alcohols,total acids and other flavor substances in fermented grains in control group and experience group
3 结论
在白酒发酵过程中,产香酵母的加入增加了白酒中酯类物质含量和种类,丰富酒体风味,从而提升白酒的品质[29]。为此,本研究从浓香型白酒大曲中分离纯化获得10 株产己酸乙酯得菌株,最终筛选出1 株产己酸乙酯的菌株Y4,其己酸乙酯产量为39.1 mg/L。结合菌株形态学特征和分子生物学鉴定,确定该菌株为酿酒酵母,该酵母菌株展现出对氯化钠(NaCl)、葡萄糖、乙醇、己酸以及不同酸碱度的耐受性。通过优化其合成己酸乙酯的发酵条件,发现在培养基的糖度设定为10°Bx,初始pH 值控制在7.0,添加6%的乙醇、0.04%的己酸,保持25 ℃的培养温度,并进行48 h 静置发酵的条件下,所得到的培养基中己酸乙酯的质量浓度最高,可达到52.2 mg/L。菌株Y4 发酵产物酯类化合物相对含量达到了39.4%,其中以己酸乙酯为主。结果表明,菌株Y4 具有优良特性,可应用于白酒酿造过程中,丰富功能菌群,增加白酒发酵过程中己酸乙酯的含量。
[1] ZOU W,YE G,ZHANG K.Diversity,function,and application of clostridium in chinese strong flavor Baijiu ecosystem:A review[J].Journal of Food Science,2018,83(5):1193-1199.
[2] ZHANG H M,MENG Y J,WANG Y L,et al.Prokaryotic communities in multidimensional bottompit-mud from old and young pits used for the production of Chinese strong -flavor Baijiu [J].Food Chemistry,2020,312:126084.
[3] ZHENG X W,HAN B Z.Baijiu(白酒),Chinese liquor:History,classification and manufacture [J].Journal of Ethnic Foods,2016,3(1):19-25.
[4] XU Y Q,ZHAO J R,LIU X,et al.Flavor mystery of Chinese traditional fermented Baijiu:The great contribution of ester compounds[J].Food Chemistry,2022,369:130920.
[5] 侯雅馨,王俊山,武亚帅,等.浓香型白酒微量成分的研究进展[J].食品研究与开发,2022,43(20):194-205.HOU Y X,WANG J S,WU Y S,et al.Research progress on the trace components of strong-aroma Baijiu[J].Food Research and Development,2022,43(20):194-205.
[6] WEI Y,ZOU W,SHEN C H,et al.Basic flavor types and component characteristics of Chinese traditional liquors:A review[J].Journal of Food Science,2020,85(12):4096-4107.
[7] HE G Q,HUANG J,ZHOU R Q,et al.Effect of fortified Daqu on the microbial community and flavor in Chinese strong-flavor liquor brewing process[J].Front Microbiol,2019,10:56.
[8] 袁海珊,刘功良,白卫东,等.产酯酵母在发酵食品中的应用研究进展[J].中国酿造,2023,42(1):15-20.YUAN H S,LIU G L,BAI W D,et al.Research progress on the application of ester-producing yeast in fermented food[J].Chinese Brewing,2023,42(1):15-20.
[9] PIRES E J,TEIXEIRA J A,BRÁNYIK T,et al.Yeast:The soul of beer's aroma -A review of flavour-active esters and higher alcohols produced by the brewing yeast[J].Applied Microbiology and Biotechnology,2014,98(5):1937-1949.
[10] 郭燕,邓杰,任志强,等.响应面优化酿酒酵母与窖泥酯化细菌协同发酵产丁酸乙酯和己酸乙酯[J].食品科学,2021,42(10):209-217.GUO Y,DENG J,REN Z Q,et al.Optimization of the production of ethyl hexanoate and ethyl butyrate by cofermentation of Saccharomyces cerevisiae and esterifying bacteria from pit mud of Chinese Baijiu using response surface methodology[J].Food Science,2021,42(10):209-217.
[11] 张建敏,杨康卓,刘芳,等.一株产香假丝酵母的筛选及其特征代谢风味物质分析[J].酿酒科技,2020,318(12):34-37,43.ZHANG J M,YANG K Z,LIU F,et al.Isolation of an aroma-producing Candida pseudohumilis strain and analysis of its typical flavoring metabolites[J].Liquor-making Science &Technology,2020,318(12):34-37,43.
[12] LI W W,FAN G S,FU Z L,et al.Effects of fortification of Daqu with various yeasts on microbial community structure and flavor metabolism[J].Food Research International,2019,129:108837.
[13] HE G Q,HUANG J,WU C D,et al.Bioturbation effect of fortified Daqu on microbial community and flavor metabolite in Chinese strong -flavor liquor brewing microecosystem[J].Food Research International,2020,129:108851.
[14] FAN G S,SUN B G,XU D,et al.Isolation and identification of high-yield ethyl acetate-producing yeast from Gujinggong Daqu and its fermentation characteristics[J].Journal of the American Society of Brewing Chemists,2018,76(2):117-124.
[15] PRATT P L,BRYCE J H,STEWART G G.The effects of osmotic pressure and ethanol on yeast viability and morphology[J].Journal of the Institute of Brewing,2003,109(3):218-228.
[16] 应静,游玲,邱树毅,等.温度对浓香型白酒发酵的影响[J].中国酿造,2018,37(8):75-81.YING J,YOU L,QIU S Y,et al.Effect of temperature on fermentation of strong-flavor Baijiu[J].Chinese Brewing,2018,37(8):75-81.
[17] HASHEM M,ALAMRI S A,ASSERI T,et al.On the optimization of fermentation conditions for enhanced bioethanol yields from starchy biowaste via yeast co-cultures[J].Sustainability,2021,13(4):1890.
[18] LI Y F,LONG H,JIANG G L,et al.Protective effects of thiamine on Wickerhamomyces anomalus against ethanol stress[J].Frontiers in Microbiology,2022,13:1057284.
[19] YANG R,LIU P X,CHANG X,et al.Optimization of fermentation conditions for production of ethyl caproate in Baijiu using a selected isolate of Saccharomyces cerevisiae[J].Emirates Journal of Food and Agriculture,2022,34(1):59-69.
[20] 秦立芹,殷欢,成柳洁,等.一株高产己酸乙酯酵母菌株的筛选、鉴定及发酵条件优化[J].食品与发酵工业,2022,48(1):55-61.QIN L Q,YIN H,CHENG L J,et al.A yeast isolate with high yield of ethyl caproate:Screening,identification and fermentation optimization[J].Food and Fermentation Industries,2022,48(1):55-61.
[21] 许春艳,孙宝国,徐友强,等.合成己酸乙酯酯化酶产生菌的鉴定及产酶条件优化[J].中国食品学报,2020,20(5):138-147.XU C Y,SUN B G,XU Y Q,et al.Identification of ethyl hexanoate synthesis esterifying enzymes production strain and its enzyme production conditions optimization[J].Journal of Chinese Institute of Food Science and Technology,2020,20(5):138-147.
[22] CHEN Y,LUO W,GONG R,et al.Improved ethyl caproate production of Chinese liquor yeast by overexpressing fatty acid synthesis genes with OPI1 deletion [J].Journal of Industrial Microbiology &Biotechnology,2016,43(9):1261-1270.
[23] 刘朋肖,常煦,成柳洁,等.酿酒酵母Y3401 产己酸乙酯发酵条件的优化[J].中国食品学报,2022,22(2):178-189.LIU P X,CHANG X,CHENG L J,et al.Opti-mization of cultural conditions for ethyl caproate production from Saccharomyces cerevisiae Y3401 by response surface methodology[J].Journal of Chinese Institute of Food Science and Technology,2022,22(2):178-189.
[24] KURIBAYASHI T,KANEOKE M,WATANABE K I.Analysis of free fatty acids in sake by enzymatic method:Its application for estimating ethyl caproate[J].Journal of the Brewing Society of Japan,2012,107(9):624-631.
[25] 赵海超.pH 对酿酒酵母转录组的影响[D].呼和浩特:内蒙古农业大学,2020.ZHAO H C.Effect of pH on yeast transcripiome[D].Hohhot:Inner Mongolia Agricultural University,2020.
[26] 李欢欢,曾雪莹,谢娟,等.产香酵母的筛选鉴定及产酯条件优化[J].中国酿造,2022,41(6):87-92.LI H H,ZENG X Y,XIE J,et al.Screening and identification of aroma-producing yeasts and optimization of ester production conditions[J].Chinese Brewing,2022,41(6):87-92.
[27] 王晓丹,白晓燕,朱国军,等.HPLC-ELSD 法同时测定酵母发酵液中的多元醇[J].中国酿造,2018,37(3):162-165.WANG X D,BAI X Y,ZHU G J,et al.Simultaneous determination of polyhydric alcohols in yeast fermentation broth by HPLC-ELSD[J].Chinese Brewing,2018,37(3):162-165.
[28] 张方,张宿义,苏占元,等.有机酸对浓香型白酒品质及其酿造过程影响的研究进展[J].酿酒科技,2016,259(1):94-97,102.ZHANG F,ZHANG S Y,SU Z Y,et al.Research progress in the effects of organic acids on the quality of Nongxiang Baijiu and its production process[J].Liquor-making Science &Technology,2016,259(1):94-97,102.
[29] 彭立影,刘功良,费永涛,等.产酯酵母及其产酯关键酶的研究进展[J].食品与发酵工业,2020,46(14):275-282.PENG L Y,LIU G L,FEI Y T,et al.Research progress of ester-producing yeast and its key enzymes for esters synthesis[J].Food and Fermentation Industries,2020,46(14):275-282.