人类胃肠道中定植着数量庞大、种类繁多的微生物,这些微生物统称为“肠道菌群”[1]。肠道菌群与宿主的营养吸收、代谢和免疫等功能密切相关[2]。菌群失调会增加肥胖、糖尿病及炎症性肠病等很多慢性疾病的患病风险[3]。除受宿主遗传和环境因素等影响外,饮食也是影响肠道菌群的重要因素[4]。在上消化道不被消化的碳水化合物可以到达结肠而被肠道菌群发酵,产生包括气体、短链脂肪酸等在内的一系列代谢产物。其中,大约95%的短链脂肪酸可以被结肠细胞快速吸收,而未被吸收的部分则通过粪便排出体外[5]。研究表明,短链脂肪酸,尤其是丁酸,不仅是结肠上皮细胞的主要能量来源,还与结肠炎症和结肠癌的发生和发展密切相关[6],在维持结肠健康方面发挥着重要的作用。
淀粉作为人们日常生活中的主要碳水化合物来源,其在肠道中的消化和发酵特性对人体健康至关重要。在人体小肠中未被消化的淀粉(又称为抗性淀粉)会进入结肠,被肠道菌群利用,进而改善菌群结构并产生诸如短链脂肪酸等代谢产物。马铃薯淀粉作为一种典型的2 型抗性淀粉,其在肠道中的发酵特性已被研究。例如,体外发酵试验发现,相比于普通玉米淀粉和蜡质玉米淀粉,马铃薯淀粉具有较慢的体外发酵速率及高丁酸产量[7]。动物实验表明,相比玉米、小麦和大米淀粉,马铃薯淀粉能够显著增加小鼠粪便中阿克曼菌属(Akkermansia)、理研菌科(Rikenellaceae)的相对丰度[8],以及改善高脂饮食诱导大鼠的肠道菌群失调及炎症的发生[9]。大多数淀粉在食用前都要经过一定程度的热加工,导致其酶抗性降低,到达结肠的抗性淀粉量减少。然而,在一些情况下,如淀粉被亲水胶等物质包裹后,很多可消化的淀粉能够逃脱小肠的消化而到达结肠,成为肠道菌群的发酵底物[10]。然而,关于可消化性淀粉在结肠中的发酵特性还鲜有报道。
本文以马铃薯淀粉为研究对象,通过精准控制水分含量和加热温度,制备出一系列不同凝胶化程度的淀粉样品,利用体外粪便发酵模型探究其发酵特性,测定其在不同发酵时间的产气量、短链脂肪酸产量,并探究不同凝胶化程度的马铃薯淀粉在发酵结束时对肠道菌群组成影响的异同。试验结果对于明确可消化淀粉到达结肠对肠道健康的影响,以及设计开发靶向改善结肠健康的淀粉类食品具有重要的理论意义。
1 材料与方法
1.1 材料、仪器与设备
1.1.1 材料与试剂 马铃薯淀粉、低聚果糖(Fructooligosaccharide,FOS)、半胱氨酸盐酸盐,美国Sigma 公司;硫酸亚铁、硫酸锰、硫酸锌、氯化钴等无机盐,国药集团化学试剂公司;4-甲基戊酸,上海麦克林生化科技公司。
1.1.2 仪器与设备 HJ-M6 数显恒温磁力搅拌水浴锅,江苏新春兰科技公司;FE20/EL20 pH 计,上海梅特勒-托利多公司;TG16-WS 台式高速离心机,湘仪离心机仪器公司;Scientz-10N 真空冷冻干燥器,宁波新芝生物科技公司;DSC200 F3 示差扫描量热仪,德国Netzch 公司;GC-2010 Plus 热脱附气相色谱,日本Shimadzu(岛津)公司;ZBFFAP 熔融石英毛细管柱,美国Scientific 公司;SU3800 扫描电子显微镜,日本日立公司;HV-85高压灭菌锅,重庆雅马拓科技公司;FE20/EL20 冷冻研磨仪,上海梅特勒-托利多公司;YQX-Ⅱ厌氧培养箱,上海新苗公司;SW-CJ-2G 超净工作台,苏州净化设备公司。
1.2 试验方法
1.2.1 不同凝胶化程度马铃薯淀粉样品的制备不同凝胶化程度的马铃薯淀粉的制备方法参考Wang 等[11]的报道并略作修改。准确称取10 g 马铃薯淀粉(水分含量为16.0%)于聚丙烯袋中,加入适量蒸馏水制成不同水分含量(50%,45%,40%,50%,60%,湿基)的淀粉样品。将淀粉与水充分混合后,分别于特定的对应温度(56,64,66,66,71℃)下加热10 min。加热完成后立即放入液氮速冻10 min,冻干,研磨成粉。
准确称取3 mg 上述加热淀粉于40 μL 的铝盘中,向其中加入9 μL 蒸馏水,将制备好的样品在室温下平衡12 h,然后进行示差扫描量热分析。以空铝盘坩埚为参比,测定温度范围为20~100℃,扫描速度为10 ℃/min。所有样品的测定至少重复3 次。淀粉的凝胶化程度(Degree of gelatinization,DG)计算公式[12]如下:
式中,ΔH热处理淀粉——加热淀粉的焓值,J/g;ΔH天然淀粉——天然淀粉的焓值,J/g。
1.2.2 体外发酵试验 以天然马铃薯淀粉和上述不同凝胶化程度的马铃薯淀粉为底物,根据略作修改后的Lebet 等[13]的方法进行体外发酵试验。将配制好的碳酸-磷酸缓冲液于121 ℃下高温灭菌20 min,趁热加入半胱氨酸盐酸盐,随即冲入CO2,待溶液从蓝色变成粉色,转入厌氧箱中放置过夜,待其变为无色后使用。
新鲜粪便样本取自天津科技大学食品科学与工程学院招募的3 名健康供体(1 男2 女,18.5 kg/m2 <BMI <24.9 kg/m2)[14]。供体的选择标准主要包括:1)无饮食限制和任何消化疾病史;2)过去至少3 个月内未服用任何抗生素;3)过去两周内未服用任何益生菌产品。等量收集3 名供体的新鲜粪便并立即转入厌氧箱中,使用预还原的碳酸-磷酸缓冲液对粪便样品进行稀释(m粪便∶V缓冲液=1∶4),随后用4 层纱布过滤后收集粪便菌液。准确称量50 mg 淀粉于预先灭菌好的西林瓶中,然后分别加入1 mL 菌液和4 mL 缓冲液,充分混匀后立即用橡胶塞和铝盖密封,并移至37 ℃恒温水浴锅中进行孵育培养。以上所有工作均在粪便收集之后的2 h 内完成。在发酵不同时间点(0,4,8,12 h和24 h)测定其气体产量和pH 值,将不同发酵时间点的发酵液等分至2 mL Eppendorf 管,于-80℃下冷冻保存,用于后续的SCFA 和16S rRNA 测序。同时将不同时间点收集的发酵残渣进行冷冻干燥,扫描电子显微镜观察。将添加低聚果糖(FOS)和未添加任何碳水化合物的发酵液分别作为阳性对照和阴性对照。
1.2.3 淀粉样品的结构观察 将不同凝胶化程度的马铃薯淀粉及在不同发酵时间收集的发酵残渣用双面导电胶固定于样品台上,喷金处理,用扫描电子显微镜(SU3800)在5 kV 电压下观察淀粉样品的形貌、结构。
1.2.4 短链脂肪酸(SCFAs)的测定 采用Wang等[15]的方法测定不同时间点发酵液中短链脂肪酸含量。首先,将-80 ℃下的冷冻样品解冻并离心(13 000 r/min,10 min)。取400 μL 上清液与100 μL 含有1.56 mg/mL 硫酸铜、5%偏磷酸和4-甲基戊酸的溶液混合,使用0.45 μm 滤膜过滤后,准确吸取0.2 μL 滤液注入配备熔融石英毛细管柱的气相色谱仪中进行测定。初始柱箱温度设定为80℃,注入器和检测器温度均设置为230 ℃,柱温以8 ℃/min 的速率升至192 ℃后保持3 min。以氮气为载气,流速为1 mL/min。
1.2.5 粪便样本细菌16S rRNA 基因测序
1.2.5.1 样本DNA 提取及V3-V4 区扩增 使用TGuide S96 DNA 试剂盒对解冻样品进行核酸提取,使用Qubit dsDNA HS 试剂盒和Qubit 4.0 荧光仪对样品DNA 浓度进行检测。分别使用引物338F :5′ -ACTCCTACGGGAGGCAGCA -3′ 和806R:5′-GGACTACHVGGGTWTCTAAT-3′对 样本中提取的DNA 进行16S rRNA 基因V3-V4 区域的扩增。扩增完成后,使用Illumina novaseq 6000 对其进行双端测序。
1.2.5.2 生物信息学及多变量统计学分析 测序生成的序列使用QIIME2 中的DADA2 方法去噪[16-17],双端序列拼接并去除嵌合体序列,得到最终有效数据。以SILVA 为参考数据库,使用朴素贝叶斯分类器对特征序列进行分类学注释,可得到每个特征对应的物种分类信息,进而在门(Phylum)和属(Genus)水平上统计、比较并可视化为直方图。为探究微生物的群落变化,采用Shannon、Simpson、Chao 1 和ACE 等指标研究其α-多样性。为进一步明确短链脂肪酸与肠道菌群的相关性,对发酵结束时属水平丰度前15 位的微生物及相应样品的乙酸、丙酸和丁酸浓度进行皮尔逊(Pearson)相关分析并构建相关性热图。
1.2.6 数据处理 试验数据用至少两组平行试验的平均值±方差表示,采用SPSS 统计软件(美国SPSS 公司)进行数据的单因素方差分析(ANOVA),邓肯检验(P<0.05)差异分析。产气及产酸曲线均由GraphPad Prism 软件(Version 7.0,美国GraphPad software 公司)绘制而成。
2 结果与分析
2.1 不同凝胶化程度马铃薯淀粉的制备
不同加热条件处理得到的马铃薯淀粉的热力学参数及其对应的凝胶化程度如表1 所示。可以看出,通过控制加热条件制备出凝胶化程度从16%至100%的凝胶化马铃薯淀粉。在随后的试验中,不同凝胶化淀粉样品采用DGn 的形式表示,n代表凝胶化程度。
表1 马铃薯淀粉样品的热力学参数及其凝胶化程度
Table 1 Thermal transition parameters and degree of gelatinization of potato starch samples
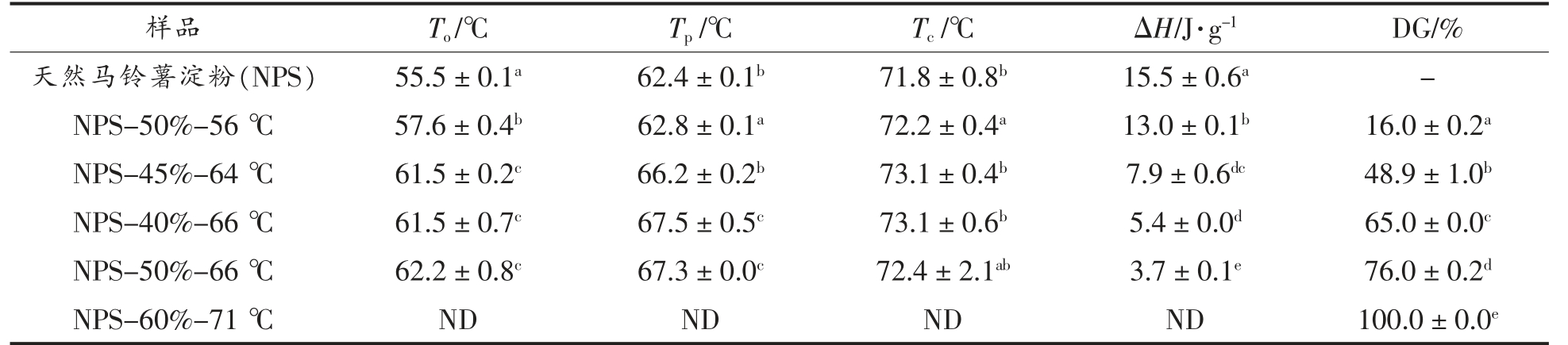
注:图中数据为平均值±标准偏差,同一列不同字母代表差异显著(P<0.05)。ND.未检测出。To.凝胶化起始温度;Tp.凝胶化峰值温度;Tc.凝胶化终止温度;ΔH.凝胶化焓值;DG.凝胶化程度。
2.2 产气量
体外发酵过程中的产气量通常被认为是膳食纤维发酵速率的粗略指标[18]。不同凝胶化程度马铃薯淀粉在不同发酵时间点的产气曲线如图1 所示。低聚果糖(FOS)在整个发酵过程中产气量最高,表明其发酵速率最快。与FOS 相比,天然马铃薯淀粉(NPS)的产气量明显下降,发酵24 h 后,其产气量(~10 mL)仅为FOS 的2/3。在发酵前半段(0~12 h),凝胶化马铃薯淀粉的产气量均高于天然马铃薯淀粉,且随着凝胶化程度的增加,其产气量呈现增加趋势。在发酵后半段(12~24 h),天然马铃薯淀粉(NPS)和低凝胶化淀粉样品(DG16)产气量仍然有显著的增加,其它样品的产气量则不再发生明显的变化,且没有显著性差异。这可能是由于中、高凝胶化程度的淀粉样品在发酵前半段已被快速利用,而天然淀粉(NPS)和低凝胶化程度淀粉(DG16)被利用的相对较慢,导致产气量增加缓慢。前期研究发现,在结肠快速发酵的食物会导致其在结肠近端产生较多的气体,进而引起胀气等肠胃不适应症等不良反应[19]。
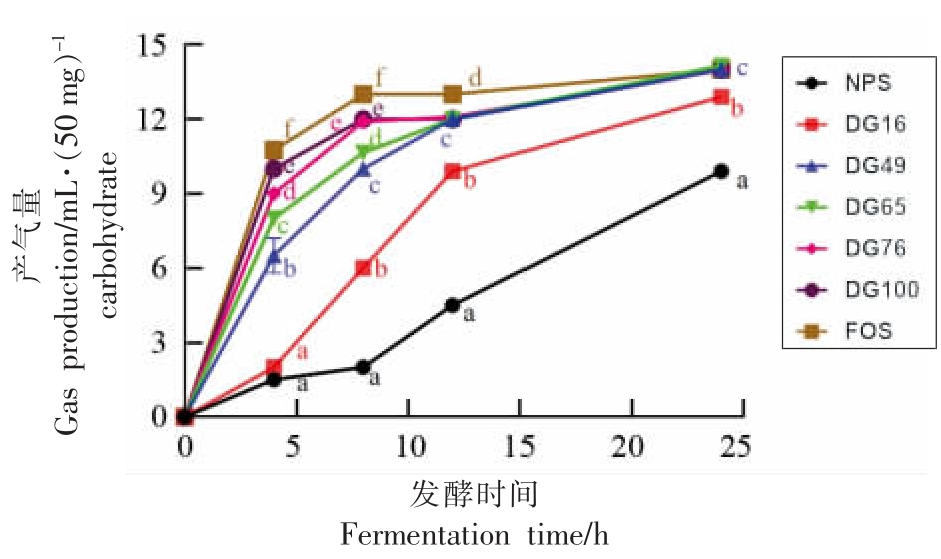
图1 不同凝胶化程度马铃薯淀粉样品在发酵不同时间点的产气曲线
Fig. 1 Gas production curves of potato starch samples with different gelatinization degrees at different fermentation time points
注:不同小写字母表示同一发酵时间点,不同马铃薯淀粉样品的产气量显著性差异(P<0.05)。
2.3 形貌变化
不同凝胶化程度马铃薯淀粉及其在不同发酵时间点样品的扫描电镜图如图2 所示。由于天然淀粉(NPS)和部分凝胶化淀粉样品(DG16、DG49、DG65 和DG76)发酵24 h 后收集不到淀粉残渣,因此仅展示发酵前12 h 的淀粉形貌变化;而对于完全凝胶化的淀粉样品(DG100),发酵8 h 后就收集不到淀粉残渣,仅展示发酵4 h 的形貌变化。不同淀粉样品随着发酵时间的延长表现出不同的形貌变化。天然和低凝胶化程度的马铃薯淀粉样品(DG16)经4 h 发酵,淀粉颗粒表面变得粗糙,少量淀粉颗粒表面出现裂纹,发酵12 h 后仍能观察到相对完整的淀粉颗粒结构。中、高凝胶化程度淀粉样品(DG49、DG65 和DG76)经4 h 发酵,绝大多数淀粉颗粒遭到严重破坏,经12 h 发酵,只剩余淀粉碎片和少数带有孔洞的淀粉残渣。所有淀粉样品在发酵24 h 后无剩余淀粉残渣,表明其几乎被微生物完全降解。对于完全凝胶化淀粉样品,发酵4 h 后只能观察到少量的微小碎片,表明其被微生物严重降解。淀粉发酵过程中微观形貌的变化与其产气量的变化相吻合。


图2 不同凝胶化程度马铃薯淀粉体外发酵前及发酵中的SEM 图
Fig. 2 SEM images of potato starches with different DG before and during in vitro fecal fermentation
注:F4、F8 和F12 分别代表不同样品在体外发酵4,8,12 h 回收的发酵底物。
2.4 pH 值及短链脂肪酸测定
不同凝胶化程度马铃薯淀粉样品在不同发酵时间点的pH 值变化曲线如图3 所示。在发酵前4 h,阳性对照FOS 组和完全凝胶化淀粉组(DG100)pH 值下降最大,而随后的发酵没有显著改变发酵液的pH 值。中、高凝胶化程度的淀粉样品(DG49、DG65 和DG76)在前4 h 的发酵过程中溶液的pH 值也快速下降,随后呈现非常缓慢的下降过程。相比之下,天然马铃薯淀粉(NPS)和低凝胶化程度的淀粉样品(DG16)在前12 h 的发酵过程中,溶液的pH 值虽然出现显著的下降,但是其pH 值均高于其它样品。在随后的12~24 h 发酵过程中,DG16 溶液的pH 值不再发生显著的变化。
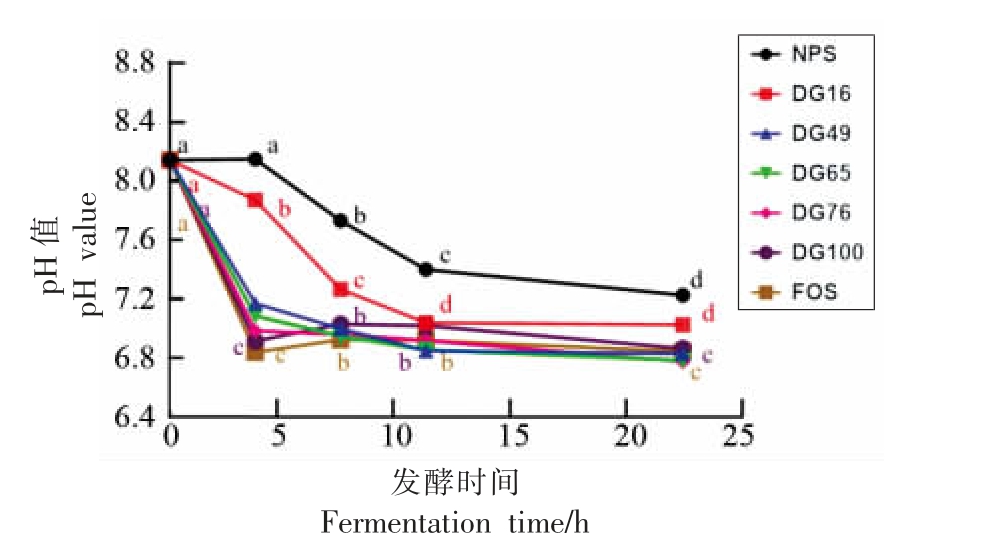
图3 不同凝胶化程度马铃薯淀粉在发酵不同时间点的pH 值变化曲线
Fig. 3 pH value change curves of potato starches with different DG during in vitro fecal fermentation course
注:不同小写字母表示同一样品在不同发酵时间点pH 值间的显著性差异(P<0.05)。
为了更好地了解不同凝胶化程度的淀粉在发酵过程中产短链脂肪酸的差异,测定发酵液中乙酸、丙酸、丁酸和总短链脂肪酸的含量(图4)。低聚果糖在发酵前8 h 快速产生了最高含量的短链脂肪酸(乙酸、丙酸、丁酸及总短链脂肪酸),而在8~24 h,短链脂肪酸的产量几乎没有增加。相比之下,中、高凝胶化程度的淀粉样品(DG49、DG65 和DG76)和完全凝胶化淀粉样品(DG100)在发酵前12 h 产生较高含量的短链脂肪酸,且随着凝胶化程度的增加呈现逐渐增加的趋势,随后的发酵阶段(12~24 h)几乎没有发生明显的变化。天然马铃薯淀粉和低凝胶化程度淀粉(DG16)在整个发酵过程中,短链脂肪酸的含量都在缓慢增加,发酵24 h 后,其产生的短链脂肪酸量(除丁酸外)均低于其它底物。发酵结束时,除完全凝胶化的淀粉样品(DG100),所有淀粉样品的丁酸产量均高于低聚果糖,表明部分凝胶化后的马铃薯淀粉,尤其是中、低凝胶化程度的淀粉(DG16 和DG49)是良好的丁酸来源底物。

图4 不同凝胶化程度马铃薯淀粉样品在不同发酵时间的乙酸(a)、丙酸(b)、丁酸(c)和总短链脂肪酸(d)的产量图
Fig. 4 Acetate(a),propionate(b),butyrate(c)and total SCFA(d)production of potato starch samples with different DG at different fermentation time
2.5 肠道菌群分析结果
2.5.1 α-多样性分析 为了评估体外发酵24 h后不同底物的细菌群落生态特征,对细菌的α-多样性指数进行测定。其中,Chao 1 指数和ACE 指数主要用于衡量物种的丰富度,Shannon 指数和Simpson 指数用于反映物种的多样性[20]。不同样品发酵后菌群的α-多样性指数如表2 所示。与空白组相比,所有样品的菌落丰富度指数(ACE 指数和Chao 1 指数)和群落多样性指数(Simpson 指数和Shannon 指数)均有所增加;相较于阳性对照FOS,天然马铃薯淀粉及不同凝胶化程度的马铃薯淀粉(DG65 除外)样品组表现出更高的丰富度指数(ACE 指数和Chao 1 指数)和更高的群落多样性指数(Simpson 指数和Shannon 指数),尽管这些数据之间的统计学差异不是很明显。这些结果表明,不同凝胶化程度的淀粉发酵后均能一定程度地提高菌群的丰富度和多样性。
表2 不同凝胶化程度马铃薯淀粉体外发酵24 h 后的α-多样性指数
Table 2 α-diversity indices of potato starch with different DG after 24 h of in vitro fermentation
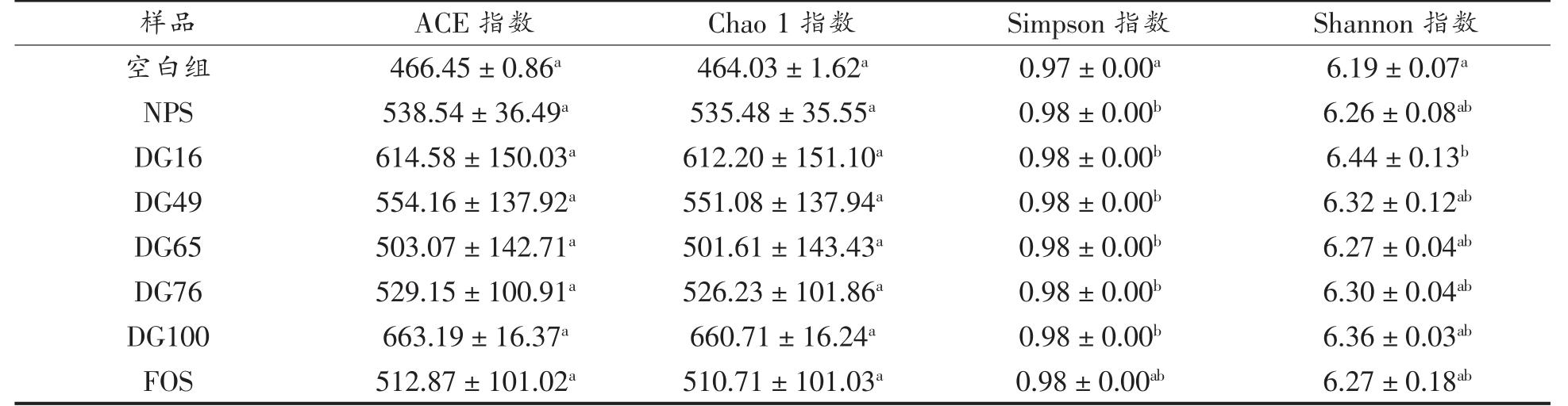
注:表中同一列不同字母代表差异显著(P<0.05)。
2.5.2 门水平及属水平的物种丰度变化 不同凝胶化程度马铃薯淀粉发酵对肠道菌群在门水平相对丰度的影响如图5 所示。由图可知,厚壁菌门和拟杆菌门是肠道菌落的主导菌群,其相对丰度占据总细菌群落的90%以上。除此之外,变形菌门、放线菌门及脱硫杆菌门的丰度也相对较高。与空白组相比,FOS 组的厚壁菌门的相对丰度呈略微下降趋势;天然马铃薯淀粉和低凝胶化程度的马铃薯淀粉样品(DG16)组的拟杆菌门丰度增加,而厚壁菌门丰度减少。中、高凝胶化程度的马铃薯淀粉组(DG49、DG65 和DG76)和完全凝胶化淀粉组(DG100)在门水平的菌群变化要小于天然淀粉和低凝胶化淀粉组,与FOS 组类似。与空白对照相比,所有样品组的变形菌门的丰度均有所下降。

图5 不同凝胶化程度马铃薯淀粉体外发酵24 h 后对肠道菌群门水平物种丰度的影响
Fig. 5 Changes in microbiota composition at phylum level after 24 h of in vitro fermentation of potato starches with different DG
为了进一步明晰不同凝胶化程度导致的细菌群落差异,选取发酵24 h 后相对丰度前15 的属进行比较(图6)。与空白组相比,FOS 发酵虽明显促进巨单胞菌属(Megamonas)的生长,但降低了粪杆菌属(Faecalibacterium)和琼脂杆菌属(Agathobacter)的丰度。与FOS 组相比,天然马铃薯淀粉发酵增加了拟杆菌属(Bacteroides)及毛螺菌科(unclassified Lachnospiraceae)的相对丰度,降低了巨单胞菌属的相对丰度;低凝胶化程度的马铃薯淀粉(DG16)发酵对菌群具有类似的影响,增加了罗斯氏菌属(Roseburia)的相对丰度。中、高凝胶化淀粉组(DG49、DG65 和DG76)和完全凝胶化淀粉(DG100)发酵对菌群的影响与FOS 类似,且随凝胶化程度的增加,巨单胞菌属的相对丰度逐渐增加。此外,凝胶化程度为49%的淀粉样品(DG49)在发酵过程中显著增加了丁酸产生菌布劳特氏菌属(Blautia)的相对丰度。
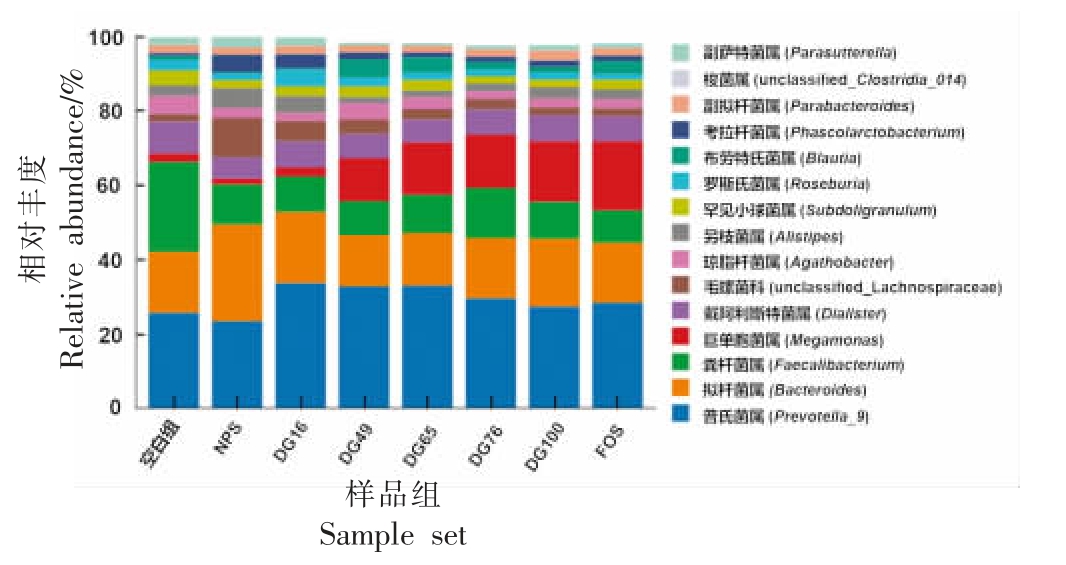
图6 不同凝胶化程度马铃薯淀粉体外发酵24 h 后属水平微生物群物种丰度变化
Fig. 6 Changes in microbiota composition at genus level after 24 h of in vitro fermentation of potato starches with different DG
2.5.3 菌群变化与短链脂肪酸的相关性分析 为进一步明晰菌群变化与短链脂肪酸生成的关系,选取属水平相对丰度前15 的微生物与乙酸、丙酸和丁酸的生成量做相关性分析(图7)。巨单胞菌属的相对丰度与乙酸(P<0.001)和丙酸(P<0.01)的生成量呈现显著的正相关关系,这一结果与之前报道巨单胞菌属可以葡萄糖为发酵底物生成乙酸和丙酸的结果相一致[21],这也很好地解释了FOS 和中、高凝胶化程度淀粉组(DG49、DG65 和DG76)在发酵结束时产生高乙酸和丙酸的原因。毛螺菌科和罗斯氏菌属的相对丰度与丁酸产量呈显著的正相关关系(P <0.001),表明这两种细菌是重要的产丁酸菌,与之前的报道类似[15,22-24]。低凝胶化程度的淀粉样品(DG16)发酵后罗斯氏菌属和毛螺菌科的相对丰度均增加,与其高丁酸产量结果一致(图4c)。由于天然马铃薯淀粉(NPS)发酵使得毛螺菌科的相对丰度增加更多,而其丁酸产量却低于低凝胶化程度的淀粉样品(DG16),这些表明罗斯氏菌属是更为重要的丁酸生成菌。
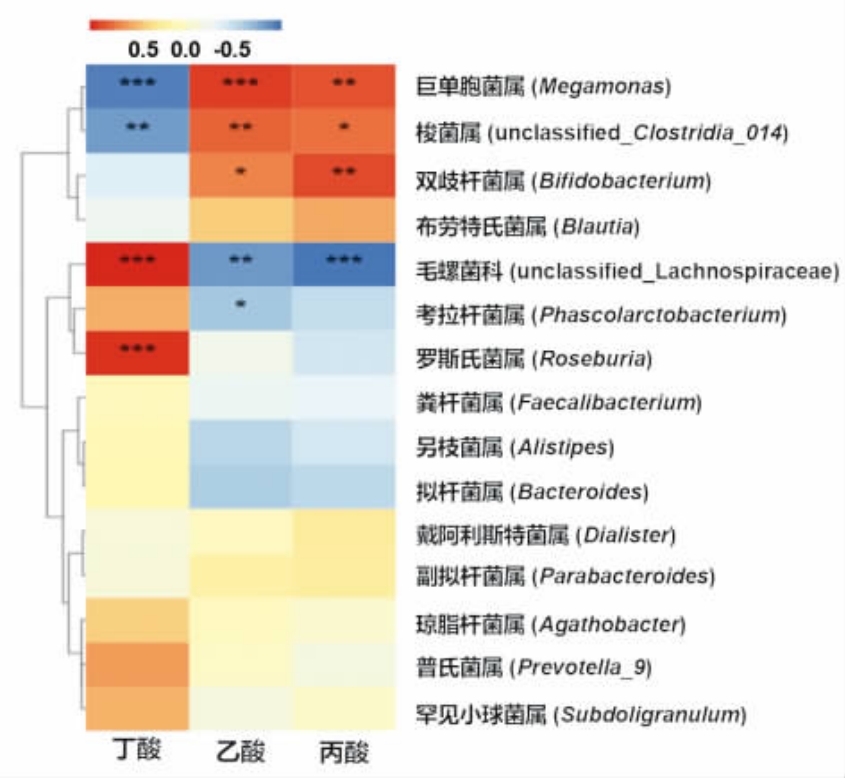
图7 体外发酵24 h 后肠道菌群(属水平)相对丰度与乙酸、丙酸和丁酸生成量的相关性热图
Fig. 7 Heatmap of the relationships between relative abundance of microbiota(genus level)and levels of acetate,propionate and butyrate after 24 h in vitro fermentation
注:*.P <0.05;**.P <0.01;***.P <0.001。
3 结论
本试验研究了不同凝胶化程度马铃薯淀粉的体外发酵特性,观察了其在发酵过程中的形貌变化。结果表明,产气量、乙酸和丙酸产量在发酵前半段(0~12 h)均随凝胶化程度的增加而逐渐上升,而在发酵后半段(12~24 h)不再发生显著的变化。天然淀粉和低凝胶化程度淀粉则在整个发酵过程中缓慢产生气体和短链脂肪酸。低凝胶化程度马铃薯淀粉(DG16)和中等凝胶化程度马铃薯淀粉(DG49)发酵分别促进了丁酸产生菌罗斯氏菌属、毛螺菌科和布劳特氏菌属的生长,导致其在发酵结束时具有最高的丁酸产量。中、高凝胶化程度淀粉组(DG49、DG65 和DG76)更好地促进了巨单胞菌属的增值,导致在发酵结束时产生较高的乙酸和丙酸。综上,中、低凝胶化淀粉马铃薯淀粉(DG16、DG49)可以通过促进产丁酸菌的微生物生长及丁酸的产生来改善结肠健康,是潜在调控肠道健康功能性食品的优良底物选择。
[1] THURSBY E,JUGE N.Introduction to the human gut microbiota[J].Biochemcal Journal,2017,474(11):1823-1836.
[2] HOU K J,WU Z X,CHEN X Y,et al.Microbiota in health and diseases[J].Signal Transduct and Targeted Therapy,2022,7(1):135.
[3] AFZAAL M,SAEED F,SHAH Y A,et al.Human gut microbiota in health and disease:Unveiling the relationship[J].Frontiers in Microbiology,2022,13:999001.
[4] VALDES A M,WALTER J,SEGAL E,et al.Role of the gut microbiota in nutrition and health[J].Science and Politics of Nutrition,2018,361:k2179.
[5] BESTEN G D,EUNEN K V,GROEN A K,et al.The role of short-chain fatty acids in the interplay between diet,gut microbiota,and host energy metabolism[J].Journal of Lipid Research,2013,54(9):2325-2340.
[6] HAMER H M,JONKERS D,VENEMA K,et al.Review article:The role of butyrate on colonic function[J].Alimentary Pharmacology &Therapeutics,2008,27(2):104-119.
[7] WANG S K,DHITAL S,WANG K,et al.Sideby-side and exo-pitting degradation mechanism revealed from in vitro human fecal fermentation of granular starches[J].Carbohydrate Polymers,2021,263:118003.
[8] BANG S J,LEE E S,SONG E J,et al.Effect of raw potato starch on the gut microbiome and metabolome in mice[J].International Journal of Biological Macromolecules,2019,133:37-43.
[9] KLINGBEIL E A,CAWTHON C,KIRKLAND R,et al.Potato-resistant starch supplementation improves microbiota dysbiosis,inflammation,and gutbrain signaling in high fat-fed rats[J].Nutrients,2019,11(11):2710.
[10] CUI C,JIANG H,GUAN M H,et al.Characterization and in vitro digestibility of potato starch encapsulated in calcium alginate beads[J].Food Hydrocolloids,2022,126:107458.
[11] WANG Y H,CHAO C,HUANG H J,et al.Revisiting mechanisms underlying digestion of starches[J].Journal of Agricultural and Food Chemistry,2019,67(29):8212-8226.
[12] BAKS T,NGENE I S,SOEST J J G,et al.Comparison of methods to determine the degree of gelatinisation for both high and low starch concentrations[J].Carbohydrate Polymers,2007,67(4):481-490.
[13] LEBET V,ARRIGONI E,AMADÒ R.Measurement of fermentation products and substrate[J].LWT-Food Science and Technology,1998,31(5):473-479.
[14] WHITE A K,VENN B,LU L W,et al.A comparison of chewing rate between overweight and normal BMI individuals [J].Physiology &Behavior,2015,145:8-13.
[15] WANG S K,ZHANG B,CHEN T,et al.Chemical cross-linking controls in vitro fecal fermentation rate of high-amylose maize starches and regulates gut microbiota composition[J].Journal of Agricultural and Food Chemistry,2019,67(49):13728-13736.
[16] BOLYEN E,RIDEOUT J R,DILLON M R,et al.Reproducible,interactive,scalable and extensible microbiome data science using QIIME 2[J].Nature Biotechnology,2019,37(8):852-857.
[17] CALLAHAN B J,MCMURDIE P J,ROSEN M J,et al.DADA2:High -resolution sample inference from Illumina amplicon data [J].Nature Methods,2016,13(7):581-583.
[18] MCBURNEY M I,CUFF D J,THOMPSON L U.Rates of fermentation and short chain fatty acid and gas production of six starches by human faecal microbiota[J].Journal of the Science of Food and Agriculture,1990,50(1):79-88.
[19] KAUR A,ROSE D J,RUMPAGAPORN P,et al.In vitro batch fecal fermentation comparison of gas and short-chain fatty acid production using 'slowly fermentable' dietary fibers[J].Journal of Food Science,2011,76(5):137-142.
[20] MORRIS E K,CARUSO T,BUSCOT F,et al.Choosing and using diversity indices:Insights for ecological applications from the German Biodiversity Exploratories[J].Ecology and Evolution,2014,4(18):3514-3524.
[21] SAKON H,NAGAI F,MOROTOMI M,et al.Sutterella parvirubra sp.nov.and Megamonas funiformis sp.nov.,isolated from human faeces[J].International Journal of Systematic and Evolutionary Microbiology,2008,58(4):970-975.
[22] PRYDE S E,DUNCAN S H,HOLD G L,et al.The microbiology of butyrate formation in the human colon[J].FEMS Microbiology Letters,2002,217(2):133-139.
[23] RÍOS -COVIÁN D,RUAS -MADIEDO P,MARGOLLES A,et al.Intestinal short chain fatty acids and their link with diet and human health[J].Frontiers in Microbiology,2016,7:185.
[24] VACCA M,CELANO G,CALABRESE F M,et al.The controversial role of human gut Lachnospiraceae[J].Microorganisms,2020,8(4):573.