膳食纤维被称为人体第七大营养素,国际食品法典(Codex Alimentarius Commission,CAC)将膳食纤维定义为“具有10 个或更多单元的碳水化合物(CHO)聚合物,不被人体小肠内的内源性酶水解,包括食物中天然存在的,通过物理、化学或酶方法从食物原料中提取的,人工合成的可食用碳水化合物聚合物”[1]。膳食纤维通常按溶解性被分为可溶性膳食纤维(Soluble dietary fiber,SDF)及不溶性膳食纤维(Insoluble dietary fiber,IDF),前者包括低聚糖、葡聚糖、果聚糖、果胶等,又被称为水溶性多糖,后者包括纤维素、半纤维素、木质素等[2]。较多研究指出SDF 生物降解性、相容性好,低毒性和低致敏活性,功能活性通常较IDF 更优,是生物活性研究和功能食品开发的理想材料[3-5]。
甘薯(Ipomoea batatas [L.] Lam.)属旋花科、番薯属,是我国主要种植和消费的薯类作物之一[6],富含淀粉、可溶性糖、维生素A、钙等多种营养成分,具有替代主粮的潜力[7-8]。此外,甘薯富含膳食纤维,被认为具有通便、改善肠道菌群等多种有益的作用。
国内外学者先、后报道了甘薯膳食纤维的多种生物学活性。郭金颖等[9]报道了5 种甘薯水溶性多糖对DPPH 自由基和羟自由基均有较好的清除效果。Zhao 等[10]从甘薯中分离并鉴定了一种(1→6)-α-D-葡聚糖,验证了其在小鼠体内的免疫调节活性。Liu 等[11]的报道称甘薯渣SDF 可促进体外发酵体系中的益生菌(双歧杆菌和乳杆菌)的增殖,抑制有害菌(肠杆菌、产气荚膜梭菌和拟杆菌)的增长,这一结果在实验大鼠体内得到验证。Sun等[12]由紫甘薯中分离一种碱溶性多糖,该组分可下调结肠炎小鼠体内促炎细胞因子的表达,维护肠道菌群的稳态。Wu 等[13]从紫甘薯中分离出3 种多糖,其中多糖PSPP1-1 表现出较强的抗肿瘤活性,可诱导人胃癌细胞SGC7901 和人结肠癌细胞SW620 凋亡。
目前报道的甘薯膳食纤维主要来源于生鲜甘薯、甘薯皮或甘薯渣。然而,甘薯一般经过蒸熟、去皮后才进入人们的食谱。熟制处理不仅导致甘薯果肉组织结构和物质组成的改变,也可能影响膳食纤维的结构和结合状态,进而影响其理化性质和生物利用率。目前尚未见熟制过程对甘薯SDF影响的相关报道。为此,本文采用Box-behnken 设计和满意度函数优化甘薯SDF 制备工艺,对比研究生鲜甘薯和蒸制甘薯SDF 的理化性质和消化特性,明确蒸制熟化可提高甘薯膳食纤维的可及性,以及对SDF 抗消化性的影响。本研究有助于阐明甘薯的营养健康特性,以及加工处理对其营养品质的影响。
1 材料与方法
1.1 材料与试剂
甘薯,品种:“心香”,市售;高峰α-淀粉酶(100 000 U/g)、糖化酶(100 000 U/g)、胰酶(效价1∶4 000),上海源叶生物科技有限公司;胃蛋白酶(猪源,效价1∶3 000 U),上海阿拉丁生化科技股份有限公司;α-淀粉酶(来源于猪胰腺,≥5 U/mg),西格玛奥德里奇(上海)贸易有限公司;DNS 试剂,福州飞净生物科技有限公司;大豆油,益海嘉里金龙鱼粮油食品股份有限公司。其它化学试剂均为国产分析纯级。
1.2 仪器与设备
ZN28YK809-150 多功能电蒸锅,浙江苏泊尔家电制造有限公司;LGJ-18 真空冷冻干燥机,北京松源华兴科技发展有限公司;YB-2500A 多功能粉碎机,永康市速锋工贸有限公司;SHA-B 恒温振荡器,上海力辰邦西仪器科技有限公司;KQ-400DB 数控超声波清洗器,昆山市超声仪器有限公司;UV-8000 紫外-可见光光分度计,上海元析仪器有限公司;H21000R 台式冷冻离心机,湖南湘仪实验室仪器开发有限公司。
1.3 方法
1.3.1 甘薯原料预处理 选取新鲜、无病害、无残缺、形态大小相近的“心香”甘薯,洗净、去皮、横切成约1.5 cm 厚片。
生鲜甘薯全粉制备:甘薯片冷冻干燥,粉碎,过60 目筛,备用。
蒸制甘薯全粉制备:甘薯片经沸水蒸制20 min,室温放冷后,冷冻干燥,粉碎并过60 目筛,备用。
1.3.2 甘薯SDF 提取制备 采用超声辅助热水提取法获得SDF 提取液。参考孟祥河等[14]的方法制备得到甘薯SDF,具体操作如下:调节提取液的pH 值至6.0,按甘薯粉的质量加入2%高峰氏α-淀粉酶,60 ℃酶解1.5 h;调pH 值至4.5,加入1%糖化酶,60 ℃酶解1 h;调节pH 值至7.0,加入0.5%胰酶,40 ℃酶解1 h。酶解结束后,以4 000 r/min 离心30 min,上清液旋蒸浓缩至原体积的1/5,加入4 倍体积95%乙醇,4 ℃过夜静置,4 000 r/min 离心30 min 收集醇沉物,冷冻干燥得到SDF样品。
生鲜、蒸制甘薯全粉提取制备得到的样品分别记为SDF-F、SDF-S。
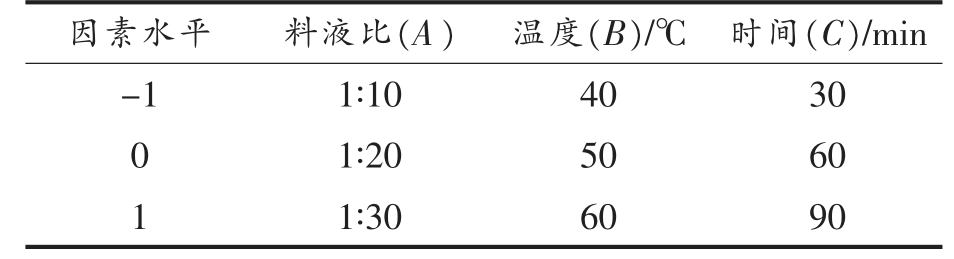
1.3.3 提取工艺响应面优化 在料液比、超声提取温度和提取时间为试验单因素的基础上,以SDF-S 提取得率和提取物中总多糖含量为响应值,采用三因素三水平的Box-Behnken 试验设计对提取参数进行优化。试验因素水平表见表1。
表1 响应面因素及水平
Table 1 Factors and levels of response surface design
1.3.4 甘薯SDF 物质组成测定
1.3.4.1 中性多糖含量测定 采用苯酚-硫酸法测定中性多糖[15]。将样品配制为0.1 mg/mL 溶液,吸取1.0 mL 样品溶液,加入1.0 mL 5%苯酚溶液,再快速加入5.0 mL 浓硫酸,静置10 min,涡旋混匀,然后将试管放置于30 ℃水浴中反应20 min,在波长490 nm 处测定吸光度。以D-葡萄糖为标准品,制作标准曲线,计算中性多糖含量。
1.3.4.2 酸性多糖含量测定 采用间羟基联苯法测定提取物中酸性多糖含量[16]。将样品配制为0.5 mg/mL 溶液,吸取0.4 mL 样品溶液,加入40 μL 4 mol/L 氨基磺酸盐溶液(pH 1.6),再加入2.4 mL 75 mmol/L 四硼酸钠-浓硫酸溶液,涡旋混匀。沸水浴20 min 后,冰浴冷却,再加入80 μL 0.15%间羟基联苯溶液,涡旋混匀,静置15 min,于波长525 nm 处测定溶液吸光度。以半乳糖醛酸为标准品,制作标准曲线,计算样品中的酸性多糖含量。
1.3.4.3 还原糖含量测定 采用3,5-二硝基水杨酸法(3,5-Dinitro salicylic acid,DNS)测定提取物中还原糖含量[17]。将样品配制为1.0 mg/mL 溶液,吸取1.0 mL 样品溶液,加入2.0 mL DNS 试剂,涡旋混匀,沸水浴5 min 后冷却至室温,加入9.0 mL 蒸馏水,混匀后在波长540 nm 处测定吸光度。以D-葡萄糖为标准品,制作标准曲线,计算还原糖含量。
1.3.4.4 膳食纤维含量测定 依据GB 5009.88-2014 《食品安全国家标准 食品中膳食纤维的测定》测定提取物中总膳食纤维含量[18]。
1.3.5 甘薯SDF 性质测定
1.3.5.1 持水力 参考Kaur 等[19]的方法并稍作修改。准确称取一定质量样品于离心管中,按1∶25比例加入蒸馏水,涡旋混匀,室温静置24 h,4 000×g 离心15 min,移除上清液后称量吸水样品质量,按式(1)计算样品持水力:
1.3.5.2 膨胀力 参考Wang 等[20]的方法并稍作修改。准确称取一定质量样品于刻度量筒中,按1∶25 比例加入蒸馏水,室温静置24 h,记录干燥样品体积和膨胀前后总体积,按式(2)计算样品膨胀力:
1.3.5.3 持油力 参考Jiang 等[21]的方法并稍作修改。准确称取一定质量样品于离心管中,按1∶10比例加入大豆油,涡旋混匀,室温静置24 h,4 000×g 离心15 min,移除上层油脂后用滤纸吸取离心管壁上残余的油脂,按式(3)计算样品持油力:

1.3.6 甘薯SDF 模拟消化试验
1.3.6.1 模拟唾液消化 参考Wu 等[22]的方法并稍作修改进行模拟唾液消化试验。模拟唾液由14.54 g/L KSCN、127.49 g/L NaCl、65.16 g/L KCl、61.60 g/L NaHCO3、41.45 g/L Na2SO4、64.58 g/L NaH2PO4、18.18 g/L 尿素和210.90 mg/L α-淀粉酶配制,再以0.1 mol/L HCl 将溶液pH 值调节至6.8。将两种SDF 配制为10 mg/mL 溶液,将5.0 mL SDF 溶液和5.0 mL 模拟唾液混匀,37 ℃水浴150 r/min 振荡模拟唾液消化,于5 min 后取样2.0 mL,立即沸水浴5 min 灭酶并冻存备用。
1.3.6.2 模拟胃消化 参考Goñi 等[23]及Chen等[24]的方法并稍作修改进行模拟胃和小肠消化试验。将0.62 g NaCl、0.22 g KCl、0.05 g CaCl2 和0.12 g NaHCO3 溶于200 mL 蒸馏水,用0.1 mol/L HCl 将溶液pH 值调节至2.0,制备模拟胃电解质液。将1.0 mL 1.0 mol/L CH3COONa(pH 5.0)和23.6 mg 胃蛋白酶加入100.0 mL 模拟胃电解质液中,混匀,再次用0.1 mol/L HCl 将溶液pH 值调节至2.0,制得模拟胃液。用1.0 mol/L HCl 将1.3.6.1节中剩余的模拟唾液消化液的pH 值调节至2.0,加入等体积的模拟胃液,混匀,37 ℃水浴150 r/min 振荡模拟胃消化,于0.5,1 h 和2 h 后取样2.0 mL,立即沸水浴5 min 灭酶并冻存备用。
1.3.6.3 模拟小肠消化 将0.54 g NaCl、0.065 g KCl 和0.033 g CaCl2 溶于100 mL 蒸馏水中,用0.1 mol/L NaOH 溶液将pH 值调节至7.0,制备模拟小肠电解质液。再将100.0 g 4%胆盐溶液和50.0 g 7%胰酶溶液加入50.0 g 模拟小肠电解质液中。用0.1 mol/L NaOH 溶液将pH 值调节至7.5,制得模拟小肠液。用0.1 mol/L NaOH 溶液将1.3.6.2 节中剩余的模拟胃消化液的pH 值调节至7.5,按体积比3∶10(模拟小肠液∶剩余模拟胃消化液)加入模拟小肠液,混匀,37 ℃水浴150 r/min 振荡模拟小肠消化,于0.5,1,2 h 和3 h 后取样2.0 mL,立即沸水浴5 min 灭酶并冻存备用。
1.3.6.4 SDF 水解率测定 按1.3.4.3 节中所述方法测定各阶段模拟消化液中还原糖含量,按式(4)计算各阶段模拟消化SDF 的水解率:

1.3.7 数据分析 试验数据以3 重复的平均值±标准差表示。采用Design-Expert 13.0.1 设计响应面试验,进行模型拟合、方差分析和提取工艺参数优化;采用IBM SPSS Statistics 26 的配对样本t-检验比较两种SDF 的性质差异,P<0.05 视为差异显著。
2 结果与分析
2.1 提取工艺参数对提取得率和总多糖含量的影响
2.1.1 料液比 当提取温度控制在50 ℃,超声提取为60 min 时,料液比对提取得率和总多糖含量的影响见图1a。在料液比为1∶10 时,SDF-S 有最高提取得率【(6.33±0.25)%】;在料液比为1∶20 时,SDF-S 有最高总多糖含量【(53.35±0.71)%】。料液比的适当增大,可使物料细胞内外浓度差增大,有利于SDF-S 的扩散溶出。然而,溶剂量过大时,较大的体积可能影响超声能量的传递[25],也不利于产物收集。

图1 料液比(a)、温度(b)、及时间(c)对SDF-S 提取得率及总多糖含量的影响
Fig. 1 Effects of solid-liquid ratio(a),temperature(b),and time(c)on the yield and total sugar of SDF-S
2.1.2 提取温度 固定料液比为1∶20,提取时间为60 min 时,提取温度对提取得率和总多糖含量的影响见图1b。温度为60 ℃时,SDF-S 有最高提取得率 【(5.73±0.47)%】,SDF-S 的总多糖含量随温度变化表现出先增高后降低的趋势,在50 ℃时,SDF-S 有最高总多糖含量 【(72.19±0.61)%】。温度较低时,分子运动较慢,SDF-S 未充分溶出。温度的升高使体系黏度将降低,溶液也更易因超声形成空化气泡,有利于传质。然而,温度过高则可能引起SDF-S 降解,从而不易被乙醇沉淀,致使提取得率和总多糖含量降低[26]。
2.1.3 提取时间 设定料液比1∶20、提取温度50℃,研究了不同超声提取时间下提取得率和总多糖含量的变化,结果见图1c。当超声时间为30 min 时,SDF-S 有最高提取得率【(5.87±0.21)%】和最高总多糖含量【(61.86±0.75)%】。在30 min 以上,SDF-S 提取得率随时间延长表现出降低趋势,SDF-S 总多糖含量表现出降低-升高-再降低的趋势。超声时间的延长,一方面将引起SDF-S 的降解,另一方面,物料的膨胀水化也将更有利于超声破碎其组织结构,促进SDF-S 的释放,故在90 min 时SDF-S 总多糖含量反而升高[26-27]。
2.2 响应面试验结果与分析
2.2.1 模型拟合与方差分析 响应面提取试验结果见表2。各次试验的SDF 提取得率(Y1)在4.32%~6.40%之间变化,样品中总多糖含量(Y2)介于60.84%~89.85%范围。对2 个响应值的数据进行回归拟合,分别得到以下拟合方程:
表2 Box-Behnken 试验设计与结果
Table 2 Box-Behnken design with experimental results
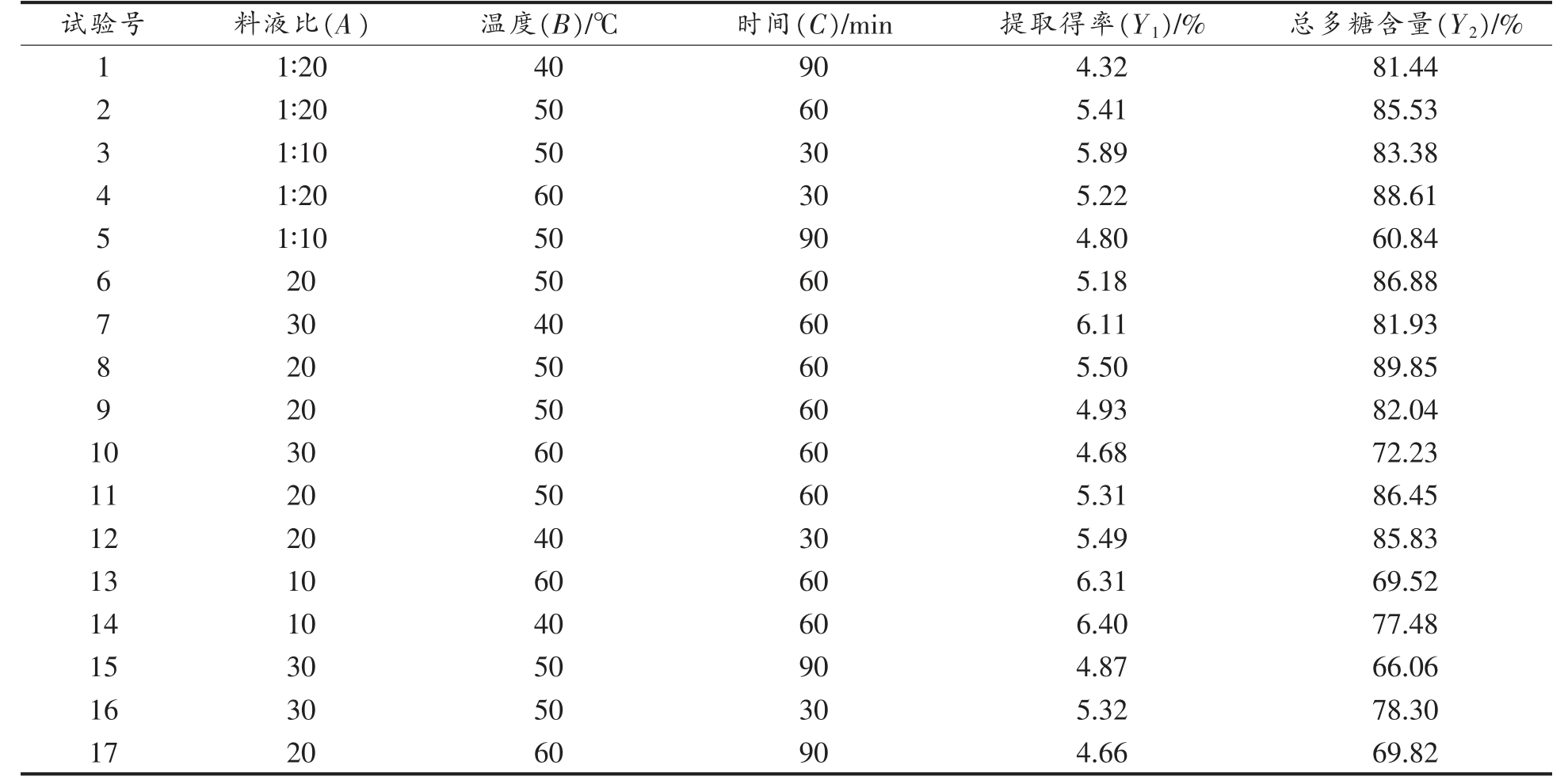
Y1=10.532 -0.085A -0.145B+0.012C -0.003AB+0.001AC+0.001BC+0.005A2+0.002B2-0.001C2;
Y2=9.511+3.822A+1.267B+0.711C -0.004AB+0.008AC-0.012BC-0.101A2-0.008B2-0.004C2。
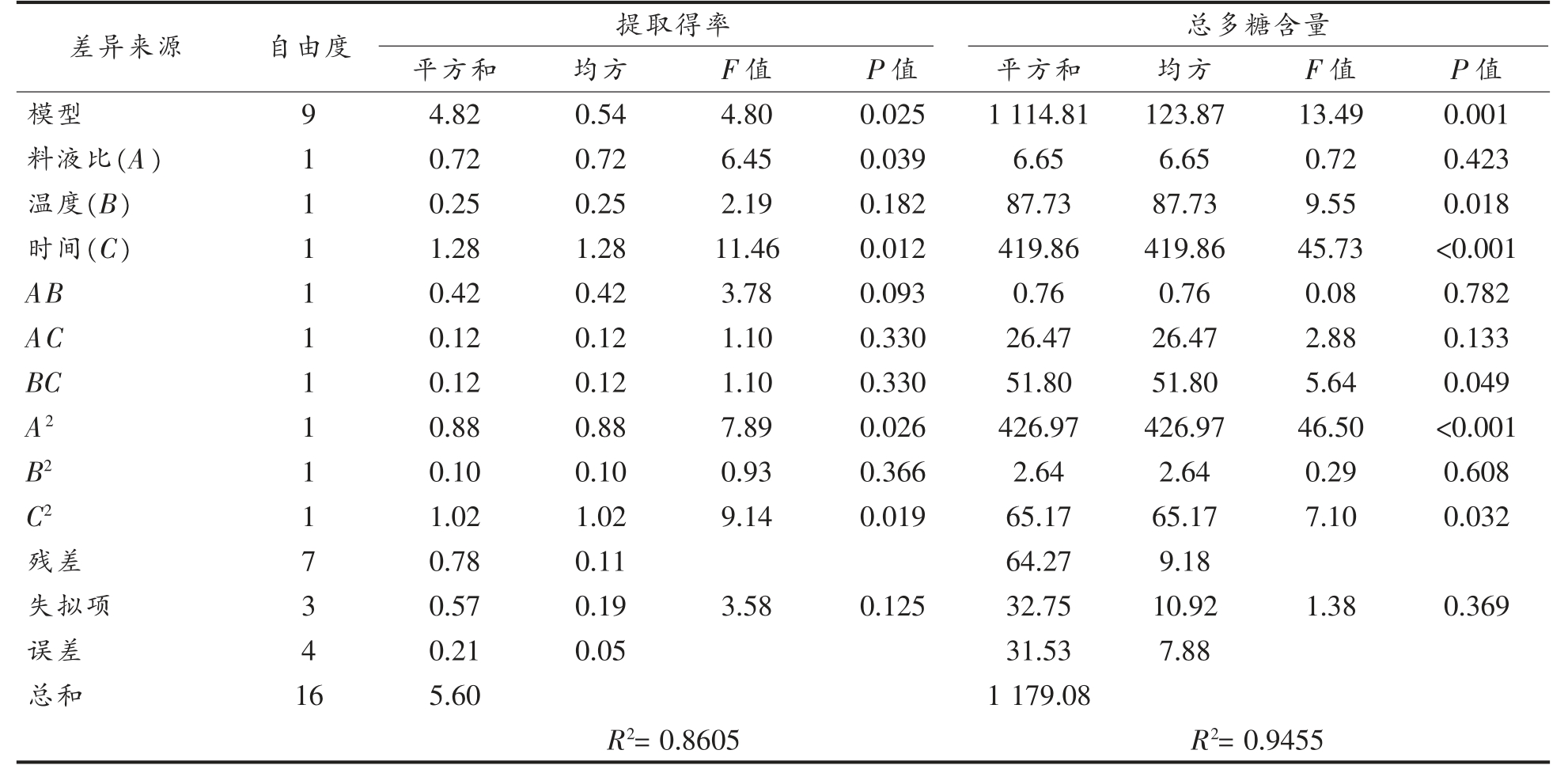
由表3 可知,两个模型均为显著(P<0.05),失拟项检验结果均不显著,R2 分别为0.8605 和0.9455,说明试验数据对模型的拟合度好,只有13.95%和5.45%的方差不能用模型来解释。通过比较回归方程中各项回归系数的绝对值和方差分析的F 值(表3),确定各因素对响应值的影响。对于提取得率,各因素的影响程度依次为:时间(C)>料液比(A)>温度(B);对于总多糖含量,各因素的影响程度依次为:时间(C)>温度(B)>料液比(A)。此外,温度与时间的交互作用对SDF-S 总多糖含量有显著影响(P<0.05),在响应曲面上,表现为坡面较陡,等高线较为密集(图2)。
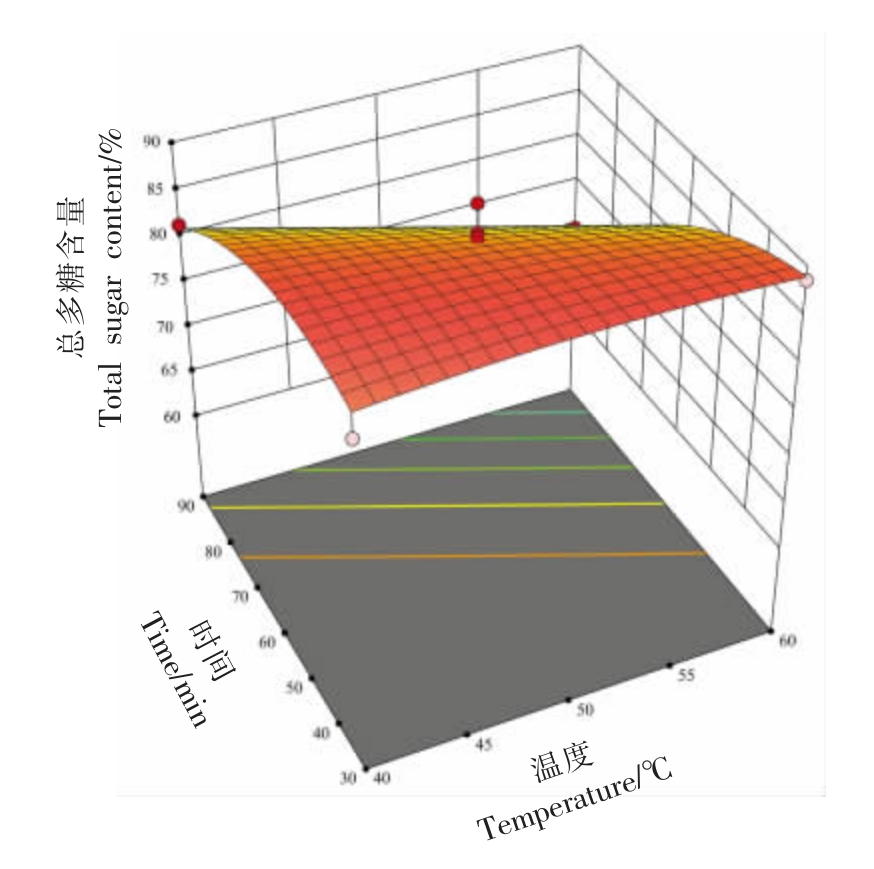
图2 温度与时间的交互作用对SDF-S 总多糖含量影响的响应面图
Fig. 2 Response surface plots of the interactive effects of temperature and time on the total sugar content of SDF-S
表3 方差分析
Table 3 Analysis of variance
2.2.2 提取工艺优化与验证 满意度函数常用于多响应值的响应面优化,通过最大化复合响应值的满意度,将多响应问题转化为单响应问题,从而确定最适合的工艺条件。这些响应值被设定为不可接受极限(0)和目标值(1),越接近于1,其结果越理想[28-29]。以SDF 提取率和总多糖含量最大化为目标,使用Design-Expert 的满意度函数功能对上述两个模型同时求取最优解,确定的最优工艺条件为:料液比1∶15.94,温度40.0 ℃,时间40.90 min,SDF-S 提取得率预测为5.87%,总多糖含量为87.86%。提取得率及总多糖含量的满意度分别为0.75 和0.93,两者复合的满意度为0.83,均接近于1,表明在优化的提取工艺参数下SDF-S 能有较好的总多糖含量及提取得率(见图3)。根据试验设备实际条件,调整提取条件为料液比1∶16,温度40 ℃,时间40 min。以此条件进行3 平行试验验证,SDF-S 提取得率为(6.13±0.25)%,总多糖含量为(84.68±0.64)%,均与预测值接近。
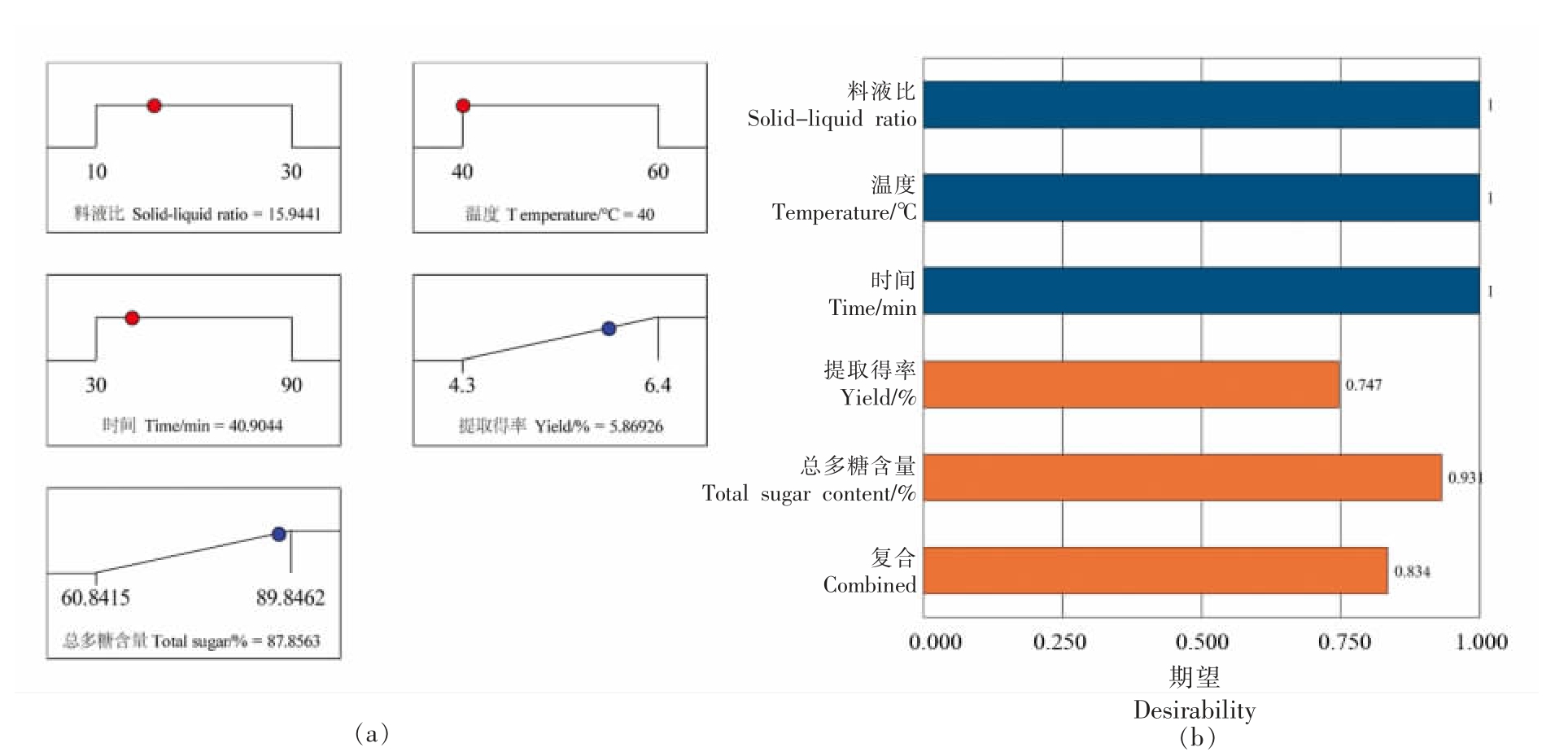
图3 优化工艺预测结果(a)及期望值(b)
Fig. 3 Prediction(a)of optimized solution and desirability(b)
2.3 蒸制前、后甘薯SDF 组成分析
采用优化的提取工艺,从蒸制前、后的甘薯中分别提取得到SDF-S 和SDF-F。经过20 min 沸水蒸制,蒸制甘薯的SDF 得率、SDF 的中性多糖含量、酸性多糖含量以及总多糖含量显著提高(P<0.05)(见表4),分别为生鲜甘薯的2.12,1.27,2.64倍和1.50 倍。在Valetudie 等[30]和Nakamura 等[31]的研究中,均发现甘薯在蒸制过程中甘薯细胞内的淀粉颗粒将膨胀并挤压细胞壁使其破碎。在Arevalo 等[32]对5 种鹰嘴豆的研究则发现,经蒸制和烘烤后的鹰嘴豆中的水苏糖、棉子糖和毛蕊糖3 种低聚糖的含量较生鲜鹰嘴豆显著增高。因此,由现有研究推测,甘薯SDF 提取得率和总多糖含量在蒸制后增加的原因可能有二:其一为在蒸制过程中,细胞内淀粉颗粒的糊化膨胀引起了甘薯细胞的破裂,结构致密的细胞壁降解释放出不同大小分子质量的纤维素、果胶等物质;其二是在细胞破裂降解的过程中,促进了其中低聚糖、抗性糊精等低分子质量糖类的释放。蒸制处理使SDF 得率或含量提高这一现象,在香菇[33]、荞麦[34]、胡萝卜[35]等作物的相关研究中也有报道。
表4 甘薯SDF 提取得率及组成(%)
Table 4 Yield and composition of sweet potato SDF(%)
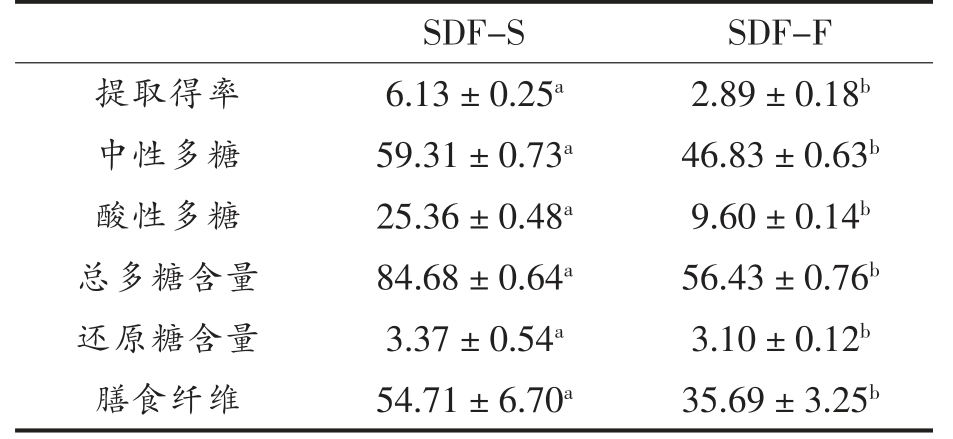
注:同行小写字母不同表示差异显著(P<0.05),下同。
SDF-S 中膳食纤维含量也发生显著提高(P<0.05),为SDF-F 的1.53 倍(见表4)。据国家标准GB 5009.88-2014 《食品安全国家标准 食品中膳食纤维的测定》所述,其方法虽适用于所有植物性食品中膳食纤维含量的测定,但不包括分子质量较低的膳食纤维组分[18]。因此,膳食纤维的测定结果可大致视为甘薯SDF 中的高分子质量多糖部分。然而,蒸、煮等常规热加工方式通常不足以使植物多糖的糖苷键断裂,植物内源的多糖水解酶也多因热不稳定而失活[36-37]。故蒸制引起的总多糖和膳食纤维含量升高,其主要来源于甘薯细胞壁中高分子质量的纤维素、果胶等物质。
2.4 蒸制前、后甘薯SDF 理化性质分析
由表5 可知,两种甘薯SDF 的部分理化性质存在差异。SDF-S 的持水力和持油力较SDF-F 显著更高(P<0.05),持水力分别为(4.60±0.31)g/g 和(3.27±0.21)g/g,持油力分别为(3.30±0.40)g/g 和(1.82±0.28)g/g。两者在膨胀力方面无显著差异,说明蒸制处理可能改变了甘薯SDF 的物理结构,使更多的基团暴露,持水力和持油力提高。持水力、持油力良好的SDF 具有较高的食品加工应用潜力,并将有助于增进消费者的饱腹感和肠道蠕动,促进肠道健康[38-40]。
表5 甘薯SDF 理化性质
Table 5 Physical and chemical properties of sweet potato SDF

2.5 蒸制前、后甘薯SDF 消化特性分析
采用体外模拟消化方法,以SDF 水解率为指标,对比分析了SDF-S 和SDF-F 在口腔、胃和小肠的消化情况,结果见图4。SDF-S 在唾液消化、胃消化和小肠消化阶段的水解率增幅依次为0.82%,12.07%和2.89%;SDF-F 在上述3 阶段的水解率依次增加了0.35%,11.40%和1.03%。2 种甘薯SDF 主要发生在胃消化阶段,在小肠阶段表现出明显的抗消化特性,符合膳食纤维的典型特征,且与Yun 等[41]和Li 等[42]对小麦胚芽多糖和黑木耳多糖模拟消化的研究结果相一致。此外,SDF-S 在唾液消化【(0.82±0.26)% vs(0.35±0.16)%】、胃消化 【(12.89±2.10)% vs(11.75±1.07)%】和小肠消化【(15.78±0.88%)vs(12.78±1.02)%】终点时的水解率均显著高于SDF-S(P<0.05),表明蒸制处理降低了甘薯SDF 的抗消化性。
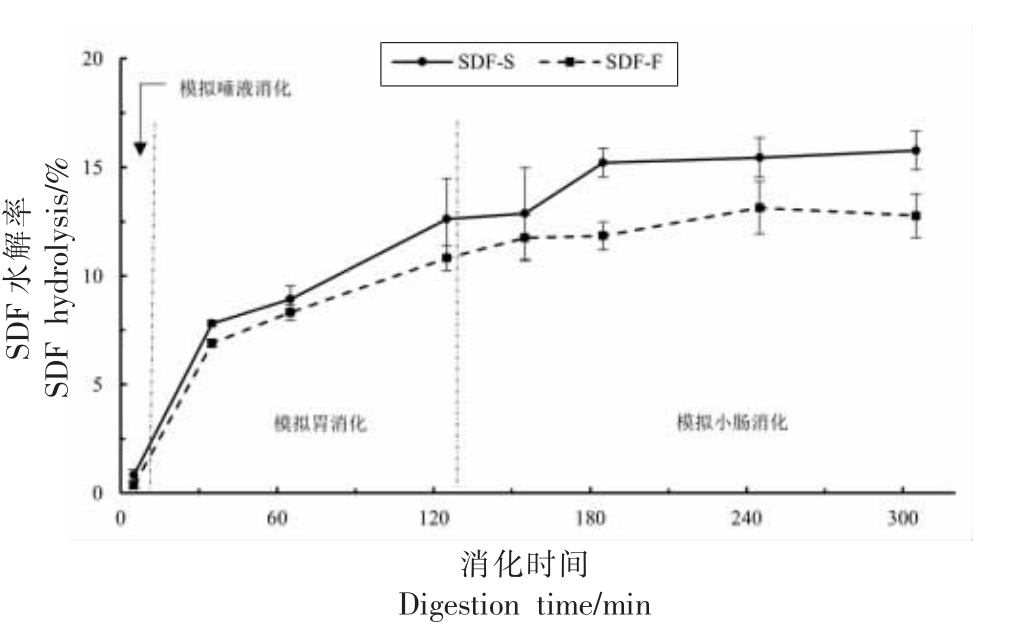
图4 模拟消化各阶段甘薯SDF 水解率
Fig. 4 Hydrolysis of sweet potato SDF during simulated digestion
3 结论
1)经过蒸制,甘薯SDF 的提取得率和总多糖含量显著升高,蒸制熟化提高了甘薯SDF 的可利用性,其中增加的多糖来自甘薯细胞壁中的纤维素、果胶等物质。
2)SDF-S 的中性多糖、酸性多糖、持水力、持油力显著高于SDF-F,两者均能抵抗小肠消化,而SDF-S 抗消化性低于SDF-F。
[1] Codex Alimentarius Commission.Guidelines on nutrition labelling:CAC/GL 2-1985[S].Rome:Food and Agriculture Organization of the United Nations,2010:3.
[2] 赵广河,张瑞芬,董丽红,等.不溶性膳食纤维调节脂质代谢研究进展[J].中国食品学报,2021,21(11):319-328.ZHAO G H,ZHANG R F,DONG L H,et al.Research progress on insoluble dietary fiber in regulating lipid metabolism[J].Journal of Chinese Institute of Food Science and Technology,2021,21(11):319-328.
[3] 叶兴乾,任艳明,陈健乐,等.果蔬营养新功能:益生元[J].中国食品学报,2021,21(6):1-10.YE X Q,REN Y M,CHEN J L,et al.The new nutritional function of fruit and vegetable:Prebiotic[J].Journal of Chinese Institute of Food Science and Technology,2021,21(6):1-10.
[4] DE ALMEIDA W S,DA SILVA D A.Does polysaccharide quaternization improve biological activity?[J].International Journal of Biological Macromolecules,2021,182:1419-1436.
[5] PATHANIA S,KAUR N.Utilization of fruits and vegetable by-products for isolation of dietary fibres and its potential application as functional ingredients[J].Bioactive Carbohydrates and Dietary Fibre,2022,27:100295.
[6] 王欣,李强,曹清河,等.中国甘薯产业和种业发展现状与未来展望[J].中国农业科学,2021,54(3):483-492.WANG X,LI Q,CAO Q H,et al.Current status and future prospective of sweet potato production and seed industry in China[J].Scientia Agricultura Sinica,2021,54(3):483-492.
[7] ALAM M K.A comprehensive review of sweet potato(Ipomoea batatas [L.] Lam):Revisiting the associated health benefits[J].Trends in Food Science &Technology,2021,115:512-529.
[8] JU D,MU T H,SUN H N.Sweet potato and potato residual flours as potential nutritional and healthy food material[J].Journal of Integrative Agriculture,2017,16(11):2632-2645.
[9] 郭金颖,牟德华.五种甘薯多糖体外抗氧化活性比较[J].粮食与饲料工业,2012(12):29-31,36.GUO J Y.MOU D H.In vitro antioxidant activity comparison of sweet potato polysaccharide[J].Cereal&Feed Industry,2012(12):29-31,36.
[10] ZHAO G H,KAN J Q,LI Z X,et al.Characterization and immunostimulatory activity of an(1→6)-α-D-glucan from the root of Ipomoea batatas[J].International Immunopharmacology,2005,5(9):1436-1445.
[11] LIU M,LI X Z,ZHOU S M,et al.Dietary fiber isolated from sweet potato residues promotes a healthy gut microbiome profile[J].Food &Function,2020,11(1):689-699.
[12] SUN J,CHEN H,KAN J,et al.Anti-inflammatory properties and gut microbiota modulation of an alkali-soluble polysaccharide from purple sweet potato in DSS-induced colitis mice[J].International Journal of Biological Macromolecules,2020,153:708-722.
[13] WU Q Y,QU H S,JIA J Q,et al.Characterization,antioxidant and antitumor activities of polysaccharides from purple sweet potato[J].Carbohydrate Polymers,2015,132:31-40.
[14] 孟祥河,戴建波,曹艳,等.亚临界水提法提高甘薯皮可溶性膳食纤维得率[J].农业工程学报,2019,35(20):303-310.MENG X H,DAI J B,CAO Y,et al.Increasing yield of soluble dietary fiber from sweet potato peel by using subcritical water extraction[J].Transactions of the Chinese Society of Agricultural Engineering,2019,35(20):303-310.
[15] DUBOIS M,GILLES K A,HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.
[16] FILISETTI-COZZI T M C C,CARPITA N C.Measurement of uronic acids without interference from neutral sugars [J].Analytical Biochemistry,1991,197(1):157-162.
[17] MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar [J].Analytical Chemistry,1959,31(3):426-428.
[18] 中华人民共和国国家卫生和计划生育委员会.食品安全国家标准 食品中膳食纤维的测定:GB 5009.88-2014[S].北京:中国标准出版社,2016:1-7.National Health and Family Planning Commission of the People's Republic of China.National food safety standard determination of dietary fiber in foods:GB 5009.88-2014[S].Beijing:China Standards Press,2016:1-7.
[19] KAUR B,PANESAR P S,THAKUR A.Extraction and evaluation of structural and physicochemical properties of dietary fiber concentrate from mango peels by using green approach[J].Biomass Conversion and Biorefinery,2021,11:1-10.
[20] WANG X X,ZHANG L P,QIN L,et al.Physicochemical properties of the soluble dietary fiber from Laminaria japonica and its role in the regulation of type 2 diabetes mice[J].Nutrients,2022,14(2):329.
[21] JIANG Z M,MU S N,MA C L,et al.Consequences of ball milling combined with high-pressure homogenization on structure,physicochemical and rheological properties of citrus fiber[J].Food Hydrocolloids,2022,127:107515.
[22] WU D T,FU Y,GUO H,et al.In vitro simulated digestion and fecal fermentation of polysaccharides from loquat leaves:Dynamic changes in physicochemical properties and impacts on human gut microbiota[J].International Journal of Biological Macromolecules,2021,168:733-742.
[23] GOÑI I,GARCIA-ALONSO A,SAURA-CALIXTO F.A starch hydrolysis procedure to estimate glycemic index[J].Nutrition Research,1997,17(3):427-437.
[24] CHEN G J,XIE M H,WAN P,et al.Digestion under saliva,simulated gastric and small intestinal conditions and fermentation in vitro by human intestinal microbiota of polysaccharides from Fuzhuan brick tea[J].Food Chemistry,2018,244:331-339.
[25] MOHAMMADPOUR H,SADRAMELI S M,ESLAMI F,et al.Optimization of ultrasound-assisted extraction of Moringa peregrina oil with response surface methodology and comparison with Soxhlet method[J].Industrial Crops and Products,2019,131:106-116.
[26] 宋思圆,苏平,王丽娟,等.响应面试验优化超声提取黄秋葵花果胶多糖工艺及其体外抗氧化活性[J].食品科学,2017,38(2):283-289.SONG S Y,SU P,WANG L J,et al.Optimization of ultrasonic-assisted extraction by response surface methodology and antioxidant activities of pectic polysaccharide from okra flowers[J].Food Science,2017,38(2):283-289.
[27] ZHU C P,ZHAI X C,LI L Q,et al.Response surface optimization of ultrasound-assisted polysaccharides extraction from pomegranate peel[J].Food Chemistry,2015,177:139-146.
[28] TOPKAFA M,AYYILDIZ H F,MEMON F N,et al.New potential humic acid stationary phase toward drug components:Development of a chemometricassisted RP-HPLC method for the determination of paracetamol and caffeine in tablet formulations[J].Journal of Separation Science,2016,39(13):2451-2458.
[29] KALKAN O,TOPKAFA M,KARA H.Determination of effect of some parameters on formation of 2-monochloropropanediol,3-monochloropropanediol and glycidyl esters in the frying process with sunflower oil,by using central composite design[J].Journal of Food Composition and Analysis,2021,96:103681.
[30] VALETUDIE J C,GALLANT D J,BOUCHET B,et al.Influcence of cooking procedures on structure and biochemical changes in sweet potato[J].Starch-Stärke,1999,51(11/12):389-397.
[31] NAKAMURA Y,KURANOUCHI T,OHARA-TAKADA A,et al.Cell structure,water status and starch properties in tuberous root tissue in relation to the texture of steamed sweetpotato (Ipomoea batatas(L.)Lam)[J].Japanese Journal of Crop Science,2010,79(3):284-295.
[32] AREVALO I,GUZMÁN-MALDONADO S H,SANCHEZ S M M,et al.Steaming and toasting reduce the nutrimental quality,total phenols and antioxidant capacity of fresh kabuli chickpea(Cicer arietinum L.)[J].Plant Foods for Human Nutrition,2020,75(4):628-634.
[33] 周浩宇,俞明君,聂远洋,等.热加工方式对香菇营养特性和抗氧化活性的影响[J].食品科学,2021,42(15):106-114.ZHOU H Y,YU M J,NIE Y Y,et al.Effects of heat processing methods on nutritional properties and antioxidant activity of Lentinus edodes[J].Food Science,2021,42(15):106-114.
[34]  M,DZIEDZIC K,GÓRECKA D,et al.Effect of boiling in water of barley and buckwheat groats on the antioxidant properties and dietary fiber composition[J].Plant Foods for Human Nutrition,2014,69(3):276-282.
M,DZIEDZIC K,GÓRECKA D,et al.Effect of boiling in water of barley and buckwheat groats on the antioxidant properties and dietary fiber composition[J].Plant Foods for Human Nutrition,2014,69(3):276-282.
[35] BOROWSKA J,KOWALSKA M,CZAPLICKI S,et al.Effect of hydrothermal processing on carrot carotenoids changes and interactions with dietary fiber[J].Food/Nahrung,2003,47(1):46-48.
[36] KALALA G,KAMBASHI B,EVERAERT N,et al.Characterization of fructans and dietary fibre profiles in raw and steamed vegetables[J].International Journal of Food Sciences and Nutrition,2018,69(6):682-689.
[37] LIU J N,BI J F,MCCLEMENTS D J,et al.Impacts of thermal and non -thermal processing on structure and functionality of pectin in fruit -and vegetable-based products:A review[J].Carbohydrate Polymers,2020,250:116890.
[38] CHEN H H,ZHAO C M,LI J,et al.Effects of extrusion on structural and physicochemical properties of soluble dietary fiber from nodes of lotus root[J].LWT,2018,93:204-211.
[39] 刘苗苗,毕冉冉,孙玉敬.果蔬与肠道菌群相作及其健康功效研究进展[J].中国食品学报,2022,22(4):387-407.LIU M M,BI R R,SUN Y J.Recent advances on the interaction between fruits or vegetables and intestinal flora and its effect on health[J].Journal of Chinese Institute of Food Science and Technology,2022,22(4):387-407.
[40] YE S X,SHAH B R,LI J,et al.A critical review on interplay between dietary fibers and gut microbiota[J].Trends in Food Science &Technology,2022,124:237-249.
[41] YUN L Y,LI D Z,YANG L,et al.Hot water extraction and artificial simulated gastrointestinal digestion of wheat germ polysaccharide[J].International Journal of Biological Macromolecules,2019,123:174-181.
[42] LI L,SU Y,FENG Y,et al.A comparison study on digestion,anti-inflammatory and functional properties of polysaccharides from four Auricularia species[J].International Journal of Biological Macromolecules,2020,154:1074-1081.