淀粉是一种来源丰富的天然生物聚合物,由直链淀粉和支链淀粉构成,广泛存在于谷类、薯类、豆类等植物中[1]。直链淀粉和支链淀粉含量和比例的差异是解释淀粉的理化性质和功能性质差异的因素之一[2]。天然淀粉具有易老化、耐水性差、凝胶能力较差、热不稳定性等缺陷,这在很大程度上限制了天然淀粉的应用。通常采用物理(微波、辐照和超声等)、化学(交联、酯化和氧化等)、生物(酶改性)等方法对天然淀粉进行改性,增强或抑制其固有性质,以满足特定应用的要求[3]。酶解改性具有反应条件温和可控、效率高、产品安全等优势,已逐渐成为淀粉改性的关键方法[4]。普鲁兰酶(Pullulanase)是一种淀粉脱支酶,能选择性地水解支链淀粉中的α-1,6 糖苷键,减小淀粉的分支化度,形成低分子质量的线性短直链分子[5]。这些线性短链分子具有更大的流动性,能够促进分子排列和聚集,使其具有良好的凝胶和重结晶性能,在食品和药物制剂中有很广阔的应用前景[6]。
壳聚糖(Chitosan,CS)是天然多糖中唯一的碱性氨基多糖,来源于甲壳素[7]。CS 具有良好的生物相容性、生物黏附性、抗氧化性、成膜性,广泛应用于食品、医药、化妆品等行业[8]。此外,它对人体健康有很大的影响,如降低胆固醇,抑制脂肪吸收,改善肠道代谢,抗菌,保护人体组织和器官[9]。近年来,越来越多的研究集中在淀粉与多糖的相互作用[10]。有研究报道CS 的加入有利于莲子淀粉-壳聚糖共混物中形成有序的分子结构,并且CS 可以改善莲子淀粉的流变学行为[11]。Diao 等[12]研究表明淀粉与CS 经干热处理后的相互作用改善了其理化性质(如糊化温度、溶胀度、消化率等)。在淀粉加工过程中添加多糖可提高淀粉的稳定性和产品质量。
近年来,许多研究利用天然淀粉与壳聚糖的相互作用来克服淀粉加工性能的不足,提高加工的稳定性,而DBS 与CS 之间的相互作用有待进一步研究。DBS 与天然淀粉的结构完全不同,推测其功能也是不同的。本试验用普鲁兰酶对玉米淀粉进行脱支处理,研究脱支处理前、后玉米淀粉与壳聚糖复合的外貌形态、结晶结构、热稳定性和流变学特性,获得一种新型的复合物改性淀粉,为其的工业应用提供理论参考。
1 材料与方法
1.1 材料与试剂
玉米淀粉(直链淀粉含量为28.7%),山东富阳生物科技有限公司;普鲁兰酶(1 500 U/mL),江苏瑞阳生物有限公司;壳聚糖(CAS:9012-76-4,脱乙酰度>90%),山东奥康生物科技有限公司;茚三酮、氘代二甲基亚砜(DMSO-d6),上海源叶生物科技有限公司;其它试剂均为分析纯级。
1.2 仪器与设备
SU1510 扫描电子显微镜,日本电子株式会社;Better2600 激光粒度分析仪,丹东百特仪器有限公司;AV Ⅲ400MHz 核磁共振波谱仪,北京布鲁克科技有限公司;DMAX2500 X-射线衍射仪,日本理学株式会社;Q50 热重分析仪,上海斯迈欧分析仪器有限公司;IS50 傅里叶变换红外光谱、MARS 60 动态流变仪,德国赛默飞世尔科技有限公司;ALPHA1-2LD 冷冻干燥机,德国CHRIST 公司;CT62A 全自动高压蒸汽灭菌锅,上海驰通仪器有限公司。
1.3 试验方法
1.3.1 脱支淀粉-壳聚糖复合物的制备 脱支淀粉的制备参照Lu 等[4]的方法并做了下调整。将10 g 玉米淀粉溶于100 mL 蒸馏水中,置于121 ℃高压蒸汽灭菌锅中20 min 使其完全糊化。将糊化淀粉冷却至58 ℃,加200 μL 普鲁兰酶进行酶解脱支5 h,灭酶,冷却至室温即可得到脱支玉米淀粉溶液(DBS)。
用1%乙酸溶液配制质量分数为0%,1%,1.5%和2%的壳聚糖溶液(CS)[13]。将脱支淀粉溶液与不同质量分数的壳聚糖溶液混合,调整pH 值至4.8~5.0,在4 ℃下搅拌24 h。离心(4 000 r/min,10 min)取沉淀物进行冷冻干燥后研磨过100 目筛,即可制备得不同质量分数的脱支玉米淀粉-壳聚糖复合物(DBS-CS)。以未进行脱支处理的玉米淀粉为空白对照,按相同的程序制备原玉米淀粉-壳聚糖复合物(MS-CS)。
1.3.2 复合率的测定 参考Panda 等[14]的方法,用茚三酮显色法测定样品的复合率。取1.3.1 节离心后的上清液0.4 mL,与2 mL HAc-NaAc 缓冲液(0.2 mol/L,pH 5.5)和1 mL 茚三酮溶液(10.00 g/L)混合,加水至5.00 mL,在沸水浴保持20 min。冷却至室温后,用60%乙醇溶液定容至10 mL,充分混匀,静置15 min 后在波长570 nm 处测定吸光度,按照式(1)计算复合率(P)。
式中,P——复合率,%;m总——壳聚糖总质量,g;m上——上清液中壳聚糖质量,g。
1.3.3 微观结构观察 利用扫描电子显微镜(SEM)观察脱支前、后玉米淀粉-壳聚糖复合物的结构变化。将样品用导电胶固定并喷金。在5 kV的加速电压下进行样品形貌观察。
1.3.4 粒径分布测定 采用湿法进样,用蒸馏水悬浮淀粉样品,在循环泵速为1 600 r/min 的转速下搅拌,水和样品的折射率分别为1.33 和1.52。当系统显示遮光率范围在5%~10%时即可进行粒径分布测定。
1.3.5 傅里叶变换红外光谱(FT-IR)分析 将干燥样品与KBr(质量比1∶150)混合压片,在400~4 000 cm-1 的扫描范围和4 cm-1 的分辨率下,扫描32 次获得了FTIR 光谱图。波数范围在1 200~800 cm-1 的所有光谱进行傅里叶去卷积,半峰宽为45.5 cm-1 和增强因子为1.9 的条件下通过1 047 cm-1/1 022 cm-1 处的吸收峰强度比来表征淀粉样品的短程有序性[15]。
1.3.6 热力学性质(TGA)分析 精确称取5.0 mg样品均匀分散在氧化坩埚中,使用热重分析仪测量样品的热特性。设置样品升温范围为30~600℃,升温速率为20 ℃/min,测试过程中保持氮气流速为60 mL/min。
1.3.7 X-射线衍射(XRD)分析 在40 kV 的电压和40 mA 的电流条件下用Cu-Kα 辐射探测器(λ=0.154 nm)进行X-射线衍射分析。扫描范围为2θ=4°~45°,扫描速度为2°/min,步长0.02°。采用MDI jade 5.0 进行图形处理,并按照式(2)计算相对结晶度(RC)。
式中,RC——相对结晶度,%;Ac——结晶区域面积;Aa——无定形区域面积。
1.3.8 核磁共振氢谱(1H NMR)分析 参照Li 等[16]的方法并作如下调整。称取10 mg 样品溶于500 μL DMSO-d6 中,在95 ℃下混合20 min 使其完全溶解,冷却后将液体全部转移至核磁管中。在25 ℃下对样品进行核磁共振氢谱分析,取样时间2.18 s,扫描32 次。
1.3.9 流变特性测定 将3.0 g 样品与25 mL 蒸馏水混合均匀,加热糊化20 min 得到待测样品糊。取约3 mL 的待测样品糊置于直径为35 mm 平行板上,设置间隙1 mm,加盖板以防止水分流失。在25 ℃下进行动态和静态流变特性的测定。
1.3.9.1 静态流变特性测定(触变环)选择旋转连续扫描程序分析静态流变特性。测定剪切速率分别在180 s 从0~300 s-1 递增,再从300~0 s-1 递减过程中样品的变化。采用Herschel-Bulkley 模型【式(3)】进行拟合分析得到样品的流变参数。方程如下:
式中,τ——剪切应力,Pa;τ0——屈服应力,Pa;K——稠度系数,Pa·sn;γ——剪切速率,s-1;n——流动特征指数,无量纲,表示液体偏离牛顿流体的程度。
1.3.9.2 动态黏弹性测定 选择振荡振幅扫描程序分析动态流变特性。振荡频率范围为0.1~10 Hz,扫描应变为0.1%,确定样品的线性黏弹性区。测量样品的储能模量(G′)和损耗模量(G")随振荡频率增加的变化情况。
1.3.10 数据处理与分析 所有试验至少做3 个平行,数据结果以“平均标±准偏差”表示。用IBM SPSS Statistics 26 对数据进行单因素方差分析和差异显著性分析(P<0.05),用Origin 2018 软件进行绘图。用MestReNova 软件分析1H NMR 谱。
2 结果与分析
2.1 SEM 分析结果
如图1 所示,通过扫描电子显微镜观察玉米淀粉、脱支玉米淀粉和脱支前、后玉米淀粉-壳聚糖复合物的微观形态。MS 颗粒呈现为表面光滑、棱角分明的多面体(图1a)。与MS 相比,MS-CS-1颗粒表面变得粗糙,颗粒表面的光滑度有所降低(图1b)。经酶解脱支处理后,得到的DBS 颗粒的表面形貌发生了明显的变化,呈不规则形状,颗粒粒径变大并且出现了明显的团聚现象(图1c)。与DBS 相比,DBS-CS 颗粒的表面略显粗糙并且有小部分颗粒相互黏附在一起。随着壳聚糖添加量的增加,复合物表面附着的壳聚糖数量逐渐增加,颗粒间的结合力也越来越紧密(图1d~1f)。

图1 脱支处理前、后淀粉-壳聚糖复合物的扫描电镜图
Fig. 1 SEM of starch-chitosan complexes before and after debranching treatment
注:MS.玉米淀粉;MS-CS.玉米淀粉-壳聚糖复合物;DBS.脱支玉米淀粉;DBS-CS.脱支玉米淀粉-壳聚糖复合物。1,2,3 分别表示为10 g/100 mL 淀粉悬浮液中添加质量分数为1%,1.5%,2%壳聚糖溶液。
2.2 粒度分布分析结果
从图2 可以看出,DBS 和DBS-CS 的粒径分布均大于MS,MS 和MS-CS-1 的粒径呈现多峰分布,而DBS-CS 复合物的粒径大多呈现单峰分布。随着壳聚糖添加量的增加,复合物的粒径也逐渐增大,粒径分布均匀,基本呈正态分布且较为狭窄。D50 值(累计粒径分布数达到50%时所对应的粒径)以MS<MS-CS-1<DBS-CS-1<DBS-CS-2<DBS<DBS-CS-3 的顺序变化。MS 的粒径分布范围大致为10~20 μm,经脱支复合后,DBS 和DBS-CS的粒径都有所增大,这可能是因为普鲁兰酶水解产生更多的线性短链分子并且短链分子之间相互缠绕聚集,导致颗粒尺寸的增加[17]。粒径小的分子相互聚集并向粒径大的方向迁移,这也与扫描电镜的结果相符合。

图2 脱支处理前、后淀粉-壳聚糖复合物的粒径分布图
Fig. 2 Particle size distribution of starch-chitosan complexes before and after debranching treatment
2.3 FTIR 分析结果
红外光谱是研究淀粉官能团和短程有序结构常用的方法。如图3 所示,所有样品在3 400 cm-1处的宽吸收带和2 930 cm-1 处分别代表葡萄糖单元中-OH 和-CH 引起的伸缩振动[18]。与MS 相比,DBS 的吸收峰与MS 相似,说明在脱支过程中没有形成新的化学键。然而,两种样品的不同之处在于脱支处理会暴露出更多的羟基,因此在3 400 cm-1 处的峰强度增强。1 639 cm-1 处的尖峰为样品中水分子的O-H 弯曲振动[19]。MS-CS 和DBS-CS样品都在1 560 cm-1 处出现了新的谱带,这是NH 弯曲(酰胺II 带)特征吸收,说明淀粉和壳聚糖形成了新的共价键,改变了分子之间的相互作用,形成淀粉-壳聚糖复合物[20]。DBS-CS 在1 560 cm-1 处的峰强度高于MS-CS,这可能是因为脱支处理降低了支链淀粉的空间位阻,暴露出更多的羟基及反应位点与壳聚糖进行复合,从而提高了淀粉与壳聚糖的复合率。在1 047/1 022 cm-1 的FTIR 吸光度比值可以表征淀粉样品的短程有序结构。在1 047/1 022 cm-1 处的FTIR 吸光度比越高,表明淀粉的短程顺序越好[15]。1 047/1 022 cm-1 的比值在淀粉间存在显著差异(表1),脱支处理和壳聚糖的加入使得淀粉样品的短程有序性均有所降低,说明淀粉的短程有序性的变化与脱支处理及壳聚糖的含量有关。
表1 样品的复合率、相对结晶度和FTIR 光谱分析参数
Table 1 The combination rate,relative crystallinity and FTIR spectra analysis parameters of samples

注:表中数据以平均数±标准差表示,同一列中不同的字母表示有显著性差异(P<0.05)。I1047/1022:1 047 cm-1 与1 022 cm-1 处吸收峰强度的比值。

图3 脱支处理前、后淀粉-壳聚糖复合物的FTIR 衍射图谱
Fig. 3 FTIR diffraction patterns of starch-chitosan complexes before and after debranching treatment
2.4 XRD 分析结果
样品的X-射线衍射图谱和相对结晶度分别如图4 和表1 所示。MS 在2θ=15.1°,17.2°,18°和23°处有明显的衍射特征峰,表明玉米淀粉属于典型的A 型晶体结构[21]。MS-CS-1 的X 射线衍射峰图与MS 相似,说明壳聚糖的加入没有改变MSCS-1 的晶体结构类型,而其相对结晶度从38.44%下降到32.49%。脱支处理后,DBS 在17.2°附近有一个主峰,在22.5°和24°处形成了新的衍射峰,是典型B 型结晶结构,这表明脱支处理在促进B 型晶体结构的形成中发挥重要作用[22]。DBS的相对结晶度(35.08%)低于MS(38.44%),反应过程是从结晶区逐渐扩展到无序的非结晶区,表明DBS 具有更多的非晶态结构。低温下脱支会促使分子链有更高的排列和聚集机会重新结合成双螺旋结构,从而形成不同的结晶结构[23]。
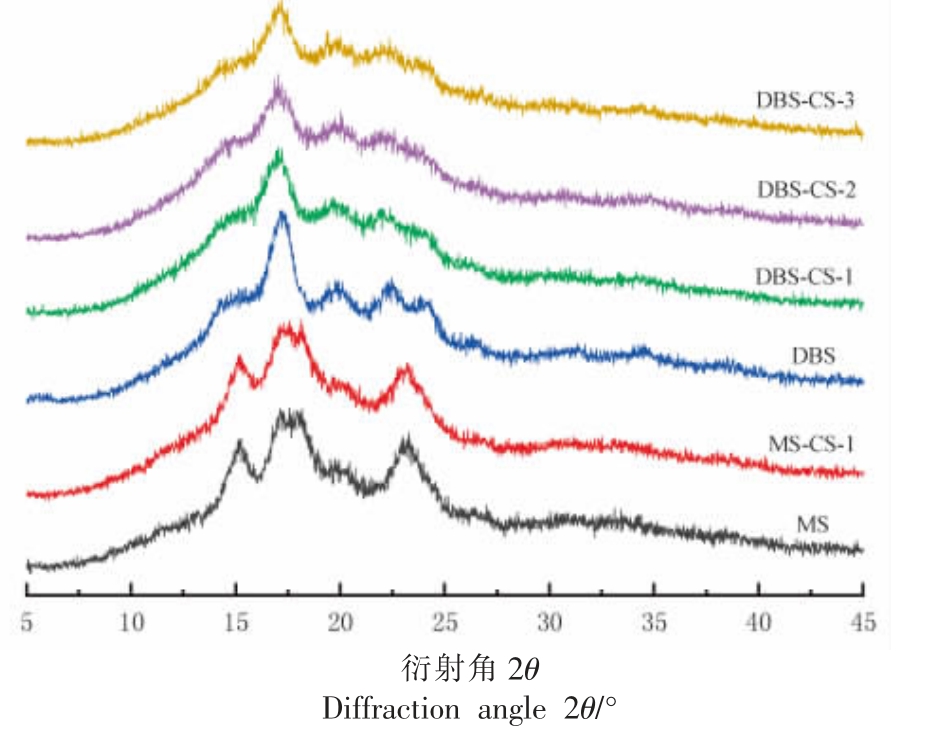
图4 脱支处理前、后淀粉-壳聚糖复合物的X 射线衍射图谱
Fig. 4 X-ray diffraction patterns of starch-chitosan complexes before and after debranching treatment
经过脱支和壳聚糖复合双重修饰后,DBS-CS复合物虽然保留原有晶体结构对应的尖峰衍射特征峰,但衍射强度有所降低,DBS-CS-1、DBS-CS-2、DBS-CS-3 的相对结晶度分别为31.52%,29.90%,29.43%。壳聚糖的加入降低了DBS-CS 复合物的相对结晶度表明CS 抑制了DBS 的再结晶,其中CS 分子通过空间位阻干扰直链分子的闭合[24]。
2.5 1H NMR 分析结果
在图5 的1H NMR 谱中观察到的共振峰是由物质的化学位移确定的,淀粉结构单元中无水葡萄糖部分的4 个质子分别在5.50×10-6(OH-3)、5.40×10-6(OH-2)、4.58×10-6(OH-6)、4.90×10-6(OH-4)处有信号[25]。溶剂DMSO-d6 在2.5×10-6 处有信号。质子的 1H 化学位移分别为3.15×10-6(H-4),3.31×10-6(H-2),3.57×10-6(H-5),3.65×10-6(H-3)和5.11×10-6(H-1)[26]。MS-CS 和DBSCS 复合物的1H NMR 光谱在1.8×10-6 处显示出一个新的信号峰,这归因于壳聚糖中乙酰氨基的共振,新峰的出现进一步表明了复合物的形成[27]。然而,DBS-CS 在1.8×10-6 处的信号峰强度明显强于MS-CS,证实脱支处理导致质子化环境的变化,脱支淀粉中有更多的羟基及反应位点与壳聚糖进行复合,这也与复合率的测定结果(表1)和FTIR光谱(图3)结果一致。
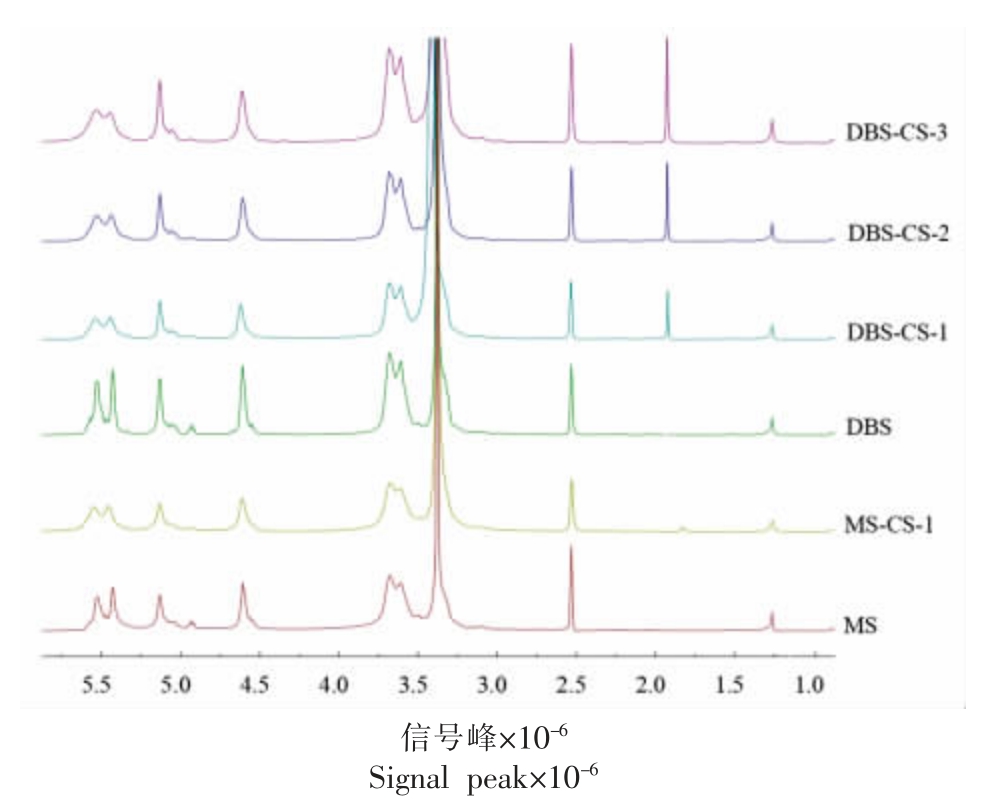
图5 脱支处理前、后淀粉-壳聚糖复合物的核磁共振氢谱图
Fig. 5 1H NMR spectra of starch-chitosan complexes before and after debranching treatment
2.6 TGA 分析结果
图6 显示了每个样品降解过程的热重(TGA)曲线和导数热重(DTG)曲线。DTG 曲线是由TG曲线的导数求导所得,代表降解过程的质量损失率。所有样品的热降解过程主要包括两个阶段。第1 失重阶段(T<125 ℃)与物理吸附和淀粉中的水分损失有关,第2 失重阶段(T>200 ℃)主要与颗粒大小和分子间作用力影响有关[28]。在200~400 ℃温度范围内DBS-CS 的失重速率总体比MS-CS低,可能是因为脱支改性能够增加线性短链淀粉链的数量,从而影响了淀粉的稳定性。DBS-CS 样品中部分淀粉链之间的排列呈无序状态,随着壳聚糖含量的增加,使得DBS-CS 的热裂解速率下降,热分解温度改变,热损失减少,说明DBS 和CS分子之间结合的紧密程度增加,需要更多的热量来完成相变,所以热稳定性得到提高。

图6 脱支处理前、后淀粉-壳聚糖复合物的TGA 和DTG 曲线
Fig. 6 The TGA and DTG curves of starch-chitosan complexes before and after debranching treatment
2.7 流变特性分析结果
2.7.1 静态流变特性测定分析(触变性)图7和表2 给出了所有样品的回归曲线和触变特性参数。表2 中流变曲线经过Herschel-Bulkley 模型拟合之后,具有较高的相关系数(R2>0.98)表明拟合方程与流变曲线有较好的相关性。剪切应力在较低速率下急剧增加,在较高速率下逐渐趋于稳定,且所有淀粉糊的流动特征指数n 小于1,表现为假塑性剪切变稀行为[29]。
表2 脱支处理前、后淀粉-壳聚糖复合物的触变特性参数
Table 2 Thixotropic characteristic parameters of starch-chitosan complexes before and after debranching treatment
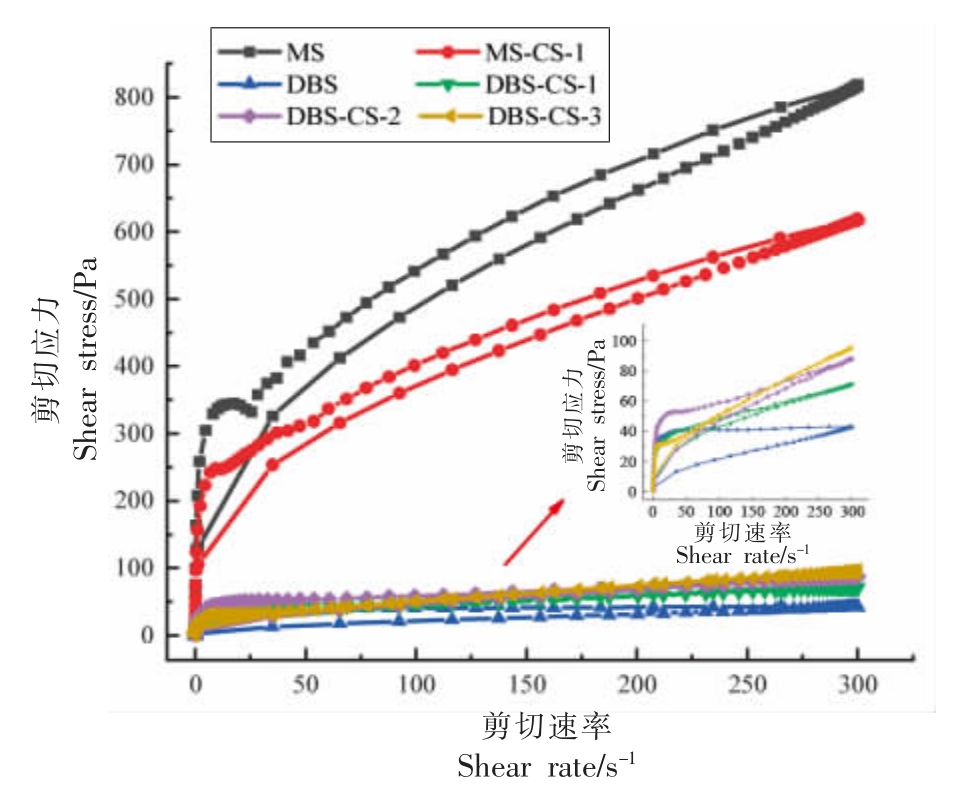
图7 脱支处理前、后淀粉-壳聚糖复合物的稳态剪切流变特性
Fig. 7 The steady shear stress of starch-chitosan complexes before and after debranching treatment
淀粉样品糊的剪切应力随剪切速率从0 s-1增加到300 s-1 所形成的流变曲线称为上行线,随剪切速率从300 s-1 减少到0 s-1 所形成的流变曲线称为下行线,此过程会形成一个闭合的“触变环”。触变环的面积大小代表淀粉凝胶结构被破坏的程度,表明样品在剪切力作用下发生了不可逆的改变[29]。“触变面积”越大,说明损伤程度越大,恢复到原来的状态难度越大[30]。如图7 和表2所示,与MS 相比,DBS 和DBS-CS 的剪切应力显著降低,“触变面积”显著减小,表明其抗剪切能力更强。这可能是因为淀粉经过脱支处理后,其内部结构被完全破坏,分子链断裂,使分子链更有利于流动,从而具有较强的抗剪切性能。抗剪切性能的提高可以提高淀粉在加工过程中的稳定性和产品质量。
2.7.2 动态黏弹性分析 动态流变学特性(储能模量G′和损耗模量G")决定了淀粉糊化后的黏弹性特性。由图8 可以看出,所有样品的G"的值均低于G′且不交叉,表明具有典型的弱凝胶动态流变行为[31]。MS 样品的G′值和G"值最高,DBS 样品的G′值和G"值最低,表明脱支处理有效降低玉米淀粉体系的黏弹性,淀粉分子内部结构重组,分子链被切割,破坏其凝胶网络结构的形成,从而DBS表现为稳定、光滑、无黏性的液体特性[22]。由于DBS 样品的G′值和G"值降低,其凝胶性变弱,影响了脱支淀粉在食品工业中的应用。随着壳聚糖含量的增加,G′值和G"值均增加,表明DBS 的黏弹性增强。此外,壳聚糖是一种增稠剂,其形成的交联网络进一步增强了淀粉的黏弹性,促进糊化淀粉的分子间结合[32]。脱支后产生的短链直链淀粉具有更好的流动性,且壳聚糖的存在阻碍了较大淀粉链的过度聚集,使得系统更加稳定。
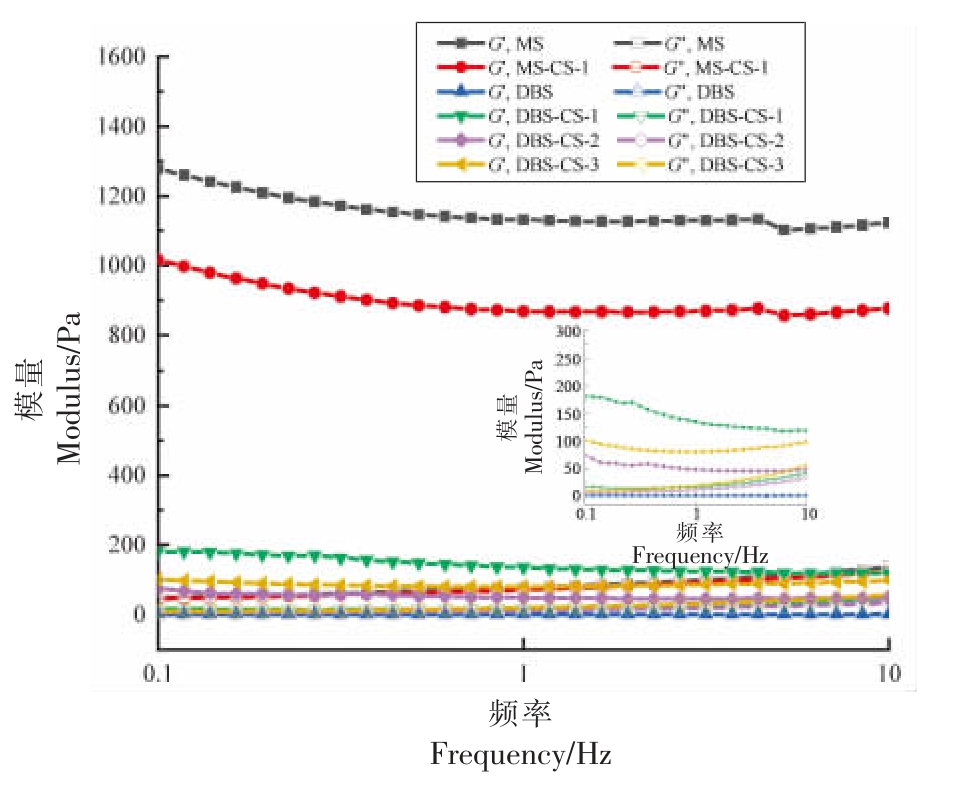
图8 脱支处理前、后淀粉-壳聚糖复合物的动态黏弹性特性
Fig. 8 The dynamic viscoelastic properties of starch-chitosan complexes before and after debranching treatment
3 结论
本试验研究结果表明,经脱支处理后,DBS 颗粒呈不规则形状,颗粒粒径变大并且其形成的复合致密性增强,可以得到一种新型的复合改性淀粉。XRD 结果表明脱支处理使得淀粉的结晶结构由A 型向B 型转变,且DBS 的相对结晶度降低。壳聚糖的加入虽不会改变淀粉的结晶类型,但其相对结晶度由32.49%降低至29.43%,可能的原因是壳聚糖的加入抑制了脱支淀粉的再结晶。FTIR和1H NMR 分别在1 560 cm-1 和1.8×10-6 处出现壳聚糖的特征化学信号峰,表明DBS 与CS 分子的复合效果较好。此外,1 560 cm-1 处DBS-CS 的峰值强度强于MS-CS,说明普鲁兰酶降低了支链淀粉的空间位阻,增强了壳聚糖与淀粉分子的相互作用。淀粉在1 047/1 022 cm-1 的比值上存在显著差异,说明淀粉的短程分子序的变化与脱支处理和壳聚糖的含量有关。TGA 结果表明,DBS-CS样品中部分淀粉链之间的排列呈无序状态,随着壳聚糖含量的增加,DBS-CS 的热裂解速率下降,热损失减少,热稳定性得到提高。流变学研究表明,所有样品具有典型的弱凝胶动态流变行为和假塑性剪切变稀行为。DBS 和DBS-CS 的“触变面积”显著减小,抗剪切能力增强。淀粉经过脱支处理后,其内部结构被完全破坏,分子链断裂,使分子链更有利于流动,从而具有较强的抗剪切性能。抗剪切性能的提高可以提高淀粉在加工过程中的稳定性和产品质量。
[1] CHAKRABORTY I,POOJA N,MAL S S,et al.An insight into the gelatinization properties influencing the modified starches used in food industry:A review[J].Food and Bioprocess Technology,2022,15(3):1-29.
[2] SEOK J Y,LEE D J,LIM S T,et al.Preparation and characterization of inclusion complexes between debranched maize starches and conjugated linoleic acid[J].Food Hydrocolloids,2019,96(11):503-509.
[3] NAGAR C K,DASH S K,RAYAGURU K,et al.Isolation,characterization,modification and uses of taro starch:A review[J].International Journal of Biological Macromolecules,2021,192(12):574-589.
[4] LU H,YANG Z,YU M T,et al.Characterization of complexes formed between debranched starch and fatty acids having different carbon chain lengths[J].International Journal of Biological Macromolecules,2021,167(12):595-604.
[5] XIAO W H,SHEN M Y,REN Y M,et al.Controlling the pasting,rheological,gel,and structural properties of corn starch by incorporation of debranched waxy corn starch[J].Food Hydrocolloids,2022,123(8):107136.
[6] CHANG R R,XIONG L,LI M,et al.Interactions between debranched starch and emulsifiers,polyphenols,and fatty acids[J].International Journal of Biological Macromolecules,2020,150(2):644-653.
[7] ARDEAN C,DAVIDESCU C M,NEMES N S,et al.Factors influencing the antibacterial activity of chitosan and chitosan modified by functionalization[J].International Journal of Molecular Sciences,2021,22(14):7449.
[8] 孟令伟,王洪江,刘伟,等.壳聚糖-明胶复合涂膜处理对南果梨保鲜效果的研究[J].农产品加工,2018(17):1-3.MENG L W,WANG H J,LIU W,et al.Study on the effect of chitosan-gelatin composite coating on the preservation of Nanguo Pear[J].Farm Products Processing,2018(17):1-3.
[9] HELGASON T,WEISS J,MCCLEMENTS D J,et al.Examination of the interaction of chitosan and oil-in-water emulsions under conditions simulating the digestive system using confocal microscopy[J].Journal of Aquatic Food Product Technology,2008,17(3):216-233.
[10] CHEN S,QIN L,CHEN T,et al.Modification of starch by polysaccharides in pasting,rheology,texture and in vitro digestion:A review[J].International Journal of Biological Macromolecules,2022,207(3):81-89.
[11] ZHENG M J,LEI S Z,WU H Q,et al.Effect of chitosan on the digestibility and molecular structural properties of lotus seed starch[J].Food and Chemical Toxicology,2019,133(7):110731.
[12] DIAO Y J,SI X,SHANG W T,et al.Effect of interactions between starch and chitosan on waxy maize starch physicochemical and digestion proper ties[J].CyTA-Journal of Food,2017,15(3):327-335.
[13] SONG J L,ZONG J H,MA C Y,et al.Microparticle prepared by chitosan coating on the extruded mixture of corn starch,resveratrol,and α-amylase controlled the resveratrol release[J].International Journal of Biological Macromolecules,2021,185(6):773-781.
[14] PANDA P K,YANG J M,CHANG Y H,et al.Modification of different molecular weights of chitosan by p-coumaric acid:Preparation,characterization and effect of molecular weight on its water solubility and antioxidant property [J].International Journal of Biological Macromolecules,2019,136(6):661-667.
[15] HUANG S Q,CHAO C,YU J L,et al.New insight into starch retrogradation:The effect of shortrange molecular order in gelatinized starch[J].Food Hydrocolloids,2021,120(5):106921.
[16] LI M,WANG J,WANG F F,et al.Insights into the multi-scale structure of wheat starch following acylation:Physicochemical properties and digestion characteristics [J].Food Hydrocolloids,2022,124(11):107347.
[17] 王志伟,王喆,周中凯.不同支链比例玉米淀粉脱支重结晶后的组分变化[J].食品工业科技,2019,40(20):66-70.WANG Z W,WANG Z,ZHOU Z K.Composition changes of debranched and recrystallized corn starch with different branch ratio[J].Science and Technology of Food Industry,2019,40(20):66-70.
[18] WU C M,SUN R,ZHANG Q,et al.Synthesis and characterization of citric acid esterified canna starch(RS4)by semi-dry method using vacuummicrowave-infrared assistance[J].Carbohydrate polymers,2020,250(8):116985.
[19] YANG F,DU Q L,MIAO T,et al.Interaction between potato starch and Tremella fuciformis polysaccharide[J].Food Hydrocolloids,2022,127(1):107509.
[20] MU H Y,SONG Z X,WANG X,et al.Microencapsulation of algae oil by complex coacervation of chitosan and modified starch:Characterization and oxidative stability[J].International Journal of Biological Macromolecules,2022,194(12):66-73.
[21] 郑玉玉,杨晔,尹登科,等.微波对玉米淀粉结构及理化性质的影响[J].食品科学,2022,43(11):99-104.ZHENG Y Y,YANG Y,YIN D K,et al.Effect of microwave on the structure and physicochemical properties of maize starch[J].Food Science,2022,43(11):99-104.
[22] NING Y J,CUI B,YUAN C,et al.Effects of konjac glucomannan on the rheological,microstructure and digestibility properties of debranched corn starch[J].Food Hydrocolloids,2020,100(3):105342.
[23] MA Z,YIN X,CHANG D,et al.Long-and shortrange structural characteristics of pea starch modified by autoclaving,α-amylolysis,and pullulanase debranching [J].International Journal of Biological Macromolecules,2018,120(8):650-656.
[24] HUONG N T M,HOA P N,HUNG V P.Effects of microwave treatments and retrogradation on molecular crystalline structure and in vitro digestibility of debranched mung-bean starches[J].International Journal of Biological Macromolecules,2021,190(9):904-910.
[25] ABDUL HADI N,WIEGE B,STABENAU S,et al.Comparison of three methods to determine the degree of substitution of quinoa and rice starch acetates,propionates,and butyrates:Direct stoichiometry,FTIR,and 1H-NMR[J].Foods,2020,9(1):83.
[26] LI M,WANG F F,WANG J,et al.Manipulation of the internal structure of starch by propionyl treatment and its diverse influence on digestion and in vitro fermentation characteristics [J].Carbohydrate Polymers,2021,270(7):118390.
[27] ZHU C,ZOU S Q,RAO Z Q,et al.Preparation and characterization of hydroxypropyl chitosan modified with nisin[J].International Journal of Biological Macromolecules,2017,105(8):1017-1024.
[28] TANG H B,QU Y F,LI Y P,et al.Synthesis of hydroxypropylated debranched pea starch with high substitution degree in an ionic liquid,and its characterization and properties[J].Journal of Polymer Research,2018,25(11):1-11.
[29] JIA M,WANG X X,LIU J G,et al.Physicochemical and volatile characteristics present in different grain layers of various rice cultivars[J].Food Chemistry,2022,371(9):131119.
[30] 肖悦,刘敏,刘金光,等.黄变对大米流变特性以及内部结构的影响[J].食品科学,2020,41(11):22-27.XIAO Y,LIU M,LIU J G,et al.Effects of postharvest yellowing on rheological properties and internal structure of rice[J].Food Science,2020,41(11):22-27.
[31] XIE F,ZHANG H,XIA Y J,et al.Effects of tamarind seed polysaccharide on gelatinization,rheological,and structural properties of corn starch with different amylose/amylopectin ratios [J].Food Hydrocolloids,2020,105(8):105854.
[32] LIU Y Q,CHEN Q L,FANG F,et al.The influence of konjac glucomannan on the physicochemical and rheological properties and microstructure of canna starch[J].Foods,2021,10(2):422.