大豆油是世界三大植物油之一,因独特的风味以及烹饪特性而受到越来越多的关注。目前,大豆油的加工方式主要有压榨法和浸提法2 种。浸提法的优势是提取率较高,成本较低,饼粕中剩余油脂较少,且易于实现大规模的生产[1-2]。压榨法又可分为热榨和冷榨,采用热榨工艺生产油脂时,在榨油环节前需对油料进行烘焙、炒制等预处理,其产品风味比较丰富,出油率也比较高。然而,冷榨工艺制油过程中没有上述预处理环节,通常冷榨后的油脂只需经简单的精炼处理就可以食用。此外,冷榨油压榨过程的温度较低,产品中维生素E、甾醇等生物活性物质的损失较少[3],油脂的品质也较好。
油脂的风味是消费者选择食用植物油的重要标准[4]。食用植物油的风味物质是由一些挥发性物质构成的混合物。其组成较为复杂,主要含有醛类、酮类、酯类、醇类、酚类、吡嗪类、呋喃类和含硫化合物[5-6]等成分。近年来,关于加工方式对食用植物油风味的影响研究较为广泛。Zhang 等[7]研究发现菜籽烘焙过程中醛类化合物浓度会产生不同程度的改变,导致压榨所得菜籽油的风味发生变化。在一些花生油的风味研究中,也发现因加工方式而导致的风味差异,如Dun 等[8]研究发现冷榨花生油的风味主要是醛类化合物表现出的清新、油脂的气味。然而,热榨花生油不仅呈现油脂的气味,还具有烘焙和坚果味。这可能是由于热榨花生油的风味物质中含有吡嗪类和更多的呋喃类化合物。Yin 等[9]研究发现籽粒经烘烤处理的花生油中存在一些特有的杂环类风味化合物,并且萜烯类化合物相较于冷榨花生油有一定的减少,从而导致这两种花生油在风味上存在明显的差异。上述研究表明加工方式与食用植物油的风味密切相关。
还有一些研究表明大豆油在加工中风味物质主要包括醇类、醛类、酮类、酯类、烷类和呋喃类化合物[10-13]。Multari 等[14]探究了大豆油的煎炸属性,发现煎炸后大豆油的风味物质中醇类化合物含量下降,醛类、呋喃类化合物含量上升。Xiao 等[15]研究发现大豆油在烹饪过程中生成一些醛类、酮类、酸类和呋喃类风味化合物。上述研究主要针对大豆油挥发性风味物质种类和含量的检测以及对应用中大豆油的风味特征进行分析,而不同加工方式对大豆油风味的影响鲜见研究报道。本研究采用电子鼻与气质联用(GC-MS)相结合的方法对3种加工方式(浸提、热榨和冷榨)的大豆油产品的整体风味及其挥发性物质组成进行分析。通过主成分分析(PCA)、层次聚类分析(HCA)和偏最小二乘回归分析(PLSR)等方法探究3 种加工方式对大豆油风味的影响,并根据气味活度值(OAV)判定关键风味物质。研究结果旨在为追溯大豆油中风味物质的来源,改善大豆油风味提供理论参考。
1 材料与方法
1.1 材料与试剂
本试验用浸提油(EO)、热榨油(HPO)、冷榨油(CPO)为九三粮油工业集团有限公司出品,置于阴凉避光处储存。1,2-二氯苯(色谱纯级),上海安谱公司,甲醇(色谱纯级),美国Thermo Fisher Scientific 公司。
1.2 仪器与设备
PEN3 电子鼻,德 国Airsens 公 司;SAAB-57330U 顶空固相微萃取手动进样支架,美国Supelco 公司;57328-U 顶空固相微萃取纤维(DVB/CAR/PDMS 50/30 μm),美 国Supelco 公 司;QP2020NX 气相色谱-质谱联用仪(GC-MS),日本岛津仪器公司;DB-5MS(30 m×0.25 mm×0.25 μm)毛细管色谱柱,日本岛津仪器公司。
1.3 方法
1.3.1 加工方式对大豆油风味物质的影响
1.3.1.1 电子鼻(E-Nose)参照Tian 等[16]的方法并稍作修改,使用电子鼻对3 种大豆油气味特征进行分析,电子鼻系统包含10 个传感器探针:W1C(对芳香化合物、苯敏感)、W5S(对氮氧化物敏感)、W3C(对氨敏感)、W6S(对氢化物敏感)、W5C(对烯烃、短链芳香族化合物敏感)、W1S(对甲基敏感)、W1W(对硫化物、吡嗪敏感)、W2S(对醇、醛、酮敏感)、W2W(对有机硫化物敏感)、W3S(对长链烷烃敏感)。8 mL 大豆油样品放置到20 mL 顶空样品瓶中,60 ℃水浴加热30 min。电子鼻系统参数设定为腔室流速200 mL/min,注射流速200 mL/min,测量持续120 s。用空气作为载气对传感器阵列进行清洗,使信号响应归零;样品注入量为200 μL。每个样品重复测量3 次,取平均值作进一步分析。
1.3.1.2 顶空固相微萃取-气质联用(HS-SPME/GC-MS)参照秦早等[17]的GC-MS 方法并稍作修改,将浸提、热榨、冷榨大豆油样品各取8 mL 于20 mL 顶空样品瓶中,每种样品取3 份,分别加入4 μL 标准品1,2-二氯苯并混合,用聚四氟乙烯瓶盖封隔,避光保存。将二乙烯基苯/羧基/聚二甲基硅氧烷(DVB/CAR/PDMS)纤维头在GC-MS 进样口处老化30 min,温度为250 ℃,老化完成后再插入配备好的样品顶空瓶内,在60 ℃条件下萃取40 min。采用DB-5 毛细管色谱柱分离挥发性化合物。将萃取头插入气GC-MS 进样口,在250 ℃条件下解析5 min。升温程序:40 ℃保持3 min,以5℃/min 升至80 ℃,保持5 min;以10 ℃/min 升至160 ℃,保持2 min;以10 ℃/min 升至230 ℃,保持8 min。载气(He)流速为1 mL/min。质谱条件:电子能量70 eV;传输线温度280 ℃;离子源温度230℃;质量扫描范围m/z 30~450。通过将试验质谱库与NIST17 的质谱库进行比较,鉴定了挥发性化合物。根据目标化合物的峰面积与内标物的峰面积之比,计算最终挥发性化合物的含量(以mg/kg 表示)。
1.3.2 关键风味物质的确定 根据Erten 等[18]的研究,进行GC-MS 定量检测后,通过计算OAV 值来评价单个挥发性物质对整体风味的贡献度,当OAV>1 时,则可以认为该挥发组分对整体风味产生了明显的影响。
1.4 统计分析
采用SPSS 26 软件进行显著性分析(P<0.05)。PCA 采用Origin 2022b 软件。GC-MS 检测的挥发性风味物质使用Tbtools 中的HCA 热图对比分析。PLSR 使用The Unscrambler X。上述所有试验均进行3 次重复,取平均值。
2 结果与分析
2.1 电子鼻对大豆油风味化合物的分析
利用PCA 对大豆油风味的空间分布进行了分析。如图1a 所示,PC1 和PC2 对总方差的贡献率分别为74.30%和18.90%,总和达到93.20%,提示主成分分析能够反映不同加工方式大豆油的风味特征。大豆油样品之间的风味差异主要在PC1上,3 个样品载荷图分布差异明显,EO、HPO、CPO都有各自的香气区,且平行测定结果较为稳定。EO 风味主要聚集在PC2 正轴附近,与W2W、W3S传感器较为相关。HPO 风味主要聚在PC1 的正轴上,与W1S、W2S、W5S、W6S、W1W 传感器相关性较强;而CPO 风味主要聚在PC1 的负轴上,与W1C、W3C、W5C 传感器相关性较强。这些结果表明EO、HPO 和CPO 挥发性风味物质的主要成分之间存在显著差异(P<0.05),也表明电子鼻很好的区分了不同加工工艺大豆油的风味。
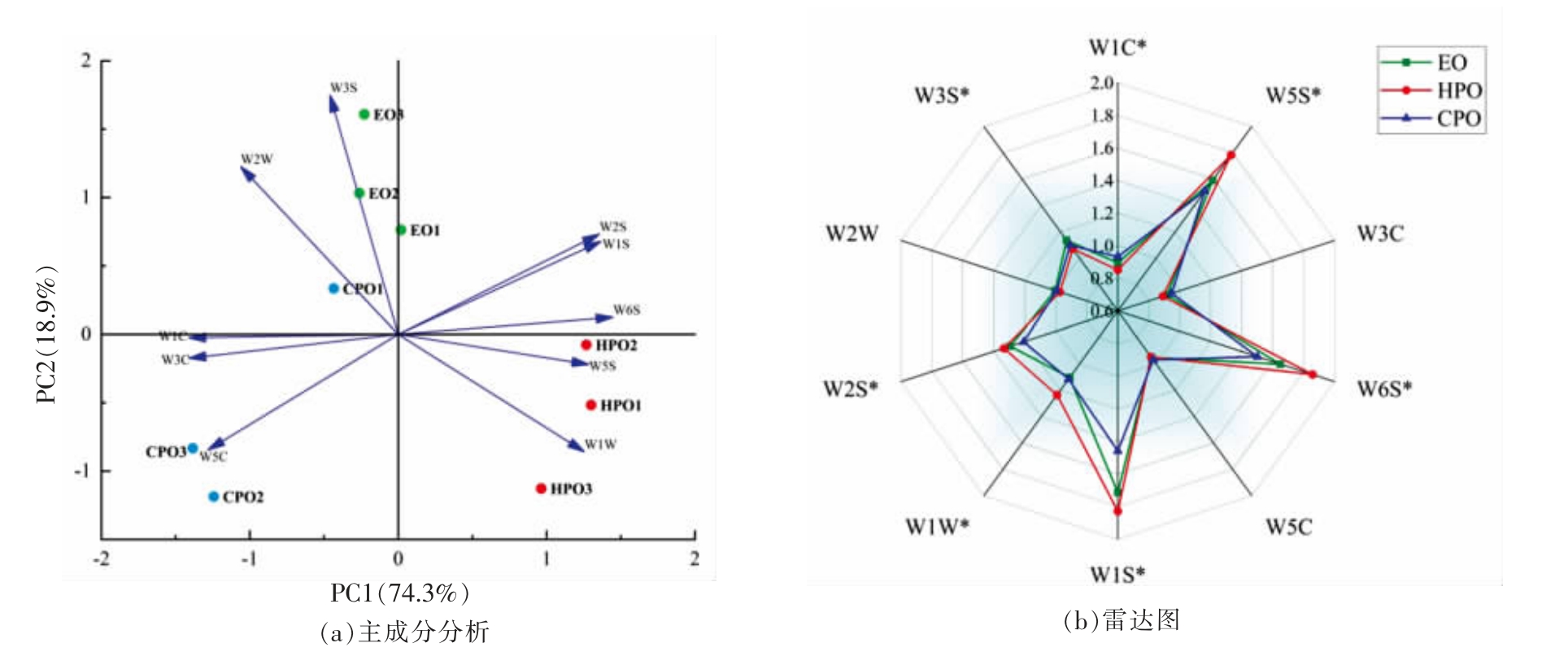
图1 加工方式对大豆油风味化合物的影响
Fig. 1 Effects of processing methods on flavour compounds in soybean oil
注:b 图中“*”表示该传感器响应差异显著(P<0.05)。
电子鼻对3 种大豆油样品响应值如图1b 所示,W1W(对吡嗪等杂环物质敏感)、W1S(对甲基敏感)、W2S(对醇、醛、酮敏感)、W3S(对长链烷类敏感)、W5S(对烯烃敏感)、W6S(对氢化物敏感)和W1C(对芳香化合物、苯敏感)传感器对不同加工方式大豆油样品中挥发性化合物的响应值均有明显差异。从整体上看,HPO 风味较为丰富,EO次之,而CPO 风味物质较寡淡。W1W、W1S、W6S和W5S 传感器对HPO 的响应值高于EO 和CPO,表明在HPO 的风味物质中可能含有更多的杂环类、硫化物、烯烃及一些氢化物;W2S 传感器对HPO 和EO 响应值高于CPO,表明HPO 和EO 的风味物质中醇类、醛类和酮类化合物多于CPO,因此3 种大豆油在传感器上响应值的差异可以表明加工方式对大豆油挥发性风味物质组成的影响是显著的(P<0.05)。
2.2 HS-SPME/GC-MS 对大豆油风味成分的分析
采用HS-SPME/GC-MS 对EO、HPO 和CPO的挥发性风味物质进行检测分析,具体风味成分和种类如表1 所示。共检出86 种风味物质,包括醛类16 种、醇类14 种、酸类7 种、萜类4 种、酯类6 种、酮类12 种、烯烃5 种、杂环类14 种、烷烃4种、酚类2 种、其它物质2 种。不同加工方式的大豆油风味物质组成存在较大差异,其中EO 中检测出53 种,HPO 中检测出54 种,CPO 中检测出45 种风味物质。3 种大豆油有相同的挥发性物质24 种。
表1 3 种大豆油中检出挥发性风味化合物含量及CAS 号
Table 1 Contents and CAS numbers of volatile flavour compounds detected in three soybean oils

(续表1)

(续表1)

注:“-”表示未检出或未查询到CAS 号;表中序号和物质与原文图3、图5 中序号相对应。
2.2.1 大豆油样品风味物质种类及所含物质数比较 将3 种大豆油样品的检测结果按照所含挥发性物质的种类进行统计。如图2 所示,EO、HPO 和CPO 的风味物质存在一定的差别。在总体上,3 种大豆油样品中检出的醛类、醇类和酮类挥发性风味物质较多。CPO 检出的挥发性物质较少(45种),这是由于加工过程经历化学及热处理程度较浅[19],风味相对寡淡所致;HPO 样品中检出风味物质的种类最多,而且其中含有13 种杂环类物质,明显多于另外2 种大豆油样品(只检测出3 种杂环类物质),这一结果与电子鼻的检测结果一致。造成这种差异的原因可能是HPO 在加工过程中的热炒或烘烤促进了油脂中的羰基与蛋白质分解出的氨基发生美拉德反应,从而生成酮类和杂环类等挥发性物质;此外,EO 中检出醛类物质14种、醇类物质14 种,均多于另外2 种大豆油样品,这可能是因为油料在加工过程中的升温或者萃取剂的加入引起最终产品风味物质的变化。从风味物质的种类上也可以发现不同加工方式的大豆油存在着明显的差异。

图2 不同工艺大豆油中各类风味物质
Fig. 2 Various types of flavour substances in soybean oil from different processes
2.2.2 大豆油风味化合物的HCA 分析 采用层次聚类(HCA)分析EO、HPO 和CPO 中风味物质并绘制热图。如图3 所示,3 种大豆油的挥发性化合物组成差异明显,聚集在不同的区域。检出的挥发性物质中醛类浓度最大,这主要是因为油脂发生氧化反应所产生的结果,例如,亚油酸发生氧化反应能够产生己醛和(E,E)-2,4-癸二烯醛,而辛醛和庚醛等则是油酸氧化反应的衍生物[13]。此外,一些存在于油脂中经典的风味物质,例如1-辛烯-3-醇(20)、(E,E)-2,4-癸二烯醛(13)等在3种大豆油中均有大量的检出,具有蘑菇和脂肪风味[20]。
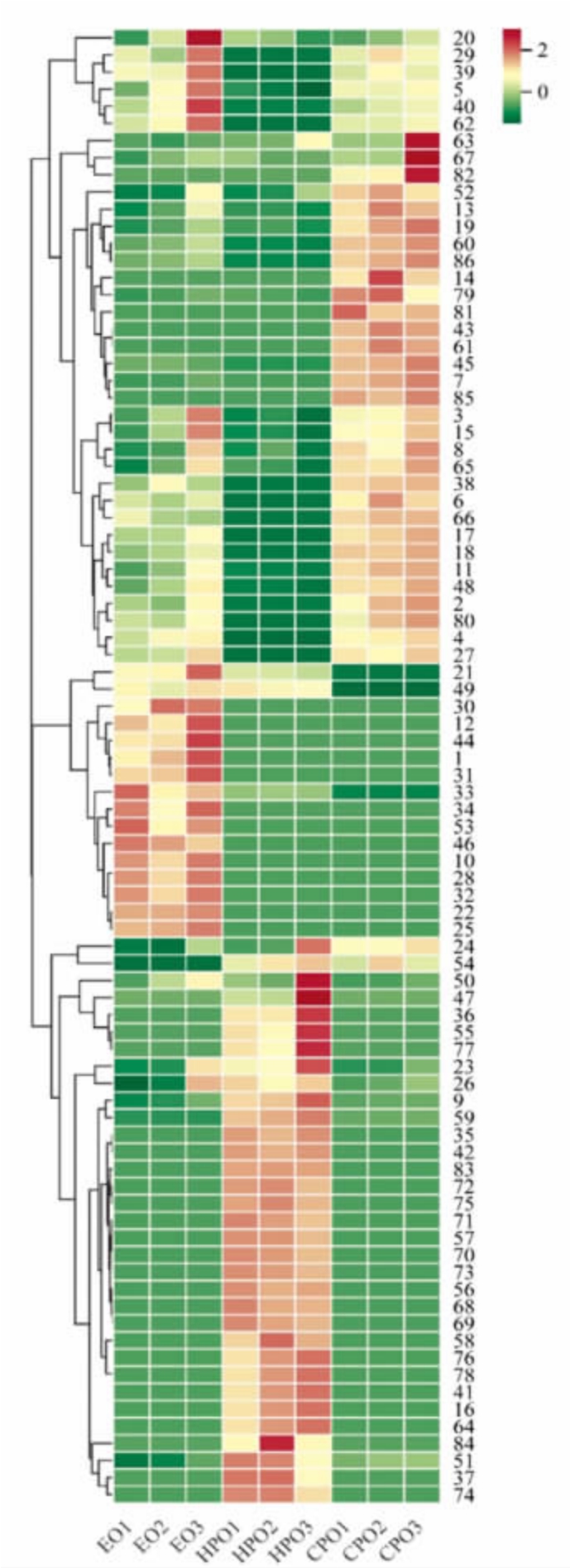
图3 大豆油GC-MS 定量检测HCA 热图
Fig. 3 Heat map for quantitative detection of HCA in soybean oil by GC-MS
注:图中序号为表1 中所对应的风味物质。
在HPO 风味物质中检出了具有焦糖风味的麦芽酚(83)以及多种风味阈值较低的杂环类化合物。例如,2,5-二甲基吡嗪(71),具有可可风味;糠醛(69)属于呋喃醛的一种,具有烤土豆和面包风味;2-呋喃甲醇(70),具有烧焦的甜味,而在EO和CPO 中并未检出上述物质。产生这种差异的原因可能是HPO 在加工中有一些加热炒制的环节,促进了美拉德反应,会产生二羰基化合物,从而进一步形成杂环类化合物,其中糠醛就是在热反应过程中由1-脱氧索酮生成[21],从而使HPO 的风味更加丰富。此外,HPO 风味物质中还检出了一些酸类(0.854 mg/L)和酮类(2.906 mg/L)化合物。这些挥发性物质在HPO 的整体风味中具有重要贡献。
CPO 的挥发物中含有较多的醛类(6.491 mg/L)化合物,例如(E,E)-2,4-庚二烯醛(7)、己醛(3)等物质,其风味通常表现为清新味和脂肪味。CPO 中还含有较多的烷烃和烯烃,这些物质是在脂质过氧化过程中由脂质氢过氧化物所形成[22],如3-甲氧基-1,7-辛二烯(61)(0.049 mg/L)、十二烷(79)(0.213 mg/L)。然而,烷烃和烯烃的气味阈值较高,对整体风味影响很小。
EO 样品中风味物质的种类较多,主要包括醇类(5.024 mg/L)、醛 类(3.809 mg/L)、酸 类(0.737 mg/L)和酮类(1.125 mg/L)等化合物。
值得注意的是,CPO 中醛类物质含量高于另外2 种大豆油的。原因在于EO、HPO 两种油均经历过高温处理,会损失一些醛类物质;而EO 中醛类物质总体含量高于HPO 的(3.809 mg/L),这可能是因为EO 在精炼过程中的高温导致油脂氧化程度较高,引起一些醛类物质的可逆增长[23]。此外,在CPO 和EO 样品中还检测出了一定浓度的α-蒎烯(38)、4-蒈烯(39)等萜烯类挥发性物质,具有松油和青草气味,其对大豆油样品整体风味具有一定的贡献。
2.2.3 大豆油风味化合物的OAV 分析 挥发性物质浓度的高低并不能直接评判其对整体风味的影响。在众多复杂的挥发性物质中,一些被称为关键风味物质的化合物对整体风味产生强烈的影响。因此,应该确定这些关键风味化合物,而不是简单地观察挥发性物质的整体情况[5]。OAV 是评价挥发性化合物对风味贡献的指标,计算方法是采用挥发性化合物的浓度除以其风味阈值,这表明浓度和气味阈值共同影响挥发性物质对整体香气的贡献[24]。通常认为OAV>1 的挥发性成分是关键风味化合物。
将GC-MS 定量分析数据与气味阈值相结合,确定3 种大豆油样品中挥发性物质OAV 值。EO、HPO 和CPO 中OAV>1 的物质及其相应风味描述如表2 所示,大豆油样品中OAV>1 的挥发性物质主要是醛类、醇类、酮类和杂环类化合物。3 种大豆油样品中共有的关键风味物质包括:己醛、庚醛、(E)-2-辛烯醛、(E)-2-壬烯醛、(E,E)-2,4-庚二烯醛、1-辛烯-3-醇、苯乙醇、2-戊基呋喃和3,5-辛二烯-2-酮。其中具有蘑菇和油脂味的1-辛烯-3-醇在3 个样品中OAV 值较高,对大豆油风味有重要的影响。
表2 EO、HPO 和CPO 风味物质OAV 值
Table 2 Flavour compounds OAV value of EO,HPO and CPO

注:表中“-”表示未检出。
比较3 种大豆油风味物质的OAV 值,CPO 的关键风味物质以醛类为主,其中具有绿色植物风味的(E,E)-2,4-庚二烯醛的OAV 值为71.03、己醛的OAV 值为8.61,大于EO 和HPO 中的OAV。(E,E)-2,4-庚二烯醛和己醛对CPO 整体风味影响较大,导致CPO 与天然油脂的风味较为接近。这可能是由于CPO 较低温度下的直接压榨,油料细胞破碎过程中脂氧合酶的钝化程度低,使得脂氧合酶反应程度较大[8]。雷春妮等[25]的研究也发现促进脂氧合酶反应可以增强初榨橄榄油中的“绿色”风味。
EO 的关键风味物质以醛类、醇类、酮类化合物为主,其中3-壬烯-2-酮的OAV 值为62.91,其风味表现为浆果味、香料味和辛辣味;此外,EO 中虽然也检出了一些杂环类挥发性物质,但只有2-戊基呋喃对整体风味具有贡献。
HPO 的关键风味物质中含有很多杂环类挥发性物质,例如甲基吡嗪(1.52)、糠醛(1.53)、2,5-二甲基-吡嗪(16.86)等杂环类化合物,呈现为木质、烘焙和可可等风味[26]。这些风味化合物可能导致HPO 与EO、CPO 的风味特征存在较大差异。
使用韦恩图对EO、HPO、CPO 中关键风味物质进行分类,进一步探究3 种大豆油样品关键风味物质的差异。如图4a 图所示,HPO 中特有4 种关键风味化合物,EO 中特有3 种关键风味物质,这些化合物的存在可能是不同加工方式大豆油之间风味特征差异的原因。图4b 中给出了差异风味物质的分子结构示意图。HPO 中是甲基吡嗪、糠醛、5-甲基-2-呋喃甲醛和2,5-二甲基-吡嗪;EO中含有戊醛、3-壬烯-2-酮、(E,Z)-2,6-壬二烯醛。HPO 中特有关键风味物质与压榨前进行的热处理有很大关系。糠醛和5-甲基-2-呋喃甲醛是在美拉德反应第二阶段中由Amadori 和Hyens 化合物发生1,2-烯醇化反应,释放氨基,进一步降解脱掉一分子水后环化生成的[27];甲基吡嗪和2,5-二甲基-吡嗪是在Strecker 降解过程中,α-氨基酮的自动缩合或与其它氨基酮缩合反应而来。吡嗪分子结构中的碳骨架则是来自于美拉德反应中碳水化合物的降解,而氮原子则可能来源于氨基酸[28,29]。这可能与HPO 在压榨工艺之前对大豆籽粒采取了高温炒制与烘烤处理有关。Siegmund等[30]的研究表明高温烘焙过程中生成的烷基化吡嗪和2-乙酰基吡咯有助于南瓜籽油的坚果和烘焙风味的形成。Ho 等[31]的研究中也表明棕榈油中含有的吡嗪类化合物是在油料的加热处理过程中产生的。EO 在加工过程中经历了较为复杂的精炼环节,其中脱臭环节的高温和真空处理对风味物质的影响较大,会损失一些风味阈值较低的吡嗪类化合物[23],导致油脂整体风味中烘焙味较弱,这与检测结果相吻合。EO 中特有关键风味物质戊醛、3-壬烯-2-酮、(E,Z)-2,6-壬二烯醛的产生可能是因为精炼过程的热处理导致油脂中生成一些不饱和脂肪酸,而这些不饱和脂肪酸的双键被氧化又会生成性质不稳定的氢过氧化物,在高温下分解成醛类和酮类等二级氧化产物[32-34],从而导致EO 与HPO、CPO 的风味物质组成存在较大的差异。综合上述分析,EO、HPO 和CPO 的整体风味差异较大,表明加工方式对大豆油风味产生了明显的影响。
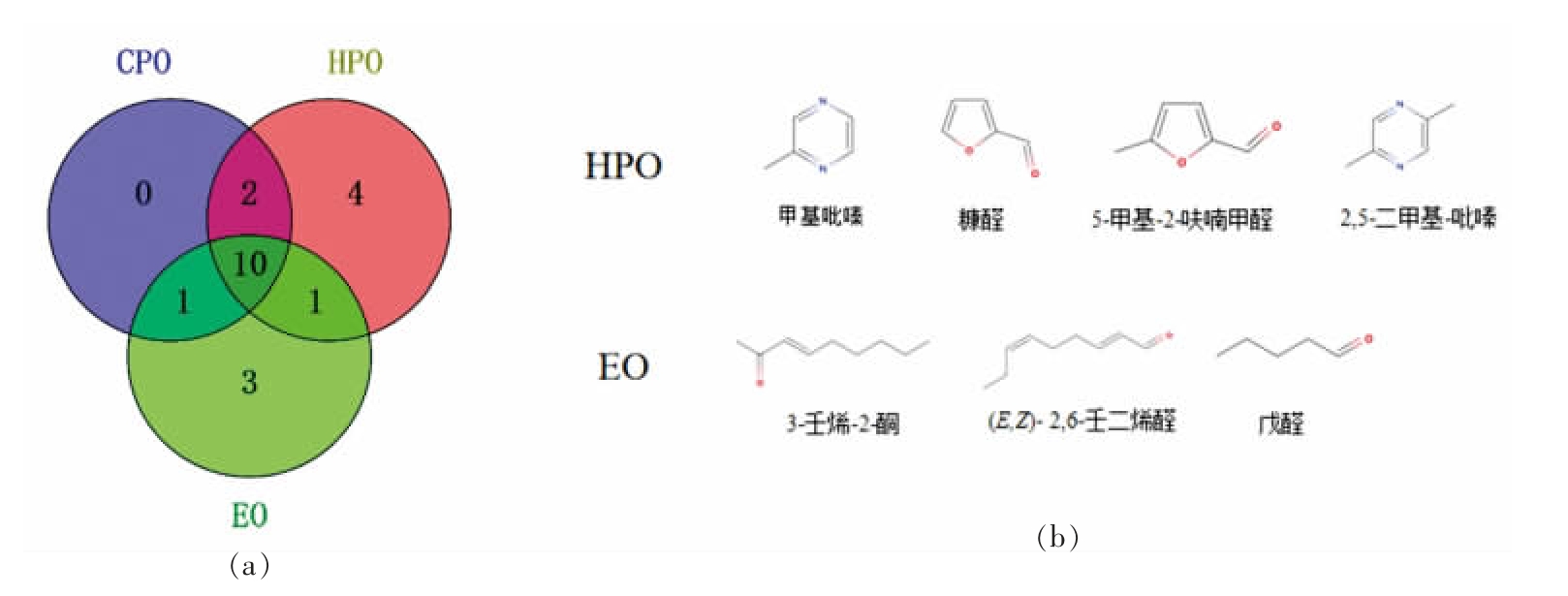
图4 EO、HPO、CPO 中关键风味物质差异韦恩图(a)和分子结构图(b)
Fig. 4 Venn diagram(a)and molecular structure chart(b)of key flavour substance differences in EO,HPO and CPO
2.3 电子鼻与GC-MS 检测结果的相关性分析
采用PLSR 分析电子鼻与GC-MS 检测结果的关联性。如图5 所示,红色为电子鼻传感器的响应值,蓝色为GC-MS 检出的挥发性化合物。
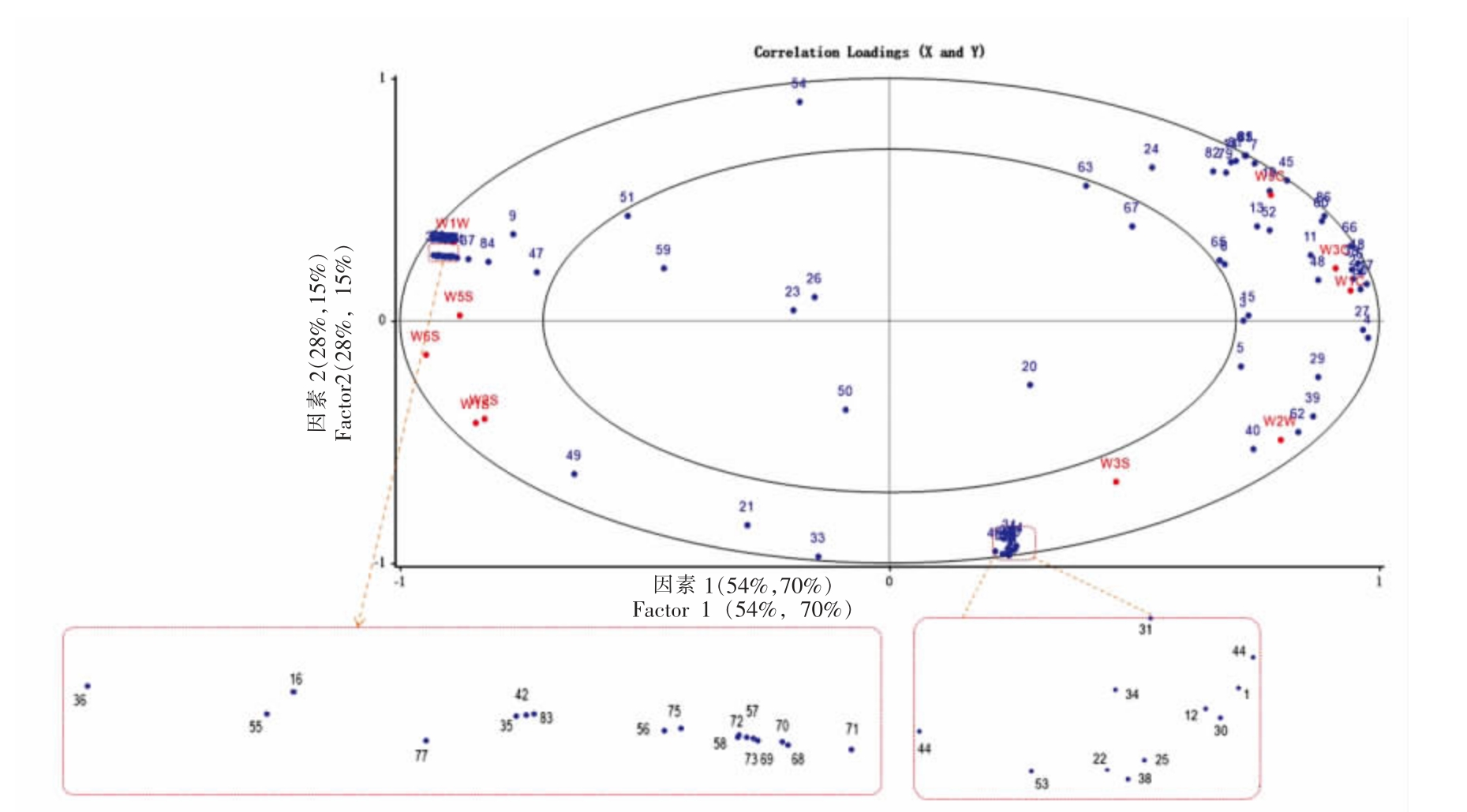
图5 电子鼻传感器响应值与GC-MS 检出挥发性物质的相关性PLSR 图
Fig. 5 PLSR plot of the correlation between E-nose sensor response values and volatile compounds detected by GC-MS
注:图中序号为表1 中所对应的风味物质。
传感器响应值与GC-MS 检测结果的总方差分别为82%和85%,因此PLSR 能够较好的解释2个变量之间的关系。电子鼻和GC-MS 检测结果之间的关系可以采用它们在图中的位置进行说明。位于两个椭圆间的挥发性物质被认为与电子鼻的检测结果相关。小椭圆内部的挥发性物质则与电子鼻检测结果的关联性较差。从整体上看,EO、HPO 和CPO 样品中的大多数风味物质存在于两个椭圆之间,这表明电子鼻与GC-MS 检测结果之间存在较好的相关性。
传感器W1C、W3C、W5C 位于因素1 和因素2 的正区域,与醇类、醛类、酮类和烷类等挥发性物质均有正相关性。这一区域包含(E,E)-2,4-癸二烯醛(13)、(E)-2-壬烯醛(11)、1-辛醇(24)、(E)-2-辛烯醛(8)、2-庚酮(48)、3,5-辛二烯-2-酮(52)、十二烷(79)和十四烷(82)等挥发性物质。
传感器W1W、W5S 位于因素1 负区域和因素2 正区域,与壬醛(9)、十七烯酸(37)、乙二醇二乙酯(47),杂环类化合物例如2,5-二甲基-呋喃甲醇(71)、2-甲基-二氢呋喃酮(77)和吡咯(74),以及酚类化合物例如5-乙烯基-2-甲氧基-苯酚(84)等呈正相关关系。
传感器W1S、W2S、W6S 位于因素1 和因素2的负区域,与2-乙基-3-甲基-2-环戊烯酮(49)、3-辛醇(21)和(E)-9-十八碳烯酸(33)等化合物存在一定程度的正相关性。
传感器W2W、W3S 位于因素1 正区域和因素2 负区域,与1,3-壬二烯(62)、3-甲基-1,6-庚二烯-3-醇(29)、庚醛(5)、戊醛(1)、1-壬烯-4-醇(25)以及萜类化合物例如α-侧柏烯(40)和4-蒈烯(39)等呈正相关性。综合上述结果,采用电子鼻和GC-MS 的协同分析能够鉴定不同加工方式大豆油的风味。
3 结论
本研究采用电子鼻与HS-SPME/GC-MS 相结合的方法对不同加工方式大豆油的风味进行研究。表明EO、HPO 和CPO 的风味物质存在较大差异。在3 种大豆油样品中,GC-MS 共检测出86 种挥发性风味物质;通过计算OAV 值确定EO 的关键风味物质中存在较多的醛类和酮类化合物,其中具有浆果味和辛辣味的3-壬烯-2-酮对油脂风味的影响很大,HPO 的关键风味物质中含有较多的杂环类化合物例如2,5-二甲基-吡嗪,使油脂具有烘焙和坚果风味,CPO 的风味受醛类物质影响较大,与天然油脂的风味相近,具有清新的、绿色植物味。另外,PLSR 表明电子鼻与GC-MS 检测结果之间具有较好的相关性。这些结果表明加工方式对大豆油的挥发性物质组成以及风味特性有明显的影响。
[1] 张凯淇,于泽,刘子伟,等.大豆油提取工艺研究进展[J].农产品加工,2022(11):85-88.ZHANG K Q,YU Z,LIU Z W,et al.Analysis and research progress of soybean oil production processes[J].Farm Products Processing,2022(11):85-88.
[2] 刘金,江敏,岳希洁,等.茶籽油提取技术及研究进展[J].食品工业,2022,43(4):283-286.LIU J,JIANG M,YUE X J,et al.Advances in research on extraction technologies of camellia seed oil[J].The Food Industry,2022,43(4):283-286.
[3] 余顺波,陈长艳,张品,等.11 种食用植物油的脂肪酸组成及主要营养成分含量[J].贵州农业科学,2022,50(7):113-120.YU S B,CHEN C Y,ZHANG P,et al.Fatty acid composition and main nutritional components of 11 edible vegetable oils[J].Guizhou Agricultural Sciences,2022,50(7):113-120.
[4] BONTE A,BRÜHL L,VOSMANN K,et al.A chemometric approach for the differentiation of sensory good and bad(musty/fusty)virgin rapeseed oils on basis of selected volatile compounds analyzed by dynamic headspace GC-MS[J].European Journal of Lipid Science and Technology,2016,119(4):1600259.
[5] ZHANG W,CAO X,LIU S Q.Aroma modulation of vegetable oils -A review[J].Critical Reviews in Food Science and Nutrition,2020,60(9):1538-1551.
[6] ANGEROSA F,MOSTALLINO R,BASTI C,et al.Virgin olive oil differentiation in relation to extraction methodologies[J].Journal of the Science of Food and Agriculture,2000,80(15):2190-2195.
[7] ZHANG L Y,CHEN J,ZHANG J X,et al.Lipid oxidation in fragrant rapeseed oil:Impact of seed roasting on the generation of key volatile compounds[J].Food Chemistry:X,2022,16:100491.
[8] DUN Q,YAO L,DENG Z Y,et al.Effects of hot and cold-pressed processes on volatile compounds of peanut oil and corresponding analysis of characteristic flavor components[J].LWT-Food Science and Technology,2019,112:107648.
[9] YIN W T,MARADZA W,XU Y F,et al.Comparison of key aroma-active composition and aroma perception of cold-pressed and roasted peanut oils[J].International Journal of Food Science &Technology,2022,57(5):2968-2979.
[10] MILDNER-SZKUDLARZ S.Application of headspacesolid phase microextraction and multivariate analysis for plant oils differentiation [J].Food Chemistry,2003,83(4):515-522.
[11] HU W,ZHANG L X,LI P W,et al.Characterization of volatile components in four vegetable oils by headspace two-dimensional comprehensive chromatography time-of-flight mass spectrometry[J].Talanta,2014,129:629-635.
[12] LIU Y,MA X,LI J W,et al.Study on the antioxidative mechanism of tocopherol loaded ethyl cellulose particles in thermal-oxidized soybean oil[J].Carbohydrate Polymers,2022,276:118734.
[13] HAIYAN Z,BEDGOOD D R,BISHOP A G,et al.Endogenous biophenol,fatty acid and volatile profiles of selected oils[J].Food Chemistry,2007,100(4):1544-1551.
[14] MULTARI S,MARSOL-VALL A,HEPONIEMI P,et al.Changes in the volatile profile,fatty acid composition and other markers of lipid oxidation of six different vegetable oils during short-term deepfrying[J].Food Research International,2019,122:318-329.
[15] XIAO L,LI C W,CHAI D,et al.Volatile compound profiling from soybean oil in the heating process[J].Food Science &Nutrition,2020,8(2):1139-1149.
[16] TIAN P,ZHAN P,TIAN H L,et al.Effects of different vegetable oils on the aroma characteristics of deep-fried shallot flavoring evaluated by HSSPME/GC-MS coupled with PLSR[J].Journal of Food Processing and Preservation,2020,44(9):e14698.
[17] 秦早,杨冉,高桂园,等.顶空固相微萃取结合气质联用分析芝麻油和芝麻香精的挥发性成分[J].食品科学,2012,33(24):263-268.QIN Z,YANG R,GAO G Y,et al.Determination of volatile compounds in sesame oil and sesame flavor using headspace solid-phase microextraction and GC-MS[J].Food Science,2012,33(24):263-268.
[18] ERTEN E S,CADWALLADER K R.Identification of predominant aroma components of raw,dry roast ed and oil roasted almonds[J].Food Chemistry,2017,217:244-253.
[19] KIRALAN M,RAMADAN M F.Volatile oxidation compounds and stability of safflower,sesame and canola cold-pressed oils as affected by thermal and microwave treatments[J].Journal of Oleo Science,2016,65(10):825-833.
[20] MATHEIS K,GRANVOGL M.Characterisation of the key aroma compounds in commercial native cold-pressed rapeseed oil by means of the SensOmics approach[J].European Food Research and Technology,2016,242(9):1565-1575.
[21] GRACKA A,JELEN H H,MAJCHER M,et al.Flavoromics approach in monitoring changes in volatile compounds of virgin rapeseed oil caused by seed roasting [J].Journal of Chromatography A,2016,1428:292-304.
[22] ZHANG Y F,WU Y Q,CHEN S R,et al.Flavor of rapeseed oil:An overview of odorants,analytical techniques,and impact of treatment[J].Comprehensive Reviews in Food Science and Food Safety,2021,20(4):3983-4018.
[23] 仲琴.菜籽油精炼和储藏过程中品质及香气成分变化研究[D].绵阳:西南科技大学,2021.ZHONG Q.Study on changes of quality and aroma components of rapeseed oil during refining and storage[D].Mianyang:Southwest University of Science and Technology,2021.
[24] YANG P,SONG H L,WANG L J,et al.Characterization of key aroma-active compounds in black garlic by sensory-directed flavor analysis[J].Journal of Agricultural and Food Chemistry,2019,67(28):7926-7934.
[25] 雷春妮,张雅珩,李经纬,等.不同品种与加工工艺对初榨橄榄油挥发性风味成分的影响[J].中国油脂,2019,44(10):35-41,54.LEI C N,ZHANG Y H,LI J W,et al.Effects of different varieties and processing technologies on volatile flavor components of virgin olive oil[J].China Oils and Fats,2019,44(10):35-41,54.
[26] JIA X,DENG Q,YANG Y,et al.Unraveling of the aroma-active compounds in virgin camellia oil(Camellia oleifera Abel)using gas chromatographymass spectrometry -olfactometry,aroma recombination,and omission studies[J].Journal of Agricultural and Food Chemistry,2021,69(32):9043-9055.
[27] 李亚丽,刘晓徐,郑培华,等.美拉德反应研究进展[J].食品科技,2012,37(9):82-87.LI Y L,LIU X X,ZHENG P H,et al.Progress on applications of the Maillard reaction[J].Food Science and Technology,2012,37(9):82-87.
[28] LIU X J,JIN Q Z,LIU Y F,et al.Changes in volatile compounds of peanut oil during the roasting process for production of aromatic roasted peanut oil[J].Journal of Food Science,2011,76(3):C404-12.
[29] YU H,ZHANG R Y,YANG F W,et al.Control strategies of pyrazines generation from Maillard reaction[J].Trends in Food Science &Technology,2021,112:795-807.
[30] SIEGMUND B,MURKOVIC M.Changes in chemical composition of pumpkin seeds during the roasting process for production of pumpkin seed oil(Part 2:volatile compounds)[J].Food Chemistry,2004,84(3):367-374.
[31] HO C W,AIDA W M W,MASKAT M Y,et al.Changes in volatile compounds of palm sap(Arenga pinnata)during the heating process for production of palm sugar [J].Food Chemistry,2007,102(4):1156-1162.
[32] SILVAGNI A,FRANCO L,BAGNO A,et al.Thermoinduced lipid oxidation of a culinary oil:A kinetic study of the oxidation products by magnetic resonance spectroscopies[J].The Journal of Physical Chemistry A,2010,114(37):10059-10065.
[33] TAVAKOLI A,SAHARI M A,BARZEGAR M,et al.The effect of refining process on the volatile compounds,oxidation stability and fatty acids profile of soybean oil using an electrostatic field[J].Journal of Food Processing and Preservation,2021,46(1):1-14.
[34] FANG Z Y,LI G Z,GU Y,et al.Flavour analysis of different varieties of camellia seed oil and the effect of the refining process on flavour substances[J].LWT -Food Science and Technology,2022,170:114040.