雷竹笋(Phyllostachys praecox),简称雷笋,是我国特有的优良栽培食用竹种。雷笋,味道鲜美,营养丰富,是一种优质的森林蔬菜,深受人们喜爱。雷笋中富含氨基酸和多种矿物质元素和维生素,其中半纤维、木质素、膳食纤维含量也很高,具有减肥、防癌、降血脂和抗衰老等保健功效[1]。然而,雷笋采收期集中,采后水分流失迅速,从切口开始形成纤维化或木质化,笋肉逐渐褐化腐烂,最终使整支竹笋失去商业和食用价值。
竹笋是竹鞭的芽萌发分化而形成的膨大的芽,代谢旺盛,将竹笋从泥土中挖取后,竹笋会发生一系列复杂的生理、生化变化,加速竹笋的衰老,使竹笋失去原有的口感[2]。竹笋的老化主要表现为笋肉质地变硬,颜色变黄[3]。有研究表明导致竹笋衰老、影响竹笋品质的主要因素是木质素的积累[4]。在竹笋木纤化过程中有多种酶起重要作用。比如苯丙氨酸解氨酶是苯丙烷途径的限速酶,它的活性高、低制约着木质素相关3 种芳香醇的产量,过氧化物酶则在最终合成纤维素和木质素中起着关键作用[5]。竹笋膳食纤维的积累过程与肉桂酸-4-羟基化酶和肉桂醇脱氢酶等活性有关。
本文将雷笋分别在常温(25 ℃)和低温(4 ℃)条件下贮藏,测定雷笋的木质素含量,木纤化相关的酶活性及基因的相对表达量,旨在为雷笋采后贮藏提供一个新方法。
1 材料与方法
1.1 材料与试剂
雷笋(Phyllostachys praecox)均采收于安吉盈元农场,当天采收和处理。
愈创木酚、过氧化氢、硼砂、硼酸、L-苯丙氨酸、过氧化氢,国产分析纯试剂;肉桂酸-4-羟基化酶联免疫分析试剂盒,上海江莱有限公司;肉桂醇脱氢酶联免疫分析试剂盒,北京Solarbio 科技有限公司。
1.2 仪器与设备
CHR OMA METER CR-400 手持色差仪,日本SEMSING 公司;Thermo MR23i 高速低温冷冻离心机,法国JOUAN 公司;UV-1800 紫外分光光度计,日本岛津公司;DK-8D 电热恒温水槽,上海精宏实验设备有限公司。
1.3 方法
1.3.1 雷笋处理 将雷笋置于封闭的无菌工作台上充分晾干(避免病原菌和虫蝇污染),分装于60 μm 厚的聚乙烯袋中,每袋8 根笋体,袋口用橡皮筋缠绕两圈,分别于4 ℃和25 ℃条件下贮藏,25℃条件下贮藏期间每2 d 取鲜样;4 ℃条件下贮藏期间每6 d 取鲜样经液氮速冻后置于-80 ℃超低温冰箱中保存以测定木纤化相关酶活以及相关基因表达水平,重复3 次。
1.3.2 色泽测定 雷笋色泽测定,采用手持色差仪测定。将手持色差仪用白板进行校准后,对每组雷笋进行L*、a*和b*值的测定,每组记录5 个点,取平均值,以未处理样品色泽值为对照色泽。计算色差总值△E。计算公式如下:
1.3.3 雷笋木质素含量的测定 木质素含量测定参照Gan等[6]的方法并做修改,称取雷笋冻样10 g 置于液氮中研磨成粉末,加入75 mL 蒸馏水和25 mL 硫酸搅拌均匀,常温静置4 h,随后加250 mL 蒸馏水沸水浴2 h。冷却后用恒重的砂芯漏斗抽滤,滤液中加10% BaCl2 溶液无絮状沉淀时停止抽滤,烘干漏斗至恒重。由漏斗质量变化计算木质素含量。
1.3.4 雷笋木纤化相关酶活的测定
1.3.4.1 过氧化物酶活性的测定 冰浴条件下,称取1.0 g 雷笋研磨样于离心管,加入提取缓冲液,低温离心后取酶液备用。POD 活性测定参考周成敏等[7]的方法,有所改动。测定时于试管中依次加入酶液0.4 mL,愈创木酚溶液0.2 mL,过氧化氢溶液2.4 mL,混匀,以蒸馏水调零,反应15 s 后开始计时,测定反应液在3 min 内于波长470 nm 处吸光值的变化,至少6 个点。
1.3.4.2 苯丙氨酸解氨酶活性的测定 PAL 活性测定参考史蔓蔓等[8]的方法,稍作修改。冰浴条件下,准确称取1.00 g 雷笋研磨样于离心管,加入提取缓冲液5 mL,低温离心,取上清液低温备用。测定时于试管中依次加入3 mL 硼酸缓冲液,0.5 mL L-苯丙氨酸,在37 ℃保温平衡10 min 后加入0.5 mL 酶液,混合后迅速测定其在波长290 nm 的吸光值为OD0,再将反应管于37 ℃保温1 h 后测定OD1。根据公式计算其PAL 活性,定义为每分钟变化0.01 为一个单位U。
1.3.4.3 肉桂酸-4-羟基化酶活性的测定 用PBS 缓冲液从保存在-80 ℃的磨碎的雷笋的提取酶液。采用ELISA 法,利用试剂盒(上海江莱有限公司)对肉桂酸-4-羟基化酶活性进行测定[9]。每个测量使用3 个重复。
1.3.4.4 肉桂醇脱氢酶活性的测定 采用酶活性检测试剂盒(北京Solarbio 科技有限公司)测定雷笋CAD 活性[10]。每个测量使用3 个重复。
1.3.5 雷笋RNA 提取及转录组学分析
1.3.5.1 雷笋RNA 提取及质量检测 取冻存于-80 ℃冰箱中贮藏天数分别为6,12,18,24 d 雷笋样品,每个处理大约5 g,采用Eastep Super 总RNA 试剂盒(上海普洛麦格)提取雷笋总RNA,用Nanodrop 和琼脂糖凝胶电泳检测RNA 浓度和完整性[11],送至生工生物工程(上海)股份有限公司建库及测序。
Super 总RNA 试剂盒(上海普洛麦格)提取雷笋总RNA,用Nanodrop 和琼脂糖凝胶电泳检测RNA 浓度和完整性[11],送至生工生物工程(上海)股份有限公司建库及测序。
1.3.5.2 转录组学分析 使用BLAST 软件将Unigene 与NR、GO、COG、KOG、NOG、KEGG 等8 个数据库进行比对,获得Unigene 的注释信息。分析木质素合成相关基因在KEGG 数据库功能注释及代谢路径[12]。按照FPKM(每千个碱基的转录每百万映射读取的片段)法计算差异基因的表达量。
1.3.6 数据统计与分析 每个试验重复3 次,以平均值±标准偏差表示测定结果。用Microsoft excel 2019 进行数据处理,用Origin 2017 作图,采用SPSS 17.0 进行数据差异显著性等方面分析。其中P>0.05 表示无显著差异,P<0.05 表示差异显著,P<0.01 表示极显著差异。
2 结果与分析
2.1 贮藏过程中雷笋色泽变化
图1 显示,在常温(25 ℃)条件下,雷笋贮藏至2 d 时,笋肉的色泽已出现黄化现象。贮藏至6 d 时,雷笋出现了很明显的黄化,有的甚至出现了腐烂的症状,已不可食用。而在低温(4 ℃)贮藏条件下,雷笋贮藏6 d,雷笋的色泽没有出现较大变化。贮藏至第24 天时,笋肉才出现黄化、腐烂症状。由此可知,低温能够有效地延长雷笋的贮藏时间,大大减缓雷笋的黄化。
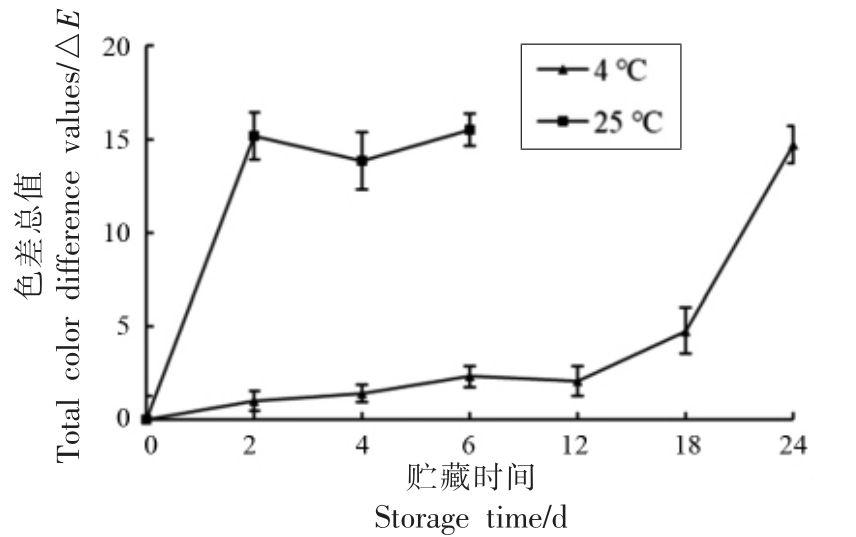
图1 贮藏过程中雷笋的色泽变化
Fig.1 Color change of Phyllostachys praecox during storage
2.2 贮藏中雷笋木质素含量变化
从图2 中可以看出,在常温(25 ℃)贮藏6 d,雷笋中的木质素含量从11.2 mg/g 增加到43.8 mg/g;木质素的含量出现了明显的上升趋势,开始老化,变得难以食用,从而失去商品价值。而低温(4 ℃)贮藏6 d 时,木质素含量为13.2 mg/g,木质素的含量没有明显的增加,保证了其商品价值,到24 d 时木质素含量增加为26.3 mg/g。很明显低温可以有效减缓木质素的合成,减慢雷笋的老化速度。采后质地极易发生劣变,如软化、木纤化等,这两者都与组织细胞壁代谢有关。木质素主要集中在于纤维、基本薄壁组织细胞和导管细胞壁中。植物组织的木纤化主要涉及苯丙素衍生途径的单螺旋体的聚合[13]。雷笋的木纤化主要是由于过氧化物酶(POD),苯丙氨酸解氨活性(PAL),肉桂酸-4-羟基化酶和肉桂酸脱氢酶等酶的作用[14]。
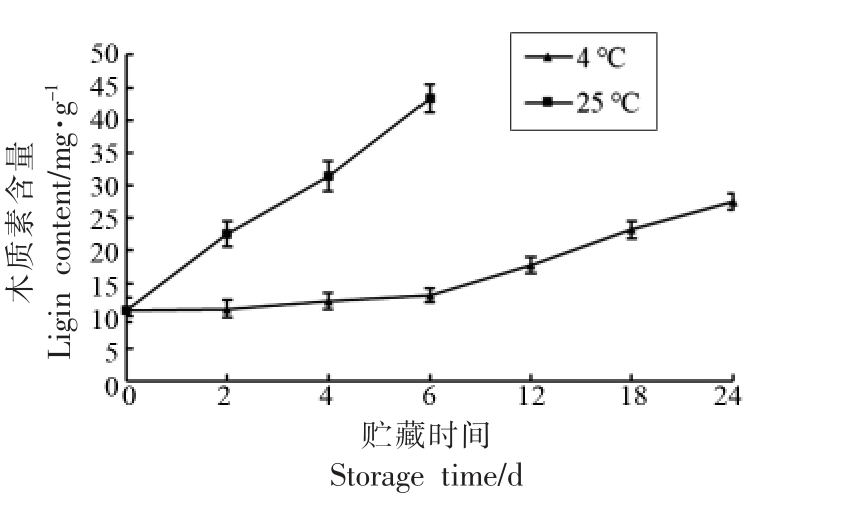
图2 贮藏中雷笋的木质素含量变化
Fig.2 Variation of lignin content in Phyllostachys praecox during storage
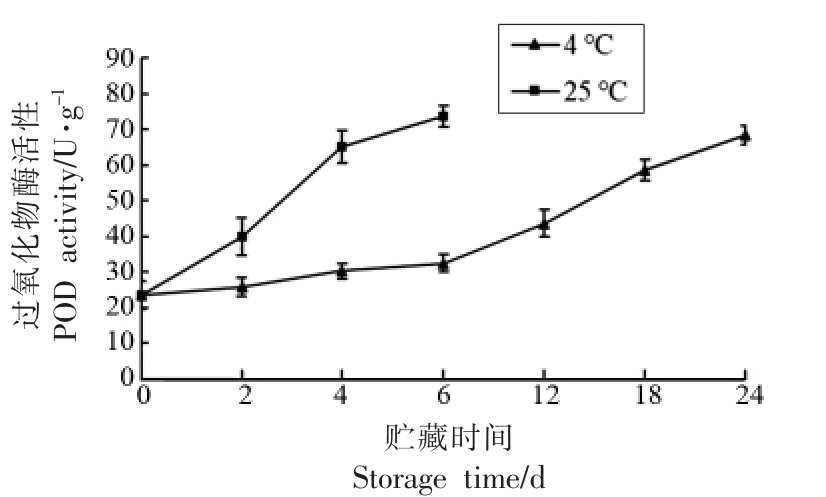
图3 贮藏中雷笋过氧化物酶活性变化
Fig.3 Variation of peroxidase activity in Phyllostachys praecox during storage
2.3 贮藏中雷笋过氧化物酶活性变化
过氧化物酶是木纤化进程中的一种酶,与木纤化密切相关[15]。植物组织的木纤化主要涉及苯丙素衍生途径的单螺旋体的聚合反应,其以形成肉桂酸酯衍生物的PAL 反应开始,并由形成木质素聚合物单物的POD 反应完成[16]。过氧化物酶是木质素生成路径中的关键酶之一。在常温(25 ℃)条件下,过氧化物酶活性变化不大,但一直维持在较高水平(110 U/g)。但在低温(4 ℃)条件下,过氧化物酶活性从14 U/g(0 d)到40 U/g(18 d),虽然变化幅度较大,但酶活性不高。
2.4 贮藏中雷笋苯丙氨酸解氨酶活性变化
竹笋的褐变与其苯丙氨酸解氨酶活性密切相关,竹笋细胞壁纤维素的沉积也与其苯丙氨酸解氨酶活性紧密相关[17],苯丙氨酸解氨酶活性是影响竹笋木纤化进程的一种关键酶。雷笋苯丙氨酸解氨酶活性随着贮藏时间延长,在4 ℃和25 ℃下都呈显著上升趋势,且25 ℃贮藏下的酶活性高于低温4 ℃贮藏,环境低温能有效降低竹笋木纤化,延长保鲜期达4 倍以上,保持雷笋鲜脆的口感(图4)。
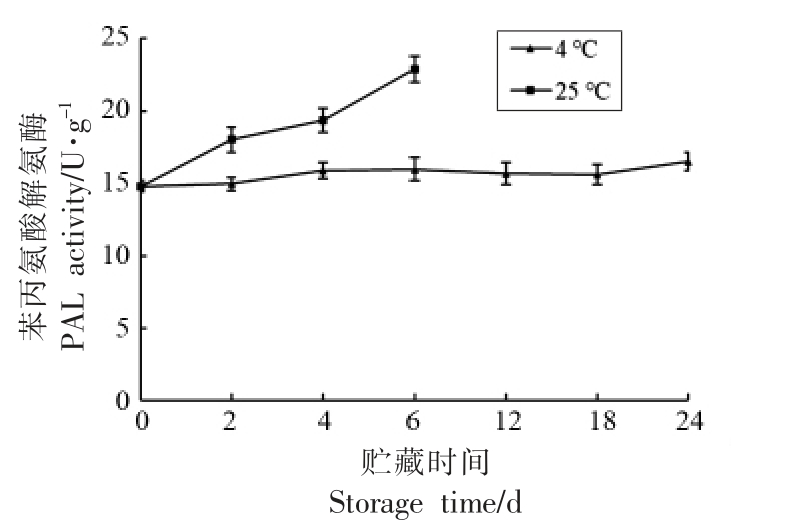
图4 贮藏中雷笋苯丙氨酸解氨酶活性变化
Fig.4 Variation of phenylalanine ammonialyase activity in Phyllostachys praecox during storage
2.5 贮藏中雷笋肉桂酸-4-羟基化酶活性变化
肉桂酸-4-羟基化酶是雷笋木纤化进程中的一种关键酶,能促进木质素的生成,增加雷笋中的木质素含量[18]。如图5 所示,低温(4 ℃)降低了肉桂酸-4-羟基化酶的活性,同样是贮藏6 d,在低温(4 ℃)贮藏的雷笋中的肉桂酸-4-羟基化酶活性只是从原来的5.8 U/g 上升为15.2 U/g。而在常温(25 ℃)条件下,肉桂酸-4-羟基化酶活性从原来的5.8 U/g 上升为41.2 U/g。由此可知低温可以减缓雷笋的木纤化进程。
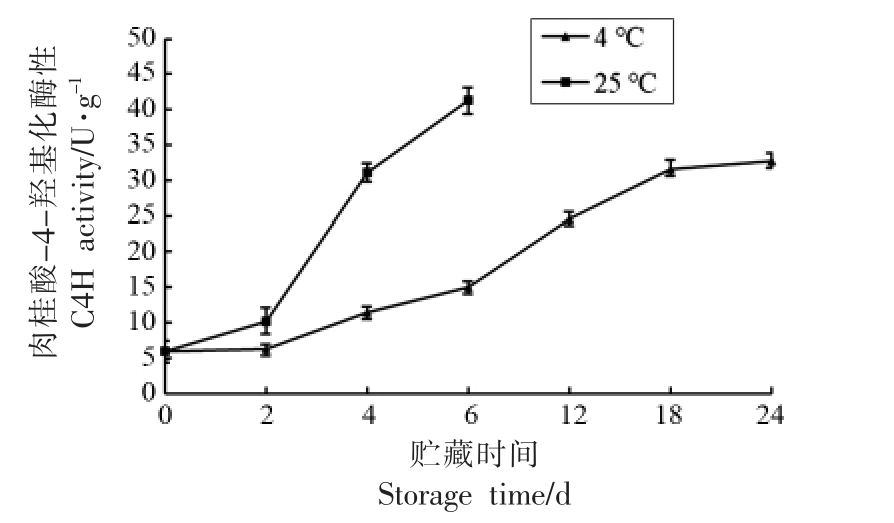
图5 贮藏中雷笋肉桂酸-4-羟基化酶活性变化
Fig.5 Variation of cinnamic acid 4-hydroxylase activity in Phyllostachys praecox during storage
2.6 贮藏中雷笋肉桂醇脱氢酶活性变化
肉桂醇脱氢酶作为木质素合成通路的限速酶,其变化在一定程度上影响着木质素含量的变化[19]。雷笋肉桂醇脱氢酶活性随着贮藏时间的延长,均呈显著上升趋势(图6),且25 ℃贮藏下的酶活性缓慢上升,由原来的658.51 U/g(0 d)上升为841.14 U/g(6 d)。酶活性的上升表明雷笋中是膳食纤维在细胞壁中的生产沉积加快;在4 ℃贮藏下的酶活性出现了先下降再上升的趋势,由原来的658.51 U/g(0 d)先下降到2 777.97 U/g(12 d)再上升为1 008.03 U/g(24 d),肉桂醇脱氢酶的酶活性先下降可能是因为在贮藏初期低温环境抑制肉桂醇脱氢酶活性,之后竹笋开始适应低温环境酶活性上升。可见低温能通过能降低酶活性来减缓雷笋的木纤化,保持雷笋的口感。
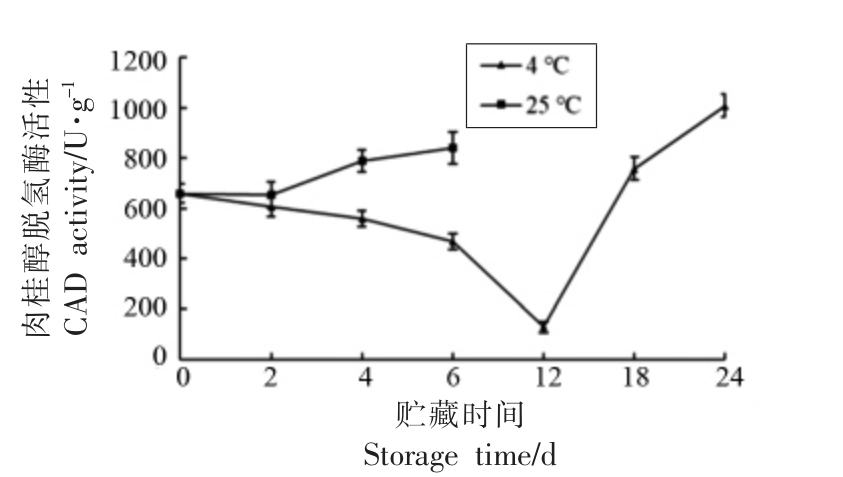
图6 贮藏中雷笋肉桂醇脱氢酶活性变化
Fig.6 Variation of cinnamyl alcohlo dehydrogenase activity in Phyllostachys praecox during storage
2.7 雷笋低温贮藏中基因差异表达分析
使用RNA-Seq 分别对低温贮藏下的每隔6 d 取样的雷笋的基因表达进行差异分析,根据表达差异倍数|log2FoldChange|>1,显著性P<0.05 的条件进行筛选[20],如图7 所示,24 d vs control、18 d vs control、12 d vs control 和6 d vs control 差异表达基因的数目分别为8 974,9 201,6 388 和6 031,总体来说,下调的基因数都要多于上调的基因数;从图7 可以看出,随着贮藏时间的增加,下调的基因数不断增加,说明低温能抑制基因的表达。低温贮藏第24 天基因下调程度最明显,贮藏第6 天,下调基因程度最小;上调基因各组差别相对不大,贮藏第12 天的上调基因数相对最少。

图7 基因表达差异分析结果
Fig.7 Results of gene expression difference
2.8 贮藏中与雷笋木纤化相关的基因表达量分析
果蔬的木纤化进程受编码木质素代谢的关键酶基因的表达调控[21]。LAC、POD、HCT、CAD、COMT 和CCR 等6 种酶密切影响木质素的变化,其活性的升高都能促进木质素的合成,使果蔬木纤化加剧[22]。从图8 可以看出,雷笋LAC-10、POD-10、HCT-10、CAD-10 和CCR-10 基因相对表达量在低温(4 ℃)贮藏过程中的变化整体呈上升趋势,与酶活性测定结果一致。CCR-10 基因的相对表达量呈现先下降后上升的趋势。可能是因为贮藏前期低温对CCR-10 基因的表达造成了影响,后期慢慢适应了低温环境,从而该基因的表达量出现了上升。而COMT-10 基因相对表达量一直减小,推测温度对该基因影响较大,低温抑制了该基因的表达。

图8 低温贮藏下雷笋木纤化相关的基因表达量
Fig.8 Gene expression levels related to dietary fiber changes in Phyllostachys praecox under low temperature storage
3 讨论
雷笋在25 ℃条件下,雷笋贮藏至6 d 时,笋肉已出现黄化、腐烂症状;而在低温(4 ℃)条件下,雷笋可贮藏至第24 天,可见低温能延长雷笋的贮藏期。在贮藏中雷笋细胞壁中木质素会一直积累增加,而低温贮藏条件下,可以延缓木质素的积累,减缓老化。木质素生物合成途径需要多种酶参与,PAL 和POD 作用于木质素合成的起始和最后合成,其酶活上升会加速产生纤维素。该结果与Huang等[23]研究蕨菜的木纤化结果一致,即PAL和POD 活性增加,加剧蕨菜老化。本试验中,雷笋PAL、POD、CAD 和C4H 酶活性随着贮藏时间延长,都呈显著上升趋势,4 ℃贮藏下的酶活性在相同天数时均显著(P<0.05)低于25 ℃贮藏下的酶活性。王杰[24]通过研究在2 ℃与20 ℃贮藏条件下的毛笋品质发现,随着贮藏温度增高,毛笋中的木质素和纤维素会加速合成,含量增加变快,其结果与本文一致。
果蔬的木纤化进程受编码木质素代谢的关键酶基因的表达调控。Lu等[25]研究发现:PpCAD1 和PpCAD2 这2 个基因主要调控梨的木质素代谢生物合成。不同种类的果蔬调控木质素合成关键酶的基因也不同,Shan等[26]研究表明,调控枇杷的木质素代谢基因主要是EjCAD1、EjPOD1 和EjPAL2这3 个基因。此外,大多数研究人员认为PAL、4CL、CAD 和POD 的活性与其对应基因的表达在协同调控木质素的合成[20]。Zhang等[27]研究表明LAC、HCT 和COMT 基因也参与调控木质素的合成。本研究结果表明:低温能抑制雷笋中大部分基因的表达,随着低温贮藏时间的增加,下调的基因数目不断增加。雷笋LAC-10、POD-10、HCT-10、CAD-10 和CCR-10 基因相对表达量在低温(4℃)贮藏下的变化整体呈上升趋势,与本文中的酶活性测定结果相一致。而COMT-10 基因相对表达量一直减小,可能温度对该基因影响较大,低温抑制了该基因表达。
4 结论
常温贮藏6 d 时,木质素含量从11.2 mg/g 增加到43.8 mg/g;低温贮藏6 d 时,木质素含量为13.2 mg/g,到24 d 时木质素含量增加到26.3 mg/g。雷笋PAL、POD、CAD 和C4H 酶活性随着贮藏时间的延长,均呈显著上升趋势,常温贮藏下的酶活性高于低温贮藏的酶活性,低温通过降低膳食纤维变化相关酶活性,从而来减缓雷笋中膳食纤维的生成。在低温贮藏环境中随着贮藏时间的延长,雷笋差异表达下调的基因数不断增加,说明低温能抑制基因的表达。24d vs control 基因下调程度最明显,6d vs control 下调基因程度最小;上调基因各组差别相对不大,12d vs control 的上调基因数相对最少。雷笋LAC-10、POD-10、HCT-10、CAD-10 和CCR-10 基因相对表达量在低温(4℃)贮藏下,整体呈上升趋势,而COMT-10 基因相对表达量则一直减小。未来可通过调控LAC-10、POD-10、HCT-10、CAD-10 和CCR-10 等关键基因的表达来调控雷笋木纤化的进程。
[1] 张静美,张锡庆,李翱翔.复合生物保鲜剂对甜龙竹笋采后贮藏保鲜效果的影响[J].世界竹藤通讯,2023,21(5):34-40.ZHANG J M,ZHANG X Q,LI A X.Effect of compound biological preservatives on post -harvest storage and fresh-keeping of Dendrocalamus brandisii shoots[J].World Bamboo and Rattan,2023,21(5):34-40.
[2] 吴志豪,张富强,吴彩娥,等.低温等离子处理对采后雷竹笋贮藏品质的影响[J].包装与食品机械,2023,41(5):1-8.WU Z H,ZHANG F Q,WU C E,et al.Effect of atmospheric cold plasma treatment on storage quality of post-harvest bamboo shoots [J].Packaging and Food Machinery,2023,41(5):1-8.
[3] ZHEN L,XIURONG X,KEBIN Y.Multifaceted analyses reveal carbohydrate metabolism mainly affecting the quality of postharvest bamboo shoots[J].Frontiers in Plant Science,2022,13:1021161.
[4] 李宣林,邢亚阁,税玉儒,等.贮藏温度对筇竹笋采后品质的影响[J].西华大学学报(自然科学版),2021,40(6):89-96.LI X L,XING Y G,SHUI Y R,et al.Effects of storage temperature on postharvest quality of Qiongqiao bamboo[J].Journal of Xihua University(Natural Science Edition),2021,40(6):89-96.
[5] 周大祥,汪开拓,匡文玲,等.果糖处理对冷藏雷竹笋品质和木质化的影响及其调控机制研究[J].食品与发酵工业,2020,46(15):175-183.ZHOU D X,WANG K T,KUANG W L,et al.Effects of fructose treatment on quality and lignification of bamboo shoots(Phyllostachys praecox)during cold storage and its regulation mode involved[J].Food and Fermentation Industries,2020,46(15):175-183.
[6] GAN J,RAHMAN R,OSMAN A,et al.Kinetics of crude peroxidase inactivation and color changes of thermally treated seedless guava(Psidium guajava L.)[J].Food and Bioprocess Technology,2011,4(8):1442-1449.
[7] 周成敏,杨继,周紫球,等.高压静电场处理对鲜切黄甜竹笋冷藏下品质的影响[J].食品工业科技,2021,42(23):319-325.ZHOU C M,YANG J,ZHOU Z Q,et al.Effects of high-voltage electrostatic field(HVEF)treatment on the quality of fresh-cut bamboo shoots(Acidosasa edulis)during cold storage[J].Science and Technology of Food Industry,2021,42(23):319-325.
[8] 史蔓蔓,张文,刘飞翔,等.竹笋采后生理生化变化及贮藏保鲜研究进展[J].食品科学,2023,44(7):13.SHI M M,ZHANG W,LIU F X,et al.A review on postharvest physiological and biochemical changes,storage and preservation of bamboo shoots[J].Food Science,2023,44(7):13.
[9] CHENG G W,BREEN P J.Activity of phenylalanine ammonialyase(PAL)and concentrations of anthocyanins and phenolics in developing strawberry fruit[J].Journal of the American Society for Horticultural Science,1991,116(5):865-869.
[10] GABOTTI D,NEGRINI N,MORGUTTI S,et al.Cinnamyl alcohol dehydrogenases in the mesocarp of ripening fruit of Prunus persica genotypes with different flesh characteristics:changes in activity and protein and transcript levels[J].Physiol Plant,2015,154(3):329-348.
[11] DAR Y,JANA B,BOSIS E,et al.A binary effector module secreted by a type VI secretion system[J].EMBO Rep,2022,23(1):e53981.
[12] WONG M M,CANNON C H,WICKNESWARI R.Identification of lignin genes and regulatory sequences involved in secondary cell wall formation in Acacia auriculiformis and Acacia mangium via de novo transcriptome sequencing[J].BMC Genomics,2011,12:342.
[13] 楼君,索金伟,张慧,等.褪黑素处理对高节竹笋低温贮藏过程中木质化的影响[J].林业科学,2019,55(12):41-49.LOU J,SUO J W,ZHANG H,et al.Effect of melatonin treatment on lignification of Phyllostachys prominens shoots during low temperature storage[J].Scientia Silvae Sinicae,2019,55(12):41-49.
[14] 黄劲松,高云,郭军,等.采后竹笋木质化研究进展[J].广东农业科学,2018,45(7):105-110.HUANG J S,GAO Y,GUO J,et al.Review of research progress on lignification of postharvest bamboo shoots[J].Guangdong Agricultural Sciences,2018,45(7):105-110.
[15] ROSELLI M,DEVIRGILIIS C,ZINNO P,et al.Impact of supplementation with a food-derived microbial community on obesity-associated inflammation and gut microbiota composition[J].Genes &Nutrition,2017,12(1):25-30.
[16] 董春凤,赵一鹤.甜龙竹笋采后不同时间及温度储藏下酶活性的变化[J].西部林业科学,2021,50(1):79-84.DONG C F,ZHAO Y H.Changes of enzyme activity of Dendrocalamus brandisii under different storage time and temperature after harvest[J].Journal of West China Forestry Science,2021,50(1):79-84.
[17] 张雄峰,赵一鹤,李沁.茶多酚处理对采后勃氏甜龙竹笋木质化的影响[J].西部林业科学,2022,51(5):7.ZHANG X F,ZHAO Y H,LI Q.Effects of tea polyphenol treatment on lignification process of postharvest Dendrocalamus brandisi bamboo shoot[J].Journal of West China Forestry Science,2022,51(5):7.
[18] 龚佳惠,陈贝莉,董欢欢,等.L-精氨酸对绿芦笋贮藏品质及生理生化特性的影响[J].保鲜与加工,2017,17(1):7-11.GONG J H,CHEN B L,DONG H H,et al.Effects of L-arginine on storage qualities and physiobiochemical characteristics of Asparagus officinalis L.[J].Storage and Process,2017,17(1):7-11.
[19] 王豪翔.毛竹笋采后木质素合成相关酶活性及其相关酶基因表达规律研究[D].杭州:浙江农林大学,2019.WANG H X.Study on lignin biosynthesis related enzyme activities and related enzyme gene expression in bamboo shoots after harvest[D].Hangzhou:Zhejiang A&F University,2019.
[20] 俞暾,郑剑,余学军.外源草酸对绿竹笋抗氧化酶和木质化的影响[J].浙江农林大学学报,2020,37(3):556-562.YU T,ZHENG J,YU X J.Effects of exogenous oxalic acid on antioxidant enzymes and lignification of Bambusa oldhami shoots[J].Journal of Zhejiang A&F University,2020,37(3):556-562.
[21] JIANG Y,XIE J,CHEN L,et al.Improving the anti-mould property of Moso bamboo surface by using a bamboo green colour preservation approach[J].Wood Material Science And Engineering,2023,18(1):161-171.
[22] BAUCHER M,HALPIN C,PETIT-CONIL M,et al.Lignin:Genetic engineering and impact on pulping[J].Critical Reviews in Biochemistry and Molecular Biology,2003,38(4):305-350.
[23] HUANG J S,ZHANG Y X,JIANG L,et al.Comparative proteomics analysis of differential proteins in response to 6-benzylaminopurine treatment in Pteridium aquilinum senescence[J].Postharvest Biology &Technology,2016,116:66-74.
[24] 王杰.竹笋细胞壁木质化及转录组差异基因表达分析与功能初探[D].南京:南京农业大学,2018.WANG J.The study of expression and analysis of different expression genes in mosobamboo shoot transcriptome associated with the lignification [D].Nanjing:Nanjing Agricultural University,2018.
[25] LU G L,LI Z J,ZHANG X F,et al.Expression analysis of lignin-associated genes in hard end pear(Pyrus pyrifolia Whangkeumbae)and its response to calcium chloride treatment conditions[J].Journal of Plant Growth Regulation,2015,34(2):251-262.
[26] SHAN L,LI X,WANG P,et al.Characterization of cDNAs associated with lignification and their expression profiles in loquat fruit with different lignin accumulation[J].Planta,2008,227(6):1243-1254.
[27] ZHANG H,YING Y Q,WANG J,et al.Transcriptome analysis provides insights into xylogenesis formation in Moso bamboo(Phyllostachys edulis)shoot[J].Scientific Reports,2018,8(1):3951-3967.