食品中的农药残留威胁人体健康,存在重大的食品安全危害风险,食品中农残检测体系的构建是目前食品中农残等安全风险控制的主要手段[1]。福美双属于二硫代氨基甲酸盐类农药,由于其低毒、广谱的杀菌作用,广泛用于水果与蔬菜的病虫害防治[2]。然而,近年来研究表明福美双对胚胎发育以及生殖有显著的影响[3]。开展果蔬样品中的福美双等农残快速检测技术研究非常必要。
我国制定了国家标准GB 2763-2021《食品安全国家标准 食品中农药最大残留限量》,其中规定食品中福美双等564 种农药10 092 项最大残留限量,并制定了一系列标准检测方法[4]。传统实验室检测方法具有较好的重现性和检测精度,然而存在依赖贵重仪器,分析成本高,前处理步骤繁琐,检测时间长等缺点[5]。构建实验室检测方法与快速检测方法结合的食品中农残检测体系,是保障食品安全的重要举措。
表面增强拉曼散射(SERS)是一种新兴指纹图谱技术,检测灵敏度高,检测速度快,操作简单,能满足对各种状态的食品基质中农药残留的检测,是食品中农残快速检测方法构建的新途径。然而,制备出高稳定性、高灵敏度的纳米结构基底,是SERS 检测的关键[6-9]。当前,已有利用SERS 方法检测甲醇溶液或果蔬中福美双的研究,然而大多基底存在制备复杂、信号不稳定、金纳米颗粒聚集度不好掌控的缺陷。进一步开发易于制备、高稳定性的纳米结构SERS 活性基底,并结合特异性分离技术检测复杂基质中的福美双显得尤为重要。目前SERS 活性基底按结构来划分可分为纳米颗粒溶胶、固体表面的金属纳米结构、复合纳米结构基底。其中复合纳米结构基底的活性衬底材料一般要求具备易制作、稳定、灵敏性高等特点。MXenes 是由MAX 相(Ti3AlC2)处理得到的类石墨烯结构。其作为SERS 活性衬底材料,不仅可以直接与检测物质的电子能级耦合实现化学增强,也能提供一个二维平台,用来负载传统SERS 基底如金属纳米颗粒(AuNPs),从而得到符合SERS 基底AuNPs/MXenes,因此在SERS 领域的表现非常值得期待[10-15]。目前国外有研究证明在MXenes 表面原位生长AuNPs 的SERS 基底具有较强的SERS 活性,而国内目前并无相关报道[16]。
本文基于AuNPs/MXenes 复合SERS 基底,利用SERS 技术建立起针对果蔬中福美双农药残留的检测方法,对甲醇溶液和实际样品中的福美双进行快速检测。
1 材料与方法
1.1 试剂与仪器
1.1.1 试剂 盐酸(HCl),上海国药化学试剂有限公司;氟化锂(LiF)、MAX 前驱体(Ti3AlC2)、无水硫酸镁(MgSO4),麦克林有限公司;柠檬酸三钠、氯金酸(HAuCl4·3H2O)、十六烷 基三甲基氯化铵(CTAC)、福美双(Thiram)标准品、甲醇(CH3OH,色谱级),上海阿拉丁试剂有限公司;冰乙酸(CH3COOH),天津富宇精细化工有限公司;正丙基乙二胺(CNWBOND PSA,40~63 μm)、C18 提取剂(CNWBOND HC-C18,40~63 μm),Anpel 有限公司;橘子购买于本地西亚超市;去离子水来自Milli-Q 净水系统(Milli-Q IQ 7000,德国默克密理博)。浓盐酸:浓硝酸以3∶1 比例混合制得王水溶液备用。
IQ 7000,德国默克密理博)。浓盐酸:浓硝酸以3∶1 比例混合制得王水溶液备用。
1.1.2 仪器 试验过程中的主要器具有:聚四氟乙烯烧杯、玻璃烧杯、pH 试纸、棕色试剂瓶、磁珠、锥形瓶、量筒、棕色试剂瓶。本试验玻璃器材在使用前均用王水泡过24 h。
磁力加热搅拌器(MS7-H550-Pro),大龙兴创实验仪器公司;电子天平(AL204),梅特勒托利多仪器公司;紫外可见分光光度计(UV-1800),日本岛津制作所;高速冷冻离心机(TW-3021HR),安徽嘉文仪器装备公司;超声波清洗机(SB-50D),宁波新芝生物科技;漩涡混合器(XW-80A),上海精科实业有限公司;显微共聚焦拉曼光谱仪(LabRAM HR Evolution),日本HORIBA 公司;扫描电镜(Merlin),德国卡尔蔡司公司;高速匀浆机(FJ-200),上海标本模型厂;Millipore 超纯水仪(Milli-Q),Millipore(美国)。
1.2 试验方法
1.2.1 AuNPs/MXenes 的制备 在聚四氟乙烯烧杯中放入磁珠,加入12 mol/L 的HCl 溶液后使用磁力加热搅拌器进行搅拌,称取1.6 g 的LiF 粉末加入体系,待搅拌至粉末溶解。称取1 g 的MXA粉末,为防止粉末与体系混合时放出大量热使反应体系沸腾,分次缓慢倒入MXA 粉末。粉末全部倒入后,在杯口覆盖带小孔的保鲜膜使反应体系密封且使反应的氢气排出,将体系温度设置为45℃,持续搅拌24 h。反应完成后,将混合溶液转移到离心管中进行离心,使用1 mol/L 的HCl 反复洗涤多次,使未反应完全的LiF 反应完全,再用去离子水反复洗涤直到上清液pH 值约为6 时,在冰水浴和氮气氛围下,使用超声波清洗机对刻蚀好的MXenes 进行超声分层1 h,得到多层MXenes悬浮液,在3 500 r/min 下离心1 h,将深绿色上清液保存在装满N2 的棕色试剂瓶中,保存在4 ℃下以备后续使用。
1.2.2 AuNPs/MXenes 复合拉曼增强基底 在玻璃锥形瓶中加入50 mL 水和1 mL 的5 g/L 氯金酸溶液,使用磁力加热搅拌器进行加热搅拌,用保鲜膜紧贴瓶口,使体系与外界隔离,将温度设置为120 ℃加热到沸腾,2 min 后加入1%的750 μL 柠檬酸钠溶液,2 min 后关闭加热系统,保持磁力搅拌,4 min 后将锥形瓶中的AuNPs 胶体溶液转移到50 mL 的离心管保存在4 ℃下;取出20 mL AuNPs 胶体溶液,进行形貌表征后在6 000 r/min转速下离心15 min,将AuNPs 胶体溶液浓缩至1 mL;再加入0.1 mL CTAC 振荡12 h 进行改性;分别取改性后的AuNPs 胶体溶液100 μL 和0,25,50,100,200 μL 的MXenes 胶体溶液进行混合组装,用去离子水定容至400 μL 得到AuNPs/MXenes 复合拉曼增强基底。
1.2.3 AuNPs/MXenes 的SERS 性能表征 拉曼增强因子是用来表征材料SERS 增强性能的重要指标[17],本试验取20 μL 10-6 mol/L 的R6G 与不同体积比的AuNPs/MXenes 基底胶体溶液20 μL 进行混合,吸入毛细玻璃管后使用显微共聚焦拉曼光谱仪对其进行SERS 检测,进行光谱信号强度优化。检测拉曼波长范围在400~2 000 cm-1 之间,激发器波长采用633 nm,求其平均光谱进行计算,在增强效果最佳的特征峰处得到其拉曼强度ISERS。在相同的参数设置下,直接测量10-2 mol/L的R6G 在相同特征峰处的拉曼光谱强度IRaman,用下式计算基底增强因子EF:
式中:NRaman——测量普通拉曼散射的R6G 浓度,mol/L;NSERS——进行SERS 检测时使用的R6G浓度,mol/L。
为表征拉曼基底是否能对目标农药福美双进行检测,配制一系列浓度梯度的福美双标准溶液进行预试验。光谱检测范围为400~1 800 cm-1,激发器波长采用633 nm。同时为了表征基底进行拉曼检测时的重现性,对100 ng/mL 福美双和基底的混合溶液的20 个不同位置进行SERS 检测。对于基底储藏期稳定的表征方法为:提前组装好15组AuNPs/MXenes 复合基底,每隔7 d 将3 组与固定浓度的福美双混合后进行SERS 检测,观察特征峰处的拉曼强度变化。得到原始光谱数据后,使用LabSpec 6 spectroscopy 软件对试验得到的光谱数据进行预处理,如平滑和去基线等。
1.2.4 福美双拉曼增强特征峰的获取与识别 使用分析天平称取福美双0.01 g,用100 mL 甲醇溶解,储存在玻璃瓶中,制备得到100 mg/L 福美双母液,吸取40 μL 于毛细管中进行SERS 检测,获取400~1 800 cm-1 范围内的SERS 光谱,激光器激发波长为633 nm。
1.2.5 福美双标准曲线的建立 用甲醇与水1∶1的溶液稀释福美双母液,得到质量浓度分别为0.2,2,20,20,2 000 ng/mL 的福美双甲醇溶液。用移液枪吸取20 μL 的上述标准溶液与组装好的20 μL AuNPs/MXenes(200 mg/L)纳米复合材料胶体溶液混合,用毛细管吸取后进行SERS 检测。SERS 检测参数如1.2.4 节,每个样品采取3 次光谱数据,最终取平均值作为分析光谱。
1.2.6 真实柑橘样品中福美双的加标、提取和SERS 检测 首先使用福美双标准溶液对柑橘进行加标,接着用高速匀浆机将柑橘切碎并且均质。称取3 g 柑橘均质样品,柑橘匀浆样品加标浓度分别为0,0.5,1,5,10×10-6。参考黄智斌[18]方法,向各装有柑橘样品的离心管中加入3 mL 的乙腈,使用圆周振荡器振荡均匀后,加入0.3 g 无水醋酸钠和1.2 g 无水硫酸镁,继续充分振荡摇匀,接着在6 000 r/min 转速下离心1 min。吸取4 mL 的橙黄色上清液于10 mL 的离心管中,倒入由150 mg PSA、300 mg 无水硫酸镁和150 mg 的C18 组成的混合粉末,振荡2 h 后,在6 000 r/min 转速下离心5 min,将离心后的淡黄色上清液转移到新的10 mL 离心管中,4 ℃保存备用。用移液枪吸取20 μL的上清液与20 μL 的AuNPs/MXenes 纳米复合材料胶体溶液混合,用毛细管吸取后进行SERS 检测。SERS 检测参数如1.2.4 节,每个样品采取3 次光谱数据,最终取平均值作为分析光谱。
2 试验结果与讨论
2.1 AuNPs/MXenes 的形貌表征
未经处理的MAX 原料MXenes 粉末如图1a所示,呈现出大而杂乱的聚集颗粒状结构,颗粒较为致密,在大颗粒周围散落着一些细小颗粒碎屑。而MAX 原料刻蚀后得到的MXenes 材料如图1b所示,呈现手风琴状结构,这是因为原料夹层中通过金属键连接的Al 层被反应体系中生成的HF刻蚀,剩下的Ti 与C 通过较为牢固的共价键和离子键连接,故结构呈现层层相叠的有序结构,从图中可以看出Al 层被刻蚀完全。这种结构层与层之间的会存在Li+作为插层剂,使用超声振荡就可以将其分离开,形成如图1c 所示的单层或少层结构[18]。

图1 制备样品的表征
Fig.1 Characterization of the as-prepared samples
利用紫外分光光度计分析AuNPs 的光学特征,得到AuNPs 在300~900 nm 间的吸收曲线如图2a 所示,在仪器自带程序中对吸收曲线进行,从图中可知金纳米颗粒的吸光度曲线峰值出现在527 nm 处,根据经验公式计算出粒径为29 nm,满足后续拉曼检测需求。
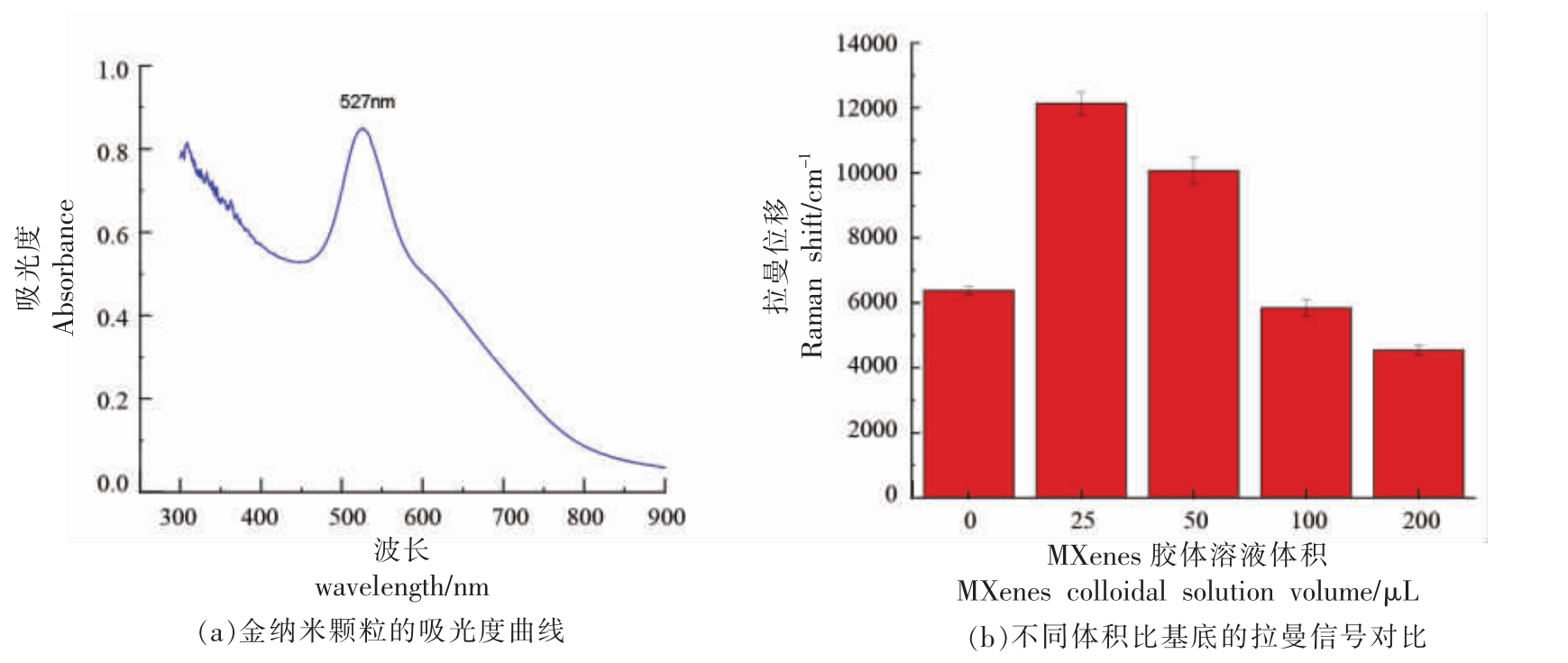
图2 金纳米颗粒的表征及信号优化
Fig.2 Characterization and signal optimization of AuNPs
式中:Y——吸光度曲线峰值位置;X——金纳米颗粒平均尺寸,nm[20]。
为了进一步对纳米金颗粒的形貌进行表征并且观察金纳米颗粒在单层MXenes 表面的附着情况,将对改性后的AuNPs 胶体溶液和MXenes 胶体溶液混合组装后进行TEM 检测,检测结果如图1d 所示。可以看出金纳米颗粒附着在单层MXenes 片上,且尺寸较为均匀,形貌与预期结果相符,可以用作后续SERS 检测。
2.2 AuNPs/MXenes 基底的拉曼性能检测
为了保证制备出的拉曼增强基底发挥更好的拉曼增强效果,对AuNPs 与MXenes 胶体溶液的体积比例进行优化试验,以R6G 作为拉曼分子探针,检测体积比为4∶1,2∶1,1∶1,1∶2 和纯AuNPs胶体溶液的拉曼增强信号,结果如图2b 示,可以看出AuNPs 与MXenes 体积比为4∶1 时拉曼增强信号最好。在AuNPs 终浓度一定的情况下,随着MXenes 的加入量增加,拉曼增强信号先增大后减小,分析原因可能是在体系中主要其拉曼增强作用的是AuNPs,少量的MXenes 可以使AuNPs 密集附着在其二维表面,从而产生更多的拉曼热点,而过多的MXenes 则会降低AuNPs 的密集程度。
拉曼性能的表征则是通过计算基底的增强因子,将10-6 mol/L 的R6G 与基底混合后获取其拉曼光谱,再获取10-6 mol/L 和10-2 mol/L 的R6G 的SERS 光谱,各体系SERS 光谱如图3 所示。从图中可以看出10-6 mol/L R6G 表面增强拉曼光谱在608,768,1 178,1 306,1 356,1 506,1 654 cm-1 处的拉曼特征峰强度较高。对比3 条光谱可知,R6G本身的拉曼信号较弱,10-6 mol/L R6G 的SERS 光谱基本无明显的拉曼特征峰,而10-2 mol/L R6G的SERS 光谱存在较低的特征峰信号,能识别出R6G 特有的拉曼信号特征峰,制备得到的AuNPs/MXenes 基底对于R6G 的拉曼信号有明显的增强效果,存在明显的SERS 效应,对比不同拉曼增强特征峰计算出的拉曼增强因子,在608 cm-1 处的增强因子最高,计算结果为1.7×105。
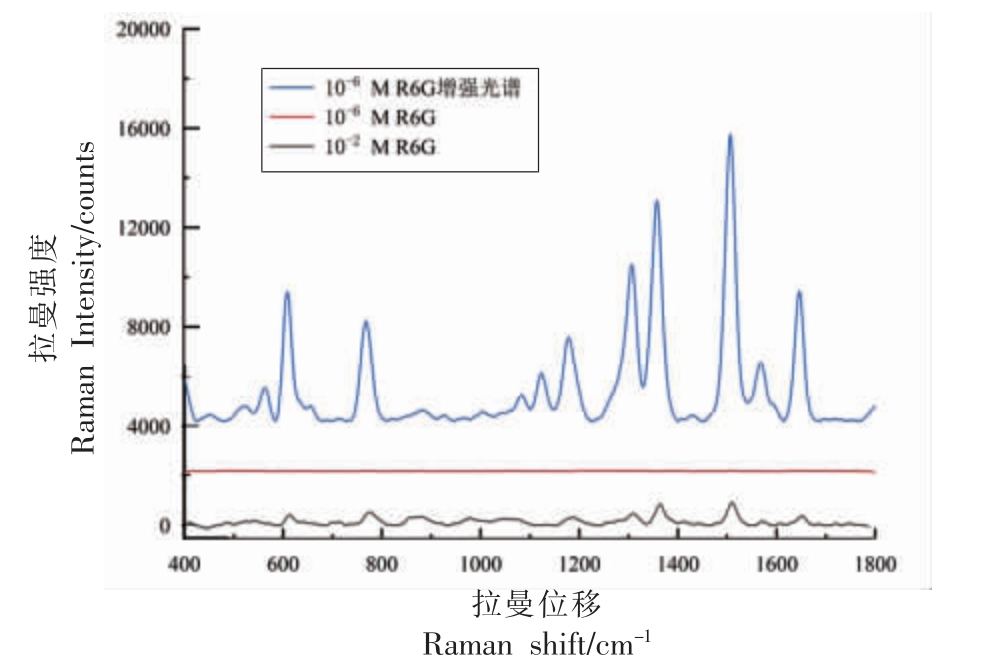
图3 不同试验条件的R6G 拉曼光谱图
Fig.3 R6G Raman spectroscopy of different experimental conditions
在预试验成功的基础上测试了AuNPs/MXenes 基底增强福美双分子拉曼信号时的稳定性,将20 μL 200 ng/mL 的福美双标准溶液与20 μL 200 mg/L AuNPs/MXenes 基底胶体溶液混合装入毛细管,对其20 个不同位置进行检测,结果如图4a 所示,可以看出拉曼光谱信号较为平均,选取1 379 cm-1 处拉曼特征峰的强度如图4b 所示,RSD=7.47%,RSD 低于10%,与其它复合基底相比信号更为稳定,如Au@Ag 纳米颗粒-氧化石墨烯基底的RSD 为13.2%,TiO2/银纳米颗粒的RSD 为11.8%[21-22]。对于储藏期的测量,在21 d 时基底检测福美双时,1 379 cm-1 处拉曼特征峰的强度呈现明显的下降趋势,故储藏期为21 d。
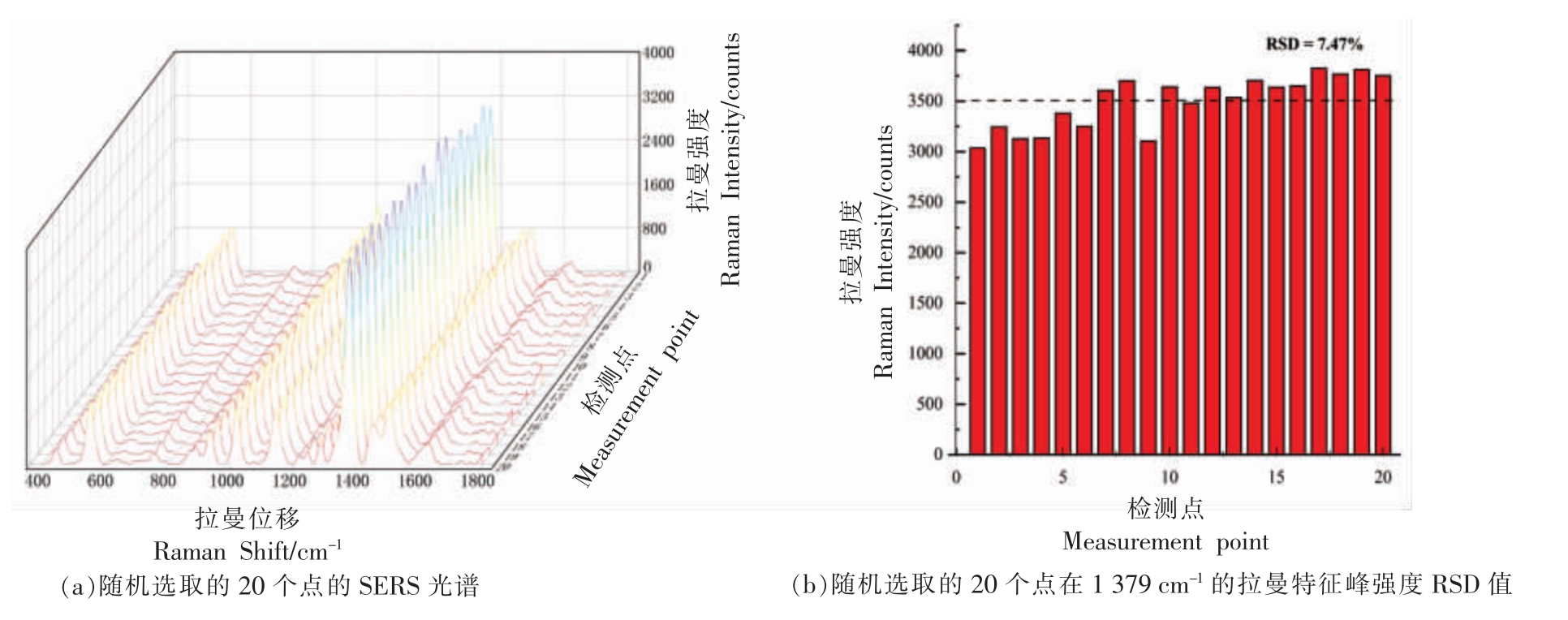
图4 基底稳定性测试
Fig.4 Substrate stability test
2.3 福美双甲醇溶液的拉曼特征峰分析
福美双甲醇溶液的SERS 光谱如图5a 所示,通过对比参考文献,对各个拉曼特征峰的进行了归类分析,分析结果如表1示[23]。在400~1 800 cm-1范围内,福美双在437,562,1 146,1 379,1 514 cm-1处有明显的拉曼特征峰,其中437 cm-1 源于CH3NC 变形和C-S 拉伸,562 cm-1 源于S-S 拉伸,1 144 cm-1 源于C-N 拉伸和CH3 摇摆振动,1 379 cm-1 源于C-N 拉伸和CH3 对称变形,1 514 cm-1源于C-N 拉伸和CH3 变形。
表1 福美双母液光谱与理论光谱的特征峰对应分析表
Table 1 Characteristic peak correspondence analysis table of thiram experimental spectrum and theoretical spectrum


图5 福美双标样的测定
Fig.5 Determination of thiram standard sample
为了表征AuNPs/MXenes 基底对福美双的定量检测效果,稀释福美双母液得到0.1,1,10,100,1 000 ng/mL 的福美双标准溶液并对其进行SERS检测,结果如图5b 所示。从图中可以看出拉曼特征峰处的拉曼强度随着浓度的增加而变强,呈现正相关,故有定量检测的潜力。
2.4 福美双的标准曲线建立
进一步分析光谱数据,得到的拉曼光谱中在1 009 cm-1 处有一个较大的杂质峰,查阅文献之后得知这是属于甲醇CH3OH 的峰,因其与福美双拉曼特征峰并不重叠,故不做处理。福美双位于562 cm-1 和1 146 cm-1 处的拉曼特征峰在质量浓度低至0.1 ng/mL 时拉曼信号很微弱,受到背景噪声影响较大,故不用其作为后续的定量分析。光谱中1 379 cm-1 处的拉曼特征峰强度较好,在极低浓度也能有较为明显的峰型存在,故用此处的拉曼特征峰强度与浓度的对数建立线性关系,结果表明线性关系较好,线性方程为:y=888x+1 151 其决定系数R2=0.986,与其它研究中的决定系数相近,说明SERS 强度与浓度对数的相关性较好,可以用于后续对于福美双残留的浓度计算。其线性相关图如图6a 所示。
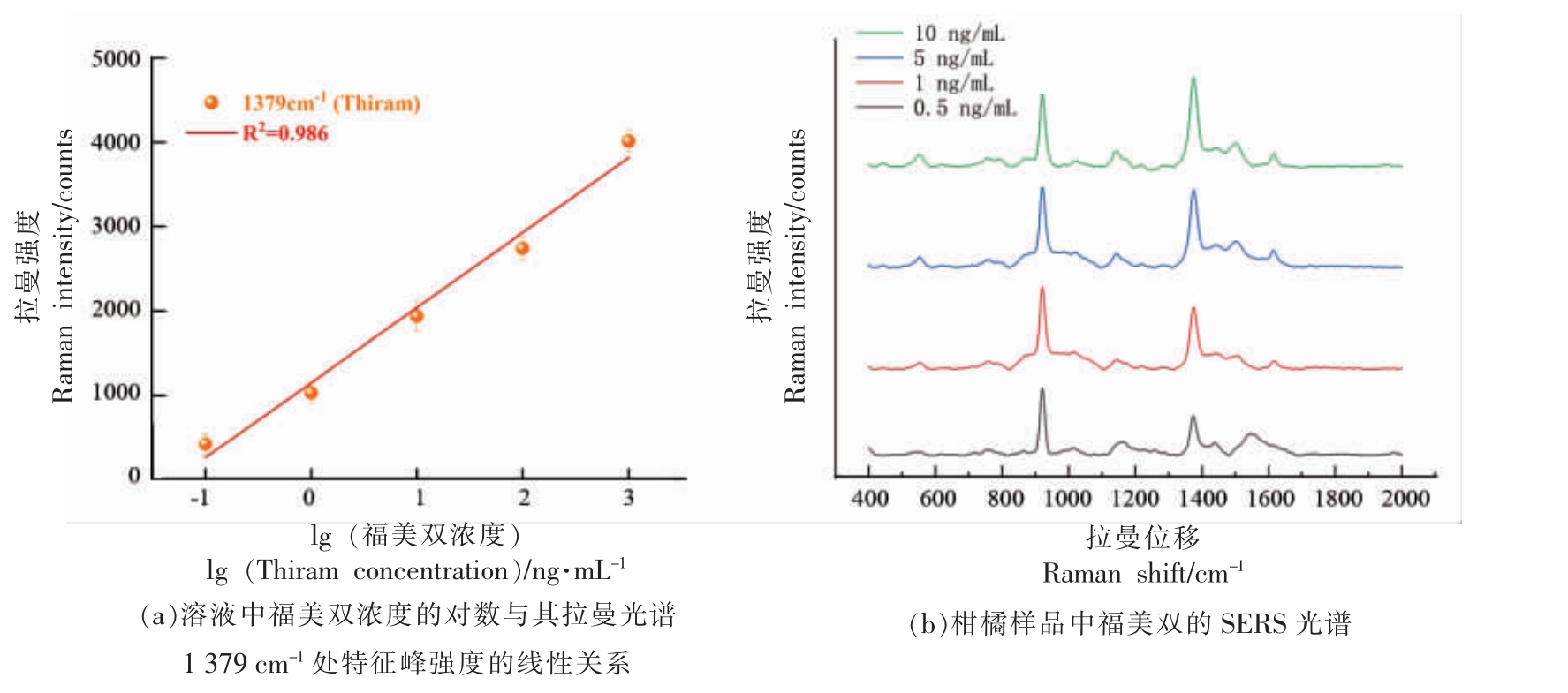
图6 福美双的标准曲线及其在实际样品中的测定
Fig.6 The standard curve of thiram and its determination in actual samples
为计算检测体系的福美双检出限(LOD),参照黄智斌[18]的计算方法,检出限的计算公式为:
式中:Sb——空白样品的标准差;m——线性关系的斜率。
根据上式对检测体系的检出限进行测定,测定出检测限为0.051 ng/mL,满足国家标准中对柑橘中的福美双中的最大残留限量5 ng/mL 的要求。
使用柑橘为真实样品,进行加标试验用来评估福美双标准曲线在实际样品中的定量效果,用QuEChERS 法对加标量分别为10,5,1,0.5 ng/mL的柑橘进行预处理。加入乙腈萃取时,由于无水醋酸钠无水硫酸镁的效果,水层和有机层迅速分层,果肉等杂质在盐析的作用下迅速沉淀至试管下端,同时盐类的溶解也释放出了部分热量,使分子运动加剧,加快了提取的过程,接着在提纯步骤加入了PSA 和C18,对得到的乙腈提取液进行纯化,吸附其中的有机酸、脂肪酸、碳水化合物等物质,溶液变得更加透明。接着对所得溶液进行SERS检测,所得的拉曼光谱如图6b 所示,可以看出加标柑橘样品测出的SERS 光谱中存在一些在提纯过程中没有去除的干扰。
为了使用福美双标准曲线对真实样品进行定量,对加标样品中福美双的浓度单位进行换算。假设QuEChERS 法可以将样品中的福美双全部提取出来,加标样品样品中福美双的质量浓度单位为mg/kg,则提取液中的福美双质量浓度单位为:
利用换算后的单位对柑橘样品中的福美双进行计算和分析。结果列于表2 中。从结果上分析,测量结果浓度比福美双加标浓度普遍偏高,分析原因可能是溶液中的杂质也会发出拉曼增强信号,干扰目标物的检测。
表2 柑橘中福美双残留的分析结果与回收率
Table 2 Analysis results and recovery rate of thiram residue in citrus

3 结论
本文运用静电组装的方法制备了AuNPs/MXenes 材料,制备的MXenes 负载金纳米的二维复合基底SERS 活性高,以福美双为检测目标,研究了基于MXenes(Ti3C2Tx)二维材料材料的表面增强拉曼散射(SERS)基底的农残快速检测方法,决定系数R2 为0.986,检测限为0.051 ng/mL,农残检测限远低于国家标准,为后续建立食品中福美双等农残SERS 检测体系提供了参考,也促进了SERS 技术在食品检测中的应用和发展。
[1] 张秀玲.中国农产品农药残留成因与影响研究[D].无锡:江南大学,2013.ZHANG X L.A study on the causes and effects of pesticide residues in agricultural products in China[D].Wuxi:Jiangnan University,2013.
[2] 郝宝琴.基于表面增强拉曼光谱技术检测抗甲状腺药物和农药残留[D].长春:吉林大学,2021.HAO B Q.Detection of antithyroid drug and pesticide residues based on surface -enhanced Raman spectroscopy[D].Changchun:Jilin University,2021
[3] 于永利,陈形,魏素香,等.福美双对斑马鱼早期胚胎原始生殖细胞和形态发育的影响[J].生态毒理学报,2014,9(6):1133-1140.YU Y L,CHEN X,WEI S X,et al.Thiram affects gene expression of primordial germcell and morphological development of zebrafish embryos[J].Asian Journal of Ecotoxicology,2014,9(6):1133-1140.
[4] 中华人民共和国国家卫生健康委员会,中华人民共和国农业农村部,国家市场监督管理总局.食品安全国家标准 食品中农药最大残留限量:GB 2763-2021[S].北京:中国农业出版社,2021:496.National Health Commission of the People's Republic of China,Ministry of Agriculture and Rural Affairs of the People's Republic of China,State Administration for Market Regulation.National Standard for Food Safety Maximum residue limit of pesticides in food:GB 2763-2021[S].Beijing:China Agriculture Press,2021:496.
[5] 李江林.适配体化纳米基底制备及SERS 检测啶虫脒和毒死蜱农残的研究[D].广州:华南理工大学,2017.LI J L.Preparation of adapted nano-substrates and SERS detection of acetamiprid and chlorpyrifos pesticide residues[D].Guangzhou:South China University of Technology,2017.
[6] ZHENG F,KE W,SHI L,et al.Plasmonic Au-Ag janus nanoparticle engineered ratiometric surface-enhanced Raman scattering aptasensor for ochratoxin a detection[J].Anal Chem,2019,91(18):11812-11820.
[7] ZHANG D R,PU H B,HUANG L J,et al.Advances in flexible surface-enhanced Raman scattering(SERS)substrates for nondestructive food detection:Fundamentals and recent applications[J].Trends in Food Science &Technology,2021,109:690-701.
[8] WANG K Q,SUN D W,PU H B,et al.Polymer multilayers enabled stable and flexible Au@Ag nanoparticle array for nondestructive SERS detection of pesticide residues[J].Talanta,2021,223(2):121782.
[9] HUSSAIN N,PU H B,SUN D W.Core size optimized silver coated gold nanoparticles for rapid screening of tricyclazole and thiram residues in pear extracts using SERS[J].Food Chemistry,2021,350:129025.
[10] DEYSHER G,SHUCK C E,HANTANASIRISAKUL K,et al.Synthesis of Mo4VAlC4 MAX phase and two-dimensional Mo4VC4 MXene with five atomic layers of transition metals[J].ACS Nano,2020,14(1):204-217.
[11] SOUNDIRARAJU B,GEORGE B K.Two-dimensional titanium nitride(Ti2N)MXene:Synthesis,characterization,and potential application as surface-enhanced Raman scattering substrate[J].ACS Nano,2017,11(9):8892-8900.
[12] TAO Q,DAHLQVIST M,LU J,et al.Two-dimensional Mo1.33C MXene with divacancy ordering prepared from parent 3D laminate with in-plane chemical ordering[J].Nat Commun,2017,8:14949.
[13] HART J L,HANTANASIRISAKUL K,LANG A C,et al.Control of MXenes' electronic properties through termination and intercalation[J].Nat Commun,2019,10(1):522.
[14] WU Z H,SUN D W,PU H B,et al.Ti(3)C(2)Tx MXenes loaded with Au nanoparticle dimers as a surface -enhanced Raman scattering aptasensor for AFB1 detection [J].Food Chemistry,2022,372:131293.
[15] SATHEESHKUMAR E,MAKARYAN T,MELIKYAN A,et al.One-step solution processing of Ag,Au and Pd@MXene hybrids for SERS[J].Sci Rep,2016,6(1):32049.
[16] YUE M,LI F,LU N,et al.Synthesis of two-dimensional Ti3C2Tx/Au nanosheets with SERS performance[J].Appl Opt,2019,58(30):8290-8294.
[17] 王芹志.基于金属有机框架的偶氮色素富集机制与SERS 检测研究[D].咸阳:西北农林科技大学,2021.WANG Q Z.Study on Azo pigment enrichment mechanism and SERS detection based on metal-organic framework[D].Xianyang:Northwest A&F University,2021.
[18] 黄智斌.基于Au@Ag 纳米棒的2D 基底的制备及其用于表面增强拉曼检测苹果中的福美双[D].广州:华南理工大学,2020.HUANG Z B.Preparation of 2D substrate based on Au@Ag nanorods and its use in surface-enhanced Raman detection of Fumei bis in apple[D].Guangzhou:South China University of Technology,2020.
[19] NAGUIB M,KURTOGLU M,PRESSER V,et al.Two-dimensional nanocrystals produced by exfoliation of Ti3AlC2[J].Advanced Materials,2011,23(37):4248-4253.
[20] FRENS G.Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions[J].Nature(Physical Science),1973,241(105):20-22.
[21] DAI H C,SUN Y J,NI P J,et al.Three-dimensional TiO2 supported silver nanoparticles as sensitive and UV -cleanable substrate for surface enhanced Raman scattering[J].Sensors and Actuators B-Chemical,2017,242:260-268.
[22] 宋昱瑛.基于表面增强拉曼光谱技术快速检测果汁中福美双和噻菌灵残留[D].上海:上海海洋大学,2020.SONG Y Y.Rapid detection of Thiram and Thiabendazole residues in fruit juice based on surface enhanced Raman spectroscopy[D].Shanghai:Shanghai Ocean University,2020.
[23] SUN H B,LIU H,WU Y Y.A green,reusable SERS film with high sensitivity for in-situ detection of thiram in apple juice[J].Applied Surface Science,2017,416:704-709.
[24] 王许欣,周澍堃,李晓敏,等.高效液相色谱-二极管阵列检测法测定小麦粉及面粉改良剂中福美双[J].色谱,2021,39(6):652-658.WANG X X,ZHOU S K,LI X M,et al.Determination of Thiram in wheat flour and flour amendment by high performance liquid chromatography with diode array detection[J].Chinese Journal of Chromatography,2021,39(6):652-658.
[25] 杨爱华,吴贺,郝培培,等.80%噁霉·福美双可湿性粉剂的高效液相色谱分析[J].天津化工,2019,33(3):7-9.YANG A H,WU H,HAO P P,et al.Analysis of 80% hymexazol thiram double wettable powder by high performance liquid chromatography[J].Tianjin Chemical Industry,2019,33(3):7-9.
[26] 袁哲,李庭铂.果蔬农药残留检测方法研究进展[J].中国果菜,2021,41(9):75-78.YUAN Z,LI T B.Research progress on detection methods of pesticide residues in fruits and vegetables[J].China Fruits and Vegetables,2021,41(9):75-78.
[27] 林诗云,吴晓波,马莉莉,等.甲基硫菌灵·福美双·硫磺可湿性粉剂的高效液相色谱分析[J].云南民族大学学报(自然科学版),2011,20(3):217-219.LIN S Y,WU X B,MA L L,et al.High performance liquid chromatography analysis of methyl Thiophanate -Methyl · Thiram · Sulfur wettable powder[J].Journal of Yunnan University for Nation alities(Natural Science Edition),2011,20(3):217-219.