β-乳球蛋白(β-Lactoglobulin,β-LG)是由乳腺上皮细胞合成并分泌的营养物质,是一种球状蛋白[1],属于脂质蛋白运载家族[2-4],主要参与疏水小分子的运输[5]。β-LG 存在于大多数哺乳动物的乳汁中,尤其在反刍动物(如奶牛、水牛)乳汁中含量最为丰富[6],然而在人乳中并未发现[7]。牛乳中β-LG 的含量因动物品种、泌乳阶段以及季节和饮食等环境因素而呈现出明显的差异性[7],不同地区不同品种的牛乳β-乳球蛋白的亚型种类有所不同。
牛乳β-LG 单体是由162 个氨基酸残基组成,分子质量(Molecular Weight,MW)约为18 300 u[8],等电点(Isoelectric Point,pI)约为5.2。牛乳β-LG 的完整氨基酸序列由Farrell 等确定,其一级结构中含有5 个半胱氨酸残基,其中4 个半胱氨酸残基组成2 个二硫键[9],分别在Cys66-Cys160 和Cys106-Cys119 之间,即每个β-LG 单体含有两个分子内二硫键和1mol 半胱氨酸。目前牛乳β-LG已报道13 种遗传变异体[8,10],分别是A,B,B*,C,D,E,F,G,H,I,J,W,Dr[11],其中最常见的是A(MW 18.363 ku,pI 5.26)和B(MW 18.276 ku,pI 5.34[12],且两者含量最高,B 变体[13]作为参考蛋白,其一级结构如图1 所示:

图1 β-乳球蛋白B 的氨基酸序列[13]
Fig.1 Primary structure of bosβ-LG B[13]
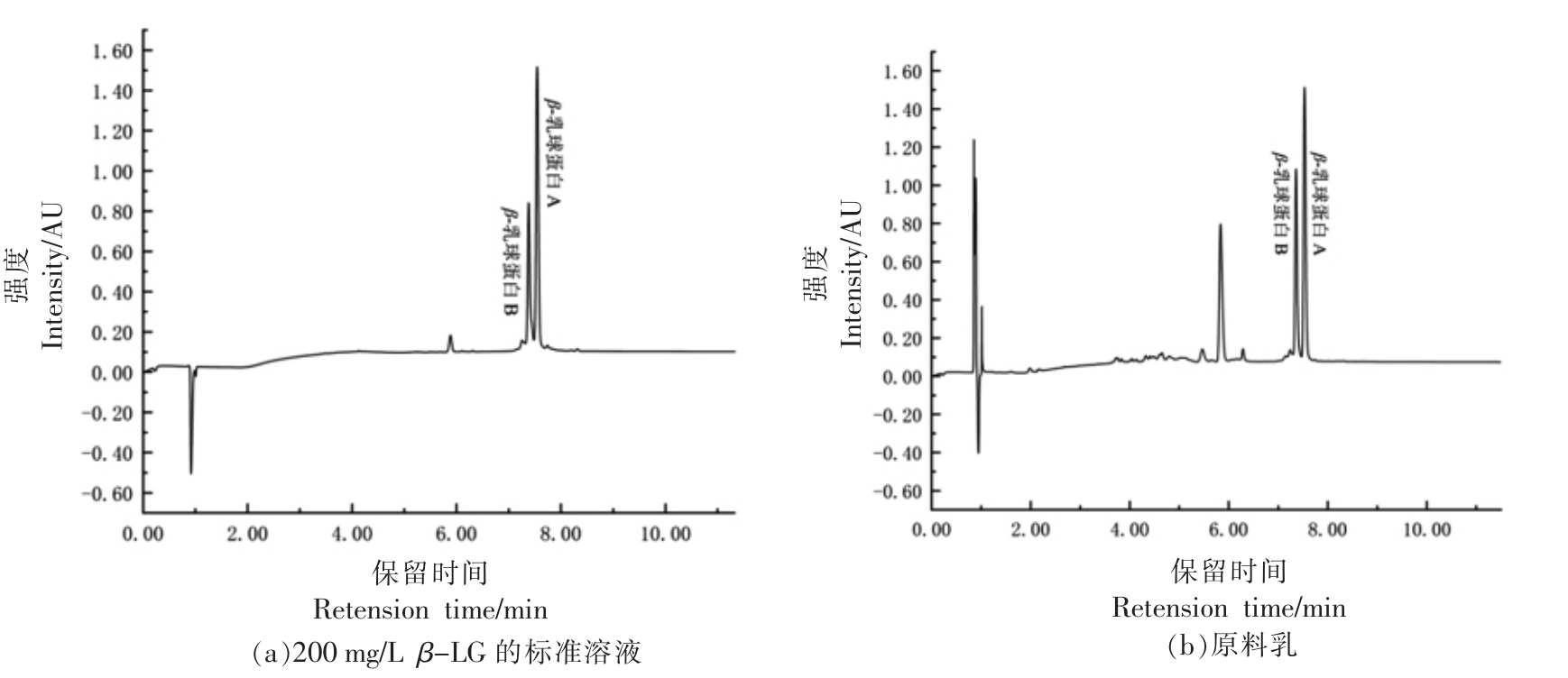
图2 β-LG 液相色谱图
Fig.2 RP-HPLC chromatogram of acid-soluble β-LG
在β-LG B 一级结构的氨基酸序列中,天然β-LG B 的Cys121 残基中的巯基是游离态的[14],两个二硫键在残基66~160 和106~119 之间[15]。与其它遗传变异体的差异见表1。
表1 牛乳β-LG 变异体间的差异
Table 1 Positions and amino acid differences in genetic variants of bovine β-Lactoglobulin

表2 上述液相色谱的参考条件[25,50-53]
Table 2 Reference conditions for the above liquid chromatography[25,50-53]
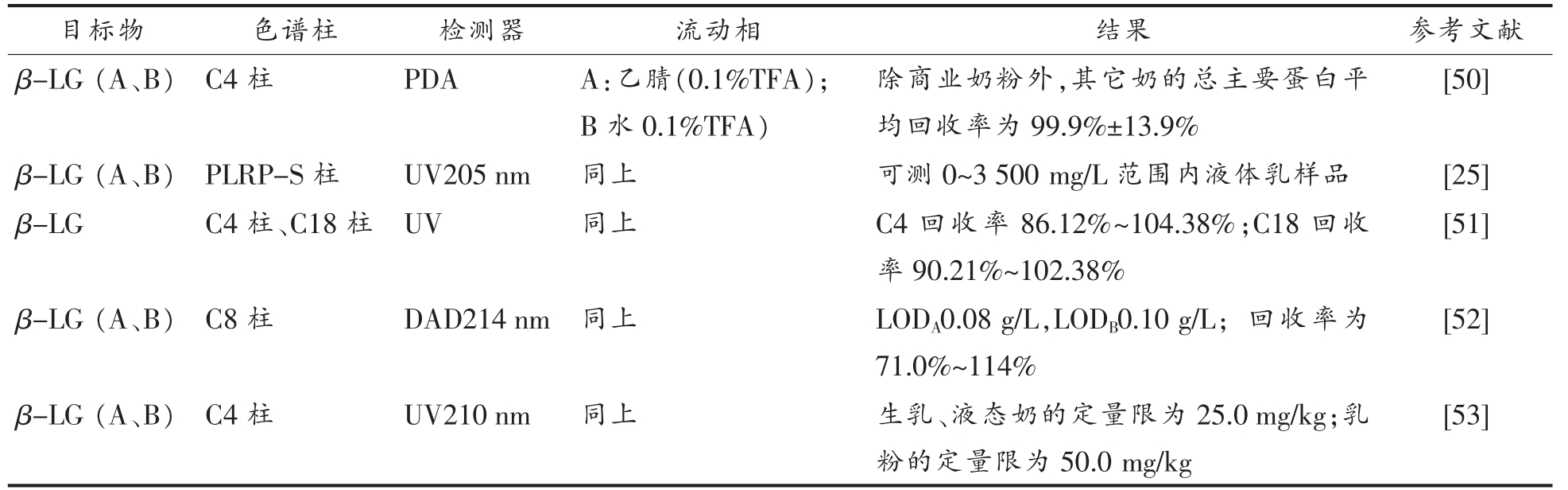
注:LOD:检出限。
如表1 所示,β-LG13 个自然变体中[11],常以变体B 为参考[11,13,16]。Farrell[13]、Caroli[16]和Martin[11]等详细报道了其它变体与B 变体中氨基酸取代的差异:变体A[17-18]和变体B 不同之处在于64 位和118 位,A 为天冬氨酸Asp(64 位)和缬氨酸Val(118 位),B 为谷氨酰胺(64 位)和丙氨酸Ala(118位),其中B 变体疏水性较低,游离半胱氨酸残基的稳定性较低,易发生不可逆变性,这主要是由于B 变体上64 位丙氨酸的替换导致其性质的变化[19],故变体A 表现出比变体B 更具酸性和疏水性[20]。Martine等[11]研究发现等位基因的产物B*具有与变体B 相同的一级结构,通过比较B*等位基因和BLG*B 等位基因的DNA 序列,找出独特差异之处,利用这些变化能很好地区分遗传信息(表型)表达。Braunschweig等[21]研究表明遗传变异性有助于区分B-LG 基因中等位基因的差异。Martin等[11]报道了变体Dr 和B*为真蛋白质变体,并发现变体Dr 是唯一以糖基化形式存在的变体,且与变体A 的氨基酸序列相同。然而,Bell 在之后的报告[18]中指出Dr 的28 位天冬酰胺替代了天冬氨酸,且出现糖基化位点。Martin等[11]提出变体W 的命名可能与异亮氨酸(56 位)转化为亮氨酸(56位)有关,然而未做进一步证实。
在牛乳中,β-LG 约占总蛋白质的10%~12%,占总乳清蛋白的50%[22],是牛乳中主要的乳清蛋白[23],不仅具有特有的营养价值,且在优质乳品中起关键作用。β-乳球蛋白作为一种天然活性蛋白,具有较强的热敏感性[24],常用作牛奶热处理强度的评估指标。通常,巴氏杀菌乳酸溶性β-乳球蛋白≥2 600 mg/L,高温巴氏杀菌乳≥2 000 mg/L,UHT 不低于50 mg/L,ESL 牛奶最低含量1 800 mg/L[25]。
β-乳球蛋白也是牛乳中主要的过敏原之一[26],属于Ⅰ类食物过敏原。为更好地解决牛乳蛋白过敏的问题,β-乳球蛋白被作为食品中牛乳过敏原的特异性标志蛋白,以筛查和鉴定食品中牛乳蛋白的存在及其含量,支撑过敏原的标识。本文从牛乳β-乳球蛋白及其变异体的检测方法方面简要综述国内外有关的研究进展,旨在为β-乳球蛋白的研究提供参考。
1 牛乳β-乳球蛋白的检测方法
目前,β-乳球蛋白的检测方法按检测原理可以分为3 大类:电泳法[27-28]、色谱法[27]、免疫学法[29]。酸溶性β-乳球蛋白的定量方法[30]主要是液相色谱法和毛细管电泳法;而酶联免疫法和电泳法主要用于不同牛奶中β-乳球蛋白的快速定性和半定量。
1.1 电泳法
电泳法,是指带电荷的蛋白质、核苷酸在惰性支持介质(如聚丙烯酰胺凝胶等)中,于电场的作用下,向其对应的电极方向按各自的速度进行泳动,使组分分离成狭窄的区带,用适宜的检测方法记录其电泳区带图谱或计算其含量(%)的方法。电泳法[28,31]是分离蛋白质的经典方法,按不同的分离原理,可包括天然凝胶电泳法、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法、尿素-PAGE 法、毛细管电泳法、等电聚焦法、二维凝胶电泳等[27]。
1.1.1 天然凝胶电泳法 天然凝胶电泳(Native gel electrophoresis),又称为非变性凝胶电泳。即在均匀电场作用下,以凝胶为介质,液体样品组分因电泳迁移率不同而发生分离。天然凝胶电泳可使用淀粉、聚丙烯酰胺或聚丙烯酰胺-琼脂糖凝胶,不使用变性剂(如SDS),目前聚丙烯酰胺凝胶的应用比较广泛[32]。天然凝胶电泳不仅保留了蛋白质的天然构象,还可用于检测特定条件下天然构象的变化[33]。此外,天然蛋白质经分离后还可进行进一步的分析,如质谱分析。
Arakawa等[33]介绍了天然凝胶电泳是观察蛋白质聚集的便捷方法,既不会使蛋白质变性也不会解离蛋白质,天然凝胶中蛋白质的迁移率取决于电荷和流体动力学大小,在低聚物或聚集体的带电状态与单体的带电状态相同的条件下,它可以提供聚集的信息;Niepmann等[34]开发了一种新的天然蛋白质凝胶系统,可以快速简便地分析几乎所有的可溶性蛋白质,特别是天然寡聚状态的碱性蛋白质,此外,还讨论了新凝胶电泳的功能原理、优点和缺点。
1.1.2 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)是根据样品中蛋白质分子质量大小的不同,使其在电泳胶中分离。一般采用的是不连续缓冲系统,与连续缓冲系统相比,能够有较高的分辨率,是聚丙烯酰胺凝胶电泳中最常用的一种蛋白表达分析技术。使用SDS-PAGE时,电泳迁移率仅与分子大小相关,由此使不同分子质量的蛋白质得以分离。为了消除电荷的干扰,需要采用十二烷基硫酸钠(SDS)对蛋白质进行变性处理[35]。
Defernez等[36]模拟了体内β-乳球蛋白和β-酪蛋白的消化模式,通过SDS-PAGE 凝胶上肽条带进行β-乳球蛋白和β-酪蛋白的鉴定和定量,同时评估了10 家实验室的定量重复性;Sharma等[37]采用SDS-PAGE 法,通过使用阳离子染料全部染色丙烯酰胺凝胶后,再对主要乳清蛋白进行染色和脱色,即β-LG 呈红色,而GMP 呈蓝色,鉴定了奶酪乳清中的糖巨肽(GMP)和β-乳球蛋白(β-LG),该方法可用于奶酪乳清中β-乳球蛋白和其它大分子的鉴定。
1.1.3 尿素-PAGE 法(Urea-PAGE)变性凝胶电泳是在凝胶中加入了碱性试剂尿素制成变性凝胶,DNA 样品在变性凝胶中的电泳分离过程称作变性凝胶电泳。尿素是一种离液剂,在高浓度下,通过破坏蛋白质使蛋白质变性稳定蛋白质二级、三级和四级结构的氢键。尿素具有中性静电荷,这意味着它不会在电场中迁移。它也是一种很好的解离剂,对酪蛋白的分析非常有用。因为它可以防止蛋白质的聚集和沉淀[32,38]。与SDS-PAGE 类似,样品制备中可能含还原剂以破坏二硫键。尿素-PAGE 算是一个不错的选择,当需要进一步分析切除的蛋白质时,可作为SDS-PAGE 的替代变性剂,因为尿素的去除比SDS 更容易[32]。
Hekken等[39]建立了一种根据荷质比在同一尿素凝胶上分离酪蛋白和乳清蛋白的快速技术,不仅清晰地分离了酪蛋白和乳清蛋白,还可以观察到β-乳球蛋白A 和B 的遗传表型分离。Veloso等[40]使用Urea-PAGE 法对掺假牛奶进行了检测,并跟踪了不同乳源奶酪中蛋白水解演变的过程,与HPLC 法检测结果比较相似。
1.1.4 毛细管电泳法 毛细管电泳法[32](Capillary electrophoresis,CE)是以弹性石英毛细管为分离通道,以高压直流电场为驱动力,依据样品中各组分之间淌度和分配行为上的差异而实现分离的电泳分析方法。
Ding等[41]采用CE 的分析方法测定了乳清粉、原料乳及婴幼儿配方奶粉中β-乳球蛋白的A 和B,在50~400 mg/L 质量浓度范围内,相关系数均大于0.9970,检出限为15 mg/L 和12 mg/L,定量限为50 mg/L 和40 mg/L。
Trimboli等[42]报道了应用毛细管电泳法快速且经济的识别掺有牛奶的羊奶,脱脂后利用碱性缓冲液分离检测,具有样品制备时间短的优点,该方法适用于不同乳基的牛奶及干酪等的掺假检验,是一种廉价且稳健的筛选方法。
Feng等[43]利用十二烷基硫酸钠-毛细管凝胶电 泳(Sodium Dodecyl Sulfate -Capillary Gel Electrophoresis,SDS-CGE),定量分析了乳基婴儿配方奶粉中的乳清蛋白的含量,并联合19 个实验室参与分析了15 种重复盲编码的婴幼儿配方粉产品,除样品NIST1849a 外,其它重复性和再现性的相对标准偏差分别为 0.83%~2.11%和2.18%~4.22%。该方法适用于定量乳基婴幼儿配方粉中的乳清蛋白含量,不适用于水解蛋白或植物基蛋白的婴儿配方奶粉。
Masci等[44]通过使用毛细管电泳技术,利用山羊奶、水牛奶、绵羊奶和牛奶中各类蛋白质作为真实性标记,检测牛奶混合物和奶酪中的掺假,几乎不需要使用溶剂,分析时间短,操作简单。适用于乳制品真伪的鉴定。
1.1.5 等电聚焦法 等电聚焦电泳[27](Isoelectric focusing,IEF)是依据蛋白质分子的净电荷或等电点进行分离的技术。在等电聚焦过程中,电场所采用的载体为两性电解质,可在电场中形成正极为酸性,负极为碱性的连续pH 值梯度,蛋白质分子在连续而稳定的线性pH 值梯度中电泳,当蛋白质迁移到其等电点位置时,净电荷为零。在电场中不再移动,因此可将各种不同等电点性质的蛋白质分离开来。
IEF 是根据等电点的差别分离蛋白质的,与蛋白质的分子质量无关。要取得满意的等电聚焦电泳分离结果,除有好的载体两性电解质外,还应加入抗对流介质(如聚丙烯酰胺凝胶),使已分离的蛋白质区带不致发生再混合。Andrei[45]综述了乳蛋白分离和鉴定的重要方法,详细介绍了等电聚焦电泳技术并指出IEF 分离蛋白质的分辨率受pH 值梯度斜率和电场强度控制。
1.1.6 二维凝胶电泳 二维凝胶电泳[27](two-dimensional gel electrophoresis,2D-GE)是目前蛋白质组研究中最有效的分离技术。其原理是根据蛋白质的两个一级属性,即等电点和相对分子质量的特异性,将蛋白质混合物在电荷(采用等电聚焦方式)和相对分子质量(采用SDS-PAGE 方式)两个方向上进行分离。蛋白质混合物在第一维方向上的分离是利用蛋白质等电点的不同在大孔凝胶中将蛋白质分离开;蛋白质混合物在第二维方向上的分离是按照蛋白质的相对分子质量的大小进行分离。通过双向电泳把复杂的蛋白质成分分离和展现在二维平面上,不但能呈现天然蛋白质表达图谱全貌和提供其PI、Mr 等,还可定量分析不同样品蛋白质的表达丰度。Chevalier等[31]介绍了使用2D-GE 时,缓冲溶液、清洗剂、增溶缓冲液及还原剂的选择和注意事项。
1.1.7 芯片实验室 芯片实验室(Lab on a chip)主要采用微流控技术,集成样品制备、分离和检测在芯片表面进行。相比于其它电泳方法,它属于微全分析系统,具有分析时间短(1~3 min 即可完成)、分析成本低、灵敏度高及所需的样本量小[46]等优点。
Anema[47]使用微流体“芯片实验室”技术分离和定量了主要的牛乳蛋白质,并将该方法与SDS-PAGE 进行了比较;使用芯片法可分离牛乳中α-La、β-LG 和αs-、β-和κ-酪蛋白,但无法分离免疫球蛋白、乳铁蛋白和血清白蛋白,试验结果表明微流控芯片技术可作为牛乳蛋白质的快速分离和定量的替代技术。Tran等[48]综述了通过电泳方法,使用微芯片技术分离蛋白质的研究进展,并总结了微芯片技术中预处理、预浓缩或从复杂基质中纯化蛋白质的不同方法及不同检测方法中涉及的蛋白质的衍生化或标记。
1.2 色谱方法
色谱学方法主要包括反相高效液相色谱法(Reversed phase-high-performance liquid chromatography,RP-HPLC)、体积排 阻色谱 法(Size exclusion chromatography,SCE)、离子交换色谱法(Ion -exchange chromatography,IEX)、质谱法(Mass spectrometry,MS)。
1.2.1 反相液相色谱法 反相高效液相色谱(Reversed phase-high-performance liquid chromatography,RP-HPLC)广泛用于牛乳蛋白质的分离、鉴定和定量研究[49],通常使用非极性固定相来进行蛋白质分离。分析样品经梯度洗脱后,在特定波长下,通过紫外、荧光或二极管阵列检测器检测,实现对待检样品的分析。
Bordin等[50]采用反相离子对色谱法分离并定量了牛乳中7 种主要的蛋白质,包括κ-酪蛋白、αs2-酪蛋白、αs1-酪蛋白、β-酪蛋白、α-乳白蛋白、β-乳球蛋白B、β-乳球蛋白A,其中涉及的样品有脱脂奶粉标准物质CRM063R、各种商业奶及原料乳。
国际标准IDF 178:2005(E)[25]中规定了,应用RP-HPLC 法测定液态奶中酸(pH=4.6)溶性β-乳球蛋白的含量,该方法在205 nm 下测试了0~3 500 mg/L 范围内的β-乳球蛋白,适用于区分不同热处理条件下的液态奶。
Kong等[51]建立了C4 柱和C18 柱的RPHPLC 法分析了10 份牛奶中β-乳球蛋白和α-乳白蛋白,并比较了两种色谱柱的性能和特性;
Ma等[52]通过RP-HPLC 法同时分离和定量了牛乳中主要蛋白质及其亚型(κ-酪蛋白、α-酪蛋白、α-乳白蛋白、A1 β-酪蛋白、A2 β-酪蛋白、β-乳球蛋白B、β-乳球蛋白A),其中β-乳球蛋白A 的检出限和加标回收率分别为0.08 g/L 和71.2-91.6%,β-乳球蛋白B 的检出限和加标回收率分别为0.10 g/L 和71.0%~111.0%;
团体标准T/TDSTIA 007-2019[53]规定了奶及奶制品中β-乳球蛋白的液相色谱测定方法,其适用于生乳、液态奶和乳粉,生乳、液态奶的定量限为25.0 mg/kg;乳粉的定量限为50.0 mg/kg。
在HPLC 的基础上进行升级,Boitz等[24]使用小颗粒反相柱,通过UPLC 检测了热处理牛乳中β-乳球蛋白,仅需3 min 即可完成。相较传统的RP-HPLC,RP-UPLC 大大节省了时间。
除了RP-HPLC,其它基于阴离子或阳离子交换色谱的方法(HILIC-MS)[54]多用于热处理后β-乳球蛋白的聚集情况。
1.2.2 体积排阻色谱法 体积排阻色谱法(Size exclusion chromatography,SEC),也称为凝胶过滤或凝胶渗透色谱法[55]。根据蛋白质的流体力学体积,使用交联聚合物(如葡聚糖和琼脂糖)组成的多孔柱,以达分离蛋白质,可用于蛋白质大小、定量、分子质量的测定。色谱柱中的孔会捕获并阻止较小分子的迁移,而较大的分子会更快通过。因此较大的分子首先洗脱,即保留时间短;较小分子洗脱较晚,保留时间更长。
随着各种孔径尺寸排阻色谱柱的发展,尺寸排阻色谱可分析的分子质量范围为从0.1~10 000 ku,此方法的一大优势是对所分析蛋白质的无创影响。分析物经洗脱后,有益于进行下一步分析(如质谱)的物质。
Goetz等[56]报道了SEC 与其它蛋白质测定技术,如:十二烷基硫酸钠聚丙烯酰胺凝胶电泳、芯片实验室或微流体技术和质谱,并比较每种技术的优势、应用领域、分析时间、蛋白质大小方面的局限性和定量性能。
1.2.3 离子交换色谱法 离子交换色谱(Ion-exchange chromatography,IEX)是根据蛋白质对离子交换树脂(固定相)上带电位点的静电吸引力来分离蛋白质。牛乳蛋白质携带的静电荷取决于他们所处环境的pH 值,离子色谱主要用来分离蛋白质。
Ye等[57]报道了应用IEX 从牛乳清蛋白中分离β-乳球蛋白B 和β-乳球蛋白A 的方法,通过使用强阴离子交换剂进行吸附和分离。
1.2.4 质谱法 质谱(Mass spectrometry,MS)可以解析、鉴定和定量蛋白质,通过测定可获得蛋白质的分子质量、氨基酸序列及翻译后的修饰信息(如修饰的位置和类型)。质谱法中,首先蛋白质通过一些上述分离技术(电泳法和色谱法)进行分离后,再由质谱仪根据质荷比的差异进行分析。常用的是液相色谱-质谱联用(LC-MS)。
Ren等[58]报道了应用UPLC-MS 法同时测定婴幼儿配方奶粉中α-乳白蛋白和β-乳球蛋白的含量。在选定区域监测模式下,该方法具有速度快和检测限低的优点。
Vincent等[59]建立了LC-ESI-Q-TOF MS(liquid chromatography -electrospray ionization -Quadrupole-Time of Flight Mass spectrometry)法高通量检测牛奶中的主要蛋白质,比较了来自不同牛品种的牛奶且适用于大批量牛奶样品的检测,也可用于UHT 牛奶、全脂山羊奶和母乳样品。
Miranda等[60]报道了一种改进的LC-MS 法,通过观察到的蛋白质分子质量与完整蛋白质的理论质量进行比较,准确测定牛乳中6 种主要蛋白质(αs1-,αs2-,β-and κ-CN,α-LA and β-LG),包括等位基因和剪接变体,以及翻译后修饰产生的异构体,且具有较好的分辨率。
Anantharamkrishnan等[61]利用选定的风味物质侧链和β-乳球蛋白末端氨基之间发生反应,形成共价键,再应用UPLC/ESI-QTOF MS 监测在β-乳球蛋白与风味物质形成共价键时发生的质量转移,探寻分子中的反应位点,进一步了解风味物质与β-LG 的相互作用。
1.3 免疫学方法
免疫学方法是检测β-乳球蛋白的重要方法,主要包括酶联免疫吸附法(enzyme-linked immune sorbent assay,ELISA)、免疫层 析技术(Immunochromatography,ICA)、电化学 免疫技 术(Electrochemical Immunoassay,ECIA)、蛋白微阵列技术(Protein microarray chip)、表面等离子体共振技术(Surface plasmon resonance SPR)等。
1.3.1 酶联免疫吸附法 酶联免疫吸附法(enzyme-linked immune sorbent assay,ELISA)是免疫反应和酶催化显色反应相结合的一种免疫诊断技术。将有免疫活性的抗原或抗体结合在固体载体上,使待测物与之发生免疫反应,配合酶催化的显色反应显示时候存在目标物,在一定条件下显色深浅与待测物中抗原或者抗体的量成正比,具有操作简单、速度快、灵敏度高、特异性强和速度快等优点。该方法常用的类型是竞争性ELISA(cELISA)和夹心ELISA 法(sELISA)[62]。
Luis等[63]采用cELISA 和sELISA 两种形式来检测牛乳β-乳球蛋白,分析了11 种表示含有牛乳蛋白的食品,试验结果表明11 种食品均含有β-乳球蛋白,且cELISA 法检测结果高于sELISA法;He等[64]利用β-乳球蛋白多克隆抗体为检测抗体,将其与纳米铂偶联制备检测探针,建立了高灵敏度的夹心ELISA 检测方法,并对婴幼儿奶粉等样品进行了检测分析,方法的检测结果与商业夹心ELISA 试剂盒基本保持一致。
1.3.2 免疫层析技术 免疫层析技术(Immunochromatography,ICA)是将特异的抗体先固定于条状纤维层析材料上,当浸入测试液后,通过毛细管作用使待测物在层析条上移动,当移动至固定有抗体的区域时,样品中相应的抗原即与该抗体发生特异性结合,通过标记物实现特异性的免疫诊断。常用的标记物质有镧系稀土元素螯合物、上转磷光材料(UPC)、荧光胶乳颗粒、荧光微球、量子点、免疫磁珠、纳米磁性微粒、核酸适配体等。
Pyo等[65]总结了荧光标记免疫层析技术开发和应用的最新进展,并提出了它们未来的潜在优势,尤其是高灵敏度检测,适用于低浓度分析物的测定。Wu等[66]利用牛乳β-乳球蛋白单克隆抗体,建立了金免疫层析方法,共检测了110 个进出口食品样品,其中106 个样品检测结果与过敏原标识一致,结果表明该方法可用于食品中β-乳球蛋白的快速半定量检测。
1.3.3 电化学免疫技术 电化学免疫分析技术(Electrochemical Immunoassay,ECIA)是将免疫技术与电化学检测相结合的一种免疫分析方法。具有灵敏度高、检测范围宽、检出限低等优点,适用于小体积样品中痕量物质的测定。常用的标记物主要有两类:生物酶及电化学活性物质。
Lettieri等[67]开发了一种基于β-乳球蛋白适配体的电化学方法,采用循环伏安法在石墨表面电沉积聚苯胺-邻氨基苯甲酸共聚物。然后将氨基修饰的适配体序列固定在共聚物修饰的传感器表面上,分析不同浓度的β-LG 溶液,用链霉亲和素-碱性磷酸酶偶联物标记后进行亲和反应,加入酶底物后通过差分脉冲伏安法对其进行检测。β-乳球蛋白的浓度范围为0.01~1.0 mg/L,检出限为0.053 μg/L。
Sun等[68]利用抗体的特异性识别和生物传感技术,设计了一种新型的无标记光电化学免疫传感器用以检测乳制品中的过敏原β-乳球蛋白。将Ag2S 敏化的纺锤形BiVO4/BiOBr 异质结固定在ITO 电极表面,并以硫代乙醇酸为连接物,将β-乳球蛋白固定在电极表面,通过检测不同抗原浓度的光电流,实现β-LG 的定量检测。β-LG 的线性范围为10~100 ng/mL,最低检出限为3.7 pg/mL,该方法不仅对β-LG 具有较强的特异性识别,且不受牛奶中其它蛋白的影响。此电化学免疫传感器稳定性好、线性范围宽、灵敏度高、重现性好。
1.3.4 蛋白微阵列技术 蛋白质微阵列(又称蛋白质芯片,Protein microarray chip),它是在固相支持物表面高密度排列探针蛋白或抗体点阵,可特异的捕获样品中的分子,然后用激光扫描系统或CCD(电感耦合器件)获取数组图像,最后用专门的计算机软件进行图像分析和结果定量。
Li等[69]基于竞争性免疫反应和银增强技术,以可见数组点作为检测信号,建立了可视化微阵列法检测各种牛奶中α-乳白蛋白、β-LG 和乳铁蛋白,β-乳球蛋白的检出限为0.05 mg/L,且样品分析结果与高效液相色谱法相吻合,具有高通量、特异性强、灵敏度高等优点;Ricciardi等[70]基于微悬臂共振器阵列,使用相同的多克隆抗体为捕获剂,建立了夹心免疫识别测定法检测牛奶过敏原β-乳球蛋白,β-乳球蛋白的LOD 和LOQ 分别为0.04,0.1 mg/L,比市售的ELISA 试剂盒有更低的检出限和定量限,是微悬臂梁共振器阵列成功检测低浓度牛奶过敏原的首例。
1.3.5 表面等离子体共振技术 表面等离子体共振技术(surface plasmon resonance,SPR)检测原理是利用光学生物传感器或电化学信号传导器使抗原和抗体发生反应,然后用SPR 的光学生物传感技术检测抗原和抗体的吸附反应,由此进行定量。这种方法是一种直接无需标记的定量分析,可用于乳中β-乳球蛋白的检测。例如,Billakanti等[71]采用SPR 法定量测定了原料奶及其它乳制品中的α-乳白蛋白、β-乳球蛋白、牛血清白蛋白、乳铁蛋白和免疫球蛋G 5 种乳清蛋白,研究了固定化抗体的稳定性和分析的可重复性,确定了样品间SPR 响应的最佳pH 值,同时对比了反相液相色谱法和标准酶联免疫吸附测定法;Ashley等[72]应用SPR 传感器,采用多克隆抗体直接测定牛奶过敏原β-乳球蛋白,该方法灵敏且无标记,方法检出限为0.164 μg/mL。
2 结语
本文回顾了三大类检测技术在牛乳β-乳球蛋白中的大量应用。虽然二维凝胶电泳的图像分析可获得牛乳β-LG 的相对定量,但面临着自动化困难、动态范围差和灵敏度有限等问题。液相色谱(LC)和毛细管电泳(CE)等技术克服了二维凝胶的局限性,尤其是两者与质谱相结合可以检测疏水性、低分子质量的蛋白质,是从复杂混合物中分离牛乳β-乳球蛋白的有用技术。通常,LC 和CE与ESI-MS 或-MS/MS 可轻松地联用结合,基于MS 的多反应监测(Multiple reaction monitoring,MRM)技术,确定分子质量、氨基酸序列等,并产生绝对或相对的定量数据。
近年来,高通量的质谱分析已成为识别和量化蛋白质的关键技术。目前挑战在于大多数蛋白质/肽没有被有效地电离,且高丰度蛋白质存在的情况下,如何确定痕量肽,提高三重四极杆质谱仪的分辨率并克服源内碎片问题;缩短前处理时长,寻找具有与胰蛋白酶一样高特异性和效率的替代蛋白酶;针对各种蛋白类型开发了特定的蛋白质数据库和预测工具,不断更新并包含易于查找的信息,以便研究人员选择最合适的检测技术。
[1] BELLO M.Structural mechanism of the Tanford transition of bovine β -lactoglobulin through microsecond molecular dynamics simulations[J].Journal of Biomolecular Structure &Dynamics,2022,40(7):3011-3023.
[2] LEILABADI-ASL A,DIVSALAR A,SABOURY A A,et al.Probing the interaction of two chemotherapeutic drugs of oxali-palladium and 5-fluorouracil simultaneously with milk carrier protein of β-lactoglobulin[J].International Journal of Biological Macromolecules,2018,112:422-432.
[3] ROTH-WALTER F,AFIFY S M,PACIOS L F,et al.Cow's milk protein β-lactoglobulin confers resilience against allergy by targeting complexed iron into immune cells[J].The Journal of Allergy and Clinical Immunology,2021,147(1):321-334.
[4] SAWYER L.β-Lactoglobulin and glycodelin:Two sides of the same coin?[J].Frontiers in Physiology,2021,12:678080.
[5] ANGHEL L,ROGACHEV A,KUKLIN A,et al.β-Lactoglobulin associative interactions:a small-angle scattering study[J].European Biophysics Journal,2019,48(3):285-295.
[6] OFTEDAL O T.Origin and evolution of the major constituents of milk [M/OL]//McSweeney P L H and Fox P F.Advanced dairy chemistry:Volume 1A:Proteins:Basic aspects.4th Edition.New York:Springer Science and Business Media,2013:1-42.(2012-10-27)[2022-08-15].https://doi.org/10.1007/978-1-4614-4714-6_1.
[7] SAWYER L.β-Lactoglobulin[M/OL]//McSweeney P L H and Fox P F,Advanced dairy chemistry:Volume 1A:Proteins:Basic aspects.4th Edition.New York:Springer Science and Business Media,2013:211-219.(2012-10-27)[2022-08-15].https://doi.org/10.1007/978-1-4614-4714-6_7.
[8] DEETH H,BANSAL N.Whey proteins:An overview[M/OL]//University of queensland.whey proteins.Australia:Academic Press,2019:3-7.(2018-09-07)[2022-08-15].https://doi.org/10.1016/B978-0-12-812124-5.00001-1.
[9] YANG W,TU Z,WANG H,et al.Mechanism of reduction in IgG and IgE binding of β-lactoglobulin induced by ultrasound pretreatment combined with dry -state glycation:A study using conventional spectrometry and high-resolution mass spectrometry[J].Journal of Agricultural and Food Chemistry,2017,65(36):8018-8027.
[10] AMALFITANO N,STOCCO G,MAURMAYR A,et al.Quantitative and qualitative detailed milk protein profiles of 6 cattle breeds:Sources of variation and contribution of protein genetic variants[J].Journal of Dairy Science,2020,103(12):11190-11208.
[11] MARTIN P,BIANCHI L,CEBO C,et al.Genetic polymorphism of milk proteins [M/OL]//McSweeney P L H and Fox P F.Advanced dairy chemistry:Volume 1A:Proteins:Basic aspects.4th Edition.New York:Springer Science and Business Media,2013:472-474.(2012-10-27)[2022-08-15].https://doi.org/10.1007/978-1-4614-4714-6_15.
[12] ZHENG K,CHEN Y,WANG X,et al.Selective protein separation based on charge anisotropy by spherical polyelectrolyte brushes[J].Langmuir:the ACS Journal of Surfaces and Colloids,2020,36(35):10528-10536.
[13] FARRELL H M,JIMENEZ-FLORES R,BLECK G T,et al.Nomenclature of the proteins of cows'milk -sixth revision [J].Journal of Dairy Science,2004,87(6):1641-1674.
[14] BRITTAN H,MUDFORD J C,NORRIS G E,et al.Labelling the free sulfydryl group in beta-lactoglobulin A,B and C[J].International Dairy Federation,1997,10(2):200-203.
[15] QIN B Y,BEWLEY M C,CREAMER L K,et al.Functional implications of structural differences between variants A and B of bovine β-lactoglobulin[J].Protein Science,1999,8(1):75-83.
[16] CAROLI A M,CHESSA S,ERHARDT G J.Invited review:Milk protein polymorphisms in cattle:effect on animal breeding and human nutrition[J].Journal of Dairy Science,2009,92(11):5335-5352.
[17] MULVIHILL P R.Thermal unfolding of β-lactoglobulin,α-lactalbumin,and bovine serum albumin.A thermodynamic approach[J].Critical Reviews in Food Science and Nutrition,1996,36(6):565-601.
[18] GAI N,UNIACKE-LOWE T,O'REGAN J,et al.Effect of protein genotypes on physicochemical properties and protein functionality of bovine milk:A review[J].Foods,2021,10(10):2409.
[19] NAQVI Z,AHMAD E,KHAN R H,et al.Nonnative states of bovine beta-lactoglobulin induced by acetonitrile:pH-dependent unfolding of the two genetic variants A and B[J].Cell Biochemistry and Biophysics,2013,66(1):175-185.
[20] CROGUENNEC T,TAVARES G M,BOUHALLAB S.Heteroprotein complex coacervation:A generic process[J].Advances in Colloid and Interface Science,2017,239:115-126.
[21] BRAUNSCHWEIG M H,LEEB T.Aberrant low expression level of bovine beta-lactoglobulin is associated with a C to a transversion in the BLG promoter region[J].Journal of Dairy Science,2006,89(11):4414-4419.
[22] CREAMER L K,LOVEDAY S M,SAWYER L.Milk Proteins | β-Lactoglobulin[M/OL]//Fuquay J W,Encyclopedia of Dairy Sciences.Second Edition.Mississippi State:Academic press,2011:787-794.(2011-04-07)[2022-08-15].https://doi.org/10.1016/B978-0-12-374407-4.00433-7.
[23] DU P C,TU Z C,WANG H,et al.Investigation of the effect of oxidation on the structure of β-lactoglobulin by high resolution mass spectrometry[J].Food Chemistry,2021,339:127939.
[24] BOITZ L I,FIECHTER G,SEIFRIED R K,et al.A novel ultra-high performance liquid chromatography method for the rapid determination of β-lactoglobulin as heat load indicator in commercial milk samples[J].Journal of Chromatography A,2015,1386:98-102.
[25] Liquid milk-Determination of acid-soluble β-lactoglobulin content -Reverse -phase HPLC method:ISO 13875:2005[S/OL].(2005-02-01)[2022-08-15].https://www.iso.org/obp/ui/en/#iso:std:iso:13875:ed-1:v1:en.
[26] SUN Z,WANG M,HAN S,et al.Production of hypoallergenic milk from DNA-free beta-lactoglobulin(β-LG)gene knockout cow using zinc-finger nucleases mRNA[J].Scientific Reports,2018,8(1):15430.
[27] GOULDING D A,FOX P F,O'MAHONY J A.Milk proteins:An overview[M/OL]//Boland M,Singh H.Milk proteins,Third Edition.Oxford:Academic Press,2020:52-70.(2020-01-24)[2022-08-15].https://doi.org/10.1016/B978-0-12-815251-5.00002-5.
[28] SHARMA N,SHARMA R,RAJPUT Y S,et al.Separation methods for milk proteins on polyacrylamide gel:Critical analysis and options for better resolution[J].International Dairy Journal,2021,114(2021):104920.
[29] 何圣发.基于IgE 表位识别检测牛乳β-乳球蛋白过敏原的新技术[D].南昌:南昌大学,2018.HE S F.Novel approaches to the detection of bovine β-lactoglobulin by specific antibody against human IgE bingding epitopes[D].Nanchang:Nanchang University,2018.
[30] OEVER S P V D,MAYER H K.Analytical assessment of the intensity of heat treatment of milk and dairy products[J].International Dairy Journal,2021,121(2021):105097.
[31] CHEVALIER F.Analytical Methods | Electrophoresis[M/OL]//Fuquay J W,Encyclopedia of Dairy Sciences.Second Edition.Mississippi State:Academic Press,2011:185-192.(2011-04-07)[2022-08-15].https://doi.org/10.1016/B978-0-12-374407-4.00017-0.
[32] SHEEHAN D.Physical biochemistry:Principles and applications[M].West Sussex:John Wiley &SonsLtd.2nd Edition ed,2009:11-50.
[33] ARAKAWA T,PHILO J S,EJIMA D,et al.Aggregation analysis of therapeutic proteins,part 1:general aspects and tech niques for assessment[J].BioProcess International,2006,4(10):42-49.
[34] NIEPMANN M.Discontinuous native protein gel electrophoresis:pros and cons[J].Expert Review of Proteomics,2007,4(3):355-361.
[35] DUPONTD,CROGUENNECT,BRODKORDA,et al.Quantitation of proteins in milk and milk products[M/OL]// Fox P F,McSweeney P L H.Advanced dairy chemistry:Volume 1:Proteins.Third Edition,Kluwer Academic Plenum Publishers,2012:87-134.(2012-10-27)[2022-08-15].https://doi.org/10.1007/978-1-4419-8602-3_2.
[36] DEFERNEZ M,MANDALARI G,MILLS E N.Quantitative assessment of multi -laboratory reproducibility of SDS-PAGE assays:Digestion pattern of beta-casein and beta-lactoglobulin under simulated conditions[J].Electrophoresis,2010,31(16):2838-2848.
[37] SHARMA N,SHARMA R,RAJPUT Y S,et al.Distinction between glycomacropeptide and β -lactoglobulin with 'stains all' dye on tricine SDS-PAGE gels[J].Food Chemistry,2021,340:127923.
[38] STRANGE E D,MALIN E L,HEKKEN D L V,et al.Chromatographic and electrophoretic methods used for analysis of milk proteins[J].Journal of Chromatography,1992,624(1/2):81-102.
[39] HEKKEN D L V,THOMPSON M P.Application of phast system to the resolution of bovine milk proteins on urea-polyacrylamide gel electrophoresis[J].Journal of Dairy Science,1992,75(5):1204-1210.
[40] VELOSO A C,TEIXEIRA N,FERREIRA I M.Separation and quantification of the major casein fractions by reverse-phase high-performance liquid chromatography and urea-polyacrylamide gel electrophoresis Detection of milk adulterations[J].Journal of Chromatography.A,2002,967(2):209-218.
[41] DING X J,YANG Y Y,ZHAO S,et al.Analysis of α-lactalbumin,β-lactoglobulin A and B in whey protein powder,colostrum,raw milk,and infant formula by CE and LC[J].Dairy Science &Technology,2011,91(2):213-225.
[42] TRIMBOLI F,MORITTU V M,CICINO C,et al.Rapid capillary electrophoresis approach for the quantification of ewe milk adulteration with cow milk[J].Journal of Chromatography.A,2017,1519:131-136.
[43] FENG P,FUERER C,MCMAHON A.Quantification of whey protein content in milk-based infant formula powders by sodium dodecyl sulfate-capillary gel electrophoresis(SDS-CGE):Multilaboratory testing study,final action 2016.15[J].Journal of AOAC International,2018,101(5):1566-1577.
[44] MASCI M,ZOANI C,NEVIGATO T,et al.Authenticity assessment of dairy products by capillary electrophoresis[J].Electrophoresis,2022,43(1/2):340-354.
[45] ANDREI S.Analytical methods used for milk proteins separation and identification(minireview)[J].Buletin USAMV-CN,2006,63:16-20.
[46] NAZZARO F,ORLANDO P,FRATIANNI F,et al.Protein analysis-on-chip systems in foodomics[J].Nutrients,2012,4(10):1475-1489.
[47] ANEMA S.The use of ‘lab-on-a-chip’ microfluidic SDS electrophoresis technology for the separation and quantification of milk proteins[J].International Dairy Journal,2009,19(4):198-204.
[48] TRAN N T,AYED I,PALLANDRE A,et al.Recent innovations in protein separation on microchips by electrophoretic methods:An update [J].Electrophoresis,2010,31(1):147-173.
[49] BONFATTI V,GRIGOLETTO L,CECCHINATO A,et al.Validation of a new reversed-phase high-performance liquid chromatography method for separation and quantification of bovine milk protein genetic variants [J].Journal of Chromatography A,2008,1195(1/2):101-106.
[50] BORDIN G,RAPOSO F C,CALLE B D L,et al.Identification and quantification of major bovine milk proteins by liquid chromatography [J].Journal of Chromatography A,2001,928(1):63-76.
[51] KONG X Y,WANG J,TANG Y J,et al.HPLC Analysis of α-lactalbumin and β-lactoglobulin in bovine milk with C4 and C18 Column[J].Journal of Northeast Agricultural University(English Edition),2012,19(3):76-82.
[52] MA L,YANG Y,CHEN J,et al.A rapid analytical method of major milk proteins by reversed-phase high-performance liquid chromatography[J].Animal Science Journal Nihon Chikusan Gakkaiho,2017,88(10):1623-1628.
[53] 天津市奶业科技创新协会.奶及奶制品中β-乳球蛋白的测定 液相色谱法:T/TDSTIA 007-2019[S].北京:全国团体标准信息平台,2019:11.Tianjin Dairy Science and Technology Innovation Association.Determination of β-lactoglobulin in milk and dairy products-liquid chromatography method:T/TDSTIA 007-2019[S].Beijing:National group standard information platform,2019:11.
[54] CARDOSO H B,WIERENGA P A,GRUPPEN H,et al.Maillard induced aggregation of individual milk proteins and interactions involved [J].Food Chemistry,2019,276:652-661.
[55] BURGESS R R.A brief practical review of size exclusion chromatography:Rules of thumb,limitations,and troubleshooting[J].Protein Expression and Purification,2018,150:81-85.
[56] GOETZ H,KUSCHEL M,WULFF T,et al.Comparison of selected analytical techniques for protein sizing,quantitation and molecular weight determination[J].Journal of Biochemical and Biophysical Methods,2004,60(3):281-293.
[57] YE X,YOSHIDA S,NG T B.Isolation of lactoperoxidase,lactoferrin,alpha-lactalbumin,betalactoglobulin B and beta-lactoglobulin A from bovine rennet whey using ion exchange chromatography[J].The International Journal of Biochemistry &Cell Biology,2000,32(11/12):1143-1150.
[58] REN Y P,HAN Z,CHU X J,et al.Simultaneous determination of bovine alpha-lactalbumin and betalactoglobulin in infant formulae by ultra-high-performance liquid chromatography-mass spectrometry[J].Analytica Chimica Acta,2010,667(1/2):96-102.
[59] VINCENT D,ELKINS A,CONDINA M R,et al.Quantitation and identification of intact major milk proteins for high-throughput LC-ESI-Q-TOF MS analyses[J].PloS One,2016,11(10):e0163471.
[60] MIRANDA G,BIANCHI L,KRUPOVA Z,et al.An improved LC-MS method to profile molecular diversity and quantify the six main bovine milk proteins,including genetic and splicing variants as well as post -translationally modified isoforms [J].Food Chemistry,2020,5:100080.
[61] ANANTHARAMKRISHNAN V,REINECCIUS G A.Method to characterize and monitor covalent interactions of flavor compounds with β-lactoglobulin using mass spectrometry and proteomics[J].Journal of A gricultural and Food Chemistry,2020,68(46):13121-13130.
[62] LUIS R D,LAVILLA M,SáNCHEZ L,et al.Development and evaluation of two ELISA formats for the detection of β-lactoglobulin in model processed and commercial foods[J].Food Control,2009,20(7):643-647.
[63] LUIS R D,PÉREZ M D,SÁNCHEZ L,et al.Development of two immunoassay formats to detect beta-lactoglobulin:influence of heat treatment on beta-lactoglobulin immunoreactivity and assay applicability in processed food[J].Journal of Food Protection,2007,70(7):1691-1697.
[64] HE S F,CHEN H B,LI X,et al.Development of sandwich ELISA for testing bovine β-lactoglobulin allergenic residues by specific polyclonal antibody against human IgE binding epitopes[J].Food Chemistry,2017,227:33-40.
[65] PYO D,YOO J.New trends in fluorescence immunochromatography[J].Journal of Immunoassay &Immunochemistry,2012,33(2):203-222.
[66] WU X L,HE W Y,JI K M,et al.A simple and fast detection method for bovine milk residues in foods:A 2-site monoclonal antibody immunochromatography assay[J].Journal of Food Science,2013,78(3):M452-457.
[67] LETTIERI M,HOSU O,ADUMITRACHIOAIE A,et al.Beta -lactoglobulin electrochemical detection based with an innovative platform based on composite polymer[J].Electroanalysis,2020,32(2):217-225.
[68] SUN X K,LI C G,ZHU Q Y,et al.A label-free photoelectrochemical immunosensor for detection of the milk allergen β-lactoglobulin based on Ag(2)S-sensitized spindle-shaped BiVO(4)/BiOBr heterojunction by an in situ growth method[J].Analytica Chimica Acta,2020,1140:122-131.
[69] LI Z M,WEN F,LI Z H,et al.Simultaneous detection of α -lactoalbumin,β -lactoglobulin and lactoferrin in milk by Visualized Microarray[J].BMC Biotechnol,2017,17(1):72.
[70] RICCIARDI C,SANTORO K,STASSI S,et al.Microcantilever resonator arrays for immunodetection of β-lactoglobulin milk allergen [J].Sensors and Actuators,2018,254:613-617.
[71] BILLAKANTI J M,FEE C J,LANE F R,et al.Simultaneous,quantitative detection of five whey proteins in multiple samples by surface plasmon resonance[J].International Dairy Journal,2010,20(2):96-105.
[72] ASHLEY J,D'AURELIO R,PIEKARSKA M,et al.Development of a β-lactoglobulin sensor based on SPR for milk allergens detection[J].Biosensors,2018,8(2):32-40.