1980 年,俄罗斯诺贝尔奖获得者Elie Metchnikoff 首次提出益生菌的概念,阐述了乳酸菌对人体的潜在益处,并提出乳酸菌长寿论[1]。在随后的几十年时间里,人们对益生菌的研究越来越深入。研究表明,益生菌对宿主健康状况存在积极的影响。保持益生菌在胃肠道的高存活率,是益生菌在宿主体内发挥有效功能的必要条件[2-3]。然而,在口服过程中,由于益生菌对胃肠道强酸和高浓度胆汁盐的环境较为敏感,经胃肠道消化后很难存活与定殖,使最终定殖在肠道中的益生菌的数量低于世界粮农组织(FAO)所建议的最低理论值[4]。此外,由于益生菌对肠壁的附着力差,定殖效率低,进一步影响了益生菌的功效[5]。鉴于此,研究开发保护益生菌的方法,对于提高益生菌在胃肠道的存活率及在肠道的定殖率具有重大的现实意义。
目前,有多种方法可以帮助益生菌在口服过程中存活和繁衍,并提高益生菌的肠道定殖效率,如挤出[6]、冷冻干燥[7]、喷雾干燥[8]和微胶囊化[9]等。这些方法虽然在一定程度上提升了益生菌在肠道中的活性,但是存在操作复杂、产率低等问题,同时可能对益生菌造成机械损伤[10]。因此,迫切需要找到一种简单有效的方法来包埋益生菌,以增强益生菌对胃肠道环境应激的抵抗能力,延长益生菌在肠道的滞留时间,提高益生菌定殖率,达到更好地发挥益生菌在体内效能的目的。
选择合适的壁材与包埋方法对益生菌的有效包埋至关重要[11]。β-葡聚糖(GN)是一种常见的益生元,广泛存在于大麦、小麦和燕麦等天然植物中[12],可被肠道菌群代谢为短链脂肪酸,表现出丰富的生理活性,如改善肠道环境,增加肠道菌群丰度和修复肠道屏障等[13]。除了优越的生物活性,GN的大孔蜂窝状结构,可以比任何其它壁材更有效地捕获微生物。由于GN 在上消化道稳定[14],可以减轻益生菌在进入肠道过程中失活的风险,提高益生菌的存活率,并将益生菌高浓度地输送到指定部位,因此现已作为益生菌包埋壁材使用[15]。朱莹莹等[16]利用青稞β-葡聚糖对植物乳杆菌进行包埋,显著地提升了植物乳杆菌的胃肠道耐受性。然而,GN 存在黏度大、溶解性差等问题[17]。羧甲基化β-葡聚糖(mGN)在不改变GN 空间结构的同时,在很大程度上解决了其难溶于水的问题,并提升了GN 的生物活性[18]。然而,mGN 无法直接黏附在单个益生菌的表面对其进行保护。寻找到能够连接内层益生菌与壁材mGN 的 “桥梁”,是实现mGN 对单个益生菌包埋的关键。金属-酚醛网络是由酚类配体(如单宁酸)和金属离子(如Fe3+)组成的超分子复合物,可通过一步法简便地组装成配位络合物,并黏附在多种材料表面[19]。酚类物质具有较多羟基和较高的黏附能力,可通过氢键作用将mGN 吸附到金属-酚醛网络结构的表面,达到mGN 对益生菌包埋的目的。
乳酸乳球菌(Lactococcus lactis,LL)是乳酸菌属中的一种重要模式菌,同样也是食品级微生物(Generally regards as safe,GRAS),被广泛应用于食品工业[20]。LL 具有促进消化,维持肠胃菌群平衡,提高宿主免疫力和加固肠道黏膜等作用[21]。然而,关于乳酸乳球菌包埋的研究较少,而包埋单个乳酸乳球菌的研究更鲜见报道。基于此,本研究以mGN 作为壁材,通过金属-酚醛网络的桥联作用,将mGN 黏附在LL 表面,旨在探究其对所包埋的LL 胃肠道耐受性及肠道滞留能力的影响。
1 材料与方法
1.1 原料、菌种、试剂与实验动物
乳酸乳球菌由南昌大学陈廷涛教授团队提供。MRS 液体培养基,青岛高科技工业园海博生物技术有限公司;单宁酸(Tannic acid,TA),美国Sigma-Aldrich;六水合三氯化铁(FeCl3·6H2O),西陇科学股份有限公司;Sulfo-Cyanine5-DBCO(Cy5),上海阿拉丁生化科技股份有限公司;Phosphate buffer saline(PBS)缓冲片,武汉赛维尔生物科技有限公司;β-葡聚糖,爱尔兰Megazyme 有限公司。本研究中使用的所有其它试剂均为分析纯级。
10 只SPF 级C56BL/6J 雄鼠,体质量(20±2)g,周龄6~8 周,购自斯贝福(北京)生物技术有限公司(许可证号:SCXK(京)2019-0010)。饲养条件:房间温度为(22±1)℃,12 h/12 h 的灯光/黑夜循环。小鼠在自由饮食、饮水饲养适应环境1 周后,将小鼠随机分为2 组,每组5 只,分别为LL 灌胃组与LL@Fe-TA@mGN 灌胃组。
1.2 设备与仪器
BSC-1304ⅡA2 超净工作台,苏州安泰空气技术有限公司;HPX-11-80 生化培养箱,上海跃进医疗器械有限公司;TD5A-WS 台式低速离心机,湖南湘怡实验室仪器开发有限公司;ZWYR-200D恒温培养振荡器,上海智城分析仪器制造有限公司;马尔文3000 激光粒度分析仪,英国马尔文仪器有限公司;JSM-6701F 冷场发射扫描电子显微镜(Cold field emission scanning electron microscope,SEM),日本电子株式会社;透射电子显微镜(Transmission electron microscope,TEM),日本日立公司;活体成像系统,深圳凯佳光学科技有限公司。
1.3 改性葡聚糖包埋乳酸乳球菌体系的构建
参考本课题组以往方法[22]并加以改进。LL 接种于8 mL MRS 液体培养基中,并置于37 ℃的恒温培养振荡器中培养过夜。培养结束后离心(6 000 r/min,4 min)获得菌泥,并用PBS 缓冲液洗涤菌泥2 次。随后将菌泥重悬于1 mL PBS 缓冲液中,备用。将100 μL 菌悬液(活菌数约为1×108 CFU/mL)、10 μL TA 溶液(40 mg/mL)和10 μL FeCl3 溶液(10 mg/mL)分别加入880 μL PBS 缓冲液中,涡旋60 s,使其在LL 表面形成牢固的金属-酚醛网络(Fe-TA)结构,获得LL@Fe-TA 体系。用PBS 缓冲液洗涤该体系2 次,以除去未反应的TA和Fe3+。将LL@Fe-TA 体系重悬于990 μL 的PBS缓冲液中,随后加入10 μL 不同质量浓度的mGN,使得mGN 在体系中最终质量浓度为0~0.2 mg/mL,并获得羧甲基化β-葡聚糖包埋乳酸乳球菌体系LL@Fe-TA@mGN。最后用PBS 缓冲液洗涤2 次,以除去体系中多余的mGN。
1.4 LL@Fe-TA@mGN 的粒径与电位分析
取1 mL 新鲜制备的LL@Fe-TA@mGN 稀释于9 mL 去离子水中,轻轻涡旋,使其充分分散于离心管中,使用激光粒度分析仪对LL@Fe-TA@mGN 的粒径与电位进行测定。
1.5 LL@Fe-TA@mGN 的生长曲线测定
将LL@Fe-TA@mGN 按照2%(体积分数)的接种量接种于新鲜的MRS 液体培养基中。将该体系置于37 ℃的恒温培养箱中,轻轻摇晃,以未接种的MRS 液体培养基作为空白组,未包埋的LL作为对照组。培养0,2,4,6,8,10,12 h 后,使用酶标仪测定菌株在波长600 nm 处的OD 值。
1.6 LL@Fe-TA@mGN 的微观形态分析
根据Feng等[23]的方法,使用SEM 观察LL@Fe-TA@mGN 的表面形态。将MRS 液体培养基中的菌体样本离心(6 000 r/min,4 min)并去除上清液,用PBS 缓冲液洗涤3 次。随后将沉淀用2.5%的戊二醛溶液固定3 h。紧接着被固定的样本用PBS 缓冲液洗涤3 次,再用清水洗涤2 次。用体积分数30%,50%,70%,80%,90%的乙醇溶液连续对样本进行脱水,每次脱水15~20 min。之后用100%的乙醇溶液脱水2 遍,每次脱水15~20 min。使用干燥箱在40 ℃下对样品进行干燥10~15 min,随后进行喷金并上样观察。将1 滴细菌悬浮液小心地沉积在Formvar/carbon 200 目网格上并在空气中干燥,随后进行TEM 观察。
1.7 LL@Fe-TA@mGN 的胃液与胆盐耐受性研究
将等量LL 和LL@Fe-TA@mGN(1×109 CFU/mL)分别转移到1.6 mL 新鲜的模拟胃液中(Simulated gastric fluid,SGF;pH 2.5,1 000 mL 蒸馏水,5 g 胃蛋白酶,8.5 g NaCl)和4%胆汁盐中。然后,在37 ℃,200 r/min 的摇床条件下孵育。在预定时间点(0,1,2 h)取300 μL 反应溶液,离心(6 000 r/min,4 min)得到沉淀,并用PBS 缓冲液洗涤2 次。在连续稀释后,将获得的细菌悬液涂布在固体MRS 平板上。37 ℃孵育24 h 后,进行菌落计数。
1.8 LL@Fe-TA@mGN 的体内滞留成像
将10 只C57BL/6J 小鼠(禁食12 h)分为2组,分别口服Cy5 标记的LL@Fe-TA@mGN 和LL(1×109 CFU/mL)。使用活体成像系统在小鼠口服给药后预定时间点(4 h,8 h)获取小鼠活体胃肠道图像。
1.9 数据处理与分析
采用GraphPad Prism 8 进行统计分析,数据以“平均值±标准差”表示。统计学显著性分析采用单因素方差分析(ANOVA)。*:P <0.05;**:P <0.01;***:P <0.001;****:P <0.0001。
2 结果与分析
2.1 LL@Fe-TA@mGN 的粒径与电位
粒径与电位分析是验证益生菌包埋是否成功的重要手段。当使用具有不同电势的壁材包埋益生菌时,所得益生菌包埋体系的整体带电情况会发生相应改变。Anselmo等[24]利用层层自组装的方法对芽孢乳酸菌进行包埋,未包埋的益生菌带有负电,包裹上一层壳聚糖后,体系变成正电,随后在最外层包裹上带负电的海藻酸钠,使体系的整体电势变成负电。Liu等[25]也通过粒径与电位的变化来说明益生菌的包埋情况。本研究中,通过LL@Fe-TA@mGN 的粒径与电位分析,确定了LL的包埋情况与最外层mGN 的最佳使用剂量。如图1 和图2 所示,相对于未包埋的LL,LL@Fe-TA@mGN 的粒径与电位都有显著变化,说明mGN被金属-酚醛网络结构(Fe-TA)吸附在LL 的表面。当包埋LL 的mGN 质量浓度为0.12 mg/mL时,LL@Fe-TA@mGN 的粒径和zeta-电位都达到峰值,表明在该质量浓度下,单个LL 被mGN 完全包裹。
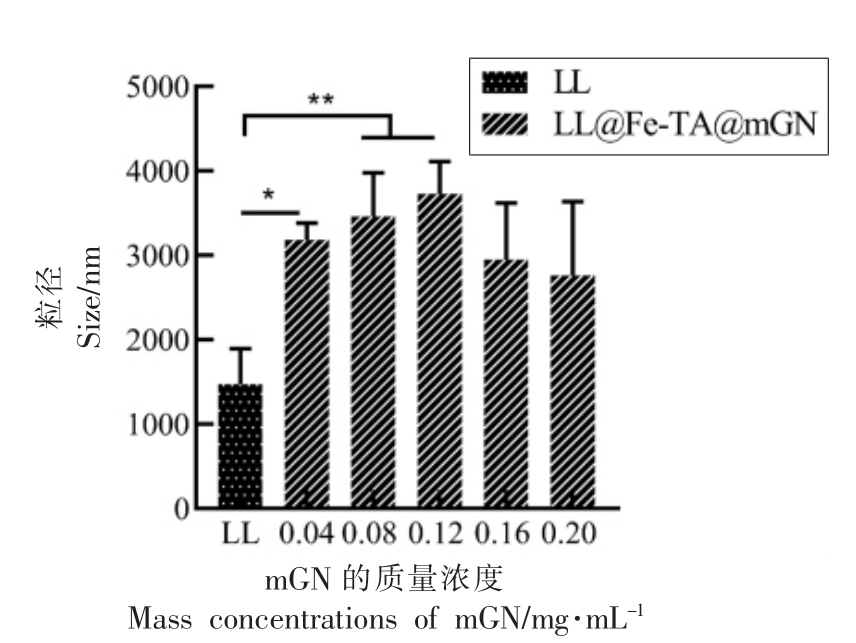
图1 包埋过程中使用的mGN 质量浓度(0~0.2 mg/mL)对LL@Fe-TA@mGN 粒径的影响
Fig.1 Size distribution characterization of LL@Fe-TA@mGN encapsulated with different mass concentrations of mGN(from 0 to 0.2 mg/mL)during the encapsulation process
注:*.P <0.05;**.P <0.01。
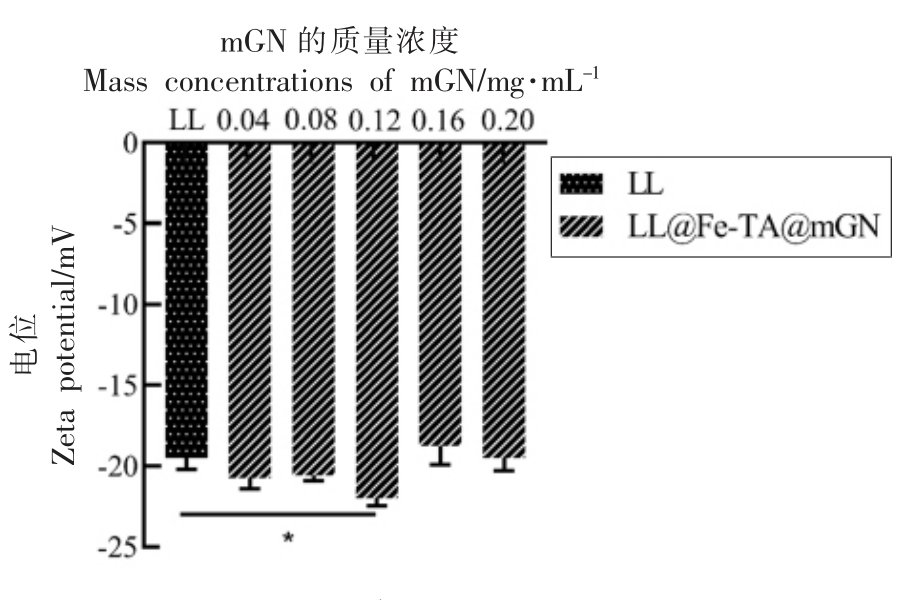
图2 包埋过程中mGN 质量浓度(0~0.2 mg/mL)对LL@Fe-TA@mGN zeta-电位的影响
Fig.2 Zeta potential characterization of LL@Fe-TA@mGN encapsulated with different mass concentrations of mGN(from 0 to 0.2 mg/mL)during the encapsulation process
注:*.P <0.05。
2.2 LL@Fe-TA@mGN 的生长曲线测定
为了排除mGN 包埋抑制LL 生长的可能性,对比了12 h 内LL@Fe-TA@mGN 与未包埋的LL的生长曲线。由图3 可知,mGN 包埋未影响LL 的生长,为后续研究奠定了基础。
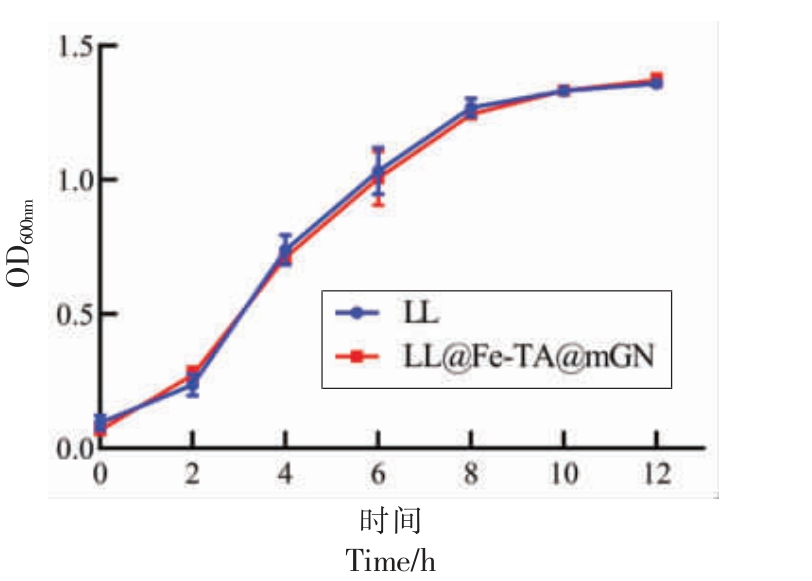
图3 LL 与LL@Fe-TA@mGN 的生长曲线
Fig.3 Growth curves of LL and LL@Fe-TA@mGN
2.3 LL@Fe-TA@mGN 的微观形态分析
通过SEM 与TEM 表征可以观察到包埋前、后的LL 形态。从图4 可以发现,未包埋的LL 表面光滑,而包埋后的LL 结构完整,表面粗糙,且没有LL 暴露在外面。这一结果说明通过金属-酚醛网络结构的桥联作用,可将mGN 作为壁材有效地包埋单个LL。TEM 分析结果也证明了mGN 被黏附在单个LL 的表面。此外,SEM 与TEM 分析结果表明,包埋后的LL 粒径会发生显著变化。

图4 LL(a)与LL@Fe-TA@mGN(b)的SEM图(×30k)
Fig.4 SEM images of LL(a)and LL@Fe-TA@mGN(b)(×30k)
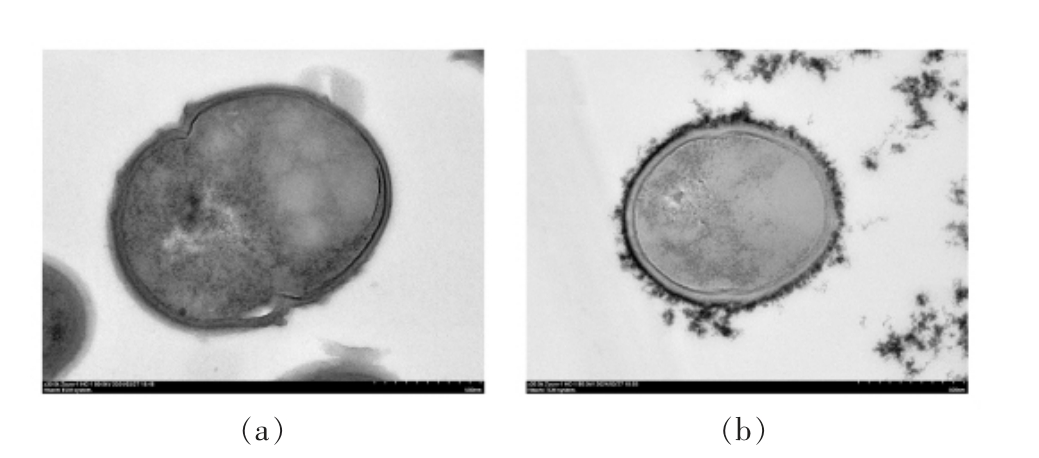
图5 LL(a)与LL@Fe-TA@mGN(b)的TEM图(×30k)
Fig.5 TEM images of LL(a)and LL@Fe-TA@mGN(b)(×30k)
2.4 LL@Fe-TA@mGN 的胃液与胆盐耐受性研究
益生菌对胃液是非常敏感的。在通过胃部环境的时候,益生菌常因受到强酸(pH≤2.5)的影响而失活,因此增强益生菌在胃部环境的抗性是其发挥生物活性的前提[26]。如图6 所示,未包埋的LL在模拟胃液(SGF)的环境下孵育0.5 h,存活率降至39.35%;孵育1 h 后,存活率为13.00%;孵育2 h 后,LL 基本全部死亡,存活率仅有0.71%。而包埋过的LL 存活率始终高于未包埋的LL,且存在显著性差异。LL@Fe-TA@mGN 在SGF 环境下孵育0.5 h 的存活率高达68.60%,孵育1 h 后存活率变为31.79%。即使在孵育2 h 后,益生菌的存活率仍然有10.39%,是未包埋益生菌存活率的14.63倍。该结果表明,经mGN 包埋后LL 抵抗胃液的能力显著提升。
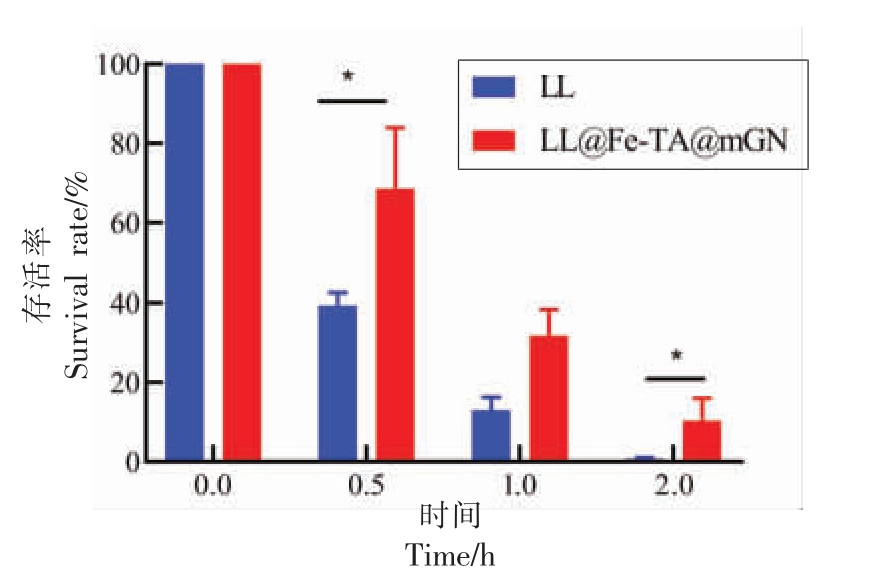
图6 LL 与LL@Fe-TA@mGN 暴露在模拟胃液(pH 2.5)中的存活率
Fig.6 Survival rate of LL and LL@Fe-TA@mGN after exposure to SGF(pH 2.5)
注:*.P <0.05。
人们在摄入食物时,十二指肠会分泌荷尔蒙,从而刺激胆囊收缩。胆汁在胆囊收缩的影响下通过胆管进入肠道[27]。胆盐承担了胆汁的主要消化功能,由于胆盐在人体中易形成胶束,且肠道-肝脏循环系统的存在,使得每个胆盐分子在消化阶段能够被重复利用多次,这极大地影响了益生菌的活性。因此为了能够以一定的数量定殖于肠道并发挥生物活性,益生菌还需要抵抗胆盐的降解[28]。由图7 可知,包埋后的LL 抵抗胆盐的能力显著提升,即使在胆盐中孵育2 h,活菌数量仍然有42.66%,相对于未包埋的LL 的存活率(22.01%)具有显著性差异。以上结果表明,mGN 赋予了LL较好的抗胆盐性能。
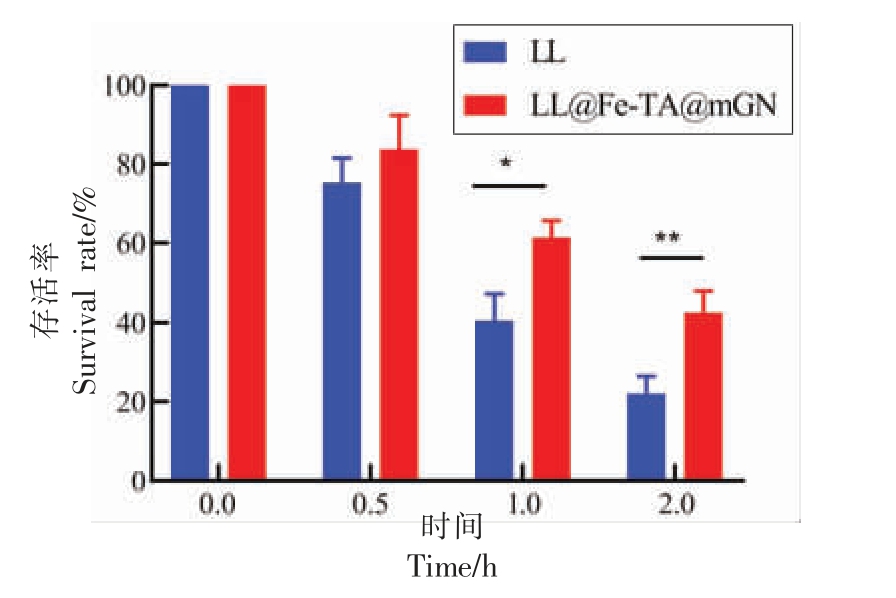
图7 LL 与LL@Fe-TA@mGN 暴露在胆盐中的存活率
Fig.7 Survival rate of LL and LL@Fe-TA@mGN after exposure to bile salts
注:*.P <0.05;**.P <0.01。
2.5 LL@Fe-TA@mGN 的体内滞留成像
肠道蠕动加速了益生菌的排泄。减缓益生菌被排出体外的速度有利于益生菌在肠道的定殖。mGN 作为一种益生元,可被肠道中的肠道菌群代谢形成短链脂肪酸。随着最外层mGN 的破坏,Fe-TA 结构随之暴露。鉴于金属-酚醛网络结构较强的黏附能力,进一步探究了LL@Fe-TA@mGN 在体内的滞留能力。使用Cy5 对LL 进行标记[22],并构建Cy5 标记的LL@Fe-TA@mGN。用标记后的LL 或者LL@Fe-TA@mGN 灌胃小鼠,分别在4 h和8 h 后进行活体成像,结果如图8 所示。由图8可知,给药4 h 后,被灌胃LL 组的小鼠的体内荧光强度显著弱于灌胃LL@Fe-TA@mGN 的小鼠,说明LL 被大量的代谢排出体外。即使在灌胃8 h后,LL@Fe-TA@mGN 在小鼠体内仍然保持较高的益生菌数量,而LL 基本被排出体外。以上结果表明,LL@Fe-TA@mGN 具有更好的体内滞留能力。
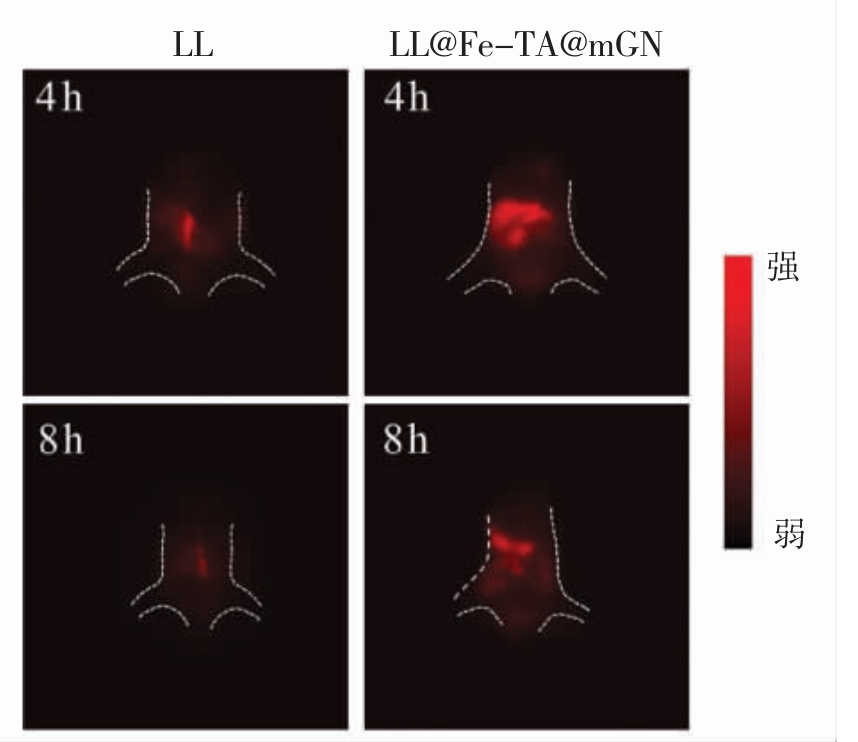
图8 小鼠灌胃Cy-5 标记的LL 或者LL@Fe-TA@mGN 后的体内成像
Fig.8 In vivo fluorescence imaging of mice gavaged with Cy-5 labeled LL@Fe-TA@mGN or LL
3 结论
本文以羧甲基化β-葡聚糖为壁材,通过金属-酚醛网络结构的桥联作用,可实现对单个乳酸乳球菌的完整包埋。这种包埋方法简单、快速,在不改变乳酸乳球菌自身结构的情况下,可显著提升乳酸乳球菌的抗胃液与抗胆盐能力,并延长其在体内的滞留,从而帮助乳酸乳球菌在体内更好地繁殖。研究结果为乳酸乳球菌包埋体系的构建提供了新思路,并为提高乳酸乳球菌在胃肠道的活性提供了理论依据。
[1] CREMON C,BARBARO M R,VENTURA M,et al.Pre-and probiotic overview[J].Current Opinion in Pharmacology,2018,43:87-92.
[2] LIN S,MUKHERJEE S,LI J,et al.Mucosal immunity-mediated modulation of the gut microbiome by oral delivery of probiotics into Peyer's patches[J].Science Advances,2021,7:eabf0677.
[3] 贺鼎元,何东升,涂家生.工程化益生菌活菌制剂在疾病治疗中的研究进展[J].药学研究,2024,43(2):159-163.HE D Y,HE D S,TU J S.Research progress of engineered probiotic live bacteria preparation in disease treatment [J].Journal of Pharmaceutical Research,2024,43(2):159-163.
[4] DE ARAUJO ETCHEPARE M,NUNES G L,NICOLOSO B R,et al.Improvement of the viability of encapsulated probiotics using whey proteins [J].Lwt -Food Science and Technology,2020,117:108601.
[5] 杨心远.具有功能性涂层的益生菌递送系统增强肠道定植治疗肠炎研究[D].郑州:郑州大学,2022.YANG X Y.Study on the probiotic delivery system with the functional coating to enhance intestinal colonization for the treatment of enteritis[D].Zhengzhou:Zhengzhou University,2022.
[6] 蔡文静,孙嘉蕾,韩雪.益生菌微胶囊的研究进展[J].食品科技,2022,47(2):36-42.CAI W J,SUN J L,HAN X.Research progress of probiotics microcapsule[J].Food Science and Technology,2022,47(2):36-42.
[7] 秦新生.益生菌稳态化胶体输送体系的构建及其性能研究[D].广州:华南理工大学,2023.QIN X S.Study on the construction of emulsionbased food colloid for protecting probiotics in coloncontrolled release[D].Guangzhou:South China University of Technology,2023.
[8] 胡丽萍,李辉玉,林嘉欣,等.基于喷雾干燥法益生菌-槲皮素的共微囊化及其耐消化性研究[J/OL].食品与发酵工业:1-10.(2023-11-13)[2024-04-13].https://doi.org/10.13995/j.cnki.11-1802/ts.036942.HU L P,LI H Y,LIN J X,et al.Co-microencapsulation of probiotic-quercetin based on spraydrying and its digestibility resistance study [J/OL].Food and Fermentation Industries:1-10.(2023-11-13)[2024-04-13].https://doi.org/10.13995/j.cnki.11-1802/ts.036942.
[9] 向宁.氧化高直链淀粉-海藻酸钠复合益生菌微胶囊的构建及性能评价[D].广州:南方医科大学,2024.XIANG N.Construction and performance evaluation of oxidized high amylose-sodium alginate composite probiotics microcapsules [D].Guangzhou:Southern Medical University,2024.
[10] 陈臣,张晓丛,袁海彬,等.益生菌包埋前沿技术及其研究进展[J].中国食品学报,2023,23(1):384-396.CHENG C,ZHANG X C,YUAN H B,et al.Research progress on the advanced technology of embedding for probiotics[J].Journal of Chinese Institute of Food Science and Technology,2023,23(1):384-396.
[11] 李然,张瑛,李一雪,等.益生菌与益生元共包埋微胶囊技术研究进展[J].生物加工过程,2024,22(2):204-212.LI R,ZHANG Y,LI Y X,et al.Research progress of co-embdeding microcapsules of probiotics and prebiotics[J].Chinese Journal of Bioprocess Engineering,2024,22(2):204-212.
[12] 高若涵,马楠,王霞,等.谷物β-葡聚糖提取、分离纯化、生物活性及应用研究进展[J/OL].食品工业科技:1-12.(2024-03-21)[2024-04-13].https://doi.org/10.13386/j.issn1002-0306.2023100127.GAO R H,MA N,WANG X,et al.Cereal β-glucan extraction,isolation and purification,bioactivity and application studies in review[J/OL].Science and Technology of Food Industry:1-12.(2024-03-21)[2024 -04 -13].https://doi.org/10.13386/j.issn1002 -0306.2023100127.
[13] YANG W J,HUANG G L.Extraction methods and activities of natural glucans[J].Trends in Food Science &Technology,2021,112:50-57.
[14] LIN H W,HAN R Z,WU W.Glucans and applications in drug delivery[J].Carbohydrate Polymers,2024,332:121904.
[15] GANI A,SHAH A,AHMAD M,et al.β-D-glucan as an enteric delivery vehicle for probiotics[J].International Journal of Biological Macromolecules,2018,106:864-869.
[16] 朱莹莹,尹丽莎,杜艳,等.青稞非淀粉多糖-植物乳杆菌共微胶囊化对益生菌存活率的影响[J].中国食品学报,2023,23(11):266-275.ZHU Y Y,YING L S,DU Y,et al.Effect of comicroencapsulation of non -starch polysaccharides from highland barley and Lactobacillus plantarum on the survival of probiotics[J].Journal of Chinese Institute of Food Science and Technology,2023,23(11):266-275.
[17] WANG Y X,YIN J Y,HUANG X J,et al.Structural characteristics and rheological properties of high viscous glucan from fruit body of Dictyophora rubrovolvata[J].Food Hydrocolloids,2020,101:105514.
[18] GUO H,FENG K L,ZHOU J,et al.Carboxymethylation of Qingke β -glucans and their physicochemical properties and biological activities[J].International Journal of Biological Macromolecules,2020,147:200-208.
[19] LIN Z X,ZHOU J J,QU Y J,et al.Luminescent metal-Phenolic networks for multicolor particle labeling[J].Angewandte Chemie International Edition,2021,60(47):24968-24975.
[20] 王帅,邓木兰,梁志成,等.基于pyrF 的乳酸乳球菌食品级表达载体的构建[J/OL].食品工业科技:1-11.(2023-10-13)[2024-04-13].https://doi.org/10.13386/j.issn1002-0306.2023060149.WANG S,DENG M L,LIANG Z C,et al.Construction of a food-grade expression vector based on pyrF gene in Lactococcus lactis[J/OL].Science and Technology of Food Industry:1-11.(2023-10-13)[2024 -04 -13].https://doi.org/10.13386/j.issn1002 -0306.2023060149.
[21] 倪珊珊,黄丽英.乳酸链球菌素和乳酸乳球菌在食品工业 中的应 用[J].食品工 业,2015,36(11):244-247.NI S S,HUANG L Y.Application of Nisin and Lactococcus lactis in the food industry[J].The Food Industry,2015,36(11):244-247.
[22] XIE A Q,JI H H,LIU Z Y,et al.Modified prebiotic-Based 'Shield' armed probiotics with enhanced resistance of gastrointestinal stresses and prolonged intestinal retention for synergistic alleviation of colitis[J].ACS Nano,2023,17(15):14775-14791.
[23] FENG P P,CAO Z P,WANG X Y,et al.On-Demand bacterial reactivation by restraining within a triggerable nanocoating[J].Advanced Materials,2020,32(34):2002406.
[24] ANSELMO A C,MCHUGH K J,WEBSTER J,et al.Layer-by-layer encapsulation of probiotics for delivery to the microbiome[J].Advanced Materials,2016,28(43):9486-9490.
[25] LIU J,LI W,WANG Y X,et al.Biomaterials coating for on-demand bacteria delivery:Selective release,adhesion,and detachment[J].Nano Today,2021,41:101291.
[26] SAMEDI L,CHARLES A L.Viability of 4 probiotic bacteria microencapsulated with arrowroot starch in the simulated gastrointestinal tract(GIT)and yoghurt[J].Foods,2019,8(5):175.
[27] STURDEVANT R A L,GOETZ H.Cholecystokinin both stimulates and inhibits human food intake[J].Nature,1976,261:713-715.
[28] PATEL A K,SINGHANIA R R,PANDEY A,et al.Probiotic bile salt hydrolase:Current developments and perspectives[J].Applied Biochemistry and Biotechnology,2009,162(1):166-180.