为应对未来全球气候变化对农作物生产的挑战,以及全球人口持续增加带来的粮食营养安全问题,联合国粮食及农业组织(FAO)在2018 年提出,将39 种气候适应性强、营养价值全面、在亚洲国家广泛种植的农作物划为 “Future Smart Food(FST)”[1-2]。这39 种FST 涵盖谷物、豆类、果蔬、根茎类及坚果类等各类主要农作物,包括甜荞(Fagopyrum esculentum Moench)和苦荞(F.tataricum(L.)Gaertn)2 种常见荞麦品种[1-2]。
荞麦是一种短季蓼科作物,具有生长期短(成熟期2~3 月)、抗旱耐瘠、适应性广等特点,是我国内蒙古、吉林、黑龙江、山西等地的传统粮食作物,种植规模逐年增加[3]。荞麦面粉营养丰富,蛋白质、膳食纤维、矿物质含量要显著高于小麦面粉[4],并且荞麦蛋白是一种无麸质蛋白(Gluten-free),因此荞麦面粉被广泛用于生产无麸质烘焙食品和面制品,备受消费者欢迎[5-6]。荞麦籽粒经过脱壳后得到荞麦米,后者经磨粉得到荞麦面粉[7]。因此,完整的脱壳是保证荞麦米和面粉质量的关键因素,然而脱壳后产生了大量加工副产物——荞麦壳,其产量高达荞麦总产量的1/3[8-9]。国内外研究均证实荞麦壳富含膳食纤维、活性多糖、多酚、黄酮等生物活性成分,且淀粉、脂肪、蛋白等产能营养素含量极低[8,10]。然而荞麦壳粉口感粗糙、无味,且不可溶膳食纤维含量超过了90%而难以消化,这严重限制了其在食品生产中的应用[11]。目前,荞麦壳主要用于制作睡具填充料,造成严重的可食用资源浪费[12]。
近年来,乳酸菌发酵被广泛用于农产品及其副产物加工,能够有效提升其风味、感官及营养品质[13-16]。Mousavi等[17]利用乳酸菌和双歧杆菌发酵荞麦粉制备益生菌饮料,产品经过15 d 冷藏后,益生菌活细胞数仍维持在较高水平,结果表明荞麦粉可用于开发无麸质的益生菌饮料。这与Matejcˇeková等[18]的研究结果一致,其发现发酵荞麦饮料的风味和感官得到提升。在营养组分上,乳酸菌发酵荞麦可显著增加酚酸和黄酮等活性物质的含量,提高抗氧化活性,结果说明发酵能有效改善荞麦的营养品质[16,19-20]。在乳酸菌发酵谷物副产物方面,现有研究多关注大米米糠和小麦麸皮等,而关于发酵荞麦壳的营养特性研究仍较为匮乏。
本研究利用乳酸菌发酵苦荞麦壳,通过连续取样,分析发酵过程中的pH 值、总酚含量及抗氧化活性的变化;通过分析酚类物质含量和存在形式,评价发酵对荞麦壳结合态酚的影响;通过体外模拟胃肠消化,评价发酵对荞麦壳多酚生物可及性的影响;通过接种人粪便菌群模拟结肠酵解,分析酵解过程中pH 值和短链脂肪酸(Short-chain fatty acids,SCFA)浓度,评价发酵荞麦壳的肠道酵解特性,研究结果将为乳酸菌发酵荞麦副产物及荞麦壳精深加工提供理论参考。
1 材料和方法
1.1 材料及试剂
植物乳杆菌HH-LP56,镇江天益生物科技有限公司;荞麦壳,中粮面业(濮阳)有限公司;没食子酸,上海阿拉丁生化科技股份有限公司;DPPH,上海麦克林生化科技股份有限公司;标准品包括绿原酸、2,4-二羟基苯甲酸、咖啡酸、丁香酸、香豆酸、香草酸、阿魏酸、3,4-二甲氧基苯甲酸和水杨酸,上海麦克林生化科技股份有限公司;没食子酸、原儿茶酸、对羟基苯甲酸,西格玛奥德里奇(上海)贸易有限公司(Sigma-Aldrich);其它试剂均为分析纯级。
1.2 仪器及设备
PHSJ-6L 型pH 计,上海仪电科学仪器股份有限公司;Agilent HPLC 1290,美国安捷伦科技有限公司;岛津2010 Plus 气相色谱仪,日本岛津公司;全波长酶标仪,上海闪谱生物科技有限公司。
1.3 乳酸菌发酵处理荞麦壳
1.3.1 样品预处理 将荞麦壳粉碎并过30 目筛,得到原荞麦壳样品(标记为Raw)。
1.3.2 乳酸菌发酵工艺 称取Raw 样品,加入葡萄糖、果糖和蒸馏水后灭菌,按4‰接种植物乳杆菌HH-LP56 于37 ℃恒温培养,分别培养至3,6,9,12,24,36,48,72 h 取样,灭菌并冻干,得到不同发酵程度的荞麦壳样品,依次标记为LP-3h,LP-6h,LP-9h,LP-12h,LP-24h,LP-36h,LP-48h 和LP-72h。
1.3.3 发酵液pH 值测定 在发酵时间0,3,6,9,12,24,48,72 h 时,采用PHSJ-6L 型pH 计测定发酵体系pH 值。
1.4 总酚含量
以没食子酸为标准对照品,采用福林酚法测定各不同发酵程度的荞麦壳游离多酚含量[21]。
1.5 抗氧化活性
1.5.1 DPPH 清除能力测试 参考文献[22]的方法,取样品甲醇提取液,加入150 μL 0.3 mmol/L DPPH-甲醇溶液中,充分混匀避光反应30 min,于波长517 nm 处测定吸光度。根据公式(1)计算:
式中,A0、A1 和A2——多酚提取液分别与蒸馏水、甲醇和DPPH-甲醇溶液的混合反应体系的吸光度值。
1.5.2 ABTS 清除能力测试 参考文献[21]的方法,取ABTS-甲醇溶液与过硫酸钾溶液混合得到ABTS 工作液。取样品甲醇提取液,加入ABTS 工作液充分混合,避光反应60 min,于波长734 nm处测定吸光度。根据下列公式计算:
式中,A0——甲醇与ABTS 工作液反应体系的吸光度值;A1——样品反应体系的吸光度值。
1.6 不同结合方式酚提取与测定
1.6.1 不同结合方式酚的提取 参考Fan等[23]的方法,简述如下:1)游离态酚的提取:称取200 mg荞麦壳样品,加入3 mL 0.2 mol/L HCl 酸化后,加入5 mL 乙酸乙酯(EtAC)提取,重复3 次,合并提取液进行旋转蒸发(<40 ℃)浓缩去除EtAC,加入500 μL 甲醇进行超声复溶,得到游离态酚,待测。2)碱提结合态酚的提取:将上一步提取后的剩余物,加入4 mol/L NaOH 调整pH 至中性后冻干,加入3 mL 1 mol/L NaOH 后,充氮气保护,搅拌室温提取4 h,调整pH 值至2,再经EtAC 提取,重复3 次,同上述操作,得到碱提结合态酚,待测。3)酸提结合态酚的提取:将上一步提取后的剩余物,加入4 mol/L NaOH 调整pH 至中性后冻干,加入3 mL 2 mol/L HCl,充分涡旋和振荡,沸水浴30 min,冷却至室温后加入EtAC 提取,重复3 次,同上述操作,得到酸提结合态酚,待测。
1.6.2 液相色谱法测定酚类组成 采用HPLC 对酚类物质进行测定,色谱柱为安捷伦Eclipse XDB-C18柱(4.6 mm×150 mm,3.5 μm)搭配DAD检测器,检测波长为215 nm 和280 nm,流动相为乙腈和0.1%乙酸溶液,采用梯度洗脱方法,流速0.5 mL/min[24]。
1.7 体外模拟胃肠道消化过程
参考INFOGEST 2.0 消化方法[25],称取5 g 荞麦壳样品,加入含淀粉酶的SSF 消化液(模拟唾液),振荡孵育2 min;再加入SGF 消化液(模拟胃液),孵育2 h;最后加入SIF 消化液(模拟小肠液),孵育2 h,此时置入截留分子质量为2 ku 透析袋模拟小肠渗透吸收功能。消化结束,分别将消化靡冻干和透析袋内、外的消化靡冻干,加入0.5 mL 的LC-MS 甲醇,待测。
将消化上清液转移至截留分子质量为2 ku的半透膜透析袋,透析袋放入含有150 倍体积蒸馏水的烧杯中模拟肠吸收,重复3次(每次2 h),检测透析液中多酚含量用于评价其肠道消化率。透析结束后,将透析袋内剩余液体与消化沉淀混合后冻干,用于模拟结肠酵解。
1.8 接种人粪便模拟结肠厌氧酵解过程
招募健康成年人5名(二男三女,近3 个月无抗生素使用史),收集新鲜粪便,加入无菌、无氧的PBS 制备粪便悬浊液(质量分数20%),在厌氧环境下接种于荞麦壳作为唯一碳源的M2GSC 培养基(质量比1∶10),在37 ℃恒温培养箱酵解72 h。在0,3,6,12,24,48 h 取样,测定pH 值、产气量和SCFA 含量[23]。
1.8.1 产气量及pH 测定 发酵液pH 值,采用Horiba 电化学测试笔进行测定。
1.8.2 短链脂肪酸含量测定 参考Fan等[23]前期试验方法,取发酵液,离心取上清,加入磷酸溶液和内标2-乙基丁酸,使用岛津2010 Plus 气相色谱仪进行测定,色谱柱为DB-FFAP(30 m×0.25 μm×250 μm),使用GC Solution 工作站完成数据采集。
1.9 数据处理
结果以“平均值±标准差”表示,使用Graphpad prism 9.4 软件对数据进行显著性分析,采用Oneway ANOVA 或Two-way ANOVA 与Raw组进行多重比较分析,以(*)P <0.05或(**)P <0.01 表示。
2 结果与分析
2.1 乳酸菌发酵过程中pH 值、总酚含量及抗氧化活性的变化
植物乳杆菌HH-LP56 发酵荞麦壳过程中pH值变化如图1a 所示,观察到pH 值在发酵前3 h开始快速下降;在3~6 h 的下降速度最快,pH 值降低到5 以下;在6~12 h,pH 值继续缓慢下降至4 左右;在12~72 h,pH 值稳定在4 左右,这也是大多数乳酸菌发酵的最适pH值[26]。在多酚含量上,与Raw 相比,发酵6,9,12 h 的荞麦壳总酚含量显著增加(P <0.01),且含量较为接近,在5.61~5.83 mg/g 之间。此外,发酵24,36,48,72 h 的荞麦壳总酚含量进一步增加,含量在6.75~7.32 mg/g 之间,其中发酵48 h 荞麦壳总酚含量最高,然而在发酵72 h 总酚含量有所降低。研究广泛报道乳酸菌发酵过程中总酚含量增加与抗氧化活性呈正相关[14,27-28]。图1c 和1d 表明不同发酵时间的荞麦壳的抗氧化能力较为相似,这可能是因为发酵后各荞麦壳已经含有较高含量的总酚所导致。此外,Raw 的荞麦壳的ABTS 自由基清除能力要略弱于其它样品。

图1 发酵过程中发酵液pH值(a)、发酵荞麦壳多酚含量(b)的动态变化及其对DPPH(c)和ABTS(d)自由基清除能力测试(n=3)
Fig.1 Changes of pH value during the fermentation of buckwheat hulls(a),the content of polyphenols in fermented buckwheat hulls(b)and their scavenging capability on DPPH(c)and ABTS(d)radicals(n=3)
注:*.P <0.05;**.P <0.01,下同。
以上结果说明乳酸菌发酵显著增加荞麦壳中总酚含量。基于发酵过程中总酚含量和抗氧化活性变化,本研究选择具有代表性的发酵6 h(LP-6h),24 h(LP-24h)和48 h(LP-48h)的样品进行后续研究。
2.2 乳酸菌发酵荞麦壳中酚类物质组成和分布的变化
进一步探究发酵荞麦壳中酚类物质组成和分布的变化,及其上消化道的生物可及性,采用标准化的Infogest 2.0 法模拟胃肠道消化过程。基于笔者前期研究结果[29],本研究重点关注荞麦壳样品含量较高的6 种酚酸单体,分别是没食子酸、原儿茶酸、香豆酸、香草酸、水杨酸和对羟基苯甲酸(图2)。Raw 样品中含量最高的是没食子酸(131.79 mg/kg),其次是原儿茶酸(97.66 mg/kg),香豆酸(46.59 mg/kg),香草酸(37.17 mg/kg),水杨酸(31.78 mg/kg)和对羟基苯甲酸(mg/kg)。前期研究发现,荞麦壳中原儿茶酸含量最高,可达390.71 mg/kg,其次为没食子酸(108.61 mg/kg)、对羟基苯甲酸(33.91 mg/kg)和香草酸(27.54 mg/kg)等,这可能是受荞麦壳产地和品种等导致的差异[29]。这6种酚酸单体在荞麦壳中,以游离态、碱提结合态和酸提结合态形式存在,除水杨酸外,其余5 种酚酸均以结合态为主要存在形式,经乳酸菌HH-LP56发酵处理后,没食子酸和原儿茶酸含量呈显著变化。与Raw 组相比,各不同发酵程度的荞麦壳样品的没食子酸和原儿茶酸含量均显著增加,特别是游离态没食子酸含量由24.45 mg/kg(Raw)增加数倍至145.87 mg/kg(LP-6h),142.88 mg/kg(LP-24h)和143.48 mg/kg(LP-48h);游离态原儿茶酸含量由31.05 mg/kg(Raw)增加至113.61 mg/kg(LP-6h),103.30 mg/kg(LP-24h)和108.99 mg/kg(LP-48h)。此外,3 种发酵均显著促进了游离态香草酸的释放(P <0.01),LP-24h 和LP-48h 显著促进了对羟基苯甲酸含量的增加(P <0.01 和P <0.05),这可能是由于发酵降低了不可溶NSP 含量,增加可溶性NSP 含量,从而促进结合态酚释放,促进游离态酚类含量增加[23]。发酵处理对香豆酸和水杨酸的游离态释放影响较小。综上,这表明乳酸菌HH-LP56 发酵可特异性促进没食子酸和原儿茶酸的游离态释放,导致总含量的显著增加。

图2 未发酵与发酵荞麦壳中主要酚类化合物的含量和存在形式(n=3)
Fig.2 The contents and forms of main phenolics in raw and fermented buckwheat hulls(n=3)
经Infogest 2.0 模拟消化后,Raw 样品中含量最高的是没食子酸(21.95 mg/kg),原儿茶酸(10.31 mg/kg),水杨酸(8.46 mg/kg),对羟基苯甲酸(7.46 mg/kg)和香草酸(6.98 mg/kg)(图3)。发酵处理显著促进了原儿茶酸在上消化道的生物暴露情况,LP-24h 显著促进了没食子酸在上消化道的暴露情况,对香草酸、水杨酸和对羟基苯甲酸均无显著性影响。
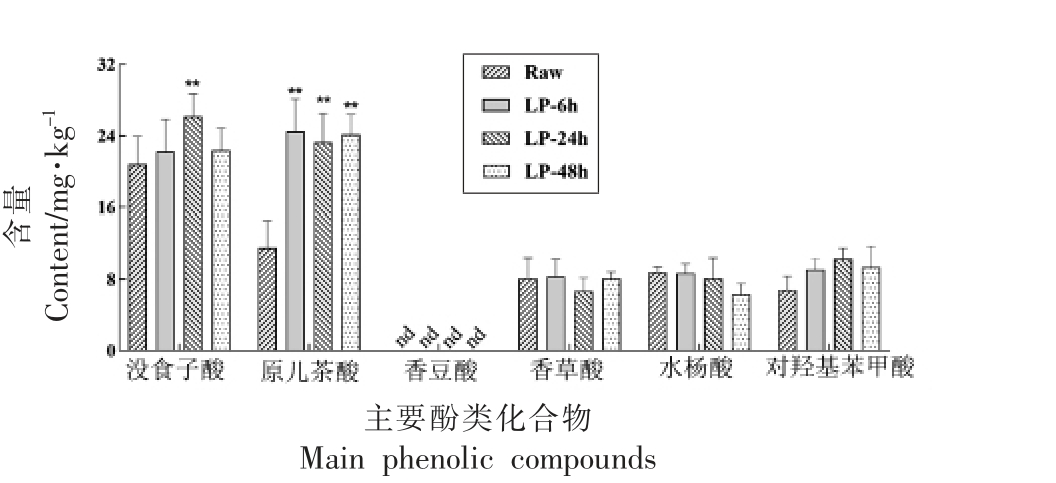
图3 未发酵与发酵荞麦壳中主要酚类化合物的肠道生物可及性(n=3)
Fig.3 The in vitro bio-accessibility of main phenolics in raw and fermented buckwheat hulls(n=3)
2.3 乳酸菌发酵对荞麦壳肠道酵解过程中pH 值和产气量的影响
将发酵荞麦壳经体外胃肠消化模拟后的残渣用于接种5 位志愿者粪便菌群,体外模拟结肠酵解,测定pH 值和产气量(图4)。荞麦壳中膳食纤维(Dietary fiber,DF)含量高达90%以上,而可溶性DF 的含量仅为0.5%左右[11]。研究报道乳酸菌发酵可有效增加谷物麸皮中可溶性DF 的含量,且可溶性DF 的肠道酵解速度和酵解程度要远大于不可溶DF[23,30]。粪便菌群酵解膳食纤维产生大量易挥发有机酸,降低pH 值,增加挥发性气体产量[30]。总体来看(图4a),pH 值在结肠酵解前期(0~12 h)持续降低,然而在酵解后期(12~48 h)持续上升。并且,在同一时间点,未发酵和发酵荞麦壳的pH 值和产气量均较为接近。在部分志愿者菌群中,发酵荞麦壳中pH 值下降速度更快,气体产量更高。在发酵3 h 后,Donor 1、2 及3 中发酵荞麦壳pH 值均明显低于Raw组(图4c、4e 和4g)。并且在Donor 1 中,发酵荞麦壳在酵解6 h 和12 h后的pH 值仍明显低于Raw 组。在产气量上,Donor 1 和4 在酵解24 h 后,LP-48 h 组的气体产量要明显高于Raw 组。结果说明发酵荞麦壳在肠道酵解过程中,pH 值和产气量的变化与志愿者粪便菌群来源有关,即受到肠道菌群个体差异的影响[31]。


图4 未发酵和发酵荞麦壳在结肠酵解过程中的pH 值和产气量变化
Fig.4 Change on the pH value and gas production during in vitro colonic fermentation of raw and fermented buckwheat hulls
注:图a~b,n=5;图c~l,n=3。
2.4 乳酸菌发酵对荞麦壳在肠道酵解过程中主要短链脂肪酸含量的影响
研究广泛报道,发酵加工副产物工业大麻壳等,可显著促进可溶性NSP 含量增加,增强肠道酵解特性[23]。膳食纤维经结肠酵解后产生有机酸主要为SCFA,是肠道酵解特性的重要指标之一,其中乙酸、丙酸、丁酸三者的总量占人体总SCFA含量的90%[23,32]。总体来看(图5a、6a 和7a),随着肠道酵解时间的延长,乙酸、丙酸、丁酸的含量均略有增加,然而未发酵与发酵荞麦壳在主要短链脂肪酸含量上并无显著差异(P >0.05)。然而在部分志愿者菌群中,未发酵与发酵荞麦壳之间存在显著差异。在Donor 1 酵解24 h 和48 h 后,3 组发酵荞麦壳的乙酸(图5b)、丙酸(图6b)、丁酸(图7b)含量均显著高于Raw组(P <0.05 或P <0.01);在Donor 2 酵解48 h 后,3 组发酵荞麦壳的乙酸(图5c)和丙酸(图6c)含量显著高于Raw组(P <0.05 或P <0.01),然而对丁酸无显著增加作用;在Donor 3 酵解48 h 后,3 组发酵荞麦壳的丁酸(图5d)含量显著高于Raw组(P <0.05 或P <0.01);在Donor 4 和5 酵解过程,未观察到3 组发酵荞麦壳的一致性促进作用。在健康人和小鼠粪便中,戊酸含量要远低于3 种主要SCFA[31]。图8a 说明酵解过程中戊酸的总体变化趋势与3 种主要SCFA 一致。同时观察到戊酸含量在24 h 和48 h 快速增加,接近丙酸和丁酸的含量,这主要是因为Donor 1,3,4 中戊酸含量增加导致。
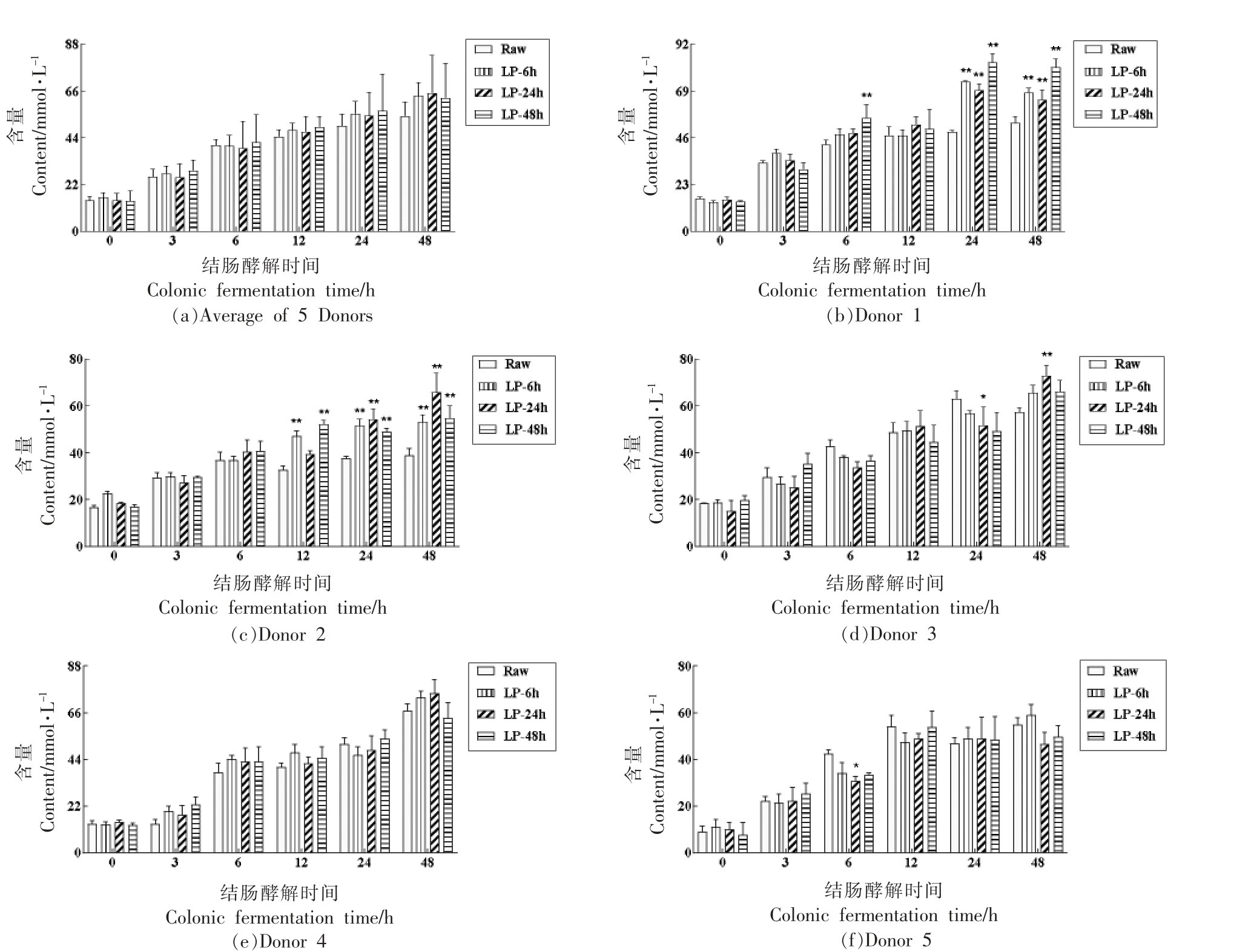
图5 未发酵和发酵荞麦壳在结肠酵解过程中的乙酸含量变化
Fig.5 Change on the acetate content during in vitro colonic fermentation of raw and fermented buckwheat hulls
注:图a,n=5;图b~f,n=3。

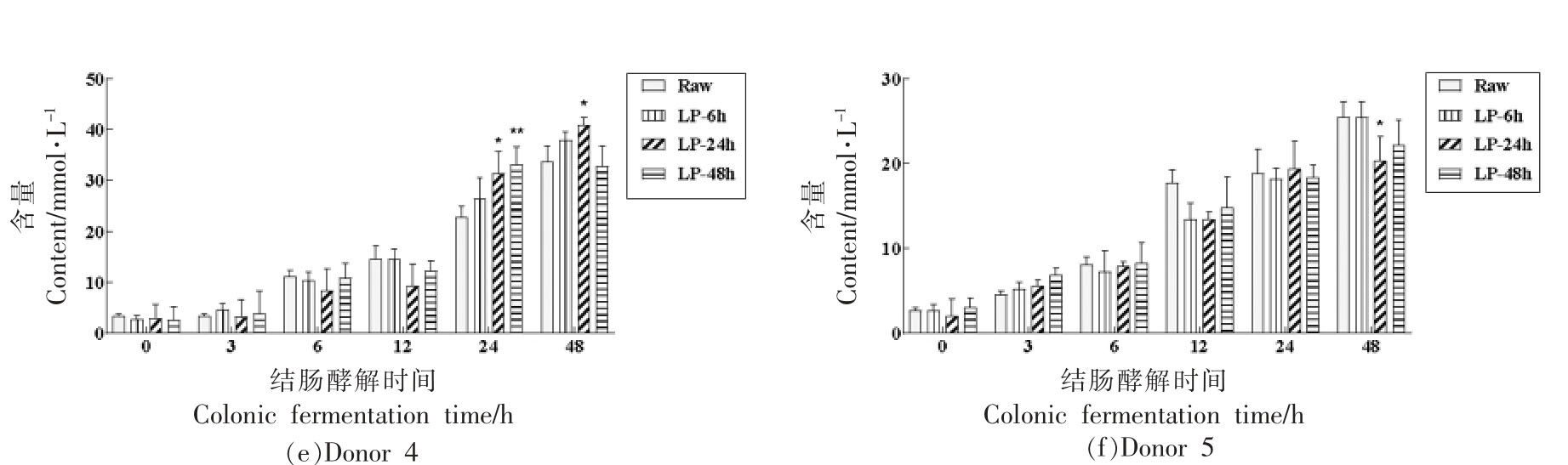
图6 未发酵和发酵荞麦壳在结肠酵解过程中的丙酸含量变化
Fig.6 Change on the propionate content during in vitro colonic fermentation of raw and fermented buckwheat hulls
注:图a,n=5;图b~f,n=3。

图7 未发酵和发酵荞麦壳在结肠酵解过程中的丁酸含量变化
Fig.7 Change on the butyrate content during in vitro colonic fermentation of raw and fermented buckwheat hulls
注:图a,n=5;图b~f,n=3。
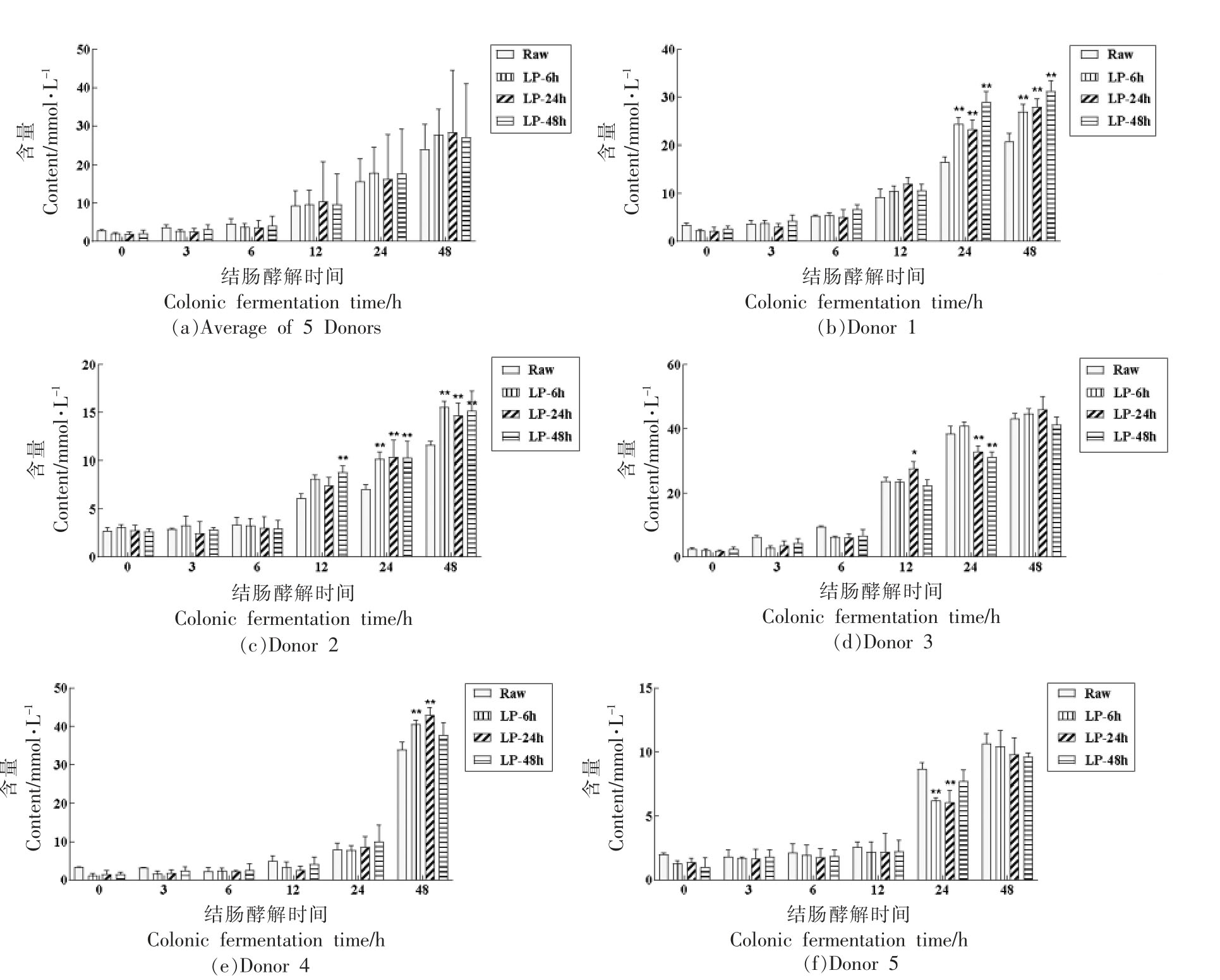
图8 未发酵和发酵荞麦壳在结肠酵解过程中的戊酸含量变化
Fig.8 Change on the valerate content during in vitro colonic fermentation of raw and fermented buckwheat hulls
注:图a,n=5;图b~f,n=3。
以上结果表明发酵荞麦壳对主要SCFA 含量的调节作用受到肠道菌群个体差异的影响,且菌群个体差异性的作用要比乳酸菌发酵样品对SCFA 产生的影响更为显著。
2.5 乳酸菌发酵对荞麦壳在肠道酵解过程中支链短链脂肪酸含量的影响
本研究也分析了2 种支链短链脂肪酸(Branched-chain fatty acids,BCFA)的含量,主要来自肠道酵解蛋白质的产物[23,33]。总体来看(图9a和10a),异丁酸和异戊酸含量在酵解前12 h 无明显变化,而在酵解24 h 和48 h 快速增加,此外,未发酵与发酵荞麦壳在BCFA 含量上也无显著差异。与主要SCFA 变化类似的是在部分志愿者菌群中,未发酵与发酵荞麦壳之间存在显著差异。在Donor 1 酵解24 h 后,3 组发酵荞麦壳的异丁酸(图9b)和异戊酸(图10b)含量均显著高于Raw组(P <0.05 或P <0.01);在Donor 2 酵解48 h后,3 组发酵荞麦壳的异戊酸(图10c)含量显著高于Raw组(P <0.05 或P <0.01);在Donor 3 酵解48 h 后,3 组发酵荞麦壳的异丁酸(图9d)和异戊酸(图10d)含量均显著高于Raw组(P <0.05 或P<0.01);在Donor 4 酵解48 h 后,3 组发酵荞麦壳的异丁酸(图10c)含量显著高于Raw组(P <0.01);在Donor 5 中,未观察到3 组发酵荞麦壳的一致性作用。结果说明发酵荞麦壳对BCFA 含量的调节作用受到肠道菌群个体差异的影响。

图9 未发酵和发酵荞麦壳在结肠酵解过程中的异丁酸含量变化
Fig.9 Change on the iso-butyrate content during in vitro colonic fermentation of raw and fermented buckwheat hulls
注:图a,n=5;图b~f,n=3。


图10 未发酵和发酵荞麦壳在结肠酵解过程中的异戊酸含量变化
Fig.10 Change on the iso-valerate content during in vitro colonic fermentation of raw and fermented buckwheat hulls
图11 展示了酵解过程中总SCFA 的变化,从5 个志愿者总体来看,随着肠道酵解时间的延长,总SCFA 的含量持续增加,而未发酵与发酵荞麦壳无显著差异(图11a)。同时,在Donor 1,2,3 中,观察到3 组发酵荞麦壳对总SCFA 表现为一致性地促进作用。因此,乳酸菌发酵荞麦壳可能对大多数人粪便菌群的产SCFA 能力具有改善效果。

图11 未发酵和发酵荞麦壳在结肠酵解过程中的总短链脂肪酸含量变化
Fig.11 Change on the total short-chain fatty acid content during in vitro colonic fermentation of raw and fermented buckwheat hulls
注:图a,n=5;图b~f,n=3。
3 结论
本研究利用乳酸菌HH-LP56 发酵荞麦壳,发现发酵6 h 后,总酚含量显著增加,并在发酵24 h后进一步增加,在发酵48 h 总酚含量达到最高水平。分析酚类物质组成和分布发现,乳酸菌发酵显著增加游离态没食子酸和原儿茶酸的含量,增加总酚含量。体外模拟胃肠道消化发现,发酵荞麦壳中没食子酸和原儿茶酸的肠道生物可及性显著增加。体外接种5 位志愿者粪便菌群模拟结肠酵解发现,总体上看,未发酵和发酵荞麦壳的pH 值、产气量、主要SCFA、BCFA 等均较为接近,然而,在3 位志愿者菌群中,发酵荞麦壳酵解48 h 后,总SCFA 含量均显著高于未发酵荞麦壳。研究初步表明乳酸菌发酵显著增加荞麦壳中游离态酚含量及酚类的肠道生物可及性,并在部分个体菌群中具有更好的益生元作用,结果将为乳酸菌发酵荞麦壳产品开发提供理论依据。
[1] LI X,SIDDIQUE K H.Future smart food:Harnessing the potential of neglected and underutilized species for zero hunger[J].Maternal Child Nutrition,2020,16(S3):e13008.
[2] ADHIKARI L,TULADHAR S,HUSSAIN A,et al.Are traditional food crops really 'future smart foods?'A sustainability perspective [J].Sustainability,2019,11(19):5236.
[3] WEN W,LI Z Q,SHAO J R,et al.The distribution and sustainable utilization of buckwheat resources under climate change in China[J].Plants,2021,10(10):2081.
[4] MULTARI S,NEACSU M,SCOBBIE L,et al.Nutritional and phytochemical content of high-protein crops[J].Journal of Agricultural and Food Chemistry,2016,64(41):7800-7811.
[5] SOFI S A,AHMED N,FAROOQ A,et al.Nutritional and bioactive characteristics of buckwheat,and its potential for developing gluten-free products:An updated overview[J].Food Science Nutrition,2023,11(5):2256-2276.
[6] GRAZIANO S,AGRIMONTI C,MARMIROLI N,et al.Utilisation and limitations of pseudocereals(quinoa,amaranth,and buckwheat)in food production:A review[J].Trends in Food Science Technology,2022,125:154-165.
[7] 张帅.小型全自动荞麦脱壳机的研制[J].农业技术与装备,2021(12):47-48.ZHANG S.Research of small automatic buckwheat shelling machine[J].Agricultural Technology &Equipment,2021(12):47-48.
[8] 张超,李冀新.荞麦壳的研究进展[J].粮油食品科技,2006,14(3):8-9.ZHANG C,LI J X.Process of buckwheat hull[J].Science and Technology of Cereals,Oils and Foods,2006,14(3):8-9.
[9] 王玥,刘子琦,聂萌滋,等.锌离子络合法快速分离纯化荞麦壳黄酮及其抗AGEs 活性[J].中国食品学报,2023,23(10):167-177.WANG Y,LIU Z Q,NIE M Z,et al.Rapid separation and purification of buckwheat hull flavonoids by zinc lon complexation andthe anti-AGEs activity[J].Journal of Chinese Institute of Food Science and Technology,2023,23(10):167-177.
[10] KALINOVÁ J P,VRCHOTOVÁ N,TRˇÍSKA J.Phenolics levels in different parts of common buckwheat(Fagopyrum esculentum)achenes[J].Journal of Cereal Science,2019,85:243-248.
[11] DZIEDZIC K,GÓRECKA D,KUCHARSKA M,et al.Influence of technological process during buckwheat groats production on dietary fibre content and sorption of bile acids[J].Food Research International,2012,47(2):279-283.
[12] 张晋,刘思辰,曹晓宁.不同荞麦品种种壳营养成分研究[J].中国农学通报,2021,37(32):132-138.ZHANG J,LIU S C,CAO X N.Nutrient component of seed-case of buckwheat cultivars[J].Chinese Agricultural Science Bulletin,2021,37(32):132-138.
[13] 谢俊华,聂少平,丁翘,等.植物乳杆菌NCU116发酵胡萝卜浆对免疫抑制小鼠肠道黏膜免疫的影响[J].食品科学,2015,36(21):201-206.XIE J H,NIE S P,DING Q,et al.Effect of carrot slurry fermented with Lactobacillus plantarum NCU116 on lntestinal mucosal lmmunity in immunosuppressed mice[J].Food Science,2015,36(21):201-206.
[14] ZHANG Z H,FAN S T,HUANG D F,et al.Effect of Lactobacillus plantarum NCU116 fermentation on Asparagus officinalis polysaccharide:Characterization,antioxidative,and immunoregulatory activities[J].Journal of Agricultural and Food Chemistry,2018,66(41):10703-10711.
[15] 陈子琪,郜海燕,房祥军,等.植物乳杆菌发酵香菇不同部位风味物质变化研究[J].中国食品学报,2020,20(8):130-139.CHEN Z Q,GAO H Y,FANG X J,et al.Studies on the changes of flavor substances in different parts of Lentinus edodes fermented by Lactobacillus plantarum [J].Journal of Chinese Institute of Food Science and Technology,2020,20(8):130-139.
[16] 陈惠敏,吴晓平,汪少芸.黑豆粕饮料发酵工艺的优化及其抗氧化活性评价[J].食品工业科技,2023,44(5):129-138.CHEN H M,WU X P,WANG S Y.Optimization of fermentation technology and evaluation of antioxidant activity of black soybean meal beverage[J].Science and Technology of Food Industry,2023,44(5):129-138.
[17] MOUSAVI M H,GHAREKHANI M,ALIREZALU K,et al.Production and characterization of nondairy gluten-free fermented beverage based on buckwheat and lentil[J].Food Science Nutrition,2023,11(5):2197-2210.
[18] MATEJCˇEKOVÁ Z,SOLTÉSZOVÁ F,ACˇAI P,et al.Application of Lactobacillus plantarum in functional products based on fermented buckwheat [J].Journal of Food Science Technology,2018,83(4):1053-1062.
[19] ROCCHETTI G,MIRAGOLI F,ZACCONI C,et al.Impact of cooking and fermentation by lactic acid bacteria on phenolic profile of quinoa and buckwheat seeds[J].Food Research International,2019,119:886-894.
[20] ZIELINSKI H,CIESAROVÁ Z,KUKUROVÁ K,et al.Effect of fermented and unfermented buckwheat flour on functional properties of gluten-free muffins[J].Journal of Food Science Technology,2017,54:1425-1432.
[21] 王储炎,张继刚,杨柳青,等.3 种乳酸菌发酵对蓝莓多酚、原花青素含量及抗氧化活性的影响[J].食品科学,2020,41(24):87-94.WANG C Y,ZHANG J G,YANG L Q,et al.Comparative effects of fermentation with three species of lactic acid bacteria on polyphenol and proanthocyanidin contents and antioxidant activity of blueberry fruit[J].Food Science,2020,41(24):87-94.
[22] 聂少平,谢明勇,罗珍.用清除有机自由基DPPH法评价茶叶多糖的抗氧化活性[J].食品科学,2006,27(3):34-36.NIE S P,XIE M Y,LUO Z.Antioxidative activity evaluation study on tea polysaccharide by scavenging DPPH[J].Food Science,2006,27(3):34-36.
[23] FAN S,ZHANG Z,DUNCAN G J,et al.Bioprocessing of hempseed(Cannabis sativa L.)food byproducts increased nutrient and phytochemical in vitro bioavailability during digestion and microbial fermentation[J].Applied Sciences,2023,13(9):5781.
[24] 陈建业,温鹏飞,战吉成,等.葡萄酒中11 种酚酸的反相高效液相色谱测定方法研究[J].中国食品学报,2006,6(6):133-138.CHEN J Y,WEN P F,ZHAN J C,et al.Studies on the determination of 11 phenolic acids in wines by reverse phase high performance liquid chromatography[J].Journal of Chinese Institute of Food Science and Technology,2006,6(6):133-138.
[25] BRODKORB A,EGGER L,ALMINGER M,et al.INFOGEST static in vitro simulation of gastrointestinal food digestion[J].Nature Protocols,2019,14(4):991-1014.
[26] LIU S,LI Y H,SONG X X,et al.Changes in volatile and nutrient components of mango juice by different lactic acid bacteria fermentation[J].Food Bioscience,2023,56:103141.
[27] KHUBBER S,MARTI-QUIJAL F J,TOMASEVIC I,et al.Lactic acid fermentation as a useful strategy to recover antimicrobial and antioxidant compounds from food and by-products[J].Current Opinion in Food Science,2022,43:189-198.
[28] GAO H,WEN J J,HU J L,et al.Momordica charantia juice with Lactobacillus plantarum fermentation:Chemical composition,antioxidant properties and aroma profile[J].Food Bioscience,2019,29:62-72.
[29] ZHANG Z H,FAN S T,DUNCAN G J,et al.Buckwheat(Fagopyrum esculentum)hulls are a rich source of fermentable dietary fibre and bioactive phytochemicals[J].International Journal of Molecular Sciences,2023,24(22):16310.
[30] GIDLEY M J,YAKUBOV G E.Functional categorisation of dietary fibre in foods:Beyond 'soluble'vs 'insoluble'[J].Trends in Food Science Technology,2019,86:563-568.
[31] FAN S T,ZHANG Z H,ZHAO Y S,et al.Recent advances in targeted manipulation of the gut microbiome by prebiotics:From taxonomic composition to metabolic function [J].Current Opinion in Food Science,2023,49:100959.
[32] DUNCAN S H,RUSSELL W R,QUARTIERI A,et al.Wheat bran promotes enrichment within the human colonic microbiota of butyrate -producing bacteria that release ferulic acid[J].Environmental microbiology,2016,18(7):2214-2225.
[33] REICHARDT N,VOLLMER M,HOLTROP G,et al.Specific substrate-driven changes in human faecal microbiota composition contrast with functional redundancy in short-chain fatty acid production[J].The ISME Journal,2018,12(2):610-622.