在食品工业领域,动物脂肪是被广泛应用的生产原料。它能够赋予食品良好的质地和口感,同时增添风味,使食物变得美味可口[1]。动物脂肪在加工过程中,能够溶解并渗透到食材中,提供额外的润滑性和丰富的口感,提高食品的食用价值。然而动物脂肪中含有较高比例的饱和脂肪酸,过量摄入饱和脂肪酸会增加血液中不良胆固醇的水平,从而增加冠心病、高血压和高脂血症等心血管疾病的风险[2]。沙丁鱼油富含多不饱和脂肪酸(PUFA)[3]。根据2023 年渔业统计年鉴显示,2022年沙丁鱼总产量约为9 万t。沙丁鱼油的提取率可达到67.86%,其中DHA(二十碳五烯酸)含量达26.56%,EPA(二十二碳六烯酸)含量为2.64%[4]。DHA 和EPA 是ω-3 型多不饱和脂肪酸的一种类型,它们具有抗炎和抗血小板凝聚的特性,有助于保护血管内壁的完整性,预防动脉粥样硬化的形成。这也是食品加工行业越来越注重开发低饱和脂肪酸、低胆固醇产品的原因之一。然而,鱼油在生产和加工中,ω-3 型脂肪酸易氧化,影响其适口性和安全性[5]。
油凝胶是通过添加凝胶剂,使油料凝聚成固体或半固体的状态。凝胶剂与油料中的分子通过氢键、π-π 键、范德华力以及静电作用力等作用力相互结合,形成复杂的三维网络结构。其分子之间的交联作用可以调节和控制油脂的流变特性和保油性。通过选择适当的凝胶剂,可以将油脂转化为凝胶状,从而有效保存原有的营养成分[6]。蜂蜡是由直链烷烃、长链脂肪酸、长链脂肪醇、蜡酯、醛、酮、甘油酯或二酯的混合物组成[7],其具有出色的结晶能力,在极低的质量分数下,也能够有效地和油料中的分子交联形成稳定的凝胶[8],是一种理想的制备油凝胶的凝胶剂。蜂蜡中原始的小分子形成晶体链,这些晶体链不断交联形成更多的结晶区,从而增强油凝胶的网络结构[9]。
调节凝胶剂的种类和含量使油凝胶获得不同的凝胶特性[10]。为了找到最适合替代动物脂肪的蜂蜡基鱼油凝胶,需要根据需求调整蜂蜡的使用量,以开发出与猪油相似的流变特性和质构特性的油凝胶产品。本研究对不同蜂蜡添加量的蜂蜡基鱼油凝胶体系和微观结构进行评价,以找到与猪油稳定性能最相似的蜂蜡基鱼油凝胶。以沙丁鱼油作为基础油料,蜂蜡作为凝胶剂来制作油凝胶,以猪油作对照,从外观、保油率、硬度、凝胶强度、流变学和微观结构等方面分析不同蜂蜡添加量对油凝胶的影响,以期找出最合适的蜂蜡添加量来制备油凝胶,用于研究代替猪油的鱼油凝胶产品。
1 材料与方法
1.1 试验材料
沙丁鱼油(食用级),陕西天雷生物科技有限公司;天然蜂蜡(食用级),东光县汇恒蜡制品厂;猪油(食用级),四川高金食品股份有限公司。
1.2 试验仪器与设备
CX43 型光学显微镜,日本Olympus 公司;TA-XTplus 型物性分析仪,英国SMS 公司;HAAKE-MARSⅢ型高级模块化流变仪,美国Thermo Fisher Scientific 公司;智能数显磁力加热搅拌器,杭州米欧仪器有限公司;JIDI-20R 型台式多用途高速冷冻离心机,广州吉迪仪器有限公司。
1.3 试验方法
1.3.1 蜂蜡基鱼油凝胶制备 参照Barbut等[11]的方法并稍作修改,取若干个100 mL 的烧杯,分别称取质量分数为2%,4%,6%,8%,10%,12%,14%,16%,18%,20%的蜂蜡经60 ℃预热后,加到鱼油中,在80 ℃下使用磁力搅拌器加热搅拌,直至得到澄清的溶液。然后将溶液取出,在室温下冷却,直至形成蜂蜡基鱼油凝胶,再转入4 ℃冰箱中保存24 h,备用。猪油作为对照组。
1.3.2 外观形态观测 参照Amanda等[12]的方法并稍作修改,将这10 组制备的油凝胶样品分装至20 mL 的具塞透明玻璃瓶中,并分别将其瓶口向上、瓶口向下放置拍照,采用目视检测法观测蜂蜡基鱼油凝胶的外观形态,并分析形成油凝胶的临界质量分数。
1.3.3 保油率测定 根据Fayaz等[13]的方法并稍作修改。称量空离心管的质量计为m0,将所制的蜂蜡基鱼油凝胶样品放到离心管中称量其总质量计为m1,再将其置于离心机中,室温条件下以10 000 r/min 离心15 min,再将离心后的离心管倒置30 min,以析出液体油,用滤纸吸干液体油后称量剩余样品和离心管的总质量计为m2。每个样品需要进行3 次重复试验。通过公式(1)计算样品的保油能力:
1.3.4 硬度测定 参考Zheng等[14]的方法并稍作修改。通过使用质构仪来测量蜂蜡基鱼油凝胶的硬度。选择P/10 的探针、探头来测定,以1 mm/s的稳定速度移动。
1.3.5 凝胶强度测定 参考Kaewdang等[15]的方法并稍作修改。采用物性分析仪测定蜂蜡沙丁鱼凝胶的凝胶强度。选用直径10 mm 的圆柱形P10探针,测试前速度2 mm/s,测试中速度1 mm/s,测试后速度2 mm/s,穿刺距离20 mm,触发值0.01 N。
1.3.6 油凝胶流变行为分析 使用直径为35 mm的平行板(P35)来分析蜂蜡基鱼油凝胶样品,所有样品均需要在25 ℃下进行,其几何间隙为1 mm。
1.3.6.1 静态流变性测定 参考Narine等[16]的方法并稍作修改,测定在不同剪切速率下蜂蜡基鱼油凝胶的表观黏度,取适量蜂蜡基鱼油凝胶均匀涂布于平板上,在25 ℃条件下测定其表观黏度,剪切速率范围为0.01~100 s-1,固定应变为0.01%。
1.3.6.2 动态流变性测定 参考Vilela等[17]的方法并稍作修改,在25 ℃条件下,通过动态频率扫描蜂蜡基鱼油凝胶,固定振幅,频率范围为1~10 Hz,记录样品在扫描过程中随频率变化的弹性模量(G′)和黏性模量(G″)。
1.3.7 微观结构观察 参考Pieve等[18]的方法并稍作修改,在25 ℃条件下,取蜂蜡沙丁鱼凝胶样品20 μL 置于载玻片中间,轻轻盖上盖玻片,防止气泡产生,并通过光学显微镜观察。使用ImageJ软件对盒计数分形维数(Db)进行定量分析。计算公式如下:
通过图像分析得到的分形维数是基于二维空间的计算。
1.3.8 数据统计分析 本试验样品质构特性分析需进行5 次平行测定,其它试验需平行3 次。数据测量值以“平均值±标准差”来表示,使用JMP Pro 13 统计软件对数据进行方差分析和Tukey 多重比较,置信度为95%(P<0.05)。
2 结果与分析
2.1 蜂蜡基鱼油凝胶外观形态
外观形态是判断油凝胶形成的重要指标。通过调整蜂蜡的添加量,可以制备不同质量分数的蜂蜡基鱼油凝胶样品。为了观察蜂蜡对鱼油的凝胶行为,将含有样品的小瓶倒置,以检查油凝胶的流动性。如果油凝胶呈现不流动状态,说明该样品已经形成了稳定的凝胶。如图1 所示,质量分数为2%的凝胶剂形成的蜂蜡基鱼油凝胶倒置时能快速流动,当质量分数为4%及以上时均不流动,可推测蜂蜡基鱼油凝胶形成的临界范围为2%~4%。另外,蜂蜡基鱼油凝胶的外观颜色也是影响消费者选择的因素。通过不断增加蜂蜡添加量,蜂蜡基鱼油凝胶颜色逐渐加深,从淡黄色变成了黄色。猪油对照组体现出较好的稳定性,倒置后没有出现流动现象,说明猪油本身具有稳定的结晶性能,且储存时间越长,结晶能力越强[19]。结果表明,蜂蜡基鱼油凝胶形成的临界范围为2%~4%,并且随着蜂蜡的添加油凝胶颜色由淡黄色变为黄色。

图1 蜂蜡添加量对油凝胶外观形态的影响
Fig.1 Effect of beeswax addition on the appearance and morphology of oleogels
2.2 蜂蜡基鱼油凝胶保油率
保油率是衡量油凝胶捕获液态油能力的指标,也是评估油凝胶网络物理稳定性的基本参数之一。它反映了凝胶剂对液体油在三维网络结构中的滞留程度[20]。在食品加工和储存过程中,液体油往往会从食品中析出,导致口感变差、外观不佳以及食品质量下降。通过使用具有高持油率的油凝胶,可以改善此问题。高保油率的油凝胶能够有效捕获和固定液体油,阻止其从食品中分离出来。这意味着在食品加工中添加这样的油凝胶可以提高产品的稳定性,并减少液体油析出的风险。这有助于保持食品的口感、外观和质量,并延长产品的货架寿命[21]。由图2 可以看出,随着蜂蜡添加量的增加,蜂蜡基鱼油凝胶的保油率不断升高,Pandolsook等[22]也得到相似的结论,这可能是因为蜂蜡提供了一种有效的封闭结构,使得鱼油不易流失。蜂蜡的添加可以提高沙丁鱼油凝胶的保油效果,然而当蜂蜡添加量低于8%时,其保油率相对较低。在质量分数为8%~20%时,蜂蜡形成的油凝胶保油率均达到99%以上,无显著性差异(P<0.05)。这种现象可以解释为随着蜡酯含量的增加,蜡基油凝胶的结构更加紧密和有序,因为长链脂肪酸和脂肪醇分子具有较长的烷基链,它们在油脂中能够形成更多的晶体网络结构,并且分子间作用力也更强,使鱼油凝胶有良好的凝胶性能[23]。高的保油率表明油凝胶具有良好的抗油脂迁移能力,适用于改善食品工业中油脂的液体油析出问题。由此可知,鱼油凝胶的蜂蜡添加量在6%~8%时是高保油率的临界范围,在8%~20%时保油率显著高于猪油对照组。蜂蜡基鱼油凝胶的保油能力与凝胶剂质量分数之间存在紧密的关联,也受晶体的形态、分布和大小等因素的影响。
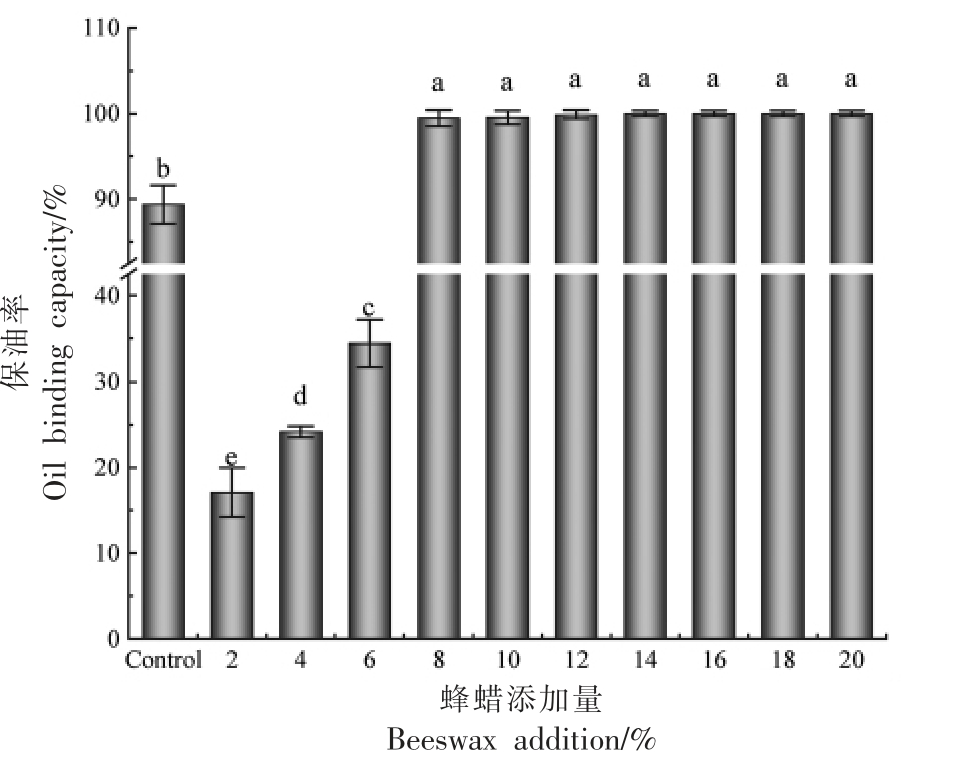
图2 蜂蜡添加量对油凝胶保油率的影响
Fig.2 Effect of beeswax addition on oil binding capacity of oleogels
注:不同小写字母表示有差异性显著(P<0.05)。
2.3 蜂蜡基鱼油凝胶质构特性
本研究通过测定蜂蜡基油凝胶的硬度和凝胶强度来表征其质构特性。其中油凝胶的硬度是评估凝胶剂对鱼油捕获能力的重要指标,硬度越大,说明油凝胶中的结晶网络结构越紧密,从而对鱼油的捕获能力越强[24]。凝胶的硬度主要取决于结晶网络的紧密程度。当凝胶剂形成的结晶网络越密集、有序时,凝胶的硬度就会变得越大。这意味着凝胶能够更好地捕获和固定鱼油分子,使其难以逸出凝胶结构。由表1 可知,猪油样品具有良好的硬度和凝胶强度,这可能是因为猪油凝胶的晶体分子呈现出β′晶型,促进了机体结构的稳定[25]。随着蜂蜡添加量的增加,蜂蜡基鱼油凝胶的硬度不断增大。此结果与Hwang等[26]研究结果类似,较高的蜂蜡浓度可以提高油凝胶的硬度。当蜂蜡添加量小于8%时,鱼油凝胶的硬度较低且低于猪油对照组。当蜂蜡添加量高于6%时,不同蜂蜡添加量的鱼油凝胶的硬度差异显著,说明参与晶体网络构建的蜂蜡越多,油凝胶的硬度会逐渐增强[27],这可能是因为在高蜂蜡添加量的凝胶体系中,其形成的三维网络结构更加致密。由此可知,蜂蜡的添加量对油凝胶的硬度有着较大影响,随着蜂蜡添加量的增加,油凝胶的硬度也随之增大。当蜂蜡添加量为10%时,与对照组猪油硬度更相似。
表1 蜂蜡添加量对油凝胶硬度和凝胶强度的影响
Table 1 Effect of beeswax content on hardness and gel strength of oleogels
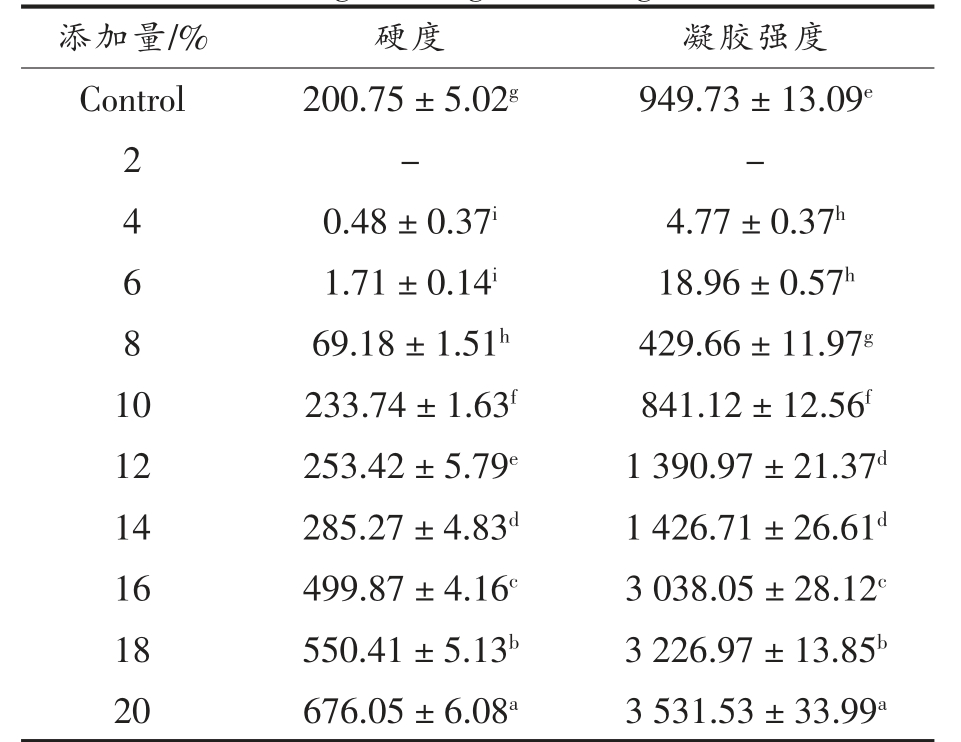
注:不同小写字母表示有差异性显著(P<0.05)。
凝胶强度是油凝胶结构稳定性的关键指标,它主要取决于蜂蜡在油凝胶中形成的结晶网络的紧密程度。蜂蜡在油凝胶中以晶体形式存在,并能够在油基质中形成高度有序的结构。这是因为蜂蜡晶体通过相互连接形成一个密集的网络结构,类似于网状结构或骨架,提高了鱼油凝胶的稳定性。这种结晶网络结构能够有效阻碍油分子的运动和流动,使油凝胶具有较高的黏度从而表现出较强的凝胶强度。由表1 可知,当蜂蜡添加量为10%时,凝胶强度与对照组猪油最为接近。且随着蜂蜡添加量的增加,蜂蜡基鱼油凝胶的凝胶强度也随之增强,这与Zhao等[28]发现更多含量的蜡晶体可以使油凝胶有更高的硬度和凝胶强度的结果相似。这可能是因为三维网络中蜡簇数量的增加促使凝胶形成坚固的三维网状结构,由此推测蜂蜡浓度会对凝胶强度造成极大影响。当蜂蜡油凝胶添加量为2%~6%时,凝胶强度几乎为0,可能是由于油凝胶强度太小,无法达到设备检测限。当添加量在8%~20%时,显著性差异较大,说明凝胶强度对蜂蜡的添加量极为敏感。综上,随着蜂蜡添加量的增加,蜂蜡基鱼油凝胶强度提高,蜂蜡添加量为10%时,与对照组猪油的结果接近。
2.4 蜂蜡基鱼油凝胶流变行为
2.4.1 静态流变行为 油凝胶的表观黏度与剪切速率有密切关系,剪切作用会导致分子之间的碰撞增多,从而促进热和质量的传递,同时剪切作用还会破坏凝胶剂分子之间的相互作用力和晶体键,并改变了晶体颗粒的大小,高剪切速率改变了分子的运动速率和排列顺序,这会导致晶体的大小、分布及数量发生变化[29]。不同蜂蜡添加量的沙丁鱼油凝胶的表观黏度随剪切速率的变化如图3所示,在低剪切速率的情况下,表观黏度较高,随着剪切速率的增加,凝胶的表观黏度呈现下降的趋势,这说明随着剪切速率的加快,鱼油凝胶的黏度下降,表现出剪切稀化现象[30],一般认为剪切稀化现象是溶液中的聚合物链在不断剪切的环境下,聚合物的连接点不断地被破坏和聚合。当剪切速率足够大时,聚合物连接点被破坏的速度大于聚合的速度,导致连接点的量不断下降,宏观上表现为鱼油凝胶黏度下降。在同一剪切速率下,随着蜂蜡添加量的增加,鱼油凝胶的表观黏度也更高,这可能是因为蜂蜡的添加丰富了油凝胶内部的结晶区,结晶网络更加致密[31],使得鱼油凝胶的黏弹性增加。对照组猪油的静态流变曲线位于蜂蜡添加量8%~10%之间,可推测在此范围内油凝胶与猪油静态流变特性相似。
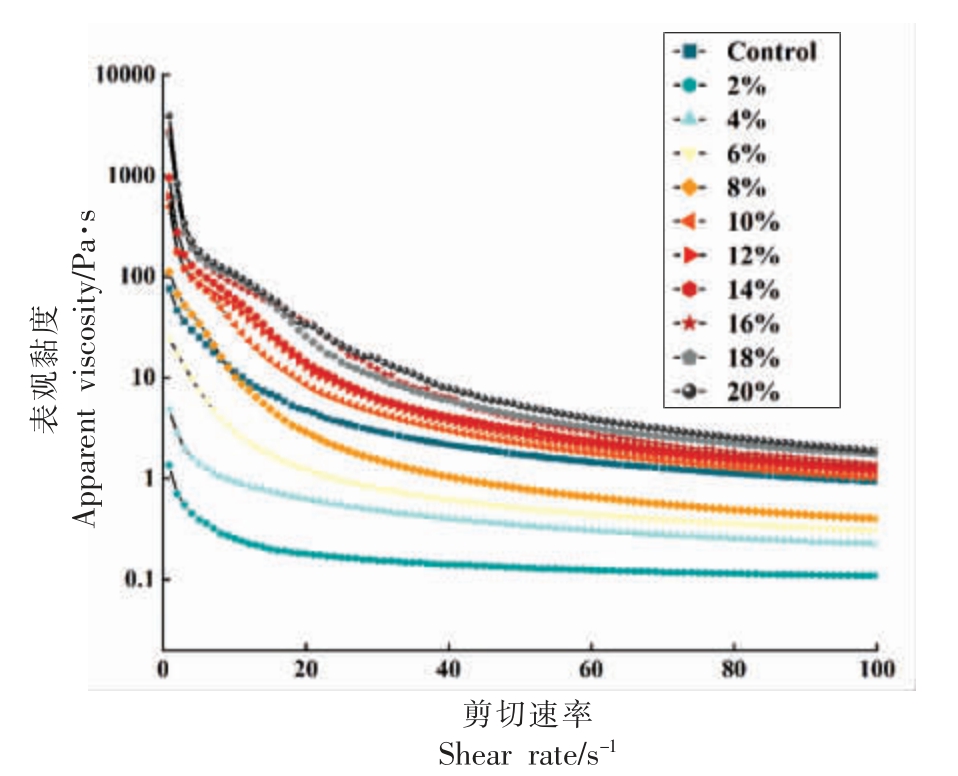
图3 蜂蜡添加量对油凝胶静态流变行为的影响
Fig.3 Effect of beeswax addition on static rheological behavior of oleogels
2.4.2 动态流变行为 动态流变学研究的是鱼油凝胶在不同应力、频率条件下的流变特性,频率扫描测试是一种常用的试验方法,用于测量油凝胶在固态和液态状态下的性质,通过频率扫描测试,可以了解到鱼油凝胶在不同频率下的响应情况,分别用弹性模量(G′)和黏性模量(G″)表示[28]。通过频率扫描测试能够观察凝胶在不同时间尺度下的流变行为,将凝胶分为强凝胶、弱凝胶和黏性凝胶[32]。当G′大于G″时被定义为处于凝胶状态[33]。不同蜂蜡添加量的沙丁鱼油凝胶的黏弹性模量随剪切速率的变化如图4 所示,在同一频率下,随着蜂蜡添加量的增加,鱼油凝胶的G′和G″都随之增加,鱼油凝胶弹性越大。在测定范围内,G′始终大于G″,表明鱼油凝胶形成紧密的凝胶结构,与Shi等[31]通过研究添加蜂蜡添加量对流变特性的影响结果一致。当频率改变时,鱼油凝胶G′不会随之发生变化,始终处于直线状态,可知样品是强凝胶[34]。对照组猪油的G′不随频率的改变发生变化,G′始终大于G″,可推测猪油具有相似的流变特性,猪油的G′与G″在蜂蜡基鱼油凝胶的蜂蜡添加量为6%~8%之间,且更接近8%。这些结果表明,蜂蜡的添加有助于结晶的形成,利于构建出更坚固的凝胶结构,并且在蜂蜡添加量为6%~8%时,与猪油结构最为相近。
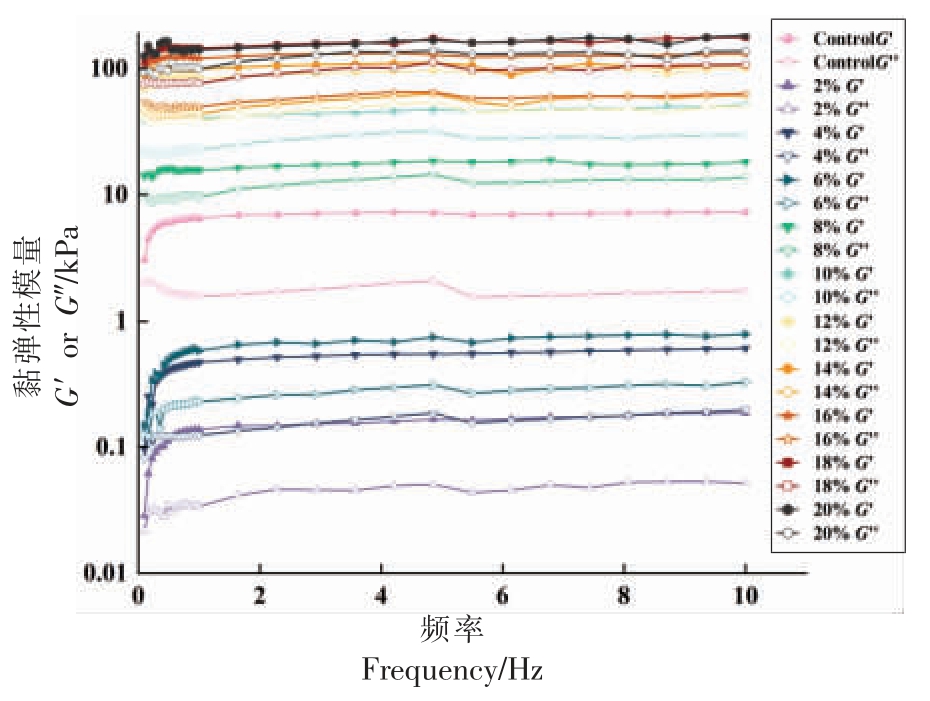
图4 蜂蜡添加量对油凝胶动态流变行为的影响
Fig.4 Effect of beeswax addition on dynamic rheological behavior of oleogels
2.5 微观结构
蜂蜡基鱼油凝胶的宏观性质受微观结构的影响。蜂蜡在液态油中的结晶通常会产生颗粒凝胶,其中晶体和结晶聚集体的范德华网络将液态油固定成具有更紧密的晶体的网状结构[35],从而提高了蜂蜡基鱼油凝胶的韧性和凝胶强度,增强对鱼油的捕获能力。鱼油凝胶在显微镜下观察的结果如图5 所示,蜂蜡基鱼油凝胶形成的晶体形状均为针状晶体,此结果与Yılmaz等[36]结果相似。少部分晶体呈现簇状,表明晶型复杂,很可能存在晶型的中间过渡态。蜂蜡基鱼油凝胶通常表现出“同质多晶”现象,其中α、β、β′是3 种常见晶型,稳定性和熔点依次升高,β′晶型的微观结构大多体现为针状,β′晶型能使凝胶具有更加光滑、细腻的外观,由此可见蜂蜡基油凝胶以β′型晶体为主,且β′型晶体可以促进晶链的延伸和晶体结构的形成[37],而猪油的微观结构显示出均匀密集的球状结晶,可推测猪油也为β′型晶体。不同蜂蜡添加量的鱼油凝胶蜂蜡聚集程度和晶体尺寸存在差异,随着蜂蜡添加量的增加,鱼油凝胶体系中的结晶物质增多,晶体间的相互作用更复杂。随着蜂蜡添加量的增加,鱼油凝胶的结晶区变得密集,结晶的尺寸也变宽[38],入射光的色散效应更强,油凝胶的透明度下降[35],导致样品颜色加深。当蜂蜡添加量为2%时,结晶区稀薄,针状结晶不明显,当蜂蜡添加量为20%时,结晶区密集,凝胶结构紧凑、均匀,表明蜂蜡的添加量增加,使凝胶具有更好的交联性,这一现象体现出了蜂蜡基鱼油凝胶体系具有良好的结构稳定性。

图5 蜂蜡添加量对油凝胶微观结构的影响
Fig.5 Effect of beeswax addition on microstructure of oleogels
分型维度可以被用来衡量油凝胶中晶体的聚集程度,并与油凝胶中的蜂蜡质量分数相关联[39],通过使用ImageJ 软件对盒计数Db 进行定量分析[40],分型维度可以反映出油凝胶中晶体的聚集程度。分型维度与凝胶嵌入空间的饱满程度和空间质量分布有一定的联系[39],可以反映出油凝胶中晶体的聚集程度。不同蜂蜡添加量对油凝胶分型维数的影响如图6 所示,随着蜂蜡添加量的增加,油凝胶的分型维度逐渐增加。表明蜂蜡添加量的增加可以促使鱼油凝胶中晶体的聚集程度增强。这种现象可能是由于晶体数量增加,这些增加的晶体引入了更多的相互作用接触点,从而增强了晶体之间的相互作用力。当蜂蜡添加量在2%~8%之间时,蜂蜡的不同添加量对油凝胶的分型维度产生了显著影响。随着蜂蜡添加量的增加,油凝胶的分型维度显著上升。然而,当蜂蜡添加量超过8%时,蜂蜡的添加量对油凝胶的分型维度没有显著影响。根据对照组的结果,可以观察到猪油的分型维度明显较高,这表明猪油的晶体呈现出很好的聚集性。结果表明,蜂蜡添加量的增加促进了鱼油凝胶晶体间的聚集作用,并显著提高了鱼油凝胶的稳定性。同时,猪油的晶体结构具备了良好的晶体聚集特性。
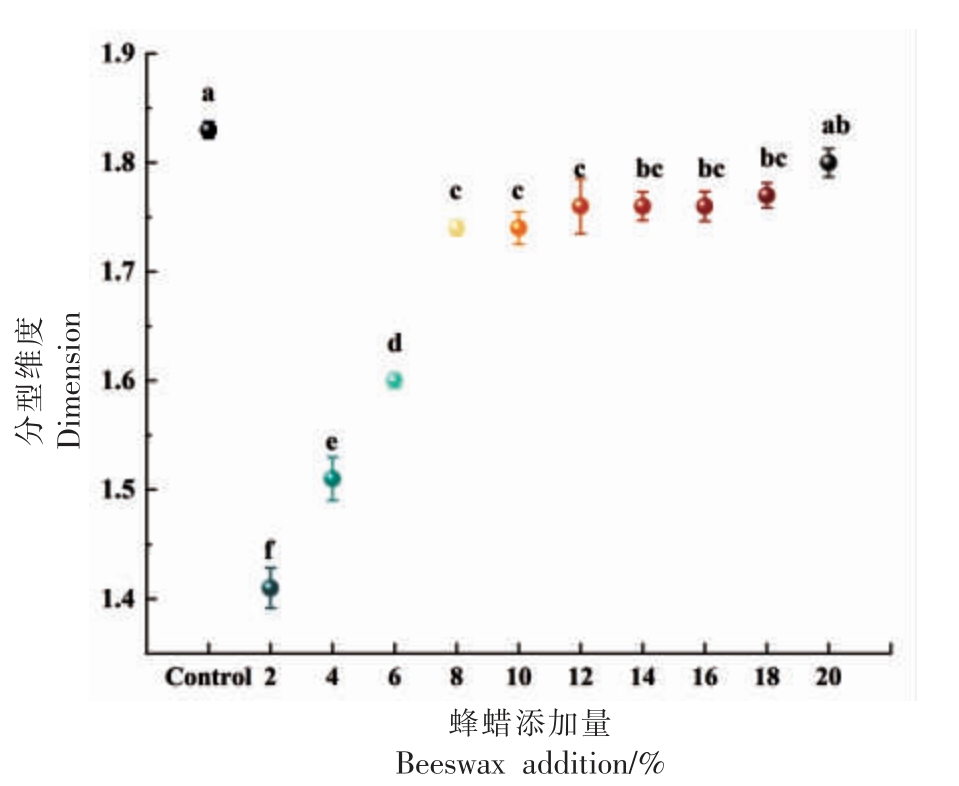
图6 蜂蜡添加量对油凝胶分型维度的影响
Fig.6 Effect of beeswax additions on the dimension of oleogels
注:不同小写字母表示有差异性显著(P<0.05)。
3 结论
蜂蜡基鱼油凝胶随着蜂蜡添加量的增加,其保油性、硬度、凝胶强度随之增加,表观黏度也增加,并且出现剪切稀化现象。动态流变学图像显示蜂蜡基鱼油凝胶具有形成固体状态的期望,与固体猪油状态相似。微观结构表明蜂蜡基鱼油凝胶为β′晶型,β′晶型促进了晶体的形成、聚集和结晶,加强了凝胶网络结构的稳定。通过与对照组猪油的持油性、质构特性及流变特性的对比,鱼油凝胶的蜂蜡添加量在6%~10%范围内,与猪油的稳定性能相似。综上,晶体结构能够影响保油率、凝胶强度、流变性质,然而蜂蜡自组装对蜂蜡基鱼油凝胶宏观性质的影响机制还不明确,需要进一步研究。
[1] QU K X,QIU H T,ZHANG H,et al.Characterization of physically stable oleogels transporting active substances rich in resveratrol[J].Food Bioscience,2022,49:101830.
[2] MANTOVANI A C G,CHENDYNSKI L T,GALVAN D,et al.Thermal-oxidation study of biodiesel by proton nuclear magnetic Resonance(1H NMR)[J].Fuel,2020,274:117833.
[3] CHAKRABORTY K,JOSEPH D.Production and characterization of refined oils obtained from Indian oil sardine(Sardinella longiceps)[J].Journal of Agricultural and Food Chemistry,2015,63(3):998-1009.
[4] RUDKOWSKA I,GARENC C,COUTURE P,et al.Influence of omega-3 fatty acids and the PPAR-Alpha L162V polymorphism on cytokine gene expression levels in human macrophages[J].Journal of Nutrigenetics and Nutrigenomics,2009,2(4):217.
[5] ROBERTA T,NICOLA C,MARISA C C,et al.Fortification of dark chocolate with microencapsulated phytosterols:Chemical and sensory evaluation [J].Food &Function,2018,9(2):1265-1273.
[6] BOTEGA D C,MARANGONI A G,SMITH A K,et al.The potential application of rice bran wax oleogel to replace solid fat and enhance unsaturated fat content in ice cream[J].Journal of Food Science,2014,78(9):C1334-C1339.
[7] LUO W G,LI T,WANG C S,et al.Discovery of beeswax as binding agent on a 6th-century BC Chinese turquoise-inlaid bronze sword[J].Journal of Archaeological Science,2012,39(5):1227-1237.
[8] WANG R P,SCHUMAN T.Towards green:A review of recent developments in bio-renewable epoxy resins from vegetable oils[J].Rsc Green Chemistry,2015,9:202-241.
[9] AWAD T,ROGERS M,MARANGONI A.Scaling behavior of the elastic modulus in colloidal networks of fat crystals[J].The Journal of Chemistry B,2004,108(1):171-179.
[10] PERNETTI M,MALSSEN K,FLTER E,et al.Structuring edible oils by alternatives to crystalline fat[J].Current Opinion in Colloid and Interface Science,2007,12(4/5):221-231.
[11] BARBUT S,WOOD J,MARANGONI A.Potential use of organogels to replace animal fat in comminuted meat products[J].Meat Science,2016,122:155-162.
[12] AMANDA N D,CHARLES G A.The effects of guar gum and other select gums and gelling carbohydrates on appearance,texture,and heating characteristics of wet pet foods[J].Journal of Animal Science,2020,98(Suppl.4):57.
[13] FAYAZ G,GOLI SAH,KADIVAR M.A novel propolis wax-based organogel:Effect of oil type on its formation,crystal structure and thermal properties[J].Journal of the American Oil Chemists Society,2017,94(1):47-55.
[14] ZHENG H X,MAO L K,CUI M N,et al.Development of food-grade bigels based on κ-carrageenan hydrogel and monoglyceride oleogels as carriers for β-carotene:Roles of oleogel fraction[J].Food Hydrocolloids,2020,105:105855.
[15] KAEWDANG O,BENJAKUL S.Effect of ethanolic extract of coconut husk on gel properties of gelatin from swim bladder of yellowfin tuna[J].LWT-Food Science and Technology,2015,62(2):955-961.
[16] NARINE S S,MARANGONI A G.Mechanical and structural model of fractal networks of fat crystals at low deformations[J].Physical Review E,1999,60(6):6991-7000.
[17] VILELA J A,PERRECHIL F D A,PICONE C S F,et al.Preparation,characterization and in vitro digestibility of gellan and chitosan-gellan microgels[J].Carbohydrate Polymers:Scientific and Technological Aspects of Industrially Important Polysaccharides,2015,117:54-62.
[18] PIEVE S D,CALLIGARIS S,CO E,et al.Shear nanostructuring of monoglyceride organogels[J].Food Biophysics,2010,5(3):211-217.
[19] CAMPOS R,NARINE S S,MARANGONI A G.Effect of cooling rate on the structure and mechanical properties of milk fat and lard[J].Food Research International,2002,35(10):971-981.
[20] OKURO P K,TAVERNIER I,SINTANG B,et al.Synergistic interactions between lecithin and fruit wax in oleogel formation[J].Food and Function,2018,9(3):1755-1767
[21] 宗孟,李陆茵,李兴伟,等.植物蜡及液态植物油构建油凝胶的物性研究[J].中国油脂,2019,44(11):17-22.ZONG M,LI L Y,LI X W,et al.Study on physical properties of oil gel constructed from vegetable wax and liquid vegetable oil[J].China Oils and Fats,2019,44(11):17-22.
[22] PANDOLSOOK S,KUPONGSAK S.Influence of bleached rice bran wax on the physicochemical properties of organogels and water-in-oil emulsions[J].Journal of Food Engineering,2017,214:182-192.
[23] BLACH C,GRAVELLE A J.Revisiting the crystallization behavior of stearyl alcohol:Stearic acid(SO:SA)mixtures in edible oil[J].Rsc Advances,2016,6(84):81151-81163.
[24] MENG Z,QI K Y,GUO Y,et al.Macro-micro structure characterization and molecular properties of emulsion-templated polysaccharide oleogels[J].Food Hydrocolloids,2018,77:17-29.
[25] 丁泽敏,刘渝港,夏会平,等.猪油和单甘酯含量对菜籽油凝胶油性质的影响研究[J].中国油脂,2020,45(1):5.DING Z M,LIU Y G,XIA H P,et al.Study on the influence of lard and monoglyceride content on the properties of rapeseed oil gel oil[J].China Oils and Fats,2020,45(1):5
[26] HWANG H S,KIM S,SINGH M,et al.Organogel formation of soybean oil with waxes[J].Journal of the American Oil Chemists Society,2012,89(4):639-647.
[27] BLAKE A I,MARANGONI A G.The use of cooling rate to engineer the microstructure and oil binding capacity of wax crystal networks[J].Food Biophysics,2015,10(4):1-10.
[28] ZHAO M X,LAN Y,CUI L Q,et al.Formation,characterization,and potential food application of rice bran wax oleogels:Expeller-pressed corn germ oil versus refined corn oil[J].Food Chemistry,2020,309:125704.
[29] MAZZANTI G,GUTHRIE S E,SIROTA E B,et al.Orientation and phase transitions of fat crystals under shear[J].Crystal Growth and Design,2003,3(5):721-725.
[30] GABRIELA B,VANESSA S,MATHE M,et al.Development of chitosan -based oleogels via crosslinking with vanillin using an emulsion templated approach:Structural characterization and their application as fat-replacer[J].Food Structure,2022,32:100264.
[31] SHI Y M,ZHANG M,BHANDARI B.Effect of addition of beeswax based oleogel on 3D printing of potato starch -protein system [J].Food Structure,2021,27:100176.
[32] MALKIN A Y,ISAYEV A I.SOLIDS-ScienceDirect[J].Rheology Concepts,Methods,and Applications(Second Edition),2012,5(5):223-253.
[33] ARZENI C,PÉREZ O E,PILOSOF A M R.Functionality of egg white proteins as affected by high intensity ultrasound[J].Food Hydrocolloids,2012,29(2):308-316.
[34] MALKIN A,ISAYEV A.Rheology:Concepts,methods,and applications [J].Applied Rheology,2006,16(5):240-241.
[35] PATEL A R.Understanding the oil-gelling properties of natural waxes [J].INFORM:International News on Fats,Oils and Related Materials,2016,27(5):17-20.
[36] YILMAZ E,Ö GˇÜTCÜ M.Comparative analysis of olive oil organogels containing beeswax and sunflower wax with breakfast margarine[J].Journal of Food Science,2014,79(9):E1732-E1738.
[37] CHENG K X,PAN Y M,HAN Z Y,et al.A sight of self -assembly mechanism in fish oil oleogels:Phase transition,crystal structure and non-covalent interaction[J].Food Chemistry,2024,433:137323.
[38] 王晓晨,杨雪,陈琼,等.大豆油基甘油二酯凝胶油的制备与表征研究[J].中国油脂,2017,42(1):60-65.WANG X C,YANG X,CHEN Q,et al.Preparation and characterization of soybean oil -based diglyceride gel oil[J].China Oils and Fats,2017,42(1):60-65.
[39] CHAI X H,MENG Z,CAO P R,et al.Comparative analysis of small-molecule diffusivity in different fat crystal network[J].Journal of Agricultural and Food Chemistry,2018,66(4):1015-1022.
[40] PATEL A R,BABAAHMADI M,LESAFFER A,et al.Rheological profiling of organogels prepared at critical gelling concentrations of natural waxes in a triacylglycerol solvent[J].Journal of Agricultural and Food Chemistry,2015,63(19):4862-4869.