绿原酸(Chlorogenic acid,CGA),是一类广泛存在于咖啡、向日葵、杜仲等植物中的水溶性酚类衍生物,包括3-O-咖啡酰奎尼酸、4-O-咖啡酰奎尼酸和5-O-咖啡酰奎尼酸在内的多种同分异构体(图1),具有抗氧化、抗菌和抗癌等多重功效,在食品、药品和化妆品等领域应用广泛[1-3]。绿原酸分子中存在5 个亲水的羟基基团(咖啡酸苯环部分的3,4 位点的2 个酚羟基和奎宁酸部分1,3,4 位点的3 个醇羟基)和1 个亲水的羧基基团,使得其水溶性较强,在油基产品中的应用受到限制[4-5]。为克服这一难题,科学家们采用分子修饰的方法为绿原酸添加长链烷基,从而获得亲脂性的绿原酸衍生物(Chlorogenic acid derivatives,CAD)[6]。
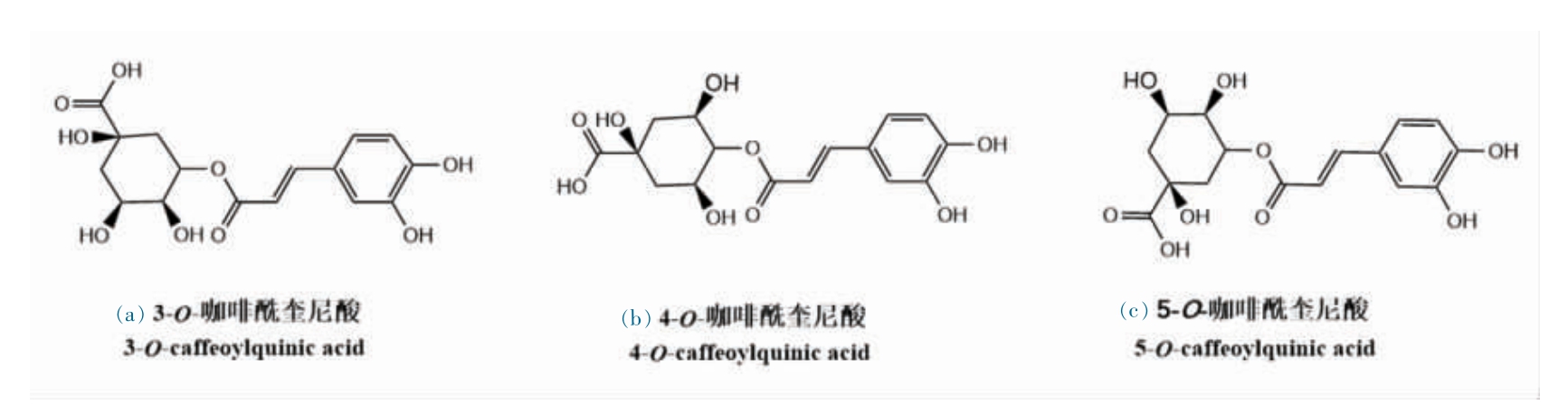
图1 绿原酸同分异构体的结构式
Fig.1 Differtent structures of chlorogenic acid isomers
绿原酸的天然衍生物存在于菊苣根等植物中,通常含量较低(4.7 mg/g dw),导致其制取成本较高,难以规模化生产[7]。目前绿原酸衍生物的制备方式主要分为化学法、生物法和酶法,其中化学合成法是目前规模化工业生产研究的主要方向。图2 整理和总结了近10 年来Web of Science 平台上绿原酸研究的相关文献。可以看出绿原酸相关研究逐年增长,在2022 年为1 800 余篇,是目前的研究热点之一。基于此,本文综述近年来绿原酸衍生物的制备方法及其活性研究进展,并对其存在的问题和发展方向进行展望,以期为绿原酸衍生物在食品、医药等相关领域的广泛应用提供参考。
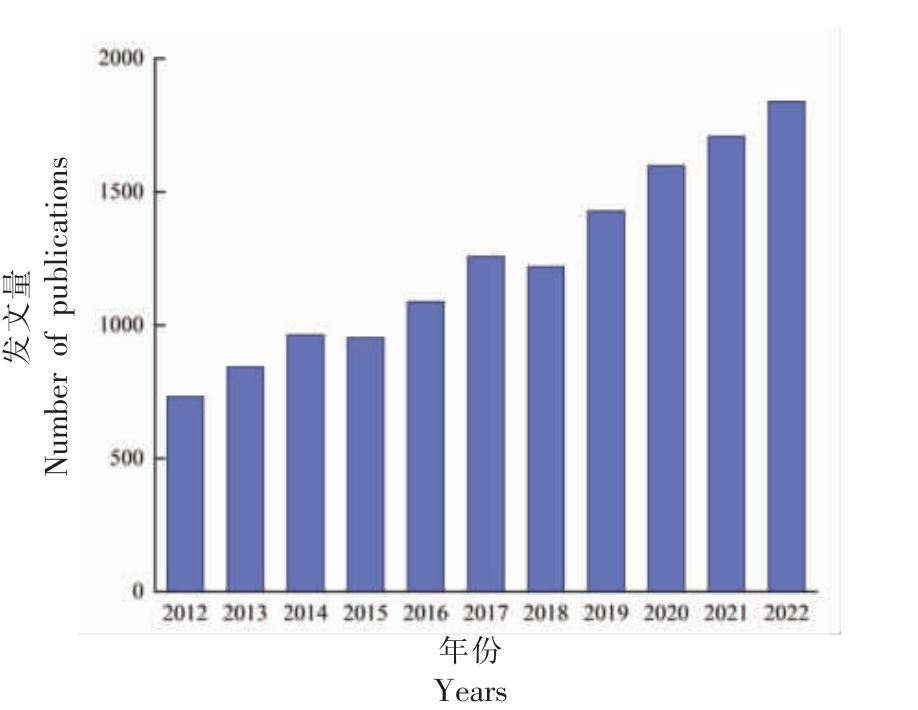
图2 近10 年绿原酸研究的发文量
Fig.2 Annual production of chlorogenic acid-related research in recent 10 years
注:数据来源于Web of Science。
1 绿原酸衍生物的制备方法
近些年来,国内外文献中绿原酸衍生物的合成方法主要以化学法与酶法为主,通常是将绿原酸分子中的羟基与脂肪酸进行酯化反应,或与脂肪酸乙烯酯等进行酯交换反应,实现绿原酸本体活性的保留与绿原酸衍生物脂溶性同步提升[8]。
1.1 化学法
化学法制备绿原酸衍生物发展较早,工艺相对成熟,然而存在高能耗、高污染、副产物多和设备腐蚀等问题。本节讨论了以酰氯法为代表的化学方法制备绿原酸衍生物的研究进展,并对其优缺点进行了评述。
1.1.1 酰氯法 酰氯法是绿原酸衍生物化学合成的主要方法之一,由Hotten 于1957 年首次提出并被其他学者广泛报道[9],图3 展示了酰氯法合成绿原酸衍生物的反应过程。例如,Xiang等[10]在2008年报道了以金银花中提取的绿原酸为原料,在35℃反应条件下将其溶解于N,N-二甲基甲酰胺后再与月桂酰氯在室温下反应4 h,最终获得收率为81.2%的绿原酸月桂酸酯。洪台[11]先将杜仲叶在微波功率为420 W 下处理12 min 后,再使用70%乙醇水溶液提取绿原酸,并将其分别与月桂酰氯、豆蔻酰氯、棕榈酰氯在三乙胺的催化作用下反应,成功制备出绿原酸癸酸酯、绿原酸月桂酸酯、绿原酸肉豆蔻酸酯、绿原酸棕榈酸酯等一系列绿原酸衍生物,其中绿原酸月桂酸酯的最高得率可达到91%;并进一步发现制备的棕榈酰绿原酸的脂溶性较绿原酸提升了22 倍以上,这主要是由于脂肪酰氯的碳链长度越长其脂溶性越强。该研究结果与Xu等[12]所报道的结果一致,表明通过癸酰氯、月桂酰氯、棕榈酰氯等长链脂肪酰氯与绿原酸的羧基发生取代反应,是提升绿原酸脂溶性的有效途径。最近Liang等[13]以三乙胺作为催化剂,采用分批添加油酰氯与CGA,在25 ℃的条件下反应20 min,CGA 的转化率即可达76.6%。与之前的研究相比,尽管有三乙胺盐酸盐等副产物导致绿原酸转化率有所降低,但该方法大幅缩短了绿原酸衍生物的制备时间,降低了反应温度,降低了绿原酸酯的制备成本。酰氯法能适用于不同链长的供体底物,其酰化能力强,并且通过工艺优化可实现较高的反应效率,被广泛应用。然而,脂肪酰氯的稳定性较差,同时反应剧烈,这增加了操作的复杂性和困难性。此外,由于酰氯反应后产生的盐酸具有较强的腐蚀性,对设备造成腐蚀损害,从而限制了酰氯法制备绿原酸衍生物的工业化发展。
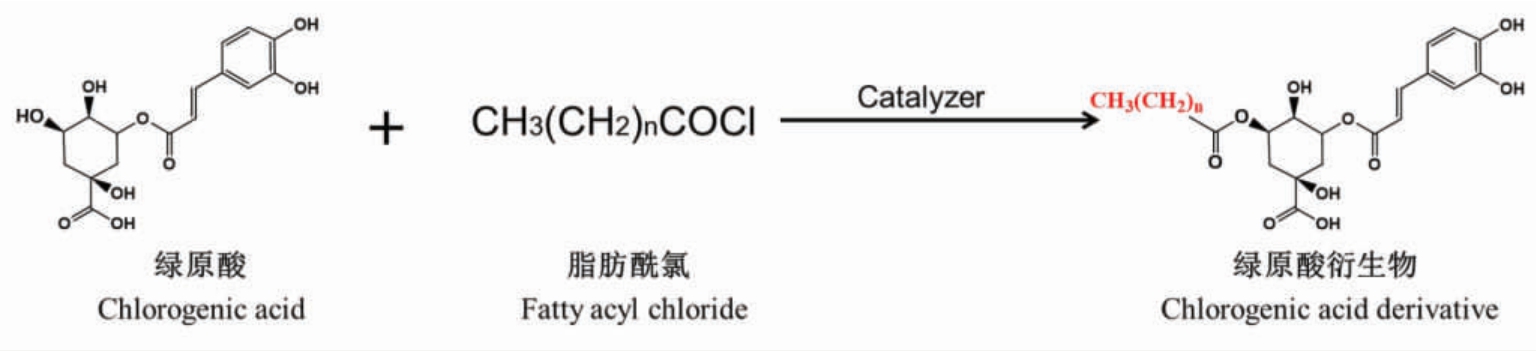
图3 酰氯法合成绿原酸衍生物的反应示意图
Fig.3 Reaction diagram of the synthesis of chlorogenic acid derivatives by acyl chloride method
1.1.2 其它方法 除酰氯法外,绿原酸衍生物的化学制备方法还包括酰化反应、缩合反应、酰胺法等多种方法,例如,姚佳欢[14]先在醋酸酐/吡啶体系中将绿原酸的5 个羟基基团全部酰化,再进行部分水解来获得特定的绿原酸衍生物(1,3,4,3'-四乙酰绿原酸,1,3,4-三乙酰绿原酸,1,3-二乙酰绿原酸,1-乙酰绿原酸),并发现羟基的位置以及酰化的程度与绿原酸衍生物的生物活性密切相关,此结果与Wang等[15]的研究也相符。Ma等[16]利用绿原酸与丙酮、3-戊酮、4-庚酮、5-壬酮、6-十一酮等一系列酮类物质,合成绿原酸缩酮衍生物,从而获得1,7-(丙酮)3,4-(丙酮)-绿原酸、1,7-(3-戊酮)3,4-(3-戊酮)-绿原酸、1,7-(4-庚酮)3,4-(4-庚酮)-绿原酸、1,7-(5-壬酮)3,4-(5-壬酮)-绿原酸、1,7-(6-十一酮)3,4-(6-十一酮)-绿原酸等长链烷基修饰的绿原酸衍生物,并且发现其中一些化合物显示出对α-葡萄糖苷酶显著的抑制活性,在降血糖药物开发方面潜力巨大。将绿原酸与胺类物质反应制备绿原酸酰胺类衍生物也是对绿原酸修饰改性的有效途径,Wang等[17]先使用奎尼酸与三甲基硅氯和石油醚制得奎尼酸硅基醚,后与丙酮和2,2-二甲氧基丙烷反应获得奎尼酸二缩丙酮,然后将其用重铬酸毗啶盐氧化后与盐酸羟氨反应,再与硼氢化钠反应制得1,3,3-氨基-3-脱氧奎尼酸,最后将其与二乙酰咖啡酰氯反应得到最终的3-咖啡酰奎尼酸酰胺,以此有效保留了绿原酸的抗氧化性并降低其毒性,在药物研发中潜力巨大。杨家强等[18]利用酰胺法将绿原酸与1-(3-二甲氨基丙基)-3-乙基碳二亚胺进行缩合反应,合成一系列绿原酸的酰胺衍生物并用柱色谱法对产物进行初步分离与纯化,通过红外光谱和核磁共振波谱鉴定了酰胺衍生物的分子结构鉴定,并且证实了其在抗肿瘤和抗氧化研究中具备与绿原酸相当的生物活性。
化学法制备绿原酸衍生物具有工艺成熟、制备高效和易于规模化生产等优势,而三乙胺等化学催化剂的使用和酸性副产物等问题易造成环境污染、设备腐蚀和安全隐患,反应生成的副产物还会造成目标产物分离纯化困难和生产成本高。因此,开发更加绿色、安全、高效的绿原酸衍生物的制备方法是未来的研究重点。
1.2 生物酶催化合成
酶法合成绿原酸衍生物是通过脂肪酶、糖酶等催化绿原酸与脂肪醇、脂肪酸等底物进行酯化反应或酯交换反应而制得,如图4 所示[19-20]。与化学法合成法相比,酶法催化制备绿原酸衍生物具有反应条件温和、专一性强、副产物少等优点,近年来已成为绿原酸衍生物的研究热点[21-24]。脂肪酶是酯酶的一个亚类,能够催化水解、醇解、酸解、酯化等一系列反应,商用时脂肪酶一般来源于青霉菌属(Penicillium sp.)、褶假丝酵母(Candida rugose)、黑曲霉菌(Aspergillus niger)、根霉属(Rhizopus sp.)、假单胞菌属(Pseudomonas sp.)等微生物[25]。表1 总结、归纳了近年来通过酯化、酯交换等酶法合成绿原酸衍生物的重要文献。
表1 酶法合成绿原酸衍生物的研究总结
Table 1 Research summary of the enzymatic synthesis of chlorogenic acid derivatives

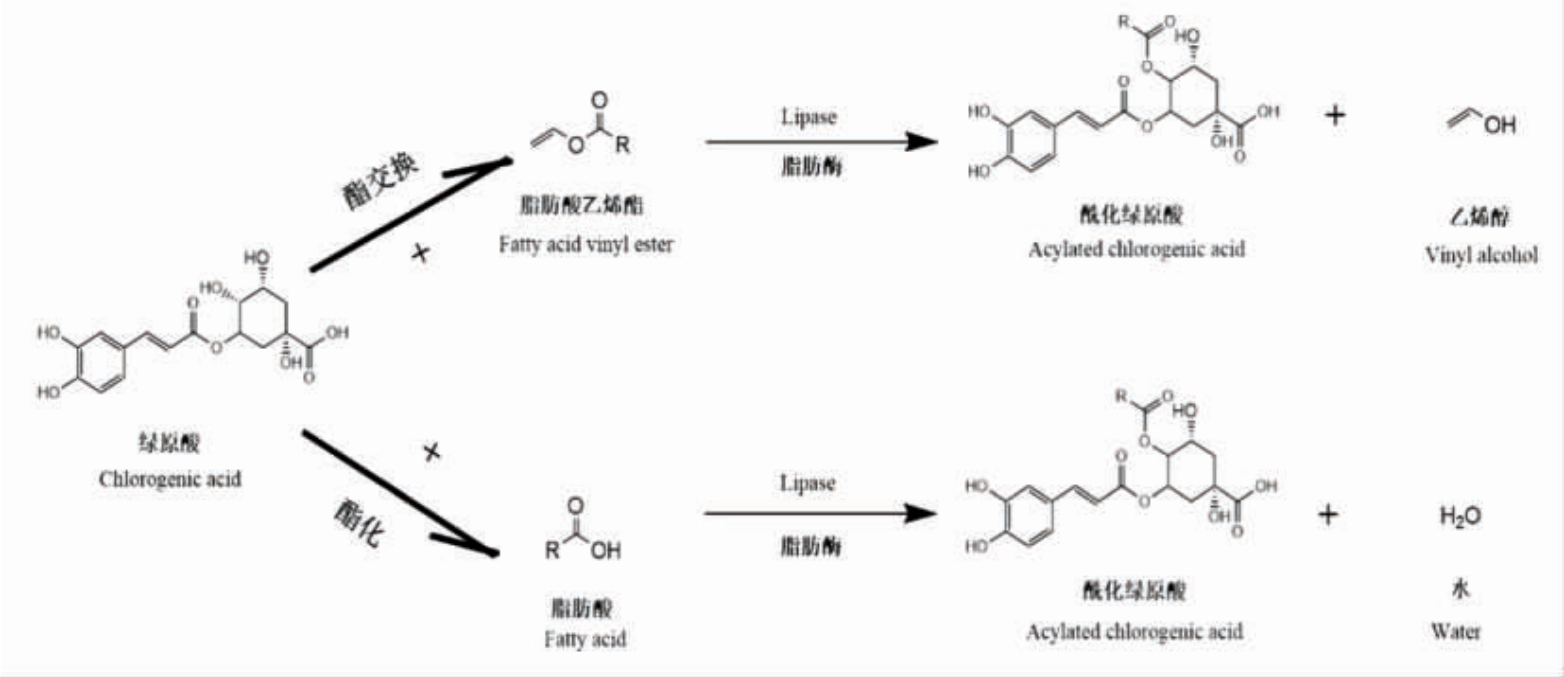
图4 脂肪酶催化合成绿原酸衍生物的反应示意图
Fig.4 Reaction diagram of the synthesis of chlorogenic acid derivatives catalyzed by lipase
1.2.1 酯化法 酶促酯化反应主要通过生物酶催化绿原酸分子中的羧基与底物(如辛醇)的羟基发生酯化反应,近年来被广泛应用于绿原酸衍生物的合成[34]。该法有效保留了绿原酸分子中的活性羟基基团,不仅可使制备的绿原酸衍生物的生物活性不受损害,还可以显著提升脂溶性[35]。
Guyot等[19]早在2000 年就报道了Novozym 435 酶催化不同链长的脂肪醇与绿原酸反应,制备了绿原酸辛酯、绿原酸月桂酯等一系列的绿原酸衍生物,并发现在叔戊醇等溶剂参与下,反应30 d 后绿原酸的转化率最高可达75%。虽然该报道中绿原酸的转化率较低,反应时间长,但对酶法合成绿原酸衍生物进行了积极的探索,为后续的绿原酸衍生物的绿色制备奠定研究基础。Hernandez等[26]以超临界CO2 作为反应溶剂并联用分子筛去除酯化反应后产生的水分,在55 ℃下反应25 h 后,实现绿原酸转化率达到85%以上。与之前的研究相比,超临界CO2 在极大程度上提高了反应效率并降低了有机溶剂的使用,为绿原酸衍生物的高效制备提供了新思路。Lorentz等[20]以廉价易得的棕榈酸为底物,通过Novozym 435 催化其与绿原酸反应7 d 后,棕榈酰绿原酸的得率达到60%以上,产物中3-O-棕榈酰绿原酸和4-O-棕榈酰绿原酸的含量与底物摩尔比有关。因此,采用酶促酯化法在绿色制备绿原酸衍生物的报道较多,然而反应时间通常都在24 h 以上,导致生产成本较高,而且有机溶剂与酶的长时间接触易导致酶活性下降和使用寿命缩短。因此,需要进一步挖掘高活性脂肪酶或开发新型酶反应装备等手段,来缩短酶促酯化法反应时间,提高绿原酸衍生物的得率[36]。
1.2.2 酯交换法 酯交换法制备绿原酸衍生物是基于绿原酸与乙酸乙烯酯等与绿原酸中的羟基发生酯交换,或先将绿原酸甲酯化再与丁醇、辛醇等脂肪醇发生酯交换,从而使绿原酸获得如长链烷基等新基团,进而提升脂溶性[37]。Giraldo等[27]先采用甲醇与绿原酸反应生成绿原酸甲酯,并进一步使用Novozym 435 酶催化其与正丁醇、正辛醇、正十二醇、正十六醇等脂肪醇发生酯交换反应,得到总产率达61%~93%的绿原酸丁酯、绿原酸辛酯、绿原酸十二烷基酯、绿原酸十六烷基酯等绿原酸衍生物。该方法可大幅缩短酶促催化反应时间并显著提升反应转化率,其原因是将绿原酸甲酯化后,可提升在脂肪醇中的溶解度,同时反应过程中持续通氮气有效带走了酯交换反应产生的水,从而提升了绿原酸丁酯、绿原酸辛酯等产物的得率。除了具有广适性的Novozym 435 酶外,Zhu等[28]报道了Lipozyme RM 催化绿原酸与脂肪酸乙烯酯进行酯交换反应,制备丁酰化绿原酸、辛酰化绿原酸、月桂酰化绿原酸等。虽然绿原酸最高转化率仅59.6%,当使用月桂酸乙烯酯作为酰基供体时,Lipozyme RM 酶能选择性地制备4-O-月桂酰绿原酸,为后续产物的分离提纯提供了便利。因此,酶促酯交换法在合成绿原酸衍生物方面表现出巨大的潜力,也是近年来学者们探索酶催化高效合成绿原酸衍生物的一个重要研究方向,然而目前还存在反应时间过长,商品化酶成本过高等不足,若要解决当下绿原酸衍生物合成中普遍低效和专一性差的难题,酯交换法合成绿原酸衍生物还有待进一步研究。
1.3 绿原酸衍生物的分离纯化
近年来,对绿原酸衍生物的研究多集中在结构鉴定方面,对分离和提纯方法的系统研究报道较少。当前,在实验室中通常是使用传统的高效液相色谱、薄层色谱、硅胶柱色谱等方法对制备的绿原酸衍生物进行分离和纯化。Giraldo等[27]以甲苯/乙酸乙酯/甲酸(5 ∶4 ∶1,V/V/V)为展开剂,通过薄层色谱法来分离所制备的绿原酸丁酯、绿原酸辛酯等烷基修饰的绿原酸酯,通过喷洒硫酸铜/磷酸(50 ∶50,V/V)后,在150 ℃下加热10 min,可以清晰地观察到绿原酸或绿原酸酯形成的斑点。Zhu等[28]在制备绿原酸衍生物的过程中,以甲基叔丁基醚作为溶剂,先在55 ℃下以蒸发的方式对产物进行浓缩,然后使用高效液相色谱法对绿原酸衍生物进行分离纯化,最后通过旋转蒸发、真空冷冻干燥来除去多余的有机溶剂,从而获得目标产物。Sun等[38]在无溶剂和无催化剂的条件下,通过化学法合成了绿原酸油醇酯,因为在最终的反应体系中存在过量的油醇,所以先通过石油醚、乙腈和水(4/3/1,V/V/V)所组成的混合溶剂对产物进行萃取,然后使用甲苯/异丙醇(6/1,V/V)作为洗脱剂在硅胶柱中进行分离,最后将收集到的洗脱液进行旋转蒸发和冷冻干燥,可以获得纯度高达98.7%的绿原酸油醇酯。赵泉[8]以制备的产率为97.6%的绿原酸乙酯为原料,通过旋蒸除去底物乙醇、乙酸乙酯,萃取、旋蒸和真空干燥等手段获得纯度为93.8%的绿原酸乙酯。与之前的研究相比,该方法实现了绿原酸衍生物的高效分离纯化,然而此法对转化率要求也较高,因此也限制了其适用的范围。
在文献报道中,绿原酸衍生物的分离纯化主要以溶剂萃取法和色谱法为主,然而存在得率低,提取时间长,溶剂损耗大,溶剂易残留等问题。此外,绿原酸衍生物种类繁多、结构相似、性质接近,当前的纯化方法难以实现目标绿原酸衍生物的定向纯化和高效富集。因此,未来绿原酸衍生物的富集精制研究应满足以下要求:1)简化分离纯化步骤,缩短操作时间;2)减少有毒有害溶剂的使用,降低能耗和污染排放,促进清洁生产。为了实现这一目标,可采用超声、微波等物理场辅助萃取,可有效缩短萃取时间,降低能耗;联用分子蒸馏、亚/超临界流体萃取等多种分离纯化技术,这些技术具有提取纯度高、无溶剂残留、无污染等优势,而且工艺简单、分离范围广,只需控制压力和温度等参数即可提取混合物中目标产物,从而提升绿原酸衍生物的纯度和得率,并减少有机溶剂使用,为绿原酸衍生物的分离纯化提供了新的策略。因此,如何减少对有效成分的破坏并高效提取目标产物,是未来绿原酸衍生物富集精制的重要发展方向。
2 绿原酸衍生物的生物活性
天然存在的绿原酸衍生物与绿原酸本体的生物活性相似[39],具有抗氧化、抗菌、抗肿瘤和调节代谢等功效。然而,人工合成的绿原酸衍生物因部分活性基团如酚羟基被取代,其体外活性较绿原酸本体有所下降[15],表2 总结了近年来绿原酸衍生物活性研究的相关文献。
表2 绿原酸衍生物的生物活性研究
Table 2 Study on the biological activity of chlorogenic acid derivatives

2.1 抗氧化活性
绿原酸衍生物的酚羟基基团可提供电子或氢原子来猝灭活性氧自由基,发挥其抗氧化能力[48],当前绿原酸衍生物的抗氧化评价方法以清除自由基的试验方法为主。Wang等[15]用不同碳链长度的乙烯基脂肪酸酯对绿原酸进行酰化,获得了乙酰化绿原酸、丁酰化绿原酸等5 种不同亲脂性的绿原酸衍生物,对其开展了1,1-二苯基-2-三硝基苯肼(DPPH)和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)自由基清除试验以及铁离子还原能力的检测,发现人工合成的绿原酸衍生物抗氧化能力均弱于绿原酸本体,尤其是乙酰化绿原酸的表现最差,其半数抑制浓度(IC50)在2 种试验中分别为110.8 μmol/L 和53.2 μmol/L,是绿原酸的2.4 倍和1.2 倍,然而在后续的细胞培养过程中亲脂性更强的中长链酰化绿原酸表现出比绿原酸更好的抗氧化能力,在CAA(Cytotoxic T-cell adherence assay)试验中,月桂酰绿原酸的CAA 单位>85,其半数有效剂量(EC50)为9.4 μg/mL,而绿原酸EC50 为29.1 μg/mL,有着最好的抗氧化效果。此研究对绿原酸分子中的1 个羟基位点进行了取代,造成绿原酸衍生物抗氧化能力的下降;在增加修饰基团的链长时,绿原酸衍生物的亲脂性优势在生物体中逐渐显现并弥补了一个羟基的损失[6]。Xu等[12]使用链长相同而不饱和度递增的脂肪酸(硬脂酸、油酸、亚油酸和亚麻酸)与绿原酸进行酯化反应,获得了以绿原酸单酯为主的衍生物,在DPPH 自由基清除试验中以mmol/L TE/mmol/L sample(TE 为三氯氧磷当量,Trolox equivalent)作为评估抗氧化能力的单位,绿原酸硬脂酸酯、绿原酸油酸酯、绿原酸亚油酸酯和绿原酸亚麻酸酯分别达到1.25,1.29,1.28,0.91 mmol/L TE/mmol/L sample,与绿原酸(1.36 mmol/L TE/mmol/L sample)相比有所下降,然而仍表现出较高水平的抗氧化活性,说明通过与绿原酸分子中羟基基团反应而进行修饰,可以在极大程度保留绿原酸抗氧化活性的前提下,获得亲脂性提高的绿原酸衍生物。
经过分子修饰后获得的绿原酸衍生物虽然抗氧化活性较绿原酸本体有所下降,但新增的亲脂性基团使其脂溶性大幅提升,有望在食用油、饲料等产品中提升应用效果。当前,绿原酸衍生物的生物活性研究以体外试验为主,未来应该加强绿原酸衍生物在生物体内抗氧化活性的研究,特别是在动物模型和人体试验中进行深入探究。
2.2 抗肿瘤与抗真菌活性
绿原酸能激活肿瘤免疫反应诱导炎症部位的中性粒细胞凋亡或反向迁移、特异性清除线粒体中异常升高的活性氧等形式发挥抗肿瘤功效[49-51]。基于绿原酸本体良好的抗肿瘤效果,张希等[40]制备了10 种不同类型的绿原酸酰胺类衍生物,发现绿原酸衍生物对HeLa 细胞的抑制率最高可达97.1%,对HCT-8 癌细胞的抑制率最高达92.5%,其效果要显著优于市场上常见的非特异性抗肿瘤药物顺铂(抑制率23.1%)。Suárez-Quiroz等[52]报道了亲脂性修饰后的绿原酸酯能够显著抑制曲霉生长,使用微量稀释法和最低抑菌浓度(MIC50 和MIC80)研究抗真菌作用,结果表明绿原酸辛酯的MIC50≤0.5~0.7 mg/mL,MIC80=1.0~1.5 mg/mL,绿原酸十二烷酯的MIC50≤0.7~1.2 mg/mL,MIC80=1.5 mg/mL,在实际培养过程中,绿原酸辛酯和十二烷酯对曲霉的抑制率最高分别可达到92.7%和83.7%,表明绿原酸酯是一种非常有效的抗真菌药剂。另外绿原酸衍生物具备抗真菌能力,这与Ma等[53]提出的绿原酸衍生物可降低真菌体内的β-1,3-葡聚糖酶活的观点相符。然而,绿原酸衍生物在生物体内的调控机制以及构效、量效关系却还有待进一步解析,绿原酸衍生物的生物学功能也有待进一步探明。
2.3 其它生物活性
除上述提及的抗氧化、抗真菌、抗肿瘤等生物活性外,田瑜等[42]还发现制备的绿原酸酰胺二聚体具有调节脂质代谢的功能,在细胞试验结束后使用油红O 染色,测定波长358 nm 下的吸光值(A)评估脂质堆积的情况,发现脂质堆积模型的吸光值为0.254,吸光值下降越多表明调节脂质代谢的能力越强,虽然与对照药辛伐他汀(A=0.239)相比还有一定差距,但绿原酸衍生物2 d(A=0.244)的抗脂质代谢紊乱作用要优于绿原酸本体(A=0.250)。与此同时,Wang等[43]发现乙酰化绿原酸、丁酰化绿原酸、辛酰化绿原酸等5 种绿原酸酰化衍生物均表现出降低α-淀粉酶和α-葡萄糖苷酶活性的效果,尤其是4-O-月桂酰绿原酸对α-淀粉酶和α-葡萄糖苷酶活性抑制的IC50 值分别为13.3 μmol/mL 和3.4 μmol/mL,而绿原酸为29.9 μmol/mL 和12.8 μmol/mL,阿卡波糖为17.5 μmol/mL 和9.4 μmol/mL,与之相比,4-O-月桂酰绿原酸在更低的浓度即可达到同等的抑制效果,表明有着比它们更高的抑制α-淀粉酶和α-葡萄糖苷酶的生物活性,同时也证实了绿原酸酰化衍生物具有降血糖的功能潜力。
因此,通过酶法定向修饰所制备的绿原酸衍生物不仅具备天然多酚常见的抗氧化、抗菌等生物活性,还比前体绿原酸和市场上常见的药物表现出更好的效果,在食品、医药、化妆品等领域都有着非常重要的研究意义和广阔的应用前景。基于绿原酸衍生物的抗氧化特性,其有望作为重要的食品添加剂应用于食用油、奶粉等食品中,为产品提供抗氧化保护,延长产品的保质期和货架期,其调节血脂和抗肿瘤等功效也拓宽了绿原酸衍生物在开发安全、高效且成本低廉的新型降血糖药物或抗癌药的潜能。此外,绿原酸的抗菌和消炎特性也为其在化妆品、保健品等领域的应用奠定了基础。然而,绿原酸衍生物仍存在结构物化特征不清,营养健康机制不明,安全评价不足等问题,这也是限制其应用的重要原因。因此,未来的研究还需要进一步建立绿原酸衍生物潜在生物风险的评估方法,实现全链条安全评估及风险评价,在此基础上,制定和完善产品标准和法律法规,为绿原酸衍生物的产业化应用奠定基础。
3 总结与展望
综上所述,绿原酸衍生物的化学法制备工艺日趋完善,酶法合成也表现出巨大的发展潜力,多样且高效的生物活性更是展现出广阔的应用前景,已成为当下的一个研究热点。然而,现阶段对于绿原酸衍生物的制备以及功能活性研究主要还有以下几方面的问题亟待解决。
1)绿原酸衍生物的高效制备体系还有待完善。虽然有研究者报道通过化学法高效制备出了绿原酸衍生物,但容易造成污染且副产物过多,而更加绿色、安全的酶法制备所需的反应时间一般较长,因此挖掘高活性脂肪酶和开发新型高效的酶反应体系是未来突破绿原酸衍生物制备的重要方向。
2)当前绿原酸衍生物分离与纯化方法以溶剂萃取法和色谱法为主,存在得率低,提取时间长,溶剂损耗大,溶剂易残留等问题。基于这些瓶颈难题,构建绿原酸衍生物的定向纯化和高效富集方法,减少对有效成分的破坏并高效提取目标产物也是绿原酸衍生物的研究重点。
3)亟待深入研究绿原酸衍生物的物化性质及其在机体内的活性作用机制。现阶段绿原酸衍生物的生物活性研究较少,仍存在结构物化特征不清,营养健康机制不明,安全评价不足等问题,这也是限制其应用的重要原因。因此,未来的研究仍需建立绿原酸衍生物潜在生物风险的评估方法,实现全链条安全评估及风险评价,在此基础上,制定和完善产品标准和法律法规,为绿原酸衍生物在食品、医药、化妆品等领域产业化应用奠定基础。
[1] LI J,WANG S P,WANG Y Q,et al.Comparative metabolism study on chlorogenic acid,cryptochlorogenic acid and neochlorogenic acid using UHPLCQ-TOF MS coupled with network pharmacology[J].Chin J Nat Med,2021,19(3):212-224.
[2] MATSUDA R,SAKAGAMI H,AMANO S,et al.Inhibition of neurotoxicity/anticancer activity of bortezomib by caffeic acid and chlorogenic acid[J].Anticancer Res,2022,42(2):781-790.
[3] NGUYEN QUOC T,VO THI KIM H,LE VAN T,et al.Extraction of cynarin and chlorogenic acid from artichoke leaves(Cynara scolymus L.)and evaluation of antioxidant activity,antibacterial activity of extract[J].Vietnam Journal of Chemistry,2022,60(5):571-577.
[4] SHARMA N,SONI R,SHARMA M,et al.Correction:Chlorogenic acid:A polyphenol from coffee rendered neuroprotection against rotenone -induced parkinson's disease by GLP-1 secretion[J].Mol Neurobiol,2022,59(12):7544.
[5] WIANOWSKA D,GIL M.Recent advances in extraction and analysis procedures of natural chlorogenic acids[J].Phytochemistry Reviews,2019,18(1):273-302.
[6] 王闪.酶法合成绿原酸酰化衍生物及其抗氧化和α-淀粉酶/葡萄糖苷酶抑制活性研究[D].无锡:江南大学,2021.WANG S.Study on antioxidant and α-amylase/glucosidase inhibition properties of ca acylated derivatives synthetized by enzyme[D].Wuxi:Jiangnan University,2021.
[7] CHADNI M,ISIDORE E,DIEMER E,et al.Optimization of extraction conditions to improve chlorogenic acid content and antioxidant activity of extracts from forced witloof chicory roots[J].Foods,2022,11(9):1217.
[8] 赵泉.绿原酸烷基酯的制备与分离纯化[D].郑州:河南工业大学,2022.ZHAO Q.Preparation and purification of chlorogenic acid alkyl ester[D].Zhengzhou:Henan University of Technology,2022.
[9] 李程志,何懿峰.酰胺类润滑脂研究进展[J].石油炼制与化工,2021,52(8):122-128.LI C Z,HE Y F.Research progress of amide grease[J].Petroleum Processing and Petrochemicals,2021,52(8):122-128.
[10] XIANG Z N,NING Z X.Scavenging and antioxidant properties of compound derived from chlorogenic acid in South-China honeysuckle[J].LWT -Food Science and Technology,2008,41(7):1189-1203.
[11] 洪台.杜仲叶绿原酸的分离纯化及其分子修饰研究[D].杭州:浙江工业大学,2012.HONG T.Study on separation and purification of chlorogenic acid in Eucommia ulmoides leaf and its molecular modification[D].Hangzhou:Zhejiang University of Technology,2012.
[12] XU Y,ZHANG J,PAN T,et al.Synthesis,characterization and effect of alkyl chain unsaturation on the antioxidant activities of chlorogenic acid derivatives[J].LWT-Food Science and Technology,2022,162:113325.
[13] LIANG S H,ZHAO Q,WEI X Z,et al.Highly efficient synthesis of chlorogenic oleate using acyl chloride method[J].Lwt-Food Science and Technology,2022,154:112817.
[14] 姚佳欢.绿原酸不同位置不同程度乙酰化物的制备及其生物活性研究[D].呼和浩特:内蒙古大学,2016.YAO J H.Synthesis and bioactivity investigation of chlorogenic acid derivatives with different acetylation degrees at different positions[D].Hohhot:Inner Mongolia University,2016.
[15] WANG S,LI Y,MENG X Y,et al.Antioxidant activities of chlorogenic acid derivatives with different acyl donor chain lengths and their stabilities during in vitro simulated gastrointestinal digestion[J].Food Chemistry,2021,357:129904.
[16] MA C M,HATTORI M,DANESHTALAB M,et al.Chlorogenic acid derivatives with alkyl chains of different lengths and orientations:Potent alpha-glucosidase inhibitors[J].J Med Chem,2008,51(19):6188-6194.
[17] WANG L N,WANG W,HATTORI M,et al.Synthesis,anti-HCV,antioxidant and reduction of intracellular reactive oxygen species generation of a chlorogenic acid analogue with an amide bond replacing the ester bond[J].Molecules,2016,21(6):737.
[18] 杨家强,曾发奎,黎刚,等.新型绿原酸酰胺衍生物的合成与生物活性评价[J].中国药学杂志,2016,51(4):264-268.YANG J Q,ZENG F K,LI G,et al.Synthesis and bioactivity evaluation of novel chlorogenic acid derivatives containing amide group[J].Chinese Pharmaceutical Journal,2016,51(4):264-268.
[19] GUYOT B,GUEULE D,PINA M,et al.Enzymatic synthesis of fatty esters in 5-caffeoyl quinic acid[J].European Journal of Lipid Science and Technology,2000,102(2):93-96.
[20] LORENTZ C,DULAC A,PENCREAC'H G,et al.Lipase-catalyzed synthesis of two new antioxidants:4 -O -and 3 -O -palmitoyl chlorogenic acids [J].Biotechnol Lett,2010,32(12):1955-1960.
[21] TETIANEC L,BRATKOVSKAJA I,CASAITE V,et al.Efficient Bi-enzymatic synthesis of aldonic acids[J].Green Chemistry,2022,24(12):4902-4908.
[22] GRITSCH S M,MIHALYI S,BARTL A,et al.Closing the cycle:Enzymatic recovery of high purity glucose and polyester from textile blends[J].Resources Conservation and Recycling,2023,188:106701.
[23] LIN L,LEDESMA-AMARO R,JI X J,et al.Multienzymatic synthesis of nylon monomers from vegetable oils[J].Trends Biotechnol,2023,41(2):150-153.
[24] MORENA A G,BASSEGODA A,NATAN M,et al.Antibacterial properties and mechanisms of action of sonoenzymatically synthesized lignin -based nanoparticles[J].ACS Appl Mater Interfaces,2022,14(33):37270-37279.
[25] ALI S,KHAN S A,HAMAYUN M,et al.The recent advances in the utility of microbial lipases:A review[J].Microorganisms,2023,11(2):510.
[26] HERNANDEZ C E,CHEN H H,CHANG C I,et al.Direct lipase-catalyzed lipophilization of chlorogenic acid from coffee pulp in supercritical carbon dioxide[J].Industrial Crops and Products,2009,30(3):359-365.
[27] GIRALDO L J L,LAGUERRE M,LECOMTE J,et al.Lipase-catalyzed synthesis of chlorogenate fatty esters in solvent-free medium[J].Enzyme and Microbial Technology,2007,41(6/7):721-726.
[28] ZHU S,WANG S,CHEN S W,et al.Lipase-catalyzed highly regioselective synthesis of acylated chlorogenic acid [J].Food Bioscience,2020,37:100706.
[29] NAM S H,KO J A,JUN W J,et al.Enzymatic synthesis of chlorogenic acid glucoside using dextransucrase and its physical and functional properties[J].Enzyme Microb Technol,2017,107:15-21.
[30] KUMAR G,SMITH P J,PAYNE G F.Enzymatic grafting of a natural product onto chitosan to confer water solubility under basic conditions[J].Biotechnol Bioeng,1999,63(2):154-165.
[31] KLINGEL T,BINDEREIF B,HADAMJETZ M,et al.Enzymatic synthesis and characterization of mono-,oligo-,and polyglucosylated conjugates of caffeic acid and gallic acid[J].J Agric Food Chem,2019,67(47):13108-13118.
[32] KISHIMOTO N,KAKINO Y,IWAI K,et al.Chlorogenate hydrolase -catalyzed synthesis of hydroxycinnamic acid ester derivatives by transesterification,substitution of bromine,and condensation reactions[J].Appl Microbiol Biotechnol,2005,68(2):198-202.
[33] KURATA A,TAKEMOTO S,FUJITA T,et al.Synthesis of 3-cyclohexylpropyl caffeate from 5-caffeoylquinic acid with consecutive enzymatic conversions in ionic liquid[J].Journal of Molecular Catalysis B:Enzymatic,2011,69(3/4):161-167.
[34] GAMAYUROVA V S,ZINOV'EVA M E,SHNAIDER K L,et al.Lipases in esterification reactions:A review[J].Catalysis in Industry,2021,13(1):58-72.
[35] MIAO M S,XIANG L L.Pharmacological action and potential targets of chlorogenic acid [J].Adv Pharmacol,2020,87:71-88.
[36] XU L J,ZHANG Y,ZIVKOVIC V,et al.Deacidification of high-acid rice bran oil by the tandem continuous-flow enzymatic reactors[J].Food Chemistry,2022,393(1):133440.
[37] WANG S,LI Y,MA C Y,et al.Enzymatic molecular modification of water-soluble polyphenols:Synthesis,structure,bioactivity and application[J].Critical Reviews in Food Science and Nutrition,2022,63(33):12637-12651.
[38] SUN C,LIU H,CHEN Y R,et al.Highly efficient synthesis of chlorogenic acid oleyl alcohol ester under non-catalytic and solvent-free conditions[J].Molecules,2023,28(9):3948.
[39] MOHAMED ISA S S P,ABLAT A,MOHAMAD J.The antioxidant and xanthine oxidase inhibitory activity of plumeria rubra flowers[J].Molecules,2018,23(2):400.
[40] 张希,许旭东,田瑜,等 绿原酸衍生物的合成及体外抗肿瘤活性研究[J].中草药,2020,51(4):937-942.ZHANG X,XU X D,TIAN Y,et al.Synthesis and in vitro antitumor activity evaluation of chlorogenic acid derivatives[J].Chinese Traditional and Herbal Drugs,2020,51(4):937-942.
[41] MA C M,KULLY M,KHAN J K,et al.Synthesis of chlorogenic acid derivatives with promising antifungal activity[J].Bioorg Med Chem,2007,15(21):6830-6833.
[42] 田瑜,王文倩,李永胜,等.绿原酸酰胺二聚体的合成及体外抗脂质代谢紊乱活性研究[J].现代药物与临床,2015,30(5):487-491.TIAN Y,WANG W Q,LI Y S,et al.Synthesis of chlorogenic acid amide dimers and their anti-lipid metabolic disorder activities in vitro[J].Drugs &Clinic,2015,30(5):487-491.
[43] WANG S,LI Y,HUANG D J,et al.The inhibitory mechanism of chlorogenic acid and its acylated derivatives on alpha-amylase and alpha-glucosidase[J].Food Chem,2022,372:131334.
[44] HEMMERLE H,BURGER H J,BELOW P,et al.Chlorogenic acid and synthetic chlorogenic acid derivatives:Novel inhibitors of hepatic glucose-6-phosphate translocase[J].J Med Chem,1997,40(2):137-145.
[45] KATARIA R,KHATKAR A.In-silico design,synthesis,ADMET studies and biological evaluation of novel derivatives of Chlorogenic acid against Urease protein and H.Pylori bacterium [J].BMC Chem,2019,13(1):41.
[46] ALSON S G,JANSEN O,CIECKIEWICZ E,et al.In-vitro and in-vivo antimalarial activity of caffeic acid and some of its derivatives[J].J Pharm Pharmacol,2018,70(10):1349-1356.
[47] JO H,ZHOU Y Y,VIJI M,et al.Synthesis,biological evaluation,and metabolic stability of chlorogenic acid derivatives possessing thiazole as potent inhibitors of alpha-MSH-stimulated melanogenesis[J].Bioorg Med Chem Lett,2017,27(21):4854-4857.
[48] 杨剀舟.绿原酸抗氧化活性及其自协同抗氧化机理研究[D].北京:中国农业大学,2016.YANG K Z.Antioxidant activity of chlorogenic acids and homologous chlorogenic acids for the search for the synergistic antioxidant mechanism[D].Beijing:China Agricultural University,2016.
[49] WANG Q H,ZHANG Q Y,ZHANG Z H,et al.Characterization of chlorogenic acid as a two-photon fluorogenic probe that regulates glycolysis in tumor cells under hypoxia[J].Journal of Medicinal Chemistry,2023,66(4):2498-2505.
[50] ZHANG W H,PIAO L H,LIU X D.Chlorogenic acid suppresses neutrophil recruitment to tumors by inducing apoptosis and reverse migration[J].Journal of Functional Foods,2020,75:104216.
[51] YE J,GAO Y,JI M,et al.Oral SMEDDS promotes lymphatic transport and mesenteric lymph nodes target of chlorogenic acid for effective T-cell antitumor immunity[J].J Immunother Cancer,2021,9(7):e002753
[52] SUÁREZ -QUIROZ M L,ALONSO CAMPOS A,VALERIO ALFARO G,et al.Anti-Aspergillus activity of green coffee 5-O-caffeoyl quinic acid and its alkyl esters[J].Microb Pathog,2013,61/62:51-56.
[53] MA C M,ABE T,KOMIYAMA T,et al.Synthesis,anti-fungal and 1,3-beta-D-glucan synthase inhibitory activities of caffeic and quinic acid derivatives[J].Bioorg Med Chem,2010,18(19):7009-7014.