非酒精性脂肪肝(Nonalcoholic fatty liver disease,NAFLD)是一种无过量饮酒史的肝实质细胞脂肪贮积和变性的病理综合征,主要是因现代人营养摄入过量且生活方式不良而导致的慢性肝病[1]。在欧美发达国家,NAFLD 是最主要的慢性肝病,发病率高达20%~30%;在我国慢性肝病中发病率仅次于病毒性肝炎,且呈现出逐年上升趋势[2]。目前治疗药物主要有噻唑烷二酮类药物(胰岛素增敏剂)、熊去氧胆酸(抗氧化剂),这些药物副作用大,会造成机体紊乱,增加肝脏负担和肝毒性[3]。
白藜芦醇(Resveratrol,Res;3,4,5-三羟基二苯乙烯)是存在于植物中的一种非黄酮类多酚化合物,具有抗肿瘤,抗氧化,肝脏保护和抗菌等多种生物活性,被广泛用于保健品和食品添加剂[4]。抗氧化应激是白藜芦醇改善NAFLD 的重要机制,白藜芦醇通过提高肝细胞内单磷酸腺苷(AMP)依赖的蛋白激酶磷酸化水平改善糖代谢途径,进而提高机体的胰岛素敏感性,同时间接抑制脂质合成途径,改善肝组织的脂质沉积[5]。然而,白藜芦醇难溶于水,导致其生物利用率低,极大地降低了它在体内的活性。目前主要通过聚合物颗粒、交联壳聚糖、脂质体、纳米胶囊等技术包埋白藜芦醇,以提高其生物利用率[6-7]。溶菌酶(Lysozme,Lys)是一类广泛存在于自然界,具有抗菌、抗炎等功能的蛋白酶。从蛋清中分离出的溶菌酶具有良好的生物相容性和药物缓释特性,易于吸收,毒副作用小,是优良的纳米载体来源。本研究对蛋源溶菌酶纳米颗粒修饰后装载白藜芦醇,提高白藜芦醇在水溶液中的溶解度和稳定性,然后,采用体外消化模型和SD 大鼠、C57BL/6J 小鼠模型研究白藜芦醇在胃肠道的稳定性、释放、生物利用率以及对非酒精性脂肪肝的干预作用。
1 材料与方法
1.1 材料与试剂
溶菌酶(Lysozme,Lys)、白藜芦醇、谷氨酰胺转氨酶(Glutamine transaminase)、二甲基亚砜、尼罗红、胃蛋白酶、胰酶、β-葡萄糖醛酸酶、胰岛素、葡萄糖,美国Sigma 公司;Bacillus licheniformis proteinase(BLP)蛋白水解酶,丹麦Novozymes 公司;SD 大鼠、C57BL/6J 小鼠,北京维通利华公司;60%高脂饲料,Research Diet 公司;甘油三酯测定试剂盒、总超氧化物歧化酶测试盒、丙二醛测定试剂盒、游离脂肪酸测定试剂盒,南京建成公司;其它试剂均为分析纯,购自北京国药集团。
1.2 仪器
Spectra Max M5 多功能酶标仪,美国Molecular Devices 公司;Nano-ZS 粒度仪,英国马尔文仪器公司;JEM-1400 透射电子显微镜(Transmission Electron Microscope,TEM),日本日立公司;LC-20AT 液相色谱仪(High Performance Liquid Chromatography,HPLC),日本岛津公司;5500Q 质谱仪(Mass spectrometry,MS),美国AB SCIEX公司;血糖仪,德国ROCHE 公司。
1.3 溶菌酶纳米颗粒制备及表征
1.3.1 溶菌酶纳米颗粒制备
1)溶菌酶纳米颗粒制备:25 mg 溶菌酶溶于40 mL PBS 缓冲液,混匀后加入10 μL BLP 酶,经50 ℃水浴30 min 可得溶菌酶纳米颗粒溶液(Lys)。待溶液降为室温后,加入300 μL 白藜芦醇(5 mg/mL)溶液于4 ℃过夜孵育后即可得到包埋白藜芦醇的溶菌酶纳米颗粒(Lys-Res)。
2)谷氨酰胺转氨酶交联溶菌酶纳米颗粒(TG-Lys)制备:将0.75 mg 的谷氨酰胺转氨酶加入5 mL 3 mg/mL 的溶菌酶纳米颗粒溶液中并混匀10 min。混合溶液于37 ℃水浴120 min,离心后弃去上清,向沉淀中加入适量超纯水振荡后离心,去除多余的谷氨酰胺转氨酶。
3)包埋白藜芦醇的交联溶菌酶纳米颗粒(TG-Lys-Res)的制备:与Lys-Res 制备方法相同,将制备好的40 mL 的TG-Lys 胶束与300 μL 白藜芦醇溶液过夜孵育,振荡离心后冻干以备试验分析。
1.3.2 溶菌酶纳米颗粒的临界胶束浓度 参考Mabrouk 等[8]的方法稍作修改。将溶菌酶用PBS 按照一定浓度梯度稀释,将质量浓度为1.0 mg/mL 的尼罗红/DMSO 溶液加入溶菌酶溶液中,使溶菌酶最终质量浓度为2×10-4 mg/mL(6×10-7 mol/L),垂直混合器旋转30 min。经0.22 μm 聚醚砜针头式过滤膜过滤,用荧光酶标仪测定荧光强度(λex=557 nm,λem=601 nm);将测出的荧光强度相对载体材料质量浓度的对数作图。
1.3.3 溶菌酶纳米颗粒的粒径、zeta 电位及复溶状态分 别配制1 mg/mL 的Lys、Lys-Res、TGLys、TG-Lys-Res 溶液,在日光条件下拍照。将4种样品分别置于测量皿中用马尔文粒径仪分别测定样品的粒径和zeta 电位,测试温度为25 ℃,平衡时间为120 s,每个样品测量6 次。
1.3.4 溶菌酶纳米颗粒的形貌表征 取10 μL 的样品滴加在铜网上孵育90 s 后,用滤纸吸去液体。滴加10 μL 超纯水,30 s 后吸去液体。再加入10 μL 的3%醋酸双氧铀染料,60 s 后用吸去液体,采用TEM 对样品中溶菌酶纳米颗粒分布及形态进行观察[9]。
1.4 白藜芦醇的测定
1.4.1 样品前处理 参考Das 等的方法[10]略作修改:3 mg 冻干样品溶于6 mL 含有蛋白水解酶(体积分数2%)的PBS/甲醇(体积比1 ∶1)溶液中,超声30 min 后于4 ℃孵育24 h,样品在3 500 r/min条件下离心15 min。取上清液,经0.22 μm 过滤膜过滤后上机分析。
1.4.2 色谱条件 白藜芦醇含量通过高效液相色谱仪测定[11]。色谱柱为C18 柱(HSS T3,100 mm×2.1 mm,美国AB SCIEX 公司)。采用超纯水(A)和甲醇(B)为洗脱液,流速为1.0 mL/min,柱温25 ℃,测定波长为306 nm,进样量为10 μL。根据标准曲线计算白藜芦醇含量,再根据公式计算其在溶菌酶纳米颗粒中的载药量。
式中:mR 为微球中所含的药量,mg;MC 为微球的总质量,mg。
1.5 溶菌酶纳米颗粒的体外释放特性及消化性
1.5.1 人工胃、肠液的配制 参考岳春华等[12]的方法略作修改。人工胃液:将1.00 g 胃蛋白酶溶于80 mL Tris-HCl 溶液,用HCl 调节pH 值为1.2 后定容至100 mL。人工肠液:称取0.68 g 磷酸氢二钾溶于50 mL 水中,用0.4 mol/L 氢氧化钠溶液调pH 值至6.8,加入1.00 g 胰酶混匀,定容至100 mL。
1.5.2 溶菌酶纳米颗粒在胃肠液中白藜芦醇的释放率 配置1 mg/mL 白藜芦醇标准品溶液,分别加入人工胃、肠液中,使白藜芦醇最终质量浓度依次为1,5,10,20,30,40,50,60,70,80,90,100 μg/mL 的白藜芦醇溶液并测定其含量,获得消化液中白藜芦醇标品的标准曲线。将30 mg 包埋白藜芦醇的溶菌酶纳米颗粒冻干粉溶于3 mL 人工胃、肠液中,置于小离心管中并用3 500 u 透析袋封口,倒置于装有10 mL 人工胃肠液的大离心管中。分别在15,30,45,60 min 时从大离心管中吸取300 μL 透析液,同时补回等量的人工胃肠液。根据标准曲线计算白藜芦醇的释放率[13]。
1.6 白藜芦醇的生物利用率测定
参考李秀平等的方法[14]略作修改。SD 大鼠禁食过夜,将包埋和未包埋的白藜芦醇(分别为包埋组和游离组)以20 mg/kg 剂量灌胃,灌胃后分别在0.5,1,2,4,8,12,24,48 h 采血200 μL;将血样静置2 h 后在3 000 r/min 离心15 min 获得血清,每250 μL 血清加100 μL 的β-葡萄糖醛酸酶于37 ℃过夜孵育,液相色谱法检测血清中白藜芦醇的浓度,再根据公式计算出绝对生物利用度(FAbs)。
绝对生物利用度(%)=AUC总/(V总×C)×100
式中:AUC总为白藜芦醇自灌胃起所有时间的药时曲线下面积,mg/mL·min;V总为白藜芦醇灌胃的总体积,mL;C 为白藜芦醇的质量浓度,mg/mL。
1.7 包埋后的白藜芦醇对NAFLD 小鼠的影响
将60 只健康7 周龄雄性C57BL/6J 小鼠适应性饲养1 周后,随机分为4 组,分别为对照组,模型组,白藜芦醇包埋组,白藜芦醇游离组。对照组饲养普通饲料,其余各组连续饲喂6 周的高脂饲料建立NAFLD 小鼠模型[15-16]。待NAFLD 模型构建成功后,将包埋和游离的白藜芦醇以最终白藜芦醇200 mg/(kg·d)的剂量分别灌胃,对照组及模型组均给予等量生理盐水。干预期间中各组小鼠每日给予相同质量的饲料并进行称重。待白藜芦醇干预6 周后,小鼠眼球取血获得血液样本,小鼠颈椎脱颈处死后,迅速解剖并称取肝脏质量。用生理盐水冲洗肝脏,取一片肝脏大叶的二分之一置于组织固定液中固定,备作病理切片;另二分之一取肝脏50 mg 加入1 mL RAPI 裂解液研磨后取上清液备用待测。
1.7.1 小鼠体质量、体脂率及肝脏质量的测定 对小鼠称重并通过小动物体成分分析仪得到小鼠体脂率。剖取肝脏时称取质量。
1.7.2 血清及肝脏生化指标检测 采用ELISA 法测定血清中甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、天冬氨酸转氨酶(ALT)、丙氨酸转氨酶(AST)及葡萄糖(GLU)的含量;将肝组织匀浆液以3 500 r/min 在4 ℃离心10 min,取上清液,测定肝脏中甘油三酯(TG)、游离脂肪酸(NEFA)、丙二醛(MDA)、超氧化物歧化酶(SOD)的含量。
1.7.3 肝组织形态学观察 用4%甲醛组织固定液固定小鼠的肝组织,常规石蜡包埋切片并用油红染色,采用荧光显微镜观察肝组织的脂肪变性程度。
1.7.4 胰岛素抵抗试验 试验方案参考吴逸宽[17]并略作修改。葡萄糖耐量试验:小鼠禁食5 h 后在0 min 时断尾取血测血糖;腹腔注射20%葡萄糖溶液,于注射后15,30,60,90,120,180 min 分别断尾取血,测各时间点血糖值以绘制曲线,并计算血糖曲线下面积。胰岛素耐量试验:禁食5 h 后断尾取血测血糖,腹腔注射胰岛素,胰岛素按0.5 U/kg体质量计算注射量,于注射后15,30,60,90,120,180 min 分别断尾取血,测各时间点血糖值以绘制曲线,并计算血糖曲线下面积。
1.8 统计分析
采用SPSS 25.0 软件进行数据统计分析和相关性分析,差异性检验采用Tukey HSD 法,P<0.05为显著性差异。采用GraphPad Prism6、Origin 2022、Microsoft Excel 分别用于分析和绘图。
2 结果与讨论
2.1 溶菌酶纳米颗粒的临界胶束浓度
临界胶束浓度(critical micelle concentration,CMC)是指溶液中颗粒开始大量形成胶束时的浓度。我们采用荧光探针法测定了溶菌酶纳米颗粒的CMC,尼罗红荧光强度与溶菌酶质量浓度对数呈线性关系,计算可得溶菌酶纳米颗粒的CMC 为1.1 μg/mL(图1),其CMC 值低于β-酪蛋白、α-乳白蛋白、玉米醇溶蛋白构建的纳米胶束[18-20],说明溶菌酶自组装形成胶束所需要的蛋白浓度较低,能够在较低浓度下在溶液中维持胶束结构的完整性,有利于药物的递送。
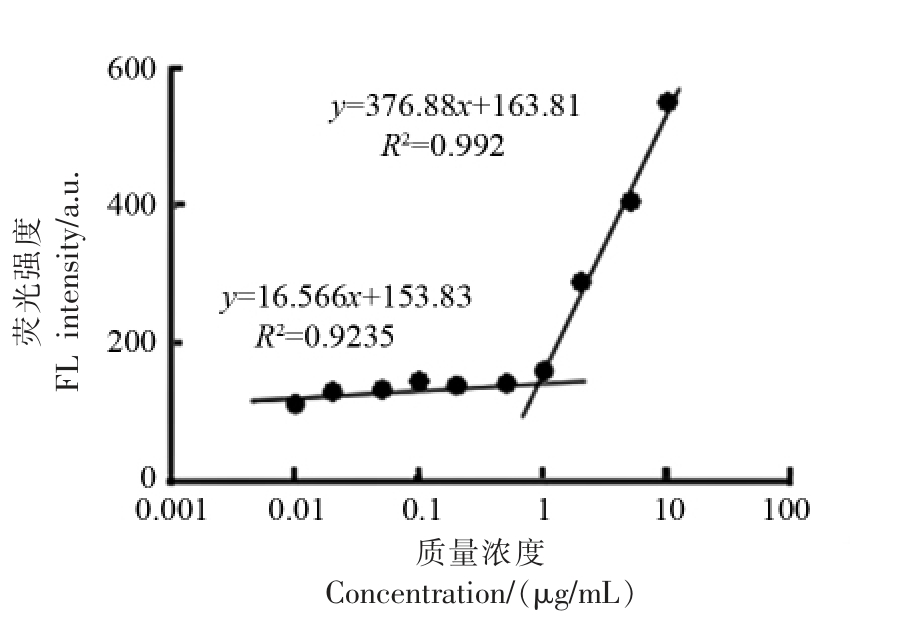
图1 溶菌酶纳米颗粒的临界胶束浓度
Fig. 1 Critical micelle concentration of lysozyme micelles
2.2 不同白藜芦醇纳米胶束的粒径及形态分布观察
分别对溶菌酶纳米颗粒的粒径分布、zeta 电位、表面形貌及其分布进行表征。经酶解形成的溶菌酶纳米颗粒(Lys)平均粒径为36 nm,胶束分布均匀(图2a),zeta 电位为+5.8 mV(图2e),与之前报道结果基本一致[21];谷氨酰胺转氨酶是一种广泛存在于动、植物和微生物体内的酰基转移酶,它能够催化蛋白间/内的酰基转移反应而发生共价交联,增强蛋白的热稳定性、持水性和胶凝能力等[22]。经谷氨酰胺转氨酶催化发生共价交联形成的溶菌酶纳米颗粒(TG-Lys)平均粒径为44 nm(图2b),zeta 电位为+4.6 mV(图2e);包埋白藜芦醇的溶菌酶纳米颗粒(Lys-Res)平均粒径增大到52 nm,分布均匀(图2c),zeta 电位为+5.4 mV(图2e),与Lys 的电位差异较小(P>0.05),说明白藜芦醇是被溶菌酶纳米颗粒包埋,而非互相作用;包埋白藜芦醇的交联溶菌酶纳米颗粒(TG-Lys-Res)平均粒径增大到58 nm(图2d),zeta 电位为+3.9 mV(图2e)。
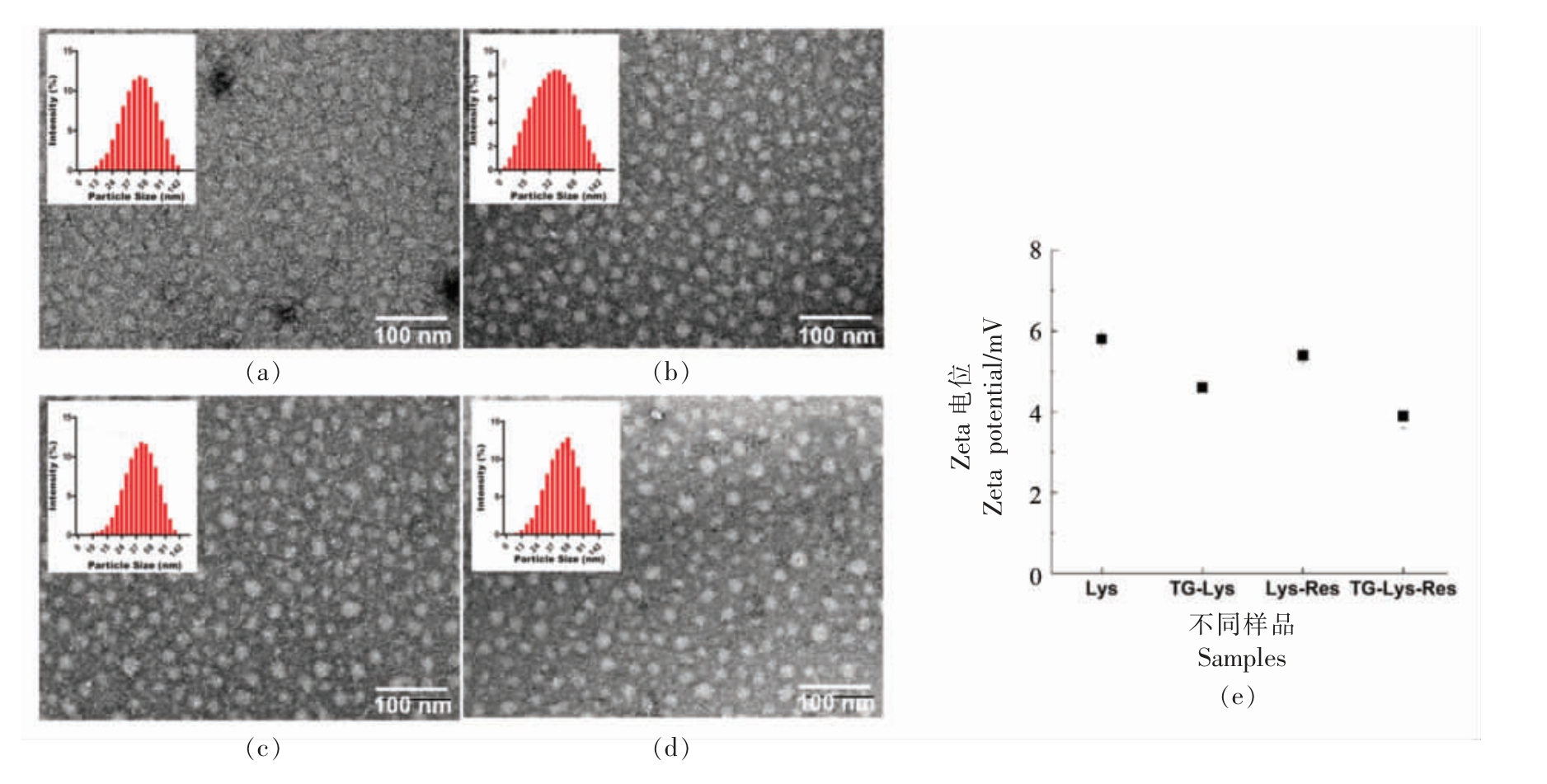
图2 溶菌酶纳米颗粒(Lys,a)、谷氨酰胺转氨酶催化交联的溶菌酶纳米颗粒(TG-Lys,b)、包埋白藜芦醇的溶菌酶纳米颗粒(Lys-Res,c)、包埋白藜芦醇的经转氨酶交联溶菌酶纳米颗粒(TG-Lys-Res,d)的透射电镜形态和粒径分布以及4 种颗粒的zeta 电位(e)
Fig. 2 The TEM images and size distribution of lysozyme(Lys)micelles(a),glutamine transaminase(TG)-hydrolyzed Lys micelles(b),resveratrol loaded Lys micelles(c)and resveratrol loaded TG-Lys micelles(d)and zeta potential of these micelles(e)
2.3 纳米胶束载药量和复溶性
采用HPLC 法测定溶菌酶纳米颗粒内白藜芦醇的含量。结果表明HPLC 测定方法建立良好,标准曲线线性关系良好(图3a),Lys-Res 和TGLys-Res 两种载体内白藜芦醇载药率分别为14.5%和21.2%,说明经谷氨酰胺转氨酶交联催化后的溶菌酶纳米颗粒粒径更大,载药量更高。将4 种样品复溶于水中,Lys 和TG-Lys 均呈澄清透明无色液体;Lys-Res 和TG-Lys-Res 呈乳白色透明液体(图3b),说明溶菌酶酶切形成的纳米胶束稳定性好,可作为包埋难溶性疏水药物的载药载体,以解决其在体内吸收率较低的问题。
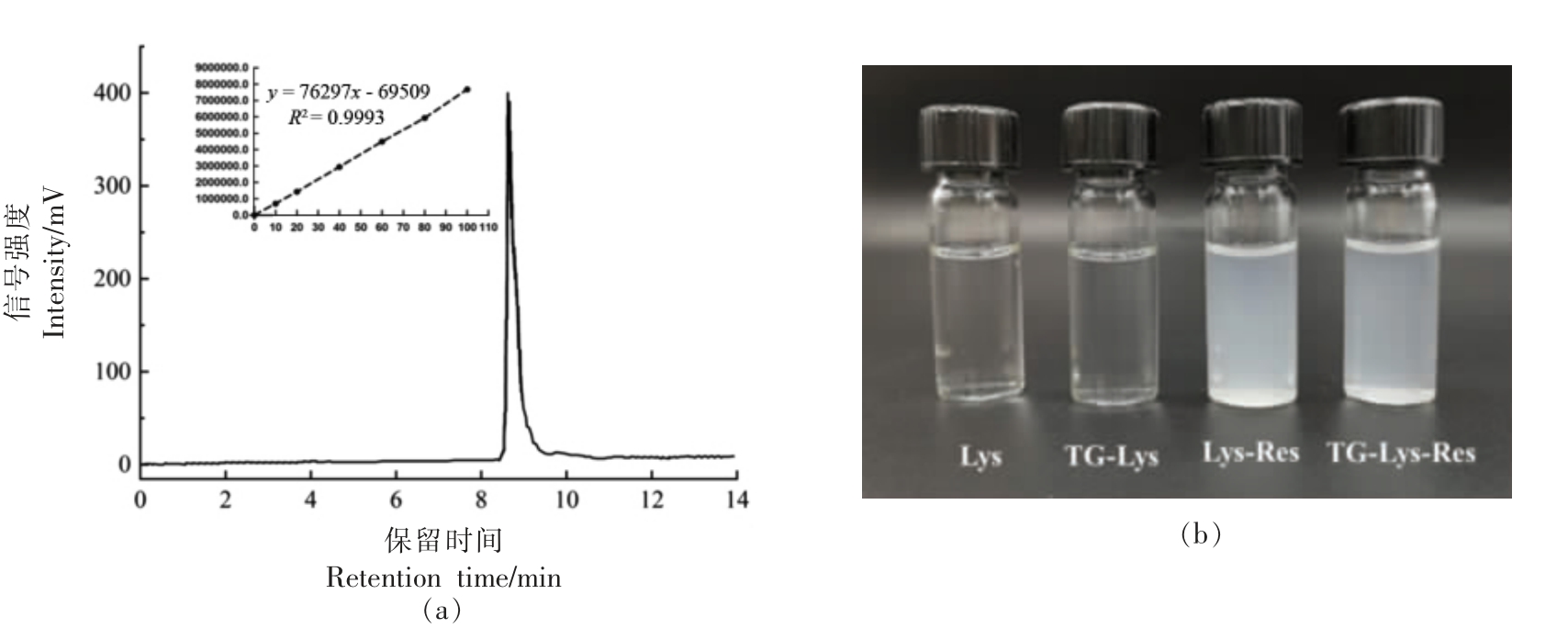
图3 高效液相色谱测定白藜芦醇的色谱图及标准曲线(a)和溶菌酶纳米颗粒的复溶状态(b)
Fig. 3 The HPLC chromatography of resveratrol and standard curve(a)and the re-solubility of lysozyme micelles(b)
2.4 溶菌酶纳米颗粒在胃、肠液中的稳定性和释放情况
采用体外消化模型研究Lys-Res 和TG-Lys-Res 两种载体在胃肠液中稳定性及其内部白藜芦醇的释放率。未经交联的Lys-Res 在胃液中逐渐水解,模拟胃液消化60 min 后测得白藜芦醇释放率为62%(图4a);而经谷氨酰胺转氨酶交联后的TG-Lys-Res 在模拟胃液中水解速率较慢,水解程度较低,经60 min 胃消化后白藜芦醇的释放率仅为~28%(图4c),而大多数完整溶菌酶纳米颗粒则经胃排空随食糜进入肠道。肠液中含有胰蛋白酶、糜蛋白酶、羧肽酶等诸多蛋白水解酶可将绝大多数蛋白彻底水解,因此Lys-Res 和TG-Lys-Res 两种载体在模拟肠液中均发生水解消化20 min 后白藜芦醇的释放率分别为67%和61%,二者差异不显著(图4b、4d),说明经谷氨酰胺转氨酶催化交联后的TG-Lys-Res 载体耐受胃液消化,耐消化稳定性提高,可以以纳米颗粒形式将白藜芦醇完整快速地转运至小肠而被吸收利用。
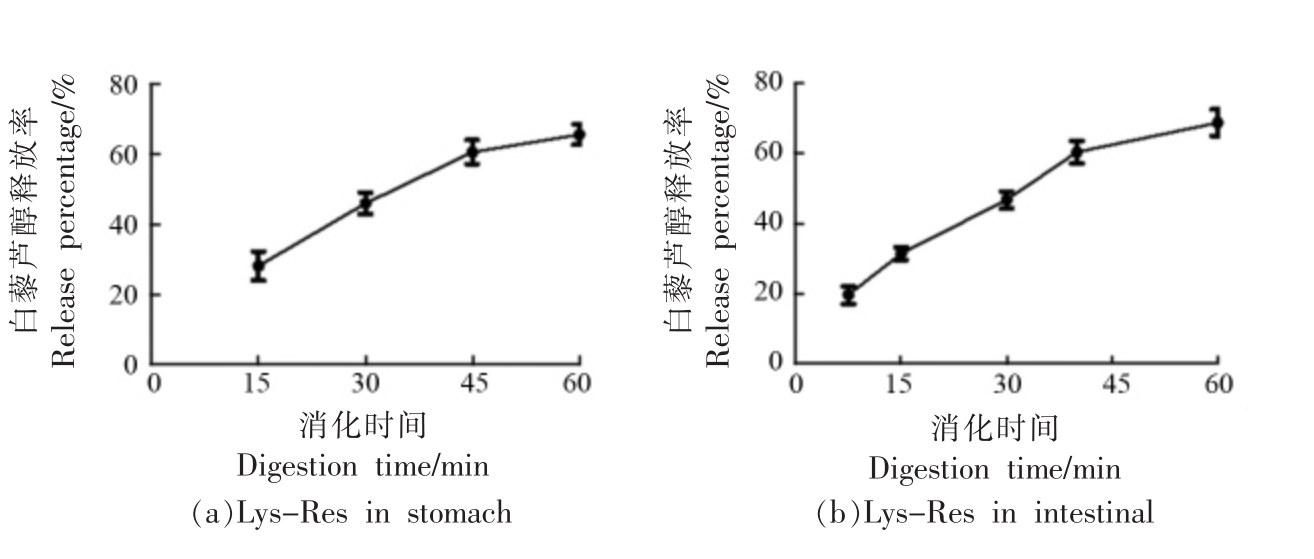

图4 Lys-Res 和TG-Lys-Res 在胃肠道的水解率(a-d)和TG-Lys-Res 的TEM 形态变化(e-j)
Fig. 4 The hydrolysis percent of Lys-Res and TG-Lys-Res in gastric and intestinal digestion(a-d)and the TEM images of TG-Lys-Res during the digestion(e-j)
为进一步探究TG-Lys-Res 在胃肠中消化过程中形态变化,采用TEM 观察其在胃肠液消化0,30,60 min 后的形态。未经胃肠液消化的溶菌酶纳米颗粒呈球状,分布均匀(图4e、4h);经胃液消化后TG-Lys-Res 形态变化并不显著,颗粒粒径变化较小,未发生聚集现象(图4f、4g);而经肠液消化,TG-Lys-Res 粒径逐渐减小,部分颗粒发生塌陷(图4i、4j),说明纳米颗粒在胰蛋白酶作用下逐渐降解,其内部白藜芦醇逐渐释放。
2.5 荷载白藜芦醇的纳米颗粒的动物水平生物利用率
选择TG-Lys-Res 作为白藜芦醇的载体(包埋组)并与未包埋的白藜芦醇(游离组)灌胃SD 大鼠,测定不同时间点大鼠血清中白藜芦醇浓度,结果如图5 所示。给药1 h 后血清中白藜芦醇浓度达到峰值,随后浓度逐渐下降。包埋组和游离组的血药质量浓度峰值(Cmax)分别为39.9 ng/mL 和12.4 ng/mL,药时曲线下面积(AUC0~48h)分别为218.6 ng/mL 和60.8 ng/mL,绝对生物利用度(FAbs)分别为3%和0.8%,经包埋后3 个指标的显著增大说明谷氨酰胺转氨酶催化交联的溶菌酶纳米颗粒可有效提高白藜芦醇的肠道吸收和生物利用率。
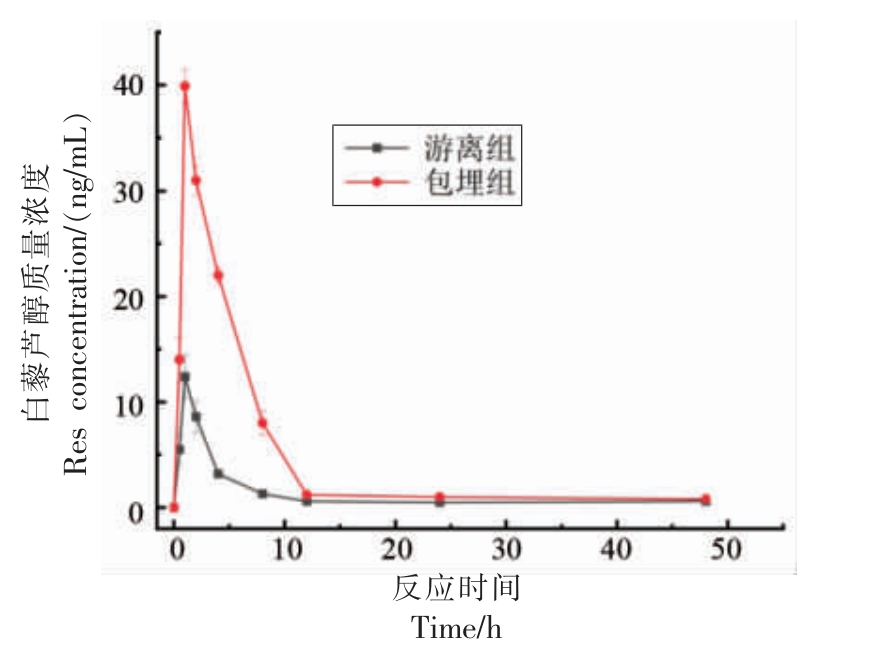
图5 白藜芦醇的浓度-时间曲线图
Fig. 5 The curve of resveratrol concentration-time in serum after oral administration
2.6 交联后溶菌酶包埋白藜芦醇颗粒对NAFLD小鼠的干预作用
2.6.1 小鼠体质量、体脂率及肝脏质量 通过高脂饲料构建NAFLD 小鼠模型,模型组平均体质量为31.87 g,肝脏质量为1.36 g,体脂率为22.36%,相较于正常小鼠组,模型组的3 个指标均显著升高(P<0.01),表明NAFLD 模型成功建立。与模型组相比,游离组小鼠体质量降低3.8%,肝脏质量降低19.9%,体脂率降低18.7%(P<0.05);而经溶菌酶包埋后的白藜芦醇处理后(包埋组),小鼠体质量降低11.1%,肝脏质量降低31.6%,体脂率降低38.9%(P<0.01),比游离组的降低效果分别提高2.9,0.59,1.1 倍,说明经包埋后的白藜芦醇能够更有效地被机体吸收,减缓NAFLD 小鼠体质量增加。
表1 各组小鼠的体质量、肝脏质量
Table 1 The body weight and live weight of mice model
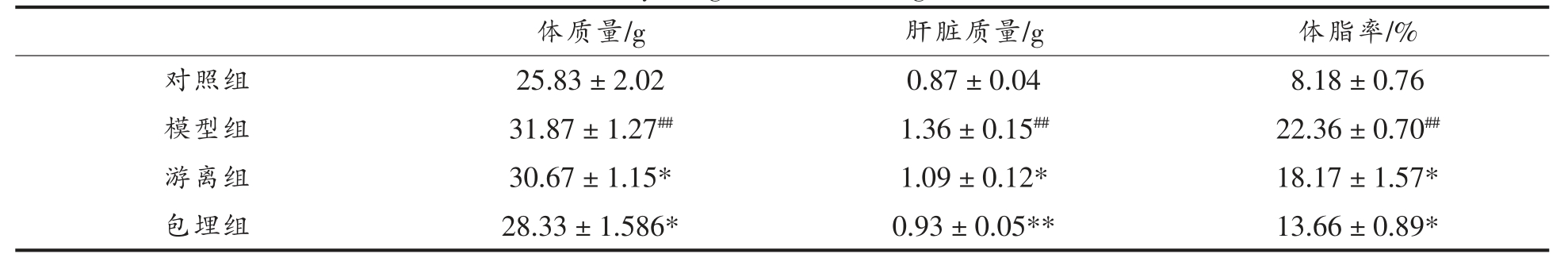
注:与对照组比较,##P<0.01,#P<0.05;与模型组相比较,**P<0.01,*P<0.05。
2.6.2 血清生化指标 血清生化指标能够间接反映肝脏的损伤程度。NAFLD 模型组小鼠血清中4项指标血清总胆固醇(TC)、血清总甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)显著高于对照组(P<0.05,表2),表现NAFLD 小鼠呈现出高脂血症。经未包埋的白藜芦醇干预后,小鼠的血清中TC、TG、HDLC、LDL-C、GLU 均显著降低(P<0.05);经包埋后的白藜芦醇干预后,TC、TG、HDL-C、LDL-C、GLU 的降低程度分别提高24.4%,40.3%,65.1%,8%,47.3%,说明包埋后的白藜芦醇可以更加有效地进入机体并发挥功效。
表2 各组小鼠的血清指标
Table 2 The serum indices of mice

注:与对照组比较,##P<0.01,#P<0.05;与模型组相比较,**P<0.01,*P<0.05。
肝脏中的转氨酶主要包括天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)[23]。这两种转氨酶在即使仅1%肝细胞损伤的情况下也会进入血液循环系统,导致血清中转氨酶含量显著增加,因此,血液中转氨酶含量是反映肝细胞受损程度最灵敏的指标[23]。高脂膳食诱导小鼠肝脏损伤从而导致NAFLD 模型组小鼠血清中AST 和ALT 显著升高(P<0.01,表2);经包埋后的白藜芦醇干预6 周,小鼠血清中AST 和ALT 分别降为57.4 和126.9 U/L,降低程度优于游离组。以上试验结果均表明,包埋后的白藜芦醇可以更加有效地降低血脂和转氨酶含量,改善由于摄入大量脂肪而引发的肝组织损伤,保护小鼠肝脏。
2.6.3 肝脏指标 肝脏中甘油三酯(TG)和游离脂肪酸(NEFA)的大量合成而排出受阻,进而导致脂肪的堆积,是NAFLD 诱发的初始阶段[24-25]。因此有效降低肝脏中TG 和NEFA 含量是改善NAFLD的主要手段。游离状态的白藜芦醇可降低TG 和NEFA 均为7.8%(表3),而经溶菌酶纳米颗粒包埋可使更多的白藜芦醇递送到肝脏发挥功效,因此,包埋组肝脏中TG 和NEFA 分别下降19.6%和17.7%,效果显著优于游离组。丙二醛(MDA)和超氧化物歧化酶(SOD)是肝脏组织氧化应激的产物,是脂质过氧化的重要指标,采用ELISA 法对肝脏组织中MDA 和SOD 含量进行测定,结果如表3所示。与对照组比较,模型组小鼠肝脏组织中SOD含量显著降低,MDA 含量显著升高(P<0.01);经白藜芦醇干预后,小鼠肝脏中SOD 含量升高,MDA 变化不显著;而经包埋后的白藜芦醇干预后,MDA 含量显著降低,SOD 含量显著升高(P<0.05),说明包埋可将更多白藜芦醇递送到肝脏,达到量效关系而降低肝脏脂质的过氧化。
表3 各组小鼠的肝脏指标
Table 3 The live indices of mice
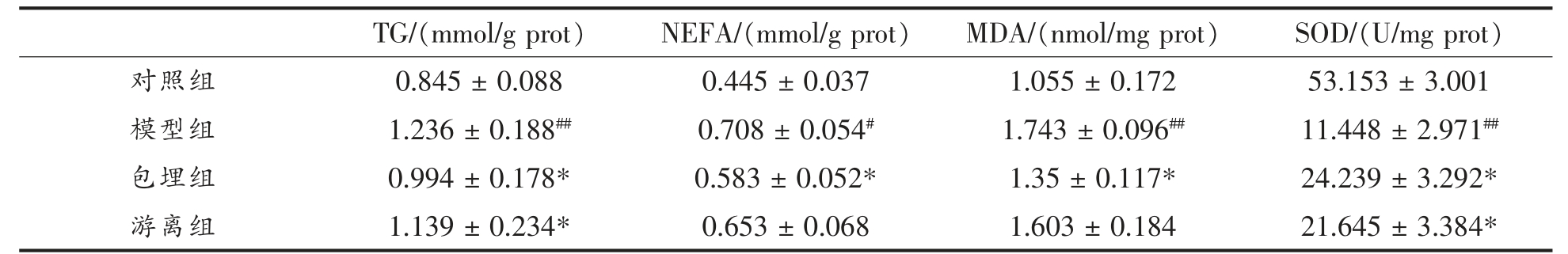
注:与对照组比较,##P<0.01,#P<0.05;与模型组相比较,**P<0.01,*P<0.05。
2.6.4 肝组织油红切片 对照组中肝细胞形态正常,胞浆清晰(图6a);模型组肝脏组织中出现脂肪变性,脂滴明显增多(图6b);经游离白藜芦醇干预后,肝脏组织中脂肪变性范围略减小,细胞内脂滴变少(图6c);而包埋组中肝细胞脂肪变性范围明显减小(图6d)。结果表明白藜芦醇能抑制脂肪在肝脏中的沉积,且白藜芦醇包埋后预防效果更明显。
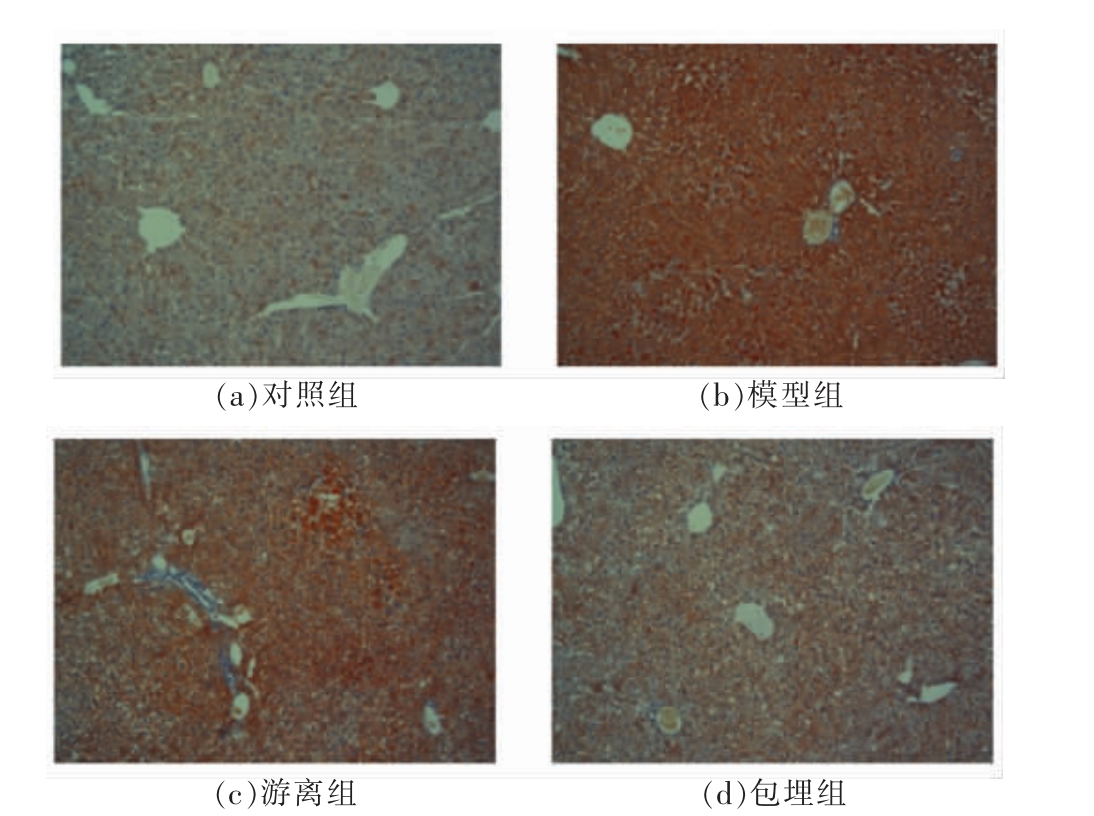
图6 小鼠肝脏的油红切片
Fig. 6 The hepatic appearance in mice
2.6.5 胰岛素抵抗 胰岛素促进胞外葡萄糖进入线粒体代谢产能,而当机体出现胰岛素抵抗后,肝脏等靶器官的胰岛素敏感性降低,需要更多胰岛素才能发挥作用;而当发展到一定阶段后,即使机体分泌更多胰岛素也难以将血糖维持在正常水平,这会诱导葡萄糖转化为脂肪在肝脏大量堆积,诱发NAFLD[26]。因此,改善胰岛素抵抗是防治NAFLD 的重要手段。葡萄糖耐量试验结果表明:白藜芦醇包埋组和游离组在15 min 即达到了血糖峰值,而模型组在30 min 才达到,且15 min 后白藜芦醇包埋组、游离组均可降低糖负荷后的血糖值(图7a),说明白藜芦醇对非酒精性脂肪肝小鼠胰岛素抵抗的糖耐量异常具有改善作用。相比游离组,包埋组血糖峰值更低、血糖降低速度更快,但曲线下面积差异不显著(P>0.05,图7b)。在胰岛素耐量试验中,模型组的血糖下降不显著,已出现胰岛素抵抗。在注射胰岛素15 min 后白藜芦醇包埋组和游离组的血糖值均低于模型组的血糖值,尤其在30 min 时白藜芦醇包埋组的血糖值与游离组相比更低(图7c、7d),表明白藜芦醇可提高小鼠的胰岛素敏感性,而且包埋后的白藜芦醇比游离白藜芦醇的效果更好。综上所述,包埋后的白藜芦醇可有效地提高小鼠葡萄糖的耐受能力和胰岛素的敏感性,改善胰岛素抵抗。
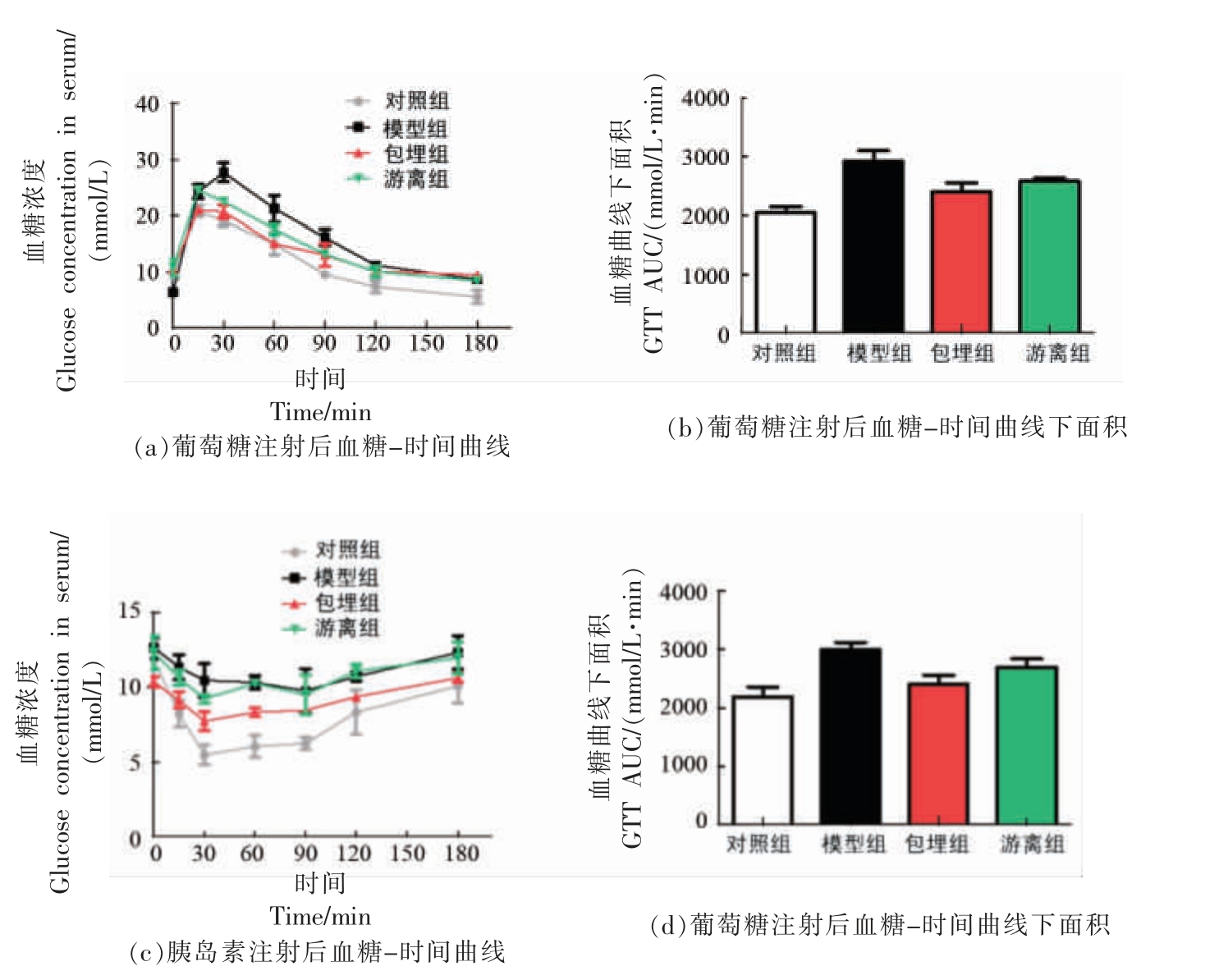
图7 白藜芦醇对小鼠糖代谢的影响
Fig. 7 Effects of Res on glycometabolism in mice
3 结论
本研究通过谷氨酰胺转氨酶交联的溶菌酶纳米颗粒载体用于白藜芦醇的高效递送。相比于未交联的溶菌酶纳米颗粒,临界胶束质量浓度提升为1.1 μg/mL,载药量提高至21.2%,粒径为58 nm。该载体耐胃消化液水解,可将更多白藜芦醇以完整形式转运到小肠,经体外肠液消化120 min 后白藜芦醇释放率达61%。采用SD 大鼠模型测定包埋前后白藜芦醇的生物利用率,结果表明包埋后白藜芦醇的血药质量浓度峰值(Cmax)提升至39.9 ng/mL,药时曲线下面积(AUC0-48h)提升至218.6 ng/mL,绝对生物利用度(Fabs)提高至3%。构建NAFLD 小鼠模型验证溶菌酶载体提高白藜芦醇对NAFLD 的干预效果,结果表明包埋后NAFLD 小鼠体脂率较游离态的白藜芦醇降低1.1倍,血清中血脂指标血清总胆固醇(TC)、血清总甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)均显著降低,肝脏中甘油三酯(TG)和游离脂肪酸(NEFA)、肝脏组织氧化应激产物丙二醛(MDA)和超氧化物歧化酶(SOD)均显著降低,说明与未包埋的白藜芦醇比较,经溶菌酶包埋后的白藜芦醇对小鼠NAFLD 的干预效果更佳。因此,谷氨酰胺转氨酶交联之后的溶菌酶纳米载体在口服递送功能活性物质方面具有极大潜力。
[1] 谢鹏超,邱利焱.纳米载体在非酒精性脂肪肝药物治疗中的研究进展[J].中国现代应用药学,2021,38(13):1610-1617.XIE P C,QIU L Y.Development of nanocarriers in drug treatment of non-alcoholic fatty liver disease[J].Chinese Journal of Modern Applied Pharmacy,2021,38(13):1610-1617.
[2] FRIEDMAN S L,NEUSCHWANDER-TETRI B A,RINELLA M,et al.Mechanisms of NAFLD devel opment and therapeutic strategies[J].Nature Medicine,2018,24(7):908-922.
[3] 尚敬.白藜芦醇改善高脂喂养大鼠胰岛素抵抗和肝脏脂毒性机制的研究[D].武汉:华中科技大学,2008.SHANG J.Study on the improvement of insulin resistance and hepatic lipotoxicity mechanisms in high-fat-fed rats by resveratrol[D].Wuhan:Huazhong University of Science and Technology,2008.
[4] 冯稳稳.基于乳清分离蛋白-海藻酸钠复合载体的活性物质的包埋研究[D].无锡:江南大学,2018.FENG W W.Study on the encapsulation of active substances based on whey protein isolate -sodium alginate composite carrier[D].Wuxi:Jiangnan University,2018.
[5] 黄旭琳.负载白藜芦醇的Zein-果胶核/壳型纳米颗粒制备及生物活性研究[D].广州:广东药科大学,2017.HUANG X L.Preparation and biological activity study of zein-pectin core/shell nanocarriers loaded with resveratrol[D].Guangzhou:Guangdong Pharmaceutical University,2017.
[6] 金海蓉.白藜芦醇脂质体凝胶对小鼠银屑病模型的治疗及经皮给药药代动力学研究[D].上海:第二军医大学,2015.JIN H R.Therapeutic effects of resveratrol liposomes gel on psoriasis-like mouse model and the study of transdermal drug pharmacokinetics[D].Shanghai:Second Military Medical University,2015.
[7] 吴炜豪.小麦醇溶蛋白/多糖复合粒子的制备及其荷载白藜芦醇的研究[D].无锡:江南大学,2018.WU W H.Preparation of wheat alcohol-soluble protein/polymer composite particles and their loading with resveratrol[D].Wuxi:Jiangnan University,2018.
[8] MABROUK M M,HAMED N A,MANSOUR F R.Physicochemical and electrochemical methods for determination of critical micelle concentrations of surfactants:A comprehensive review[J].Monatshefte für Chemie -Chemical Monthly,2022,153(2):125-138.
[9] LI X,LI L,MA Y,et al.Changes in protein interactions in pasteurized milk during cold storage[J].Food Bioscience,2020,34:100530.
[10] DAS S,NG K Y.Colon-specific delivery of resveratrol:Optimization of multi -particulate calcium -pectinate carrier[J].International Journal of Pharmaceutics,2010,385(1):20-28.
[11] SINGH G,PAI R S,PANDIT V.Development and validation of a HPLC method for the determination of trans-resveratrol in spiked human plasma[J].Journal of Advanced Pharmaceutical Technology &Research,2012,3(2):130.
[12] 岳春华,张志伟,符大天,等.水杨酸壳聚糖-明胶微囊制备工艺的优化[J].华西药学杂志,2014,29(5):494-496.YUE C H,ZHANG Z W,FU D T,et al.Optimization of the preparation process of salicylic acidchitosan-gelatin microspheres[J].West China Journal of Pharmaceutical Sciences,2014,29(5):494-496.
[13] QI X,SIMSEK S,CHEN B,et al.Alginate-based double-network hydrogel improves the viability of encapsulated probiotics during simulated sequential gastrointestinal digestion:Effect of biopolymer type and concentrations[J].International Journal of Biological Macromolecules,2020,165:1675-1685.
[14] 李秀平,孙静,张俊权,等.慢性应激对大鼠葡萄糖耐量及胰岛素抵抗的影响[J].中国医药导报,2007(28):25-26,118.LI X P,SUN J,ZHANG J Q,et al.The impact of chronic stress on glucose tolerance and insulin resistance in rats[J].China Medical Guide,2007(28):25-26,118.
[15] TAURIAINEN E,LUOSTARINEN M,MARTONEN E,et al.Distinct effects of calorie restriction and resveratrol on diet-induced obesity and fatty liver formation[J].Journal of Nutrition and Metabolism,2011,2011(11):525094.
[16] LI L,HAI J,LI Z,et al.Resveratrol modulates autophagy and NF-κB activity in a murine model for treating non-alcoholic fatty liver disease[J].Food and Chemical Toxicology,2014,63:166-173.
[17] 吴逸宽.萝卜硫素在改善非酒精性脂肪肝病中的作用及机制研究[D].无锡:江南大学,2021.WU Y K.The role and mechanism of radish sulfur in improving non-alcoholic fatty liver disease[D].Wuxi:Jiangnan University,2021.
[18] YILDIRIM-ELIKOGLU S,ERDEM Y K.Interactions between milk proteins and polyphenols:Binding mechanisms,related changes,and the future trends in the dairy industry[J].Food Reviews International,2018,34(7):665-697.
[19] ZHANG Y,CUI L,LI F,et al.Design,fabrication and biomedical applications of zein-based nano/micro-carrier systems[J].International Journal of Pharmaceutics,2016,513(1):191-210.
[20] HU Y,BAO C,LI D,et al.The construction of enzymolyzed α -lactalbumin based micellar nanoassemblies for encapsulating various kinds of hydrophobic bioactive compounds[J].Food &Function,2019,10(12):8263-8272.
[21] TENG W,ZHAO L,YANG S,et al.The hepatictargeted,resveratrol loaded nanoparticles for relief of high fat diet-induced nonalcoholic fatty liver disease[J].Journal of Controlled Release,2019,307:139-149.
[22] 陈书明,陈玮.复配酶制剂对面包品质的影响[J].粮油食品科技,2014,22(6):88-91.CHEN S M,CHEN W.Impact of compound enzyme preparations on bread quality[J].Grain and Oil Food Science and Technology,2014,22(6):88-91.
[23] JAKUBCZYK K,SKONIECZNA -Z˙YDECKA K,KAŁDUNSKA J,et al.Effects of resveratrol supplementation in patients with non-alcoholic fatty liver disease-A meta-analysis[J].Nutrients,2020,12(8):2435.
[24] 倪瑜琦.TRIM59 对高脂饮食诱导的小鼠非酒精性脂肪肝的保护作用及其分子机制[D].南昌:南昌大学,2021.NI Y Q.The protective effect and molecular mechanism of TRIM59 on high-fat diet-induced non-alco holic fatty liver in mice[D].Nanchang:Nanchang University,2021.
[25] CHEN X X,XU Y Y,WU R,et al.Resveratrol reduces glucolipid metabolic dysfunction and learning and memory impairment in a NAFLD rat model:involvement in regulating the imbalance of nesfatin-1 abundance and copine 6 expression[J].Frontiers in endocrinology,2019,10:434.
[26] CHEN Y,ZHANG H,CHEN Y,et al.Resveratrol alleviates endoplasmic reticulum stress -associated hepatic steatosis and injury in mice challenged with tunicamycin [J].Molecular Nutrition &Food Research,2020,64(14):2000105.