味觉,人类五感中的一员,对于食物选择、营养摄入以及情感体验具有不可或缺的作用。味觉不仅对食物的选择和营养摄入至关重要,而且与情感体验紧密相连。解码味觉的生物学基础,对于理解感知味道的神经机制至关重要,也为相关疾病的诊断和治疗提供了新的视角。随着神经成像技术的飞速发展,对味觉的认识已从化学物质的识别、受体的相互作用,拓展到更为复杂的神经感知层面。本文综述神经成像技术在味觉研究中的应用,探讨其背后的机制,以期为全面理解味觉感知提供新的视角和路径。
1 味觉感知概述
味觉感知是大脑对食物摄入和口腔加工后释放的化学分子进行解码的精细过程。在咀嚼和唾液的作用下,食物释放出能激活舌上味觉感受器的分子,这些感受器对基本口味化学物质极为敏感[1]。化学信号在神经编码环节转化为电信号,并通过神经元纤维传递至孤束核和丘脑,最终到达岛叶初级味觉区和眶额叶皮层的次级味觉区域。这些脑区的激活不仅揭示了味觉的物理属性,也与情感和记忆等高级认知功能紧密相连[2-6]。
味觉信号的神经生理学解码,是认知神经科学领域的一个重要分支。在人类中,味觉感知被细分为特性(Quality)、强度(Intensity)和情感价值(Affective value)3 个主要维度,它们共同决定了人们对食物的接受度和偏好[7]。味觉体验超越了单纯的物理识别,它与情感价值紧密相连,特定的味道能够唤起愉悦或厌恶等情感反应,这些反应受到个人偏好、文化背景和记忆的影响。认知反馈在这一过程中起调节作用,使味觉体验成为一个涵盖多感官和情感层面的综合体验。整体而言,味觉信号的处理是大脑对感官输入进行认知和情感整合的多阶段过程,展现了大脑处理味觉信息的复杂性和精妙性(图1)。
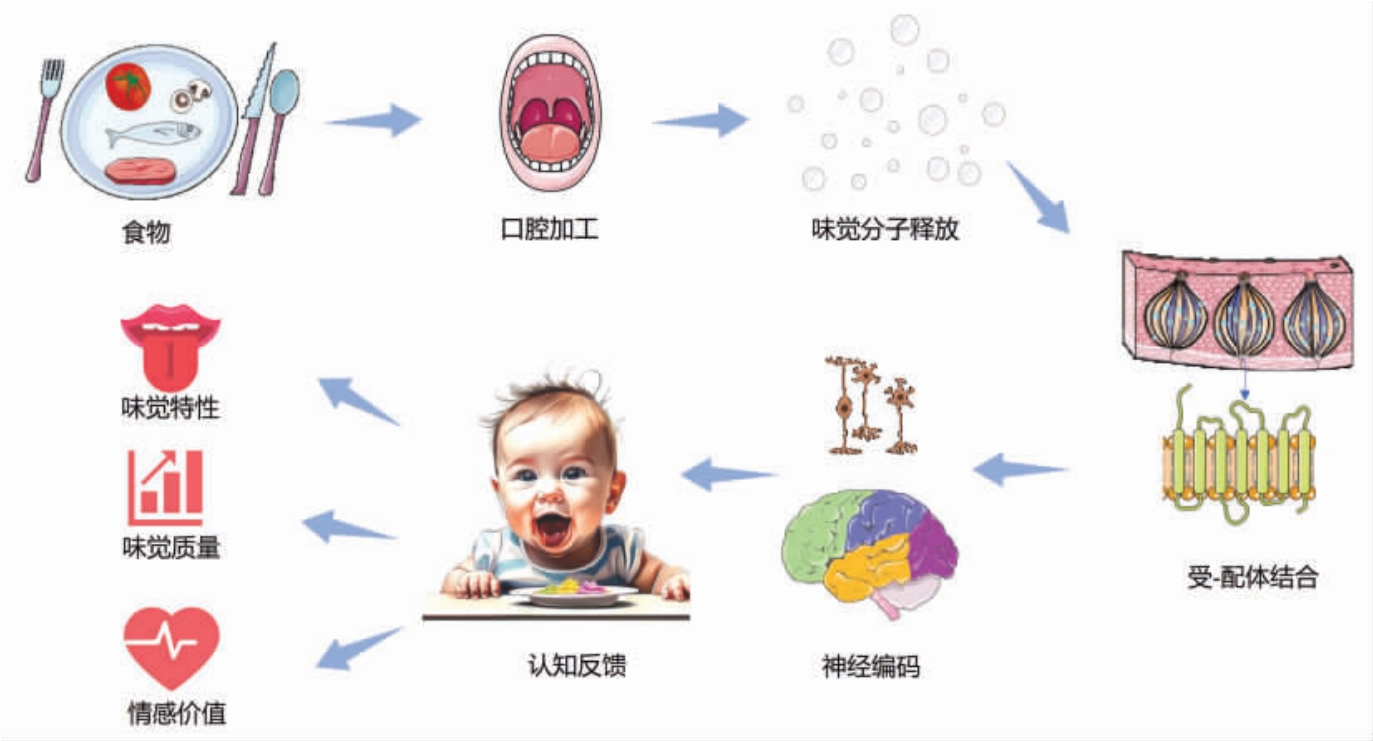
图1 味觉感知的主体路径
Fig.1 The primary pathway of taste perception

图2 味觉刺激引起的岛叶体素激活与群体fMRI 对比分析[14]
Fig.2 Insular voxel activation in response to taste stimuli and group fMRI contrast analysis[14]

图3 苦味物质6-正丙基硫氧嘧啶诱导的左侧和右侧腹外侧前额皮层血红蛋白浓度动态变化[18]
Fig.3 Dynamics of hemoglobin concentration changes in the left and right ventrolateral prefrontal cortex induced by the bitter compound 6-n-propylthiouracil[18]
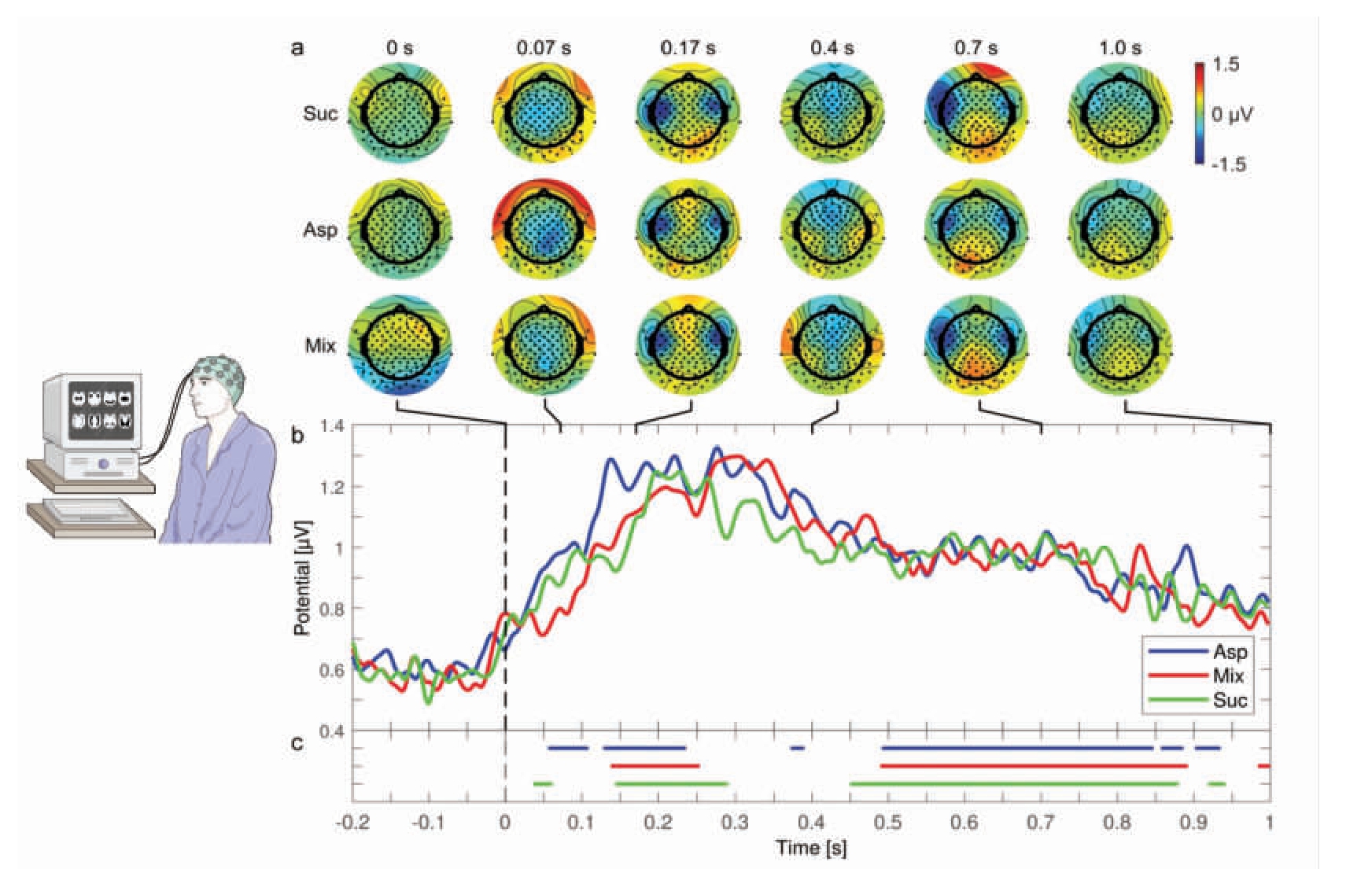
图4 对3 种甜味剂刺激的全脑平均反应模式[21]
Fig.4 Patterns of average brain response to stimuli of three sweeteners[21]
注:(a)头皮图部分展示全脑对蔗糖(Suc)、阿斯巴甜(Asp)和甜味剂混合物(Mix)刺激的平均电位变化;(b)全局场功率分析部分揭示不同甜味剂引起的大脑活动在整体功率上的分布情况;(c)根据参与者内平均诱发电位的聚类置换检验,大脑对Suc、Asp 和Mix 的反应与零显著不同的时间段情况。

图5 右侧岛叶皮层对甜味和苦味味觉刺激的主要效应分析[24]
Fig.5 Main effects analysis of sweet and bitter tastes in the right insular cortex[24]

图6 左侧侧岛叶皮层对甜味和苦味味觉刺激的主要效应分析[24]
Fig.6 Main effects analysis of sweet and bitter tastes in the left insular cortex[24]
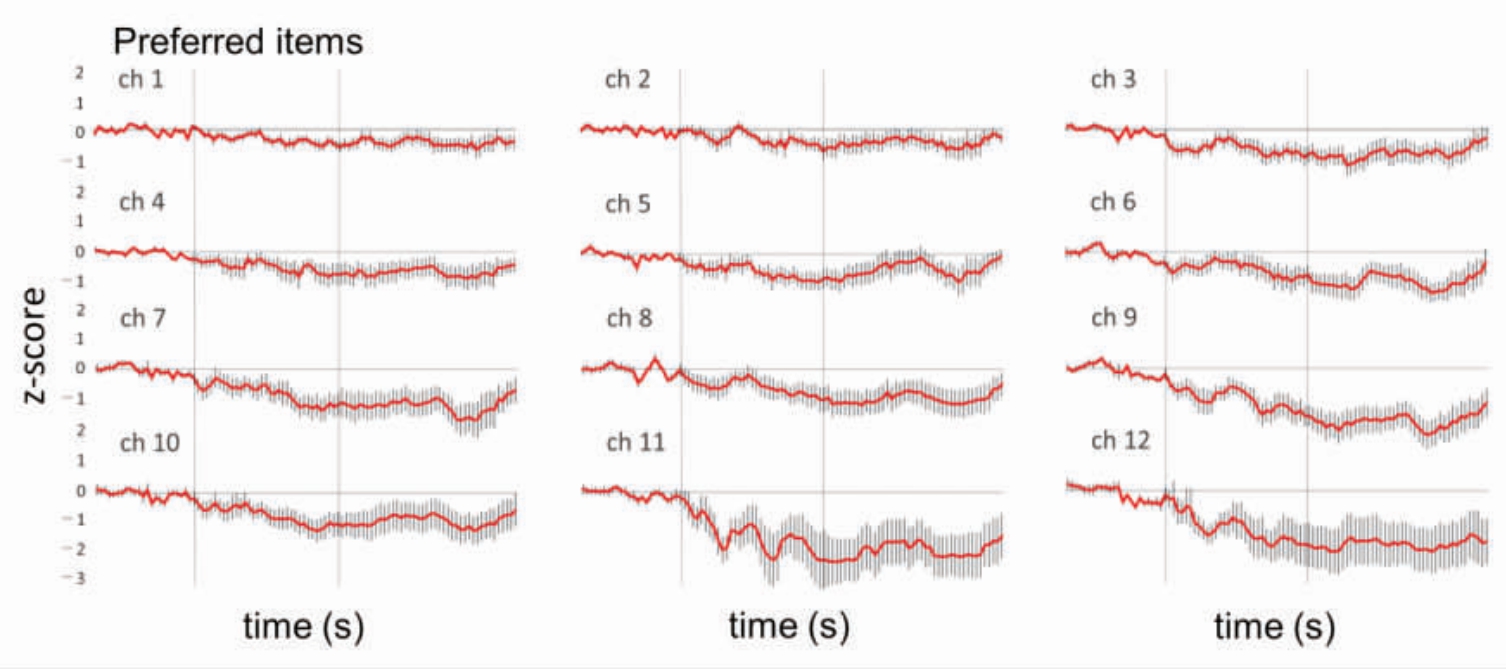
图7 偏好味觉刺激引起的氧合血红蛋白浓度变化的总体均值Z 分数[40]
Fig.7 Grand mean Z-scores of oxyhemoglobin concentration changes in response to preferred taste stimuli[40]

图8 厌恶味觉刺激引起的氧合血红蛋白浓度变化的总体均值Z 分数[40]
Fig.8 Grand mean Z-scores of oxyhemoglobin concentration changes in response to disliked taste stimuli[40]
味觉信号的传递和处理过程映射了大脑网络的协同作用机制。大脑网络由多个功能和结构相互关联的区域构成,其间的互作对于味觉信息的整合和处理至关重要。结构连接体现神经元之间的解剖学布局,而功能连接则反映在特定任务或状态下,不同大脑区域间神经元活动模式的时间依赖性[8-9]。研究这些大脑区域间的相互作用,有助于人们理解味觉感知如何在大脑中形成和调节。
2 神经成像技术概述
神经成像技术作为研究味觉感知的重要工具,通过非侵入性方式测量大脑活动,深化了人们对味觉处理机制的认识。这些技术使研究人员能够观察并分析大脑对味觉刺激的反应,从快速的电位变化到持续的血液动力学响应,揭示了大脑如何编码和解释味觉信息(表1)。
表1 味觉解码相关神经成像技术比较
Table 1 Comparison of neuroimaging techniques for gustatory decoding

脑电图(Electroencephalography,EEG)以其卓越的时间分辨率捕捉大脑对味觉刺激的即时反应,揭示了神经元突触后电位的同步化活动,为探究大脑在各种功能状态和病理条件下的活动模式提供了重要视角[10]。EEG 技术在味觉研究中的应用主要集中在捕捉和分析由味觉刺激引起的大脑电位变化,为理解味觉感知的神经机制提供了实时数据。
功能性磁共振成像(Functional magnetic resonance imaging,fMRI)技术通过测量血氧水平依赖(Blood oxygen level dependent,BOLD)信号来反映大脑活动区域的血液动力学变化[10]。这项技术以其高空间分辨率为研究者提供了深入观察大脑在特定任务或状态下激活模式的能力,帮助识别和理解味觉处理的关键脑区。fMRI 还揭示了大脑如何区分和处理不同类型的味道,以及在静息状态下的大脑功能连接(Resting-state functional connectivity,RSFC),这被认为反映了认知系统的功能状态[11]。
功能性近红外光谱成像(Functional near infrared spectroscopy,fNIRS)技术通过测量大脑活动所引起的血液动力学变化来反映神经活动。fNIRS 利用近红外光穿透颅骨和脑组织,敏感地检测氧合血红蛋白(Oxyhemoglobin,Oxy-Hb)和脱氧血红蛋白(Deoxyhemoglobin,Deoxy-Hb)的浓度变化,适合在自然行为条件下进行大脑功能研究[12]。fNIRS 的优势在于其对运动伪影的抗干扰能力较强,且易于携带和部署,使其在自然状态下的味觉感知研究中尤为适用。
这些技术的应用在味觉研究中不仅限于基础感知机制的探索,还涵盖了复杂的感知过程。EEG的实时监测能力,fMRI 的高空间分辨率以及fNIRS 的便携性和抗运动干扰特性,共同为味觉感知的多维度研究提供了强有力的工具。随着技术的不断发展和创新,这些神经成像技术在揭示大脑功能和疾病机制方面将发挥愈发重要的作用。
3 味觉感知的神经网络与认知功能
3.1 味觉特性识别的空间分布与时间动态性
味觉特性识别是味觉感知领域的关键课题,涉及大脑对不同口味特性的精确映射与处理。这一过程需要多个脑区的协同作用,呈现出复杂的时间动态特征。研究表明,通过fMRI 技术,利用分布式多体素活动模式,可以有效区分甜、咸、苦和酸等不同味觉的脑区[13]。通过探照灯球体方法,研究者观察到岛叶在处理味觉质量和强度刺激时的激活现象,特别是在右侧岛叶存在特定的激活簇[14],揭示了味觉处理的空间分布特性。利用静息状态fMRI 进行神经影像学研究,有助于研究被试个体的自发大脑活动和功能重组,探讨与执行味觉任务期间的大脑区域的差异。一项研究检查了味觉丧失患者的大脑功能连接是否与健康对照组存在差异,该研究利用感兴趣区域(Region of interest,ROI)之间的 功能连 接分析(Functional connectivity analysis,FCA)对先前研究中的功能磁共振成像数据进行重新分析,发现味觉丧失患者的某些ROI 之间的功能连接明显较弱,这些区域包括初级和次级味觉皮质、内侧前额皮质(Medial frontal cortex,MFC)和轨道前额皮质(Orbitofrontal cortex,OFC)[15]。
在味觉中枢通路的研究中,通过荟萃分析35项fMRI 研究,研究人员定义了参与味觉处理的中央味觉网络区域,并分析了44 名受试者对甜味和苦味刺激的反应。这项研究建立了一个网络模型,涵盖了双侧前、中、下岛叶、丘脑、中央前回、左杏仁核、尾状和背外侧前额皮层,并特别指出性别在味觉功能连接上的差异[16]。这些研究结果共同强调了味觉特性识别在大脑中的复杂性,以及不同脑区在处理味觉信息时的相互作用和个体差异。
Okamoto等[17]通过fNIRS 技术发现,在味觉编码任务中,受试者的外侧前额皮层(Lateral prefrontal cortex,LPFC)表现出活动,这一活动与处理其它感官信息时相似。Bembich等[18]则更加精准揭示了以6-正丙基硫氧嘧啶(6-n-Propylthiouracil,PROP)诱导的苦味感知中,敏感个体的左侧背外侧前额皮层(Dorsolateral prefrontal cortex,DLPFC)和腹外 侧前额皮层(Ventrolateral prefrontal cortex,VLPFC)出现显著激活,而对苦味不敏感的个体则未显示出此类激活。Hu等[19]的fNIRS 研究监测了受试者对甜味和酸味的反应,发现这两种味道均能显著激活大脑的额颞叶区域和PFC,其中对酸味的反应更为敏感。
此外,基于EEG 的研究也揭示了味觉分类能力与脑电图结果之间的关联。Crouzet等[20]采用EEG 技术结合时间分辨多变量模式分析(Multivariate pattern analysis,MVPA),描述了在品尝咸、甜、酸、苦4 种味道过程中,分布式皮质网络中的动态神经元活动及其对味觉质量判断的影响。对于每个时间点,分类器被训练为通过使用单个参与者的单次试验电生理活动进行多类,一对一或一对多的味觉识别。这些反应模式与味觉质量的感知决定相关:对于区分度不高的口味,参与者产生的大脑反应模式也较为模糊。这些研究为味觉相关决策与大脑反应模式预测价值之间的联系提供了初步证据。
时间动态性是味觉特性识别的关键维度之一。味觉相关的皮质激活模式在极短时间内快速变动,使得时间信息成为区分不同味觉质量的一个重要标志。EEG 研究为人们提供了关于味觉处理时间特性的高分辨率视角。例如,事件相关电位(Event-related potential,ERP)的分析,揭示了味觉刺激后150 ms 内引发的显著电生理反应,这一反应与第一味觉电位(P1)相对应[20]。这些发现为潜意识味觉处理的高时间分辨率研究奠定了基础。
定量脑电图(Quantitative EEG,qEEG)技术能够区分由不同甜味剂(如热量蔗糖、低热量阿斯巴甜以及阿斯巴甜和安赛蜜的低热量混合物)引起的反应。在行为研究中,虽然这3 种味觉刺激在感知上相似或相同,但是通过脑电图分析,可以在0.08 s 到0.18 s 的时间窗口内对它们进行区分,这为大脑反应与个体味觉刺激感知之间的功能关系提供了初步证据[21]。此外,大脑的识别能力与个体区分不同刺激的感知能力紧密相关。脑电图在区分感知相似的味觉方面的成功,为未来进行高时间分辨率、低侵入性的潜意识味觉处理研究开辟了新的道路。还有研究指出,神经味觉反应依赖于行为目标,并在130 ms 内通过Delta 波活动对特定口味信息进行编码,揭示了感知味道的时间点[22]。
关于味觉识别是否遵循特定的地形分布模式,或者是否通过空间分布编码来实现,这一议题在学术界尚存争议[2,23]。鉴于此,需要开展更多实验研究,以深入探究不同味觉刺激物在大脑激活模式上的差异性,并提供激活大脑区域的精确坐标及大脑图谱,从而为后续味觉研究提供科学依据和参考框架[5]。
3.2 味觉强度处理
在味觉感知的领域,对味觉强度的神经处理是核心环节,它涉及对食物味道浓度的评估,并进一步调节个体对食物摄入的预期。此过程不仅关乎不同味觉特性的识别,更要求大脑对味觉刺激的强度信息进行精细的分析与编码[24]。在神经生理学中,感觉刺激的强度通常由感觉细胞的放电频率所编码,而感知强度的增加通常与更显著的神经电位反应相关联[25]。基于此,可以推测对不同强度感知较敏感的人群可能会有更强的神经元反应。
3.2.1 味觉强度的空间分布和时间动态性 大脑结构的变化与味觉强度的感知紧密相连。体素基础形态 测量法(Voxel -based morphometry,VBM),作为一项基于磁共振成像(Magnetic resonance imaging,MRI)的技术,提供了对大脑结构特征与味觉处理能力关系的深入洞察。VBM 技术的应用揭示了特定脑区体积的变化与味觉感知强度之间的显著相关性。例如,右楔回、左横颞回、右颞下回和左尾状等区域的体积变化,已被证实与味觉刺激的感知强度相关联,这表明这些脑区可能在味觉处理中扮演更为广泛的角色[26]。后续研究还发现,咸味感知的强度与左侧半球特定脑区的灰质体积呈正相关,而咸味感知的愉悦度与右侧杏仁核的灰质体积呈正相关关系[27]。这些发现不仅揭示了大脑结构特征在味觉强度感知中的重要性,也为理解味觉信息的神经编码机制提供了新的视角。
在初级味觉皮层——岛叶中,对味觉刺激强度的空间模式理解尚处于初步阶段。然而,现有研究指出,岛叶及其覆盖区域的神经元对味觉刺激物浓度的变化表现出显著的活跃性[24,28-29]。Dalenberg等[30]通过fMRI 技术揭示了左岛叶在味觉特性、强度和情绪价值方面的主导作用,而右岛叶,特别是前部粒细胞区,对不同浓度的味觉刺激呈现出非线性的反应模式。
Yeung等[31]的研究强调右半球可能通过自上而下的机制影响味觉强度的处理。1 项研究发现,左、右岛叶皮质中存在专门处理味觉强度的神经团簇,这些团簇在功能上与处理味觉特性和情感价值的区域有所区分[24]。特别值得注意的是,岛叶中处理味觉强度的神经团簇展现出对不同味道浓度的非线性响应模式。这种非线性关系表明,大脑对味觉刺激的处理可能依赖于更为复杂的神经编码机制,而非简单的线性增强[24]。此外,该研究还观察到,在处理味觉强度的神经团簇中,可能存在对特定浓度味道最为敏感的空间梯度[24]。这表明岛叶皮质在处理味觉信息时,能够根据味道的浓度差异进行精细的空间映射。鲜味刺激的神经反应也引起研究者的注意,其激活的脑区包括岛/眼皮层、尾外侧眶额叶皮层,以及喙前扣带皮层的一部分。特别是当味精中添加核苷酸时,眶额叶皮层前部的BOLD 信号显示出超线性增强,这可能与鲜味的主观感知增强有关[32]。最近的研究亦证实岛叶内部的不同味觉激活模式:味觉质量主要激活右背中岛叶,味觉强度主要激活右前中岛叶,情绪价值主要激活双侧前中岛叶和中岛叶,而质量和情绪价值部分在右中背岛叶中重叠[33]。这些发现进一步强调岛叶在味觉感知中的复杂作用,不仅参与味觉质量的初步检测,还可能参与味觉强度的精细调节。这种对味觉刺激的非线性响应,可能反映大脑在处理味觉信息时的动态和适应性特征。
3.2.2 眶额皮层、杏仁核与味觉强度编码 味觉强度的神经编码过程涉及大脑多个区域的复杂交互,其中眶额皮层(Orbitofrontal cortex,OFC)和杏仁核的作用日益受到重视。OFC 在味觉感知中的作用不仅限于愉悦度的评价,还可能参与味觉强度的编码。1 项研究揭示,当参与者将注意力集中在所尝味道的强度上时,他们在初级味觉皮层以及外侧OFC 展现出更大的激活信号,这表明OFC 可能参与味觉强度的编码过程[34]。
杏仁核通常与情绪处理相关,其在味觉强度感知中的作用同样不容忽视。Veldhuizen等[35]利用fMRI 技术,通过心理、生理相互作用分析方法,使用味觉响应簇作为种子区域,以探究与味觉敏感性个体差异相关的味觉皮质区域。该研究中构建了一个动态因果模型,并最终确定一个稀疏连接模型来最佳解释观测数据。该模型揭示味觉敏感性与杏仁核到丘脑区域的抑制性连接密切相关,从而突出了杏仁核在味觉强度感知中的重要作用。这些研究结果强调味觉强度处理的神经基础是多个大脑区域间相互作用和连接模式的综合体现。深入研究这些区域的结构和功能,有助于更全面理解味觉系统如何处理强度信息。
3.3 味觉感知与情感价值
特定的味觉体验能够激发特定的情绪反应和记忆回溯,这种联系对于揭示味觉如何在人类行为和心理健康中发挥作用具有重要意义。1 项研究采集了5 种基本滋味暴露后的静息态fMRI 数据,发现味觉暴露会影响大脑中各个区域的自发功能活动,包括躯体感觉区、奖励处理区和高阶认知功能区[36],表明味觉体验不仅激活了与味觉直接相关的脑区,还影响参与情绪、奖励和认知过程的更广泛的神经网络。
味觉感知的3 个维度——特性、强度和情感价值相互作用,共同塑造了人们对食物的感知和评价。例如,一种低浓度的苦味溶液可能因其情感价值而被感知为较为强烈,而高浓度的甜味溶液可能因情感价值而被评为较弱[7]。这种情感价值的影响揭示了受试者对味觉的神经反应会根据执行的任务类型而变化[37]。当受试者接受训练,专注于评估味觉刺激的浓度而非情感价值时,他们能够更准确地使用强度来反映刺激的浓度。这种训练表明,神经编码的味觉反应具有可塑性,能够根据不同的认知要求进行调整。
在愉悦度的评价中,右背外侧OFC 对愉悦味道的响应优先于不愉快的味道,而左背侧前脑叶/盖膜区域则对不愉快味道的响应更为敏感[37]。此外,当受试者评估味道的愉悦度时,左背外侧OFC的特定区域会优先响应味道质量,并与早期味道中继区域如背侧OFC 和前脑岛连接,以处理感知的愉悦度。Avery等[38]使用fMRI 技术发现,所有味道均能激活双侧背中半岛的初级味觉皮层,然而,没有任何一个脑区对单一味道显示出稳定的偏好。基于fMRI 进行的多变量探照灯分析表明,可以在中半岛区域内准确解码不同口味的身份,并观察到情感和奖励处理区域如纹状体、眶额皮层和杏仁核的活动[38-39]。Minematsu等[40]通过fNIRS技术探究了前额皮层(Anterior prefrontal cortex,aPFC)在评估食物和饮料愉悦度中的作用,结果表明,甜味刺激导致oxyHb 浓度降低,而苦味刺激则导致浓度升高;在喜好性分析中,积极享乐刺激降低了oxyHb 浓度,而消极享乐刺激则使之升高。oxyHb 浓度与愉悦感之间存在负相关关系,这表明监测aPFC 区域的oxyHb 浓度可能有助于客观评估食物和饮料的愉悦性。
4 味觉解码的未来与挑战
在食品科学领域,对味觉解码的研究正开辟新的视野。通过深入剖析消费者的味觉感知机制,致力于设计能够精准迎合不同消费者口味偏好的产品。精确理解消费者的味觉感知对于提升食品的市场接受度至关重要。这不仅关乎于满足消费者对美味食品的追求,而且是引导健康饮食习惯和满足特定消费者群体营养需求的关键。跨学科研究的兴起,如心理学、营养学与神经科学等领域知识的融合,为味觉解码领域带来了创新的研究方向。这种综合性的研究策略,有助于深化对味觉感知神经机制的认识,增强对味觉障碍诊断与治疗的精准性。
神经成像技术,如EEG 和fMRI,为味觉障碍的诊断和治疗提供了重要工具。然而,这些技术在应用中也面临挑战。例如,EEG 的空间分辨率限制了其对特定脑区活动的精确定位能力。为了克服这一限制,研究人员正在探索提高EEG 电极的密度以及算法的改进。同时,fMRI 对运动的敏感性可能影响数据的稳定性,研究人员正在开发更稳定的扫描协议以减少运动伪影。
在味觉研究中,有效呈现味觉刺激并确保数据的可靠性和可重复性是研究设计中的关键问题。考虑到参与者在扫描过程中保持集中和舒适的时间限制,研究者必须在试验设计中平衡刺激的重复次数和试验的总时长[11,41]。在运用fMRI 技术进行连通性分析时,通常建议采用块设计,以提供足够长的测量时间,用于非时间锁定的连通性分析[42]。然而,块设计可能导致更多的习惯化,因此交替呈现两种不同质量的相似类型刺激可能是最佳的策略[43]。
5 结语
本文深入剖析了味觉解码在神经科学和食品科学交叉领域的研究进展,阐明了神经成像技术在阐释味觉感知神经机制中的核心作用。通过EEG 和fMRI 等尖端神经成像技术,能够精确捕捉和分析大脑对味觉刺激的即时反应及其随后的血液动力学变化,从而揭示了味觉信号从感官输入到高级认知处理的复杂神经网络。此外,本文亦审视了味觉特性、强度和情感价值如何共同塑造食物的感知和偏好,以及这些维度在神经层面的相互作用。
尽管神经成像技术在味觉解码领域展现出巨大潜力,本文亦指出其应用过程中的局限性,包括EEG 的空间分辨率限制和fMRI 对头部微小运动的敏感性,这些因素均可能影响数据的准确性和稳定性。此外,研究设计中如何平衡试验的重复性和持续时间,以确保数据的可靠性和参与者的舒适度,也是一项重要挑战。面对这些挑战,未来的研究需进一步优化技术方法和试验设计,以促进对味觉感知机制更深层次的理解,并推动味觉解码研究在食品开发和临床治疗中的应用。
[1] 朱忆雯,张宁龙,姜水,等.食品鲜味感知研究进展[J].中国食品学报,2021,21(1):1-16.ZHU Y W,ZHANG N L,JIANG S,et al.The research progress on food umami perception[J].Journal of Chinese Institute of Food Science and Technology,2021,21(1):1-16.
[2] CHEN X,GABITTO M,PENG Y,et al.A gustotopic map of taste qualities in the mammalian brain[J].Science,2011,333(6047):1262-1266.
[3] PFAFFMANN C.The afferent code for sensory quality[J].American Psychologist,1959,14(5):226-232.
[4] SMALL D M.Taste representation in the human insula[J].Brain Structure and Function,2010,214(5/6):551-561.
[5] YEUNG A W K,GOTO T K,LEUNG W K.Affective value,intensity and quality of liquid tastants/food discernment in the human brain:An activation likelihood estimation meta-analysis[J].NeuroImage,2018,169:189-199.
[6] IANNILLI E,SINGH P B,SCHUSTER B,et al.Taste laterality studied by means of umami and salt stimuli:An fMRI study[J].Neuroimage,2012,60(1):426-435.
[7] SMALL D M,GREGORY M D,MAK Y E,et al.Dissociation of neural representation of intensity and affective valuation in human gustation[J].Neuron,2003,39(4):701-711.
[8] SPORNS O.The human connectome:A complex network[J].Annals of the New York Academy of Sciences,2011,1224(1):109-125.
[9] VELDHUIZEN M G,CECCHETTO C,FJAELDSTAD A W,et al.Future directions for chemosensory connectomes:Best practices and specific challenges[J].Frontiers in Systems Neuroscience,2022,16:885304.
[10] DALENBERG J R,HOOGEVEEN H R,LORIST M M.Chapter 11 -Physiological measurements:EEG and fMRI[M]// ARES G,VARELA P.Methods in consumer research.Volume 2.United Kingdom:Woodhead Publishing,2018:253-277.
[11] FARRUGGIA M C,PELLEGRINO R,SCHEINOST D.Functional connectivity of the chemosenses:A review[J].Frontiers in Systems Neuroscience,2022,16:865929.
[12] MINEMATSU Y,UEJI K,YAMAMOTO T.Activity of frontal pole cortex reflecting hedonic tone of food and drink:fNIRS study in humans[J].Scientific Reports,2018,8(1):16197.
[13] KRIEGESKORTE N,GOEBEL R,BANDETTINI P.Information-based functional brain mapping[J].Proceedings of the National Academy of Sciences,2006,103(10):3863-3868.
[14] CHIKAZOE J,LEE D H,KRIEGESKORTE N,et al.Distinct representations of basic taste qualities in human gustatory cortex[J].Nature Communications,2019,10(1):1048.
[15] ZHU Y,JOSHI A,THAPLOO D,et al.Exploring brain functional connectivity in patients with taste loss:A pilot study[J].European Archives of Oto-Rhino-Laryngology,2023,280:4491-4499.
[16] PONTICORVO S,PRINSTER A,CANTONE E,et al.Sex differences in the taste-evoked functional connectivity network[J].Chemical Senses,2022,47:bjac015.
[17] OKAMOTO M,MATSUNAMI M,DAN H,et al.Prefrontal activity during taste encoding:An fNIRS study[J].Neuroimage,2006,31(2):796-806.
[18] BEMBICH S,LANZARA C,CLARICI A,et al.Individual differences in prefrontal cortex activity during perception of bitter taste using fNIRS methodology[J].Chemical Senses,2010,35(9):801-812.
[19] HU C H,KATO Y,LUO Z W,et al.An fNIRS study of taste cortical areas in human brain: Sweetness and sourness:2013 IEEE/SICE International Symposium on System Integration(SII)[C].Kobe:IEEE,2013.
[20] CROUZET SÉBASTIEN M,BUSCH NIKO A,OHLA K.Taste quality decoding parallels taste sensations[J].Current Biology,2015,25(7):890-896.
[21] ANDERSEN C A,KRING M L,ANDERSEN R H,et al.EEG discrimination of perceptually similar tastes [J].The Journal of Neuroscience Research,2019,97(3):241-252.
[22] WALLROTH R,HÖCHENBERGER R,OHLA K.Delta activity encodes taste information in the human brain[J].NeuroImage,2018,181:471-479.
[23] AVERY J A,CARRINGTON M,MARTIN A.A common neural code for representing imagined and inferred tastes[J].Progress in Neurobiology,2023,223:102423.
[24] CANNA A,PRINSTER A,CANTONE E,et al.Intensity-related distribution of sweet and bitter taste fMRI responses in the insular cortex [J].Human Brain Mapping,2019,40(12):3631-3646.
[25] OHLA K.Flexible and dynamic representations of gustatory information[J].Current Opinion in Physiology,2021,20:140-145.
[26] HWANG L D,STRIKE L T,COUVY-DUCHESNE B,et al.Associations between brain structure and perceived intensity of sweet and bitter tastes[J].Behavioural Brain Research,2019,363:103-108.
[27] YEUNG A W K.Neuroanatomical correlates of perceiving the intensity and pleasantness of intense saltiness in healthy subjects [J].Current science,2019,116:69-74.
[28] SPETTER M S,SMEETS P A,DE GRAAF C,et al.Representation of sweet and salty taste intensity in the brain[J].Chemical Senses,2010,35(9):831-840.
[29] PRINSTER A,CANTONE E,VERLEZZA V,et al.Cortical representation of different taste modalities on the gustatory cortex:A pilot study[J].PLoS One,2017,12(12):e0190164.
[30] DALENBERG J R,HOOGEVEEN H R,RENKEN R J,et al.Functional specialization of the male insula during taste perception[J].NeuroImage,2015,119:210-220.
[31] YEUNG A W K,TANABE H C,SUEN J L K,et al.Taste intensity modulates effective connectivity from the insular cortex to the thalamus in humans[J].NeuroImage,2016,135:214-222.
[32] TIAN Y,MARGULIES D S,BREAKSPEAR M,et al.Topographic organization of the human subcortex unveiled with functional connectivity gradients [J].Nature Neuroscience,2020,23(11):1421-1432.
[33] OHLA K.3.16 -Psychobiology of tasting and its role in food perception[M]//FRITZSCH B.The senses:A comprehensive reference.Second edition.Oxford:Elsevier,2020:318-332.
[34] VAN RIJN I,WEGMAN J,AARTS E,et al.Health interest modulates brain reward responses to a perceived low -caloric beverage in females [J].Health Psychol,2017,36(1):65-72.
[35] VELDHUIZEN M G,FARRUGGIA M C,GAO X,et al.Identification of an amygdala-thalamic circuit that acts as a central gain mechanism in taste perceptions[J].Journal of Neuroscience,2020,40(26):5051-5062.
[36] CHEN J,ZHAO M,HUANG L,et al.Amplitude of low-frequency fluctuation after taste exposure revealed by resting-state fMRI[J].Physiology &Behavior,2023,261:114091.
[37] BENDER G,VELDHUIZEN M G,MELTZER J A,et al.Neural correlates of evaluative compared with passive tasting[J].European Journal of Neuroscience,2009,30(2):327-338.
[38] AVERY J A,LIU A G,INGEHOLM J E,et al.Taste quality representation in the human brain[J].The Journal of Neuroscience,2020,40(5):1042-1052.
[39] AVERY J A.Against gustotopic representation in the human brain:There is no Cartesian restaurant[J].Current Opinion in Physiology,2021,20:23-28.
[40] MINEMATSU Y,UEJI K,YAMAMOTO T.Activity of frontal pole cortex reflecting hedonic tone of food and drink:fNIRS study in humans[J].Scientific Reports,2018,8:16197.
[41] SZAMEITAT A J,SHEN S,STERR A.The functional magnetic resonance imaging(fMRI)procedure as experienced by healthy participants and stroke patients -A pilot study[J].BMC Medical Imaging,2009,9:14.
[42] DAUNIZEAU J,PREUSCHOFF K,FRISTON K,et al.Optimizing experimental design for comparing models of brain function[J].Plos Computational Biology,2011,7(11):e1002280.
[43] BIRN R M,COX R W,BANDETTINI P A.Detection versus estimation in event -related fMRI:Choosing the optimal stimulus timing[J].Neuroimage,2002,15(1):252-264.