蛋白酶是一类具有复杂功能结构并能够催化蛋白质水解生成多肽及氨基酸的酶,在食品、医疗等领域应用广泛[1-2]。蛋白酶通常来源于植物、动物、微生物[3-4],而微生物来源的蛋白酶多来自于芽孢杆菌、大肠杆菌等细菌和霉菌、酵母等真菌[5-6]。然而,目前对于食药用真菌来源的蛋白酶报道较少。
蜜环菌(Armillaria mellea)属于担子菌门(Basidomycota)小皮伞科(Marasmiusrotula)蜜环菌属(Armillariella),是大型食药用菌之一[7]。虽然有研究表明,蜜环菌可产漆酶、纤维素酶、木聚糖酶、果胶酶、淀粉酶、蛋白酶等胞外酶[8-9],但是目前对蜜环菌产蛋白酶的相关性质研究较少。文超婷等[10]、佟维娜等[11]先、后开展了羊肚菌液态、固态发酵玉米醇溶蛋白研究,蛋白转化率分别为36.69%和22.36%;何音华[12]应用蜜环菌生物转化玉米蛋白粉,蛋白转化率为(33.67±2.12)%,发酵过程中主要产酸性蛋白酶,其总蛋白酶活在第15 天最高,为313.13 U/g。以上研究成果为本文的研究工作奠定了坚实的理论基础。
本文以蜜环菌液体发酵玉米醇溶蛋白的发酵产物为研究对象,采用饱和硫酸铵沉淀粗酶液,通过DEAE Sepharose Fast Flow 阴离子层析柱及Sephadex G-50 层析柱纯化,研究蛋白酶的稳定性、底物选择性及对玉米醇溶蛋白水解度等方面的酶学性质,旨在为食药用真菌来源蛋白酶的深入研究与产品开发提供参考。
1 材料与方法
1.1 材料与试剂
蜜环菌由吉林农业大学小麦和玉米深加工国家工程研究中心提供。
玉米醇溶蛋白(≥92%),上海瑞永生物科技有限公司;无水葡萄糖、蔗糖、无水碳酸钠、硫酸铵,天津光复科技有限公司;磷酸二氢钾、磷酸氢二钾、七水硫酸镁,北京化工厂;福林酚试剂、Sephadex G-50,北京鼎国昌盛生物技术有限责任公司;DEAE Sepharose FF,美国GE 公司。
1.2 仪器与设备
HZQ-F160 全温振荡培养箱,哈尔滨市东联电子技术开发有限公司;Autociave 4001136 高压灭菌锅,上海博讯实业有限公司医疗设备厂;90-2恒温磁力搅拌器,上海振荣科学仪器有限公司;WH-2 旋涡振荡器,金坛市金华仪器厂;LD5-2B型低速离心机,北京雷勃尔离心机有限公司;Z36HK 超高速冷冻离心,德国HERMLE 公司。
1.3 方法
1.3.1 培养基配制
1.3.1.1 斜面培养基 蚕蛹粉0.5%、马铃薯20%、葡萄糖1%、酵母浸粉2%、蔗糖1%、MgSO4·7H2O 0.075%、KH2PO4 0.15%、VB1 0.001%、琼脂粉1.5%,pH 值自然,在121 ℃灭菌20 min,放于27℃培养箱中生长12 d。
1.3.1.2 种子培养基 蚕蛹粉0.5%、马铃薯20%、葡萄糖1%、酵母浸粉2%、蔗糖1%、MgSO4·7H2O 0.075%、KH2PO4 0.15%、VB1 0.001%,pH 值自然,121 ℃灭菌20 min,在27 ℃、160 r/min 的条件下培养6 d。
1.3.1.3 液体发酵培养基 玉米醇溶蛋白6.5%、马铃薯20%、葡萄糖1%、蔗糖1%、MgSO4·7H2O 0.075%、KH2PO4 0.15%、VB1 0.001%,121 ℃灭 菌20 min,在27 ℃培养箱中培养6 d,转速为160 r/min。
1.3.2 蛋白酶活力的测定 根据国标《蛋白酶制剂》(GB/T 23527-2009)测定蛋白酶活力。步骤如下:将配制好的酪蛋白溶液在40 ℃水浴锅中预热5 min,取离心后的发酵液1 mL 分别加入A 组空白组3 支试管和B 组试验组3 支试管,在水浴中保温2 min,然后向A 组3 支试管中加入2 mL、0.4 mol/L 的三氯乙酸(TCA)溶液,B 组中加入1 mL的酪蛋白溶液,水浴保温10 min,再向A 组试管加入1 mL 酪蛋白溶液,B 组试管加入2 mL TCA 溶液,水浴保温20 min 后,离心10 min,取离心后每管上清液1 mL 加入至空试管中,再加入碳酸钠溶液和福林酚试剂,旋涡振荡后保温20 min,在波长680 nm 下测定吸光值。蛋白酶活力按照式(1)进行计算。
式中:A 为样品OD 值;4 为4 mL 反应液;N为样品酶液稀释倍数;10 为反应时间10 min;w 为样品中水分百分含量,%。
在以上测定条件下每分钟内水解酪蛋白产生1 μg 酪氨酸所需要的酶量定义为1 个酶活力(U)。
1.3.3 蛋白质含量的测定 根据国标《食品安全国家标准 食品中蛋白质的测定》(GB 5009.5-2016)中,使用自动凯氏定氮法测定样品中蛋白的总含量。
1.3.4 蛋白酶的分离纯化
1.3.4.1 硫酸铵分级沉淀 将粗酶液冻干粉溶解于磷酸缓冲液(pH 7.5)中,向酶液中加入硫酸铵使其饱和度达到为10%,搅拌至溶解,放于4 ℃环境静置4 h,4 ℃、8 000 r/min 离心10 min 后收集沉淀,测定上清液及沉淀中的蛋白酶活力。再向上清液中继续添加硫酸铵达到不同的饱和度,进行如上步骤的分级沉淀。确定硫酸铵沉淀范围后,沉淀出的蛋白酶在4 ℃中透析48 h 后冻干备用。
1.3.4.2 DEAE Sepharose FF 阴离子交换色谱用20 mmol/L 的磷酸缓冲液(pH 7.5)平衡色谱柱,用相同缓冲液溶解脱盐后的蛋白酶并用0.22 μm的滤膜过滤。线性洗脱液为0~0.5 mol/L NaCl 溶液(20 mmol/L pH 7.5 磷酸缓冲液配制),阶梯式洗脱,在波长280 nm 处进行紫外检测,收集各峰组分,测定蛋白酶活。
1.3.4.3 Sephadex G-50 葡聚糖层析 用20 mmol/L 的磷酸缓冲液(pH 7.5)进行平衡,将过膜后的酶液上样于层析柱中,用磷酸缓冲液洗脱,得到洗脱曲线。
1.3.5 SDS-PAGE 电泳 通过观察电泳条带判断蛋白酶的分离纯化结果,初步确定蛋白酶分子质量的大小。采用5%浓缩胶和16.5%分离胶,上样量均为10 μL,电压分别为80 V 和120 V。电泳完毕,凝胶在0.1%考马斯亮蓝R-250 溶液中使用摇床摇动2 h。凝胶变色,拍照保存。
1.3.6 蛋白酶学性质研究
1.3.6.1 最适温度及温度稳定性 在pH 值为中性条件下,以酪蛋白为底物,在30,40,50,60,70,80,90 ℃下分别测定蛋白酶活力,将酶活最高的条件记为100%,计算其它温度的相对酶活,确定该酶的最适温度。
在pH 值为中性条件下,将蛋白酶酶液分别在40,50,60,70 ℃的恒温水浴锅中保温30,60,90,120 min,在40 ℃的条件下测定酶活,以未保温前的蛋白酶酶活为100%,计算其它温度及时间下的相对酶活。
1.3.6.2 最适pH 值及pH 值稳定性 配制不同pH 值的缓冲体系,柠檬酸缓冲液(pH 值3,4,5),磷酸缓冲液(pH 值6,7),Tris-HCl(pH 值8,9),碳酸缓冲液(pH 值10,11,12),在40 ℃的条件下,测定不同pH 值下的蛋白酶活,将酶活最高的条件记为100%,计算其它pH 值条件下的相对酶活。
选择pH 值为6,7,8,9,10 的酶液分别在40℃的恒温水浴锅中保温30,60,90,120 min,然后调回最适pH 值,以未保温前的蛋白酶酶活为100%,计算各条件下的相对酶活。
1.3.6.3 不同金属离子对酶活的影响 配制含有Ca2+、Mg2+、Mn2+、Fe2+、Cu2+、Zn2+、Li+、Ba2+、Fe3+、K+的蛋白酶液,金属离子的浓度为5 mmol/L,在常温下放置60 min,分别测定蛋白酶活,以未加金属离子的蛋白酶酶活为100%,计算含有各种金属离子的相对酶活。
1.3.6.4 蛋白酶抑制剂对蛋白酶活力的影响 分别配制5 mmol/L 的苯甲基磺酰氟(Phenyl methane sulfonyl,PMSF)、乙二胺四乙酸(Ethylene diamine tetraacetic acid,EDTA)、碘乙酰胺(Iodoacetamide,IAM)和碳酰胺(Urea)的蛋白酶液,常温下放置30 min,以未添加蛋白酶抑制剂的蛋白酶酶活为100%,计算相对酶活。
1.3.6.5 酶促动力学常数测定 以酪蛋白为底物,用磷酸缓冲液(pH 7.5)配制质量浓度为1,2,5,10,15 g/L 的酪蛋白溶液,在最适条件下测定酶活,采用Lineweaver-Burk 双倒数作图法测定Km和vm 值。根据米氏方程的双倒数表达式,以1/[S]为横坐标,以1/[v]为纵坐标作图,图中横轴截距为1/Km 的绝对值,纵轴截距为1/vm,进一步计算出动力学参数米氏常数Km 和最大速率vm。
1.3.6.6 底物的选择性 用磷酸缓冲液(pH 7.5)分别配制2%的酪蛋白、牛血清白蛋白(BSA)和脱脂奶粉为底物,测定蛋白酶活,将酶活最高的条件记为100%,计算相对酶活。
1.3.7 玉米醇溶蛋白水解度的测定 称取5 g 玉米醇溶蛋白与蒸馏水混合配制成溶液,调到适宜温度和pH 值,加入纯化后的蜜环菌中性蛋白酶和市售中性蛋白酶,按照3 500 U/g 的标准加入中性蛋白酶,水解后在100 ℃水浴锅内灭酶10 min,将水解液在5 000 r/min 的条件下离心10 min,测定水解度。水解度的测定采用甲醛滴定法[13]。
1.4 数据处理
本文采用SPSS 23.0 和Orgin 8.5 软件对数据进行分析,试验设3 次重复,用平均值±标准差的形式表示。
2 结果与分析
2.1 蜜环菌发酵的玉米醇溶蛋白产物中蛋白酶活力
图1 为蜜环菌发酵的玉米醇溶蛋白过程中胞外蛋白酶活力变化趋势图,在液态发酵过程中,中性蛋白酶活力最高,其次为酸性蛋白酶,最后为碱性蛋白酶。因此在液态发酵中,蜜环菌产中性蛋白酶活力相对较强。
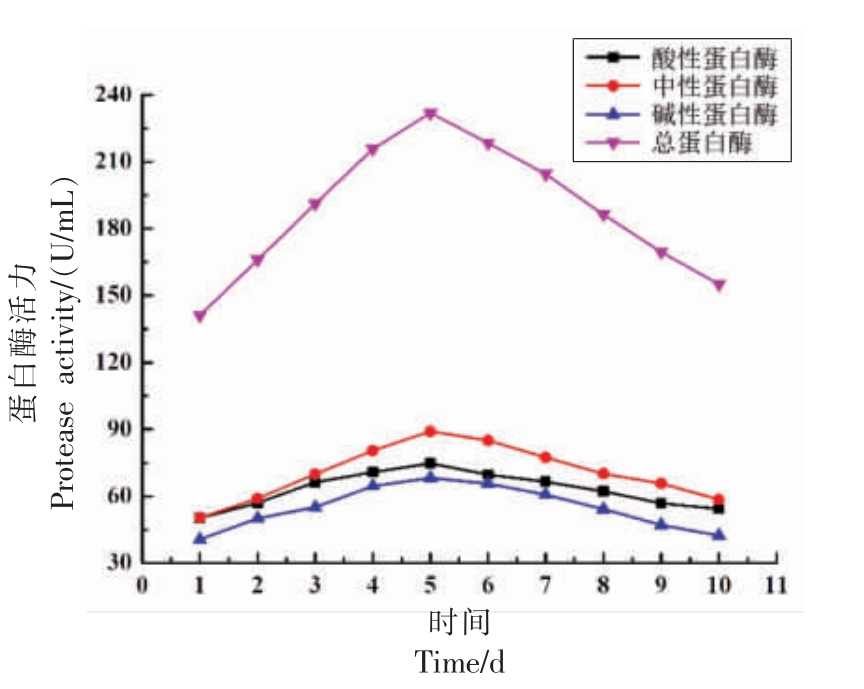
图1 蜜环菌蛋白酶活的变化趋势
Fig.1 Change trend in protease activity of Armillaria mellea
由图1 可以发现,在发酵过程中随着发酵时间的增长,蜜环菌胞外蛋白酶活在整个发酵过程中呈现先上升再下降的趋势。在1~5 d,蛋白酶活力不断增加,因为随着菌丝不断生长,蜜环菌的产酶能力不断增强,在第5 天时,胞外总蛋白酶活最高为(231.89±7.05)U/mL,中性蛋白酶活达到最大值为89.05 U/mL,随发酵时间不断增加,菌丝体出现老化、衰亡情况,产酶能力减弱导致蛋白酶活不断降低。因此,选择中性蛋白酶作为蜜环菌液态发酵玉米醇溶蛋白的主要产物并进行后续试验。
2.2 蜜环菌发酵的玉米醇溶蛋白产物中性蛋白酶的分离纯化
经发酵后过滤的粗酶液,其中含有大量的杂蛋白等物质,在这些物质的作用下,酶活会逐步降低,并发生褐变反应,使粗酶液颜色加深[14]。硫酸铵分级沉淀法是根据不同蛋白在硫酸铵中溶解度不同的特性,将目标蛋白有效同大部分杂蛋白分开,从而进行浓缩,以提高分离效率,并将粗酶液中的色素去除[15]。由图2 可知,在硫酸铵饱和度为30%时,上清液中的相对酶活为90%,随着硫酸铵饱和度的增加,上清液中的蛋白酶活不断减少,说明大部分的杂蛋白已经析出,沉淀中则与之相反。因此,本文选择硫酸铵饱和度为30%时去除杂蛋白,饱和度为30%~70%分级沉淀蛋白酶。

图2 硫酸铵饱和度对蜜环菌中性蛋白酶的影响
Fig.2 Effects of ammonium sulfate saturation on neutral protease of Armillaria mellea
将酶液上样于DEAE Sepharose FF 层析柱中,测得含有0.5 mol/L 的NaCl 酶液中相对酶活可达92%,说明蜜环菌中性蛋白酶在pH 7.5 缓冲溶液中,能够结合到离子交换介质上,可以有效同大部分杂蛋白分开,并将粗酶液中的色素去除。如图3 所示,洗脱曲线中有3 个蛋白峰,分别是未检测到蛋白酶活的杂蛋白峰1,蛋白酶集中的峰2以及含有少量酶活的峰3。如图4 所示,Sephadex G-50 葡聚糖层析洗脱曲线,共检测到2 个洗脱峰并且在20 min 时首先检测到了峰1,说明峰1 的分子质量大于峰2,同时在峰1 处检测到蛋白酶活力,峰2 则未检测到蛋白酶活,说明峰2 可能为杂蛋白,因此收集、合并峰1 的洗脱液,浓缩后,进行SDS-PAGE 检测其纯化情况。
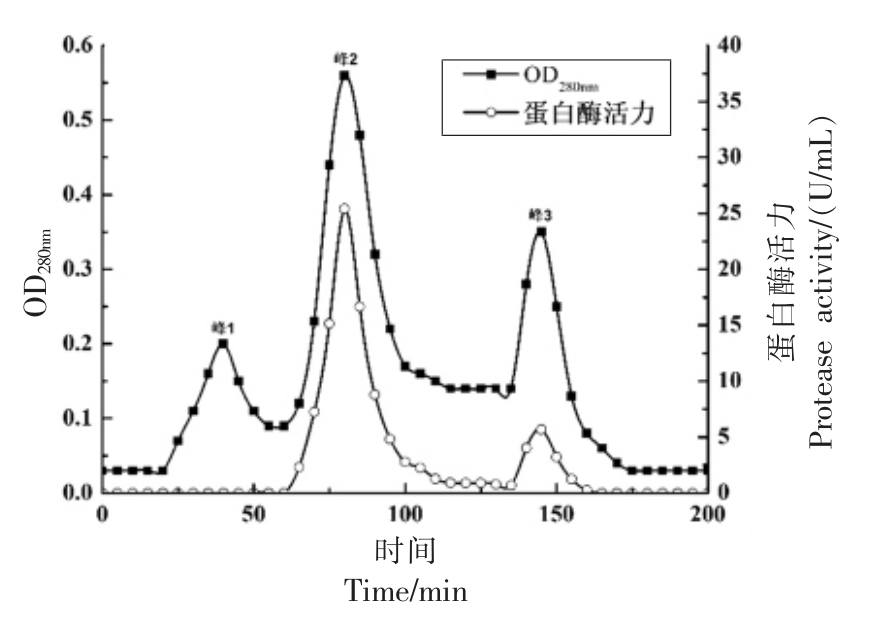
图3 蜜环菌中性蛋白酶DEAE Sepharose Fast Flow 洗脱曲线
Fig.3 Neutral protease of Armillaria mellea DEAE Sepharose Fast Flow elution curve
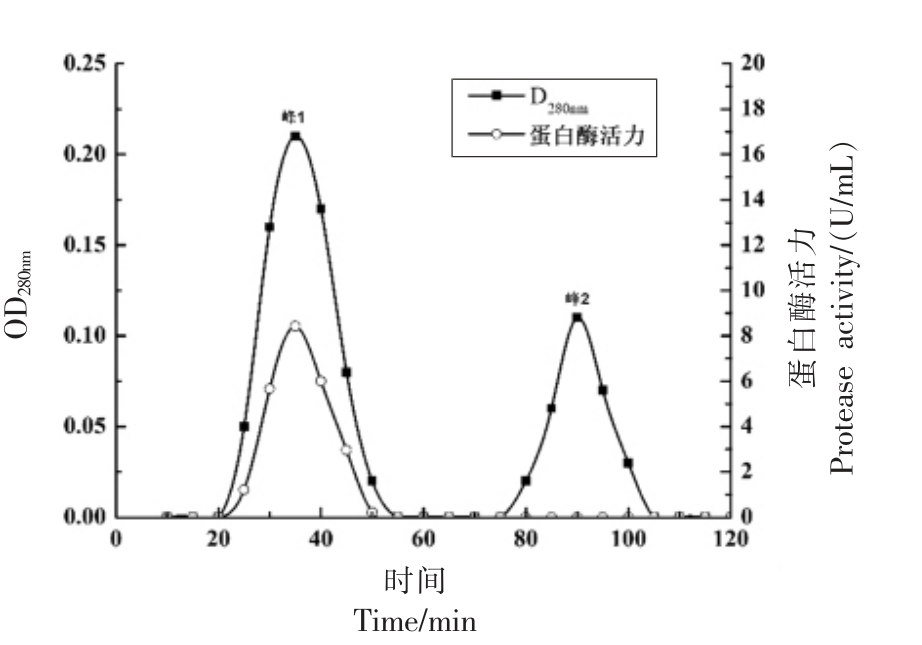
图4 蜜环菌中性蛋白酶Sephadex G-50 葡聚糖层析洗脱曲线
Fig.4 Elution curve of neutral protease of Armillaria mellea Sephadex G-50 dextran chromatography
2.3 中性蛋白酶分子质量的测定及纯化结果
采用SDS-PAGE 聚丙酰胺凝胶电泳检测中性蛋白酶的纯化情况,纯化结果如图5 及表1 所示。经过SDS-PAGE 凝胶电泳,在电泳图中呈现为单一条带,说明纯化后中性蛋白酶已达到电泳纯,对比样品蛋白质相对迁移距离与已知分子质量标准蛋白的相对迁移距离,经过计算得出蛋白酶的分子质量为18.4 ku。
表1 蜜环菌中性蛋白酶纯化参数
Table 1 Purification parameters of neutral protease from Armillaria mellea
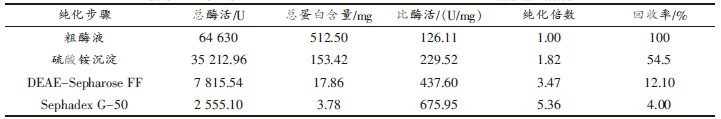
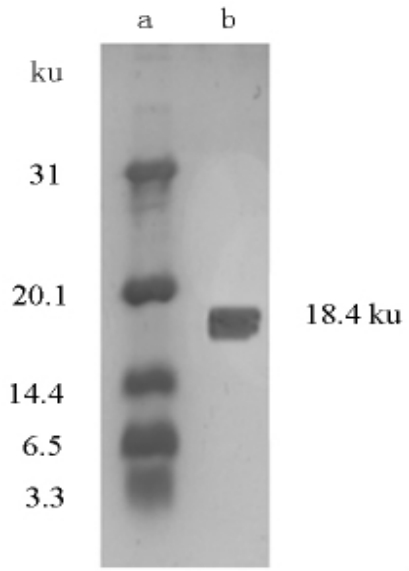
图5 纯化后蜜环菌中性蛋白酶的SDS-PAGE图
Fig.5 SDS-PAGE diagram of purified neutral protease from Armillaria mellea
注:a.Marker;b.葡聚糖层析。
蜜环菌中性蛋白酶纯化结果如表1 所示,经纯化后,比酶活达到675.95 U/mg,纯化倍数为5.36,回收率为4.0%,提示已从粗酶液中纯化得到高纯度的中性蛋白酶,说明该方法具有较好的纯化效果,在整个纯化过程中,所需时间短、工艺操作简单,因此可为其它酶制剂的工业化生产提供参考。
2.4 酶学性质研究
2.4.1 最适温度及温度稳定性 酶促反应会随着温度的升高反应加快,温度过高会导致蛋白酶变性失活,反应速率下降[16]。由图6 可知,该酶的最佳反应温度为60 ℃,在30~60 ℃时,随着温度的升高,蛋白酶活力逐渐增大,温度超过60 ℃时,酶活力不断降低,在70 ℃时检测到样品仍保持80%以上的相对酶活,说明该酶具有一定的耐高温性,80 ℃时酶活力损失严重,90 ℃基本丧失酶活力。表明该酶能够在较广的温度范围中发生酶促反应,这有利于在食品、医药领域的研究与应用。
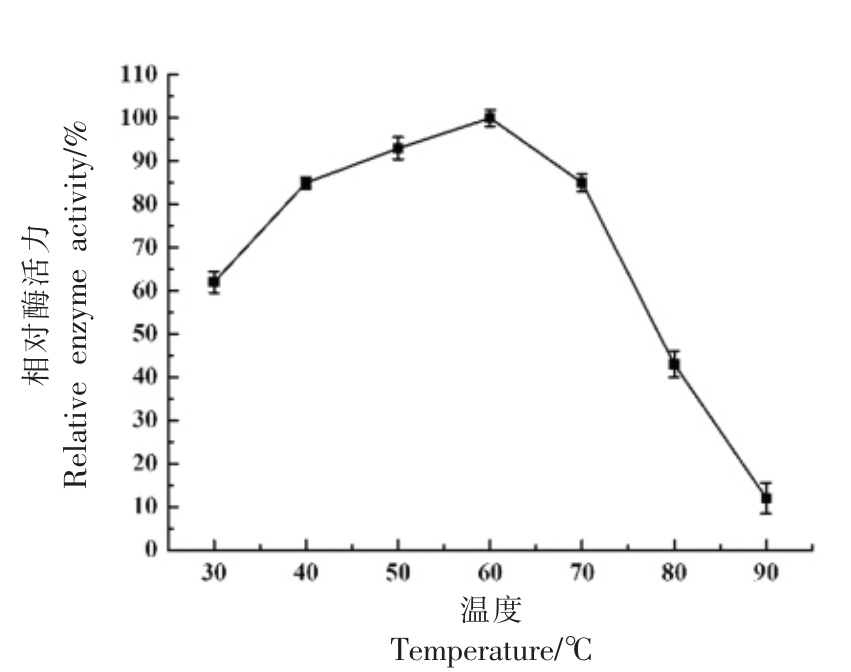
图6 温度对蜜环菌中性蛋白酶活力的影响
Fig.6 Effects of temperature on the activity of neutral protease from Armillaria mellea
由图7 可知,在温度为40~50 ℃时,保温120 min 酶活基本没有损失,说明该酶在40~50 ℃的稳定性最好;在60 ℃保温90 min 后仍检测到60%的酶活并且在高温条件下失活缓慢,说明该酶在40~60 ℃具有较好的温度稳定性,相比于从米曲霉分离出的中性蛋白酶具有更广泛的温度反应范围及温度稳定性[17]。
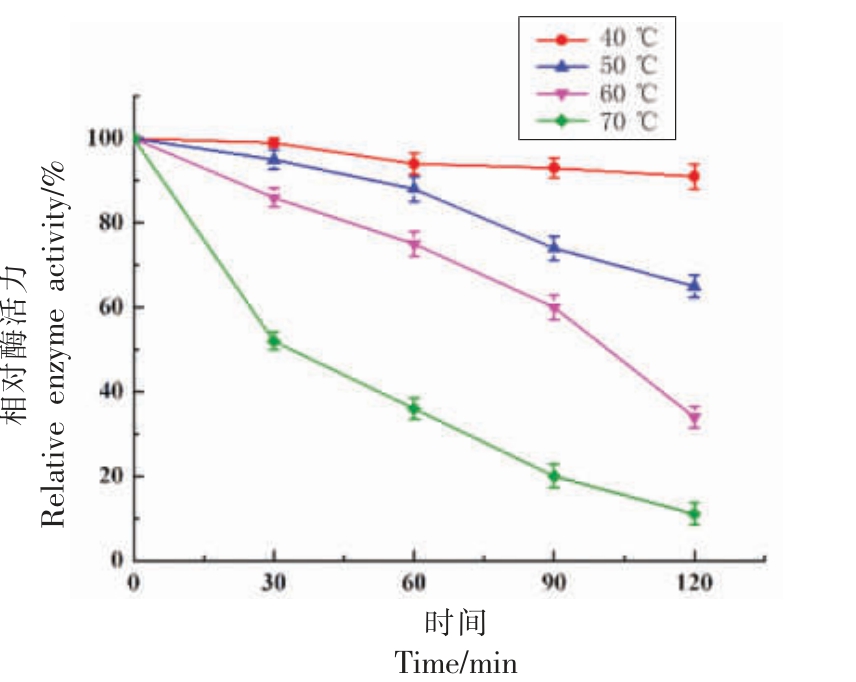
图7 温度对蜜环菌中性蛋白酶稳定性的影响
Fig.7 Effects of temperature on the stability of neutral protease from Armillaria mellea
2.4.2 最适pH 值及pH 值稳定性 不同的pH值会改变蛋白酶活性基团和底物某些基团的解离状态,影响蛋白酶与底物的结合[18-19]。pH 值过低或者过高会导致蛋白酶结构改变,从而丧失活性。如图8 所示,在pH 值3~8 之间,中性蛋白酶活力随着pH 值的升高而快速上升,pH 值8 时达到最高值,随后随着pH 值的升高而酶活力逐渐下降,当pH 值超过10 时,酶活力急速降低,表明该蛋白酶最适pH 值为8。
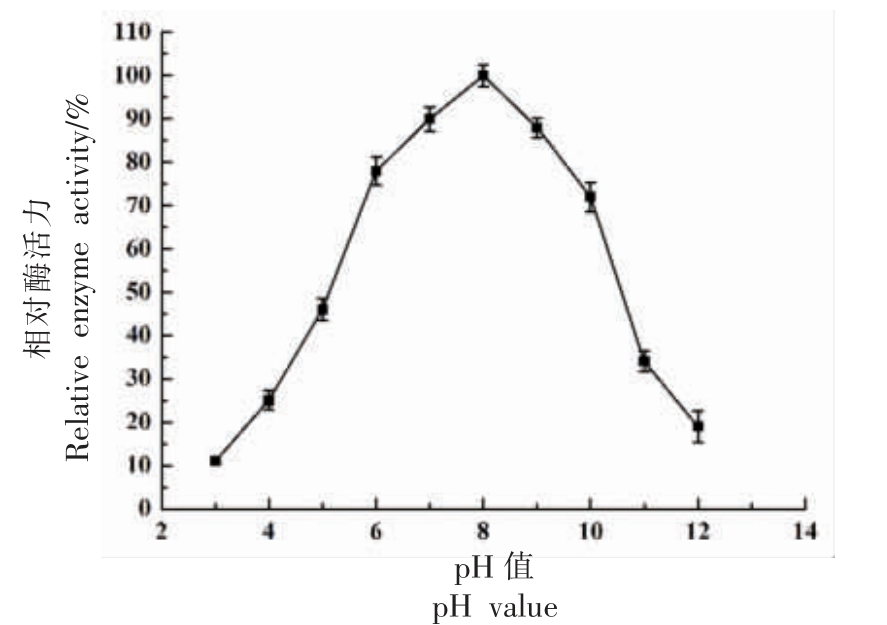
图8 pH 值对蜜环菌中性蛋白酶活力的影响
Fig.8 Effects of pH value on neutral protease activity from Armillaria mellea
由图9 可知,在pH 值6 和pH 值7 的条件下120 min 酶活基本没有损失,说明该蛋白酶在pH值6~7 的稳定性最好;当pH 值8 时120 min 后仍检测到55%的酶活,而在相对较强碱性条件下酶活力急速下降,说明该蛋白酶在pH 值6~8 具有较好的pH 值稳定性。本文中的蜜环菌中性蛋白酶的pH 值稳定性与报道的米曲霉耐盐蛋白酶[20]、贝莱斯芽孢杆菌蛋白酶相似[21]。
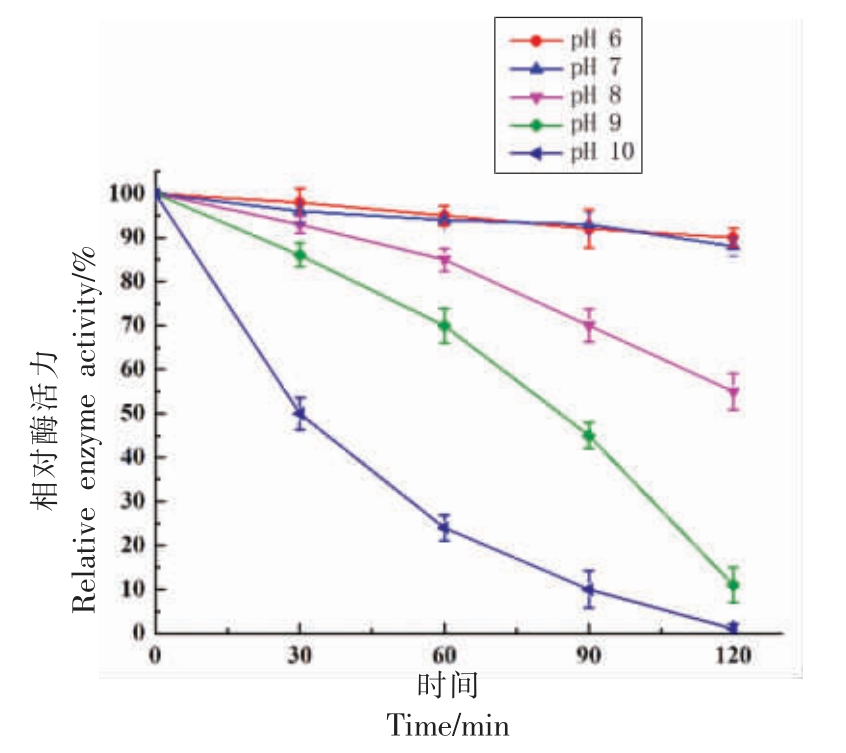
图9 pH 值对蜜环菌中性蛋白酶稳定性的影响
Fig.9 Effects of pH value on the stability of neutral protease from Armillaria mellea
2.4.3 金属离子对中性蛋白酶活力的影响 金属蛋白酶是以金属离子为活性中心,添加金属离子可以激活蛋白酶,促进酶促反应,部分金属离子也可以抑制蛋白酶的活性,因此,研究金属离子对蛋白酶活的影响可以有效规避抑制该酶的金属离子,选择具有促进蛋白酶的金属离子作为辅酶,达到提高酶促反应速率的目的[22-23]。本文考察了Ca2+、Mg2+、Mn2+、Fe2+、Cu2+、Zn2+、Li+、Ba2+、Fe3+、K+对中性蛋白酶活的影响,结果如图10 所示。Mn2+和Cu2+能够促进酶活力,Mn2+的促进作用更为明显,相对酶活达到157%,Fe2+对中性蛋白酶活有一定的抑制作用。该酶受其它离子影响较小,可能是因为其中一部分离子在细胞内外分布较为常见,部分离子可供细胞正常生存,同时也可以调节细胞内外渗透压。
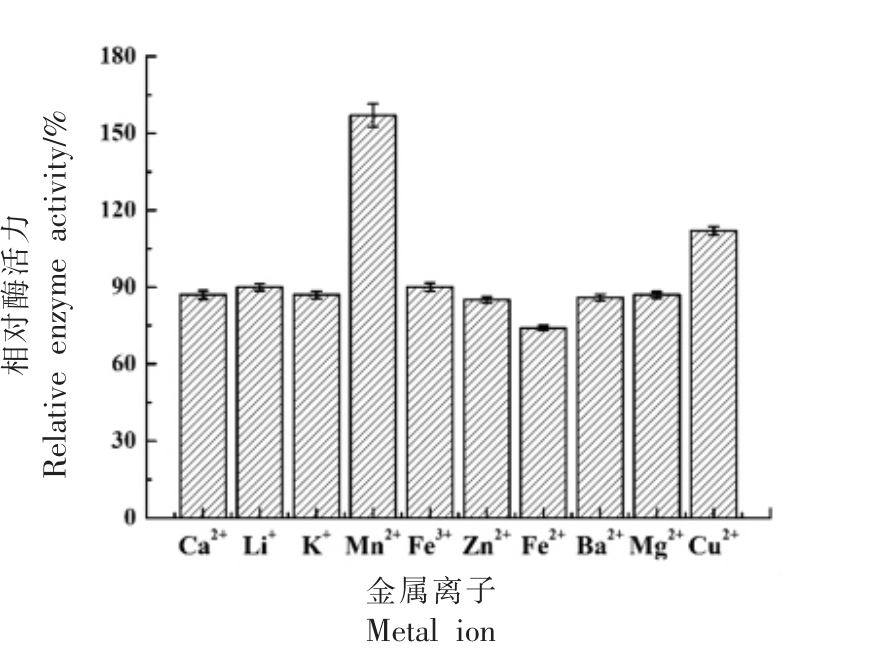
图10 金属离子对蜜环菌中性蛋白酶活力的影响
Fig.10 Effects of metal ions on the activity of neutral protease from Armillaria mellea
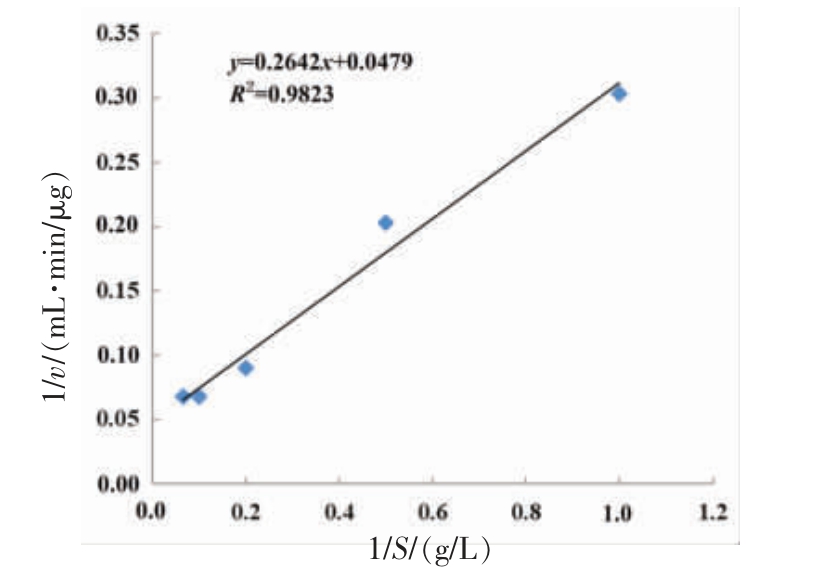
图11 蜜环菌中性蛋白酶的米氏常数双倒数图
Fig.11 Double reciprocal diagram of michaelis constant of neutral protease from Armillaria mellea
2.4.4 蛋白酶抑制剂对中性蛋白酶活力的影响蛋白酶抑制剂与蛋白酶活性中心相结合从而达到抑制蛋白酶活性的目的,因此,研究蛋白酶抑制剂对蛋白酶活力的影响可以推断蛋白酶的种类[24-25]。向酶液中加入PMSF、EDTA、IAM 及Urea 4 种抑制剂后,分别测定相对酶活,结果如表2 所示。经测定加入EDTA 的酶液中相对酶活力最低为40.2%,说明EDTA 对该蛋白酶活有明显的抑制作用,据报道EDTA 对米曲霉中性蛋白酶[26]、解淀粉芽孢杆菌B3 蛋白酶[27]均具有一定的抑制作用,证明金属在蛋白酶活力方面起重要作用,推测蜜环菌中性蛋白酶属于金属蛋白酶家族。加入PMSF、IAM 和Urea 的酶液中蛋白酶活均在90%以上,说明这3 种蛋白酶抑制剂对中性蛋白酶均无明显抑制作用。
表2 蛋白酶抑制剂对蜜环菌中性蛋白酶活力的影响
Table 2 Effects of protease inhibitors on neutral protease activity from Armillaria mellea
2.4.5 酶学动力常数的测定 米氏方程反应了底物浓度与反应速率的关系,米氏常数是重要的动力学参数,它的大小表明了酶与底物的亲和度[28-29]。米氏常数的测定方法为Lineweaver-Burk 方程和Hanes 作图法,通过双倒数法测得米氏常数Km=3.786 mg/mL,最大反应速度为vmax=20.876 μg/(mL·min),相比于吴贇婷[30]分离出的一种枯草芽孢杆菌中性蛋白酶,蜜环菌中性蛋白酶的米氏常数更小,与底物结合性更好,在实际生产中具有更大的潜力和应用前景。
2.4.6 底物的选择性 选择酪蛋白、BSA 和脱脂奶粉为3 种底物,利用蜜环菌中性蛋白酶进行水解试验,结果如图12 所示。酪蛋白属于疏水性蛋白,不易溶于水,BSA 为亲水性蛋白,极易溶于水,脱脂奶粉介于两者之间的混合蛋白,由图12 可知中性蛋白酶对酪蛋白的水解度最好,说明该蛋白对疏水键有较好的作用,更易于分解疏水性蛋白。
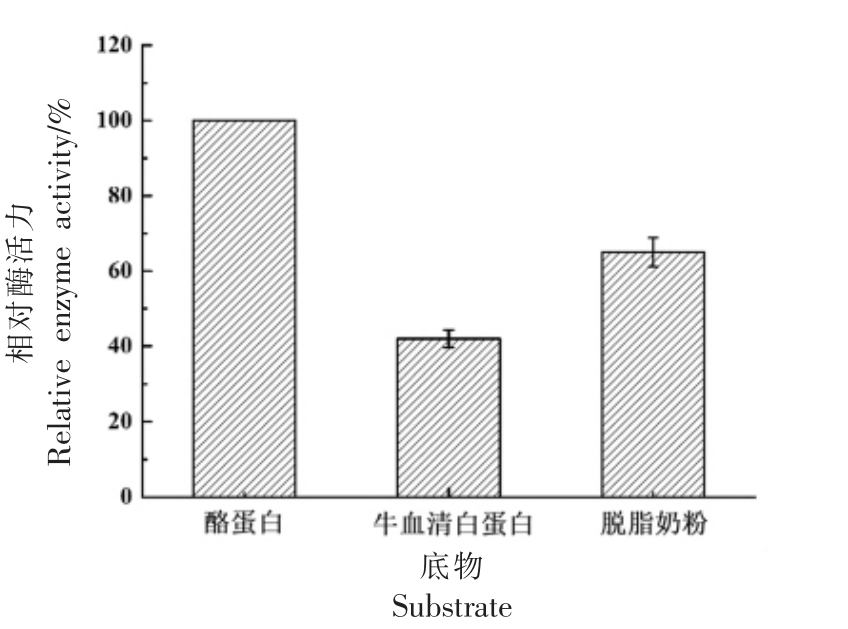
图12 蜜环菌中性蛋白酶对不同底物的水解活性
Fig.12 Hydrolytic activity of neutral protease from Armillaria mellea to different substrates
2.5 玉米醇溶蛋白水解度的测定
分别用纯化后的中性蛋白酶与市售的中性蛋白酶在60 ℃、pH 值为8 时水解玉米醇溶蛋白,比较二者的水解度。由表3 可知,蜜环菌蛋白酶水解度虽然略低于市售的中性蛋白酶,但并无明显差异,以上结果可以为从蜜环菌液态发酵玉米醇溶蛋白产物中分离出的中性蛋白酶为蛋白酶制剂的新品种的研发提供理论基础。
表3 不同中性蛋白酶对玉米醇溶蛋白水解度的影响结果
Table 3 Effects of different neutral proteases on hydrolysis degree of zein
3 结论
本文以蜜环菌发酵玉米醇溶蛋白,其产物经分离纯化得到一种分子质量为18.4 ku 的中性蛋白酶,说明该方法纯化效果良好,能够为工业分离纯化其它蛋白提供参考。在对纯化后的中性蛋白酶开展酶学性质研究发现,该酶的最适温度为60℃,pH 值为8 时酶活力最高,能在较高的温度及较宽的pH 值范围内保持较高的稳定性,具有优良的酶学性质、广泛的温度反应范围及温度稳定性,温度稳定性高的蛋白酶在工业生产中有缩小成本、提高效率等优势;EDTA 作为一种金属离子络合剂,对中性蛋白酶活有明显的抑制作用,除此之外,蜜环菌中性蛋白酶与底物结合性更好,最佳作用底物为酪蛋白,同时,蜜环菌产中性蛋白酶水解玉米醇溶蛋白能力与市售中性蛋白酶相比无明显差异,具有开发应用价值。
综合来看,本文可提高玉米醇溶蛋白利用率并且增加其经济收益,以上结果为蜜环菌中性蛋白酶在食品、医药等行业的生产与研究中提供了理论依据,为大型食药用真菌来源蛋白酶的开发与应用提供了一定的研究基础,未来可进一步深入开展蛋白酶的结构、催化特性等方面的研究。
[1] ZHU X X,HUA Y F,LI X F,et al.Growing of fungi on the stored low denatured defatted soybean meals and the hydrolysis of proteins and isoflavone glycosides by fungal enzymes[J].Food Research International,2023,163:112261.
[2] PADARIYA M,BAGINSKI M,BABAK M,et al.Organic solvents aggregating and shaping structural folding of protein,a case study of the protease enzyme[J].Biophysical Chemistry,2022,291:106909.
[3] BU X R,WANG H H,WANG Y J,et al.Effects of iron-catalyzed oxidation and methemoglobin oxidation systems on endogenous enzyme activity and myofibrillar protein degradation in yak meat[J].Food Chemistry,2023,404:134647.
[4] ZAREI M,GHANBARI R,ZAINAL N,et al.Inhibition kinetics,molecular docking,and stability studies of the effect of papain-generated peptides from palm kernel cake proteins on angiotensin-converting enzyme(ACE)[J].Food Chemistry:Molecular Sciences,2022,5:100147.
[5] LI Y L,RUAN S Y,ZHOU A Q,et al.Ultrasonic modification on fermentation characteristics of Bacillus varieties:Impact on protease activity,peptide content and its correlation coefficient[J].LWT,2022,154:112852.
[6] HADDAR A,HMIDET N,GHORBEL B O,et al.Alkaline proteases produced by Bacillus licheniformis RP1 grown on shrimp wastes:Application in chitin extraction,chicken feather-degradation and as a dehairing agent[J].Biotechnology &Bioprocess Engineering,2011,16:669-678.
[7] 张彩妮,邓百万,柏秋月,等.富硒条件下蜜环菌菌株硒耐受性及胞外酶生物活性的研究[J].微生物学报,2022,62(2):640-649.ZHHANG C N,DENG B W,BAI Q Y,et al.Study on selenium tolerance and extracellular enzyme biological activity of Armillaria mellea strains under selenium-rich conditions[J].Journal of Microbiology,2022,62(2):640-649.
[8] 贺元川,罗昌树,卫秋阳,等.退化和复壮蜜环菌菌株几个胞外酶活性的比较及转录组分析[J].食用菌学报,2022,29(3):10-18.HE Y C,LUO C S,WEI Q Y,et al.Comparison and transcriptome analysis of several extracellular enzyme activities of Armillaria mellea strains degraded and rejuvenated[J].Journal of Edible Fungi,2022,29(3):10-18.
[9] RAINA D,KUMAR V,SARAN S.A critical review on exploitation of agro-industrial biomass as substrates for the therapeutic microbial enzymes production and implemented protein purification techniques[J].Chemosphere,2022,294:133712.
[10] 文超婷,郑明珠,修琳,等.羊肚菌生物转化玉米醇溶蛋白液体发酵工艺优化[J].中国粮油学报,2016,31(2):103-108.WEN C T,ZHENG M Z,XIU L,et al.Optimization of the liquid fermentation process for the biotransformation of corn gliadin by Morchella esculenta[J].Chinese Journal of Cereals and Oils,2016,31(2):103-108.
[11] 佟维娜,蔡丹,郑明珠,等.羊肚菌固态发酵玉米蛋白粉的研究[J].中国粮油学报,2017,32(1):113-118.TONG W N,CAI D,ZHENG M Z,et al.Study on the solid-state fermentation of corn protein powder by Morchella esculenta[J].Chinese Journal of Cereals and Oils,2017,32(1):113-118.
[12] 何音华.蜜环菌发酵玉米蛋白粉产物中活性蛋白分离纯化及功能活性研究[D].长春:吉林农业大学,2018.HE Y H.Study on the isolation,purification and functional activity of active protein from corn protein powder fermented by Armillaria mellea[D].Changchun:Jilin Agricultural University,2018.
[13] WANG K D,TIAN Y P,ZHOU N D,et al.Studies on fermentation optimization,stability and application of prolyl aminopeptidase from Bacillus subtilis[J].Process Biochemistry,2018,74:10-20.
[14] WANG H R,SUN H X,GAO C,et al.A phase separation process induced by pH change for purification of His-tagged protein at low salt concentration[J].Biochemical Engineering Journal,2023,191:108792.
[15] 高兆建,王先凤,芦宁,等.用于高果糖浆制备的宛氏拟青霉嗜热嗜酸菊粉酶酶学特性分析[J].食品科学,2019,40(8):94-100.GAO Z J,WANG X F,LU N,et al.Analysis of the enzymatic characteristics of thermophilic acidophilic inulinase from Paecilomyces vannamei used for the preparation of high fructose syrup[J].Food Science,2019,40(8):94-100.
[16] LANDRY K,LEVIN R.Purification and characterization of iso-ribonucleases from a novel thermophilic fungus [J].International Journal of Molecular Sciences,2014,15(1):944-957.
[17] 冯颖杰.米曲霉蛋白酶的酶学性质及其应用研究[D].无锡:江南大学,2015.FENG Y J.Enzymatic properties and application of Aspergillus oryzae[D].Wuxi:Jiangnan University,2015.
[18] ALAVI F,JAMSHIDIAN M,REZAEI K.Applying native proteases from melon to hydrolyze kilka fish proteins(Clupeonella cultriventris caspia)compared to commercial enzyme Alcalase[J].Food Chemistry,2019,277:314-322.
[19] PRAJAPATI C D,SMITH E,KANE F,et al.Selective enzymatic modification of wool/polyester blended fabrics for surface patterning[J].Journal of Cleaner Production,2019,211:909-921.
[20] 刘艳凤.米曲霉盐胁迫机制解析和耐盐蛋白酶分离纯化、酶学性质研究[D].无锡:江南大学,2018.LIIU Y F.Analysis of salt stress mechanism of Aspergillus oryzae,isolation and purification of salttolerant protease,and study on enzymatic properties[D].Wuxi:Jiangnan University,2018.
[21] 贾仲昕,赵佳男,季芳等.高产中性蛋白酶芽孢杆菌的筛选鉴定及酶学性质研究[J].黑龙江畜牧兽医,2023(1):106-112,132.JIA Z X,ZHAO J N,JI F,et al.Screening and identification of high-yield neutral protease Bacillus and study on its enzymatic properties[J].Heilongjiang Animal Husbandry and Veterinary Medicine,2023(1):106-112,132.
[22] JERVIAN J,YANG Y H,DOO-GEUN L,et al.Expression,purification and characterization of halophilic protease Pph_Pro1 cloned from Pseudoalteromonas phenolica[J].Protein Expression and Purification,2018,152:46-55.
[23] MOREIRA K A,PORTO T S,TEIXEIRA M,et al.New alkaline protease from Nocardiopsis sp.:Partial purification and characterization [J].Process Biochemistry,2004,39(1):67-72.
[24] REKIK H,JAOUADI N Z,GARGOURI F,et al.Production,purification and biochemical characterization of a novel detergent-stable serine alkaline protease from Bacillus safensis strain RH12[J].International Journal of Biological Macromolecules,2018,121:1227-1239.
[25] 李晨,高柳芳,崔晓东,等.草鱼胰蛋白酶的亲和纯化及酶学性质[J].食品科学,2021,42(10):178-183.LI C,GAO L F,CUI X D,et al.Affinity purification and enzymatic properties of grass carp trypsin[J].Food Science,2021,42(10):178-183.
[26] 余茜.米曲霉中性蛋白酶的分离纯化及Cu2+对其酶学性质的影响[D].雅安:四川农业大学,2018.YU Q.Isolation and purification of neutral protease from Aspergillus oryzae and the effect of Cu2+ on its enzymatic properties[D].Ya'an:Sichuan Agricultural University,2018.
[27] 周婉婷,侯宏伟,贺瑞琦,等.豆豉中产蛋白酶菌株的酶学性质及风味酶基因挖掘[J].食品与发酵工业,2022,48(24):181-193.ZHOU W T,HOU H W,HE R Q,et al.Enzymatic properties of protease-producing strains from fermented soybeans and gene mining of flavor enzymes[J].Food and Fermentation Industry,2022,48(24):181-193.
[28] MOUNA B E,NADIA Z J,HATEM R,et al.Biochemical and molecular characterization of new keratinoytic protease from Actinomadura viridilutea DZ50[J].International Journal of Biological Macromolecules,2016,92:299-315.
[29] 秦日甜,卢玉丽,梁高丽,等.镰刀菌Q7-31T 金属蛋白酶FQME14 的分离纯化及鉴定[J].生物技术通报,2018,34(4):161-167.QIN R T,LU Y L,LIANG G L,et al.Isolation,purification and identification of Fusarium sp.Q7-31T metalloproteinase FQME14[J].Biotechnology Bulletin,2018,34(4):161-167.
[30] 吴赟婷.耐高温中性蛋白酶生产菌株的筛选鉴定、发酵过程优化及其酶学性质研究[D].杭州:浙江工商大学,2018.WU Y T.Screening and identification of heat-resistant neutral protease producing strains,optimization of fermentation process and study on enzymatic properties[D].Hangzhou:Zhejiang University of Technology and Industry,2018.