大米粉味道平淡,颜色浅白,具有高消化率和低致敏性,常用作无麸质产品的原料。与小麦粉制作的产品相比,大米粉缺乏与面团黏弹特性有关的面筋蛋白,也称麸质蛋白,会影响米制产品的品质,如米面条的口感不佳,弹韧性差,产品成型困难,米面包体积小,颜色差,面包屑碎,消费者接受度低等问题。因此,为无麸质产品提供必要的蛋白网络结构,是生产高质量米制品的一项重大技术挑战。
挤压是一种优良的物理改性方法,适用于工业化和连续化生产。在挤出机高温、高压、高剪切的协同作用下,蛋白质的结构会展开并重新交联,导致维持蛋白质三级和四级结构的结合力减弱,蛋白质的空间构象改变并发生变性[1-2]。在无麸质产品生产中添加非麸质蛋白可以对产品结构、质地、感官特性以及营养质量产生积极影响。乳清分离蛋白(Whey protein isolate,WPI)具有高溶解度和亲水性,可引发结构络合,有效改善大米蛋白的网络结构。Wang 等[3]挤压乳清分离蛋白浓缩物制备高营养蛋白棒,蛋白组织内部出现多个通道和较大的不规则空腔,为水的渗透提供了很好的途径,从而提高了蛋白质的持水性。大豆分离蛋白(Soy protein isolated,SPI)具有很强的持水能力,在搅拌过程中会迅速吸水,可改变米面团的流变特性。Noguchi 等[4]通过挤压蒸煮制备添加SPI 的强化米粉,扫描电镜的结果显示挤压强化米粉的气室位置聚集在内部,且密度较高,导致强化米粉具有更高的韧性。
本研究将WPI 和SPI 作为外源蛋白质与大米粉混合后挤压,利用傅里叶变换红外光谱仪、扫描电镜、粒径仪和荧光分光光度计等仪器检测挤压混合米粉蛋白的特性,探究米粉蛋白网络结构和功能特性的变化,为大米粉在无麸质食品开发中的应用提供新思路。
1 材料与方法
1.1 材料与试剂
大米,黑龙江北大荒米业有限责任公司;WPI、SPI,谷之味生物科技有限公司;盐酸、EDTA、尿素,西陇化工股份有限公司;β-巯基乙醇、Tris,上海麦克林生化科技有限公司;甘氨酸,北京博奥拓科技有限公司;所用化学试剂均为分析纯级。
1.2 主要设备与仪器
DC-1500A 高速多功能粉碎机,浙江武义鼎藏日用金属制品厂;DSE-25 双螺杆挤压膨化机,德国布拉本德公司;NP-H2-16K 台式高速离心机,宁波北角仪器科技集团有限公司;FJ200-SH高速剪切均质机,上海沪析实业有限公司;Nano-ZS90 粒度分析仪,英国马尔文仪器有限公司;F4500 荧光分光光度计,日本日立公司;Nicolet 380 型傅里叶变换红外光谱仪,英国Bio-Logic 集团。
1.3 试验方法
1.3.1 双蛋白混合挤压米粉的制备 双蛋白混合米粉的挤压工艺流程为:大米→粉碎→过80 目筛→添加蛋白【WPI ∶SPI=1 ∶3(m/m)】→调节水分(28%)→挤压(蛋白添加量10%,挤压温度123℃,螺杆转速126 r/min)→干燥→粉碎→过80 目筛→混合米粉样品,4 ℃保存备用。
1.3.2 蛋白的提取 将大米粉、挤压米粉、双蛋白混合挤压米粉分别与0.4%NaOH 溶液按料液比1 ∶10 放入到烧杯中浸泡24 h,4 000 r/min 离心20 min,去除沉淀和泛黄层,保留上清液;用盐酸调节上清液的pH 值为4.8,4 000 r/min 继续离心20 min,去除上清液;用去离子水重复离心,直至上清液完全澄清。将得到的蛋白质冻干,粉碎过120 目筛,分别得到大米蛋白(Rice protein,RP)、挤压米粉蛋白(Protein of extruded rice flour,ERP)、双蛋白混合挤压米粉蛋白(Soy protein isolated-whey protein isolate-protein of extruded rice flour,SPIWPI-ERP)。
1.3.3 巯基及二硫键含量的测定 参照Shimada等[5]的方法并略作修改。游离巯基含量的测定,使用pH 7.0 磷酸盐缓冲溶液将样品稀释成5 mg/mL溶液,分别取2 mL 样品溶液加入5 mL Tris-Gly缓冲液(0.086 mol/L Tris,0.10 mol/L Glycine,4 mmol/L EDTA,pH 8.0)后,充分振荡,加入30 μL Ellman 试剂(4 mg/mL,20 mg DTNB 溶解于5 mL Tris-Gly 缓冲液)后避光静置1 h,10 000 r/min 离心10 min,取上清液测定其在波长412 nm 处的吸光度(A412nm),对照组不加Ellman 试剂。每组样品测定3 次。
总巯基含量测定,分别取2 mL 样品溶液(5 mg/mL),依次加入5 mL Tris-Gly-Urea(0.086 mol/L Tris,0.10 mol/L Glycine,4 mol/L EDTA,8 mol/L Urea,pH 8.0)与10 mmol/L β-巯基乙醇的混合溶液,30 μL Ellman试剂(4 mg/mL,20 mg DTNB 溶解于5 mL Tris-Gly 缓冲液)后,避光静置1 h,10 000 r/min 离心10 min。取上清液并稀释10 倍测定其在波长412 nm 处的吸光度,对照组不加Ellman 试剂。每组样品测定3 次。巯基和二硫键含量计算公式如下。

式中:73.53 为Ellman 试剂的摩尔消光系数;D 为稀释系数;C 为蛋白质质量浓度,mg/mL。
1.3.4 粒径和Zeta-电位的测定 将样品分别稀释至1 mg/mL,0.45 μm 滤膜过滤后,注入样品池中进行测量,用粒度仪依次进行粒径和Zeta-电位的测定[6],重复测定3 次。
1.3.5 傅里叶变换红外光谱分析 分别将冻干样品与干燥KBr 在研钵中充分研磨,放入压模模具,在20 MPa 的压力下保持1~2 min,压片呈半透明状态。使用红外光谱仪在4 000~400 cm-1 下扫描样品,监测样品中各种化学键的变化[7]。使用Peak Fitv 4.12 软件处理1 600~1 700 cm-1 酰胺Ⅰ带红外曲线,并分析蛋白质二级结构的变化。
1.3.6 荧光光谱的测定 用0.01 mol/L 的NaOH分别将样品稀释为质量浓度0.05 mg/mL 的蛋白溶液。激发光谱扫描条件为:发射波长290 nm,激发波长300~400 nm,狭缝宽度5 nm,扫描速度240 nm/min,电压70 mV,重复测定3 次[8]。
1.3.7 微观结构的测定 分别将样品固定脱水后,用体积比1 ∶1 的100%乙醇和叔丁醇置换1次,再用纯叔丁醇置换2 次,然后将样品在冷冻干燥机中干燥4 h。镀金后利用SEM 在1 500 倍和200 倍下观察样品的微观结构[9]。
1.3.8 溶解度的测定 分别将500 mg 蛋白溶解在10 mL 0.1 mol/L pH 7.0 的磷酸盐缓冲液中,6 000 r/min 离心10 min。取1 mL 上清液加入4 mL双缩脲试剂反应30 min,在波长540 nm 处测定离心前、后各溶液的吸光值,并绘制标准曲线(图1),计算对应的蛋白质浓度[10]。每组样品测定3次。计算方法见式(3)。
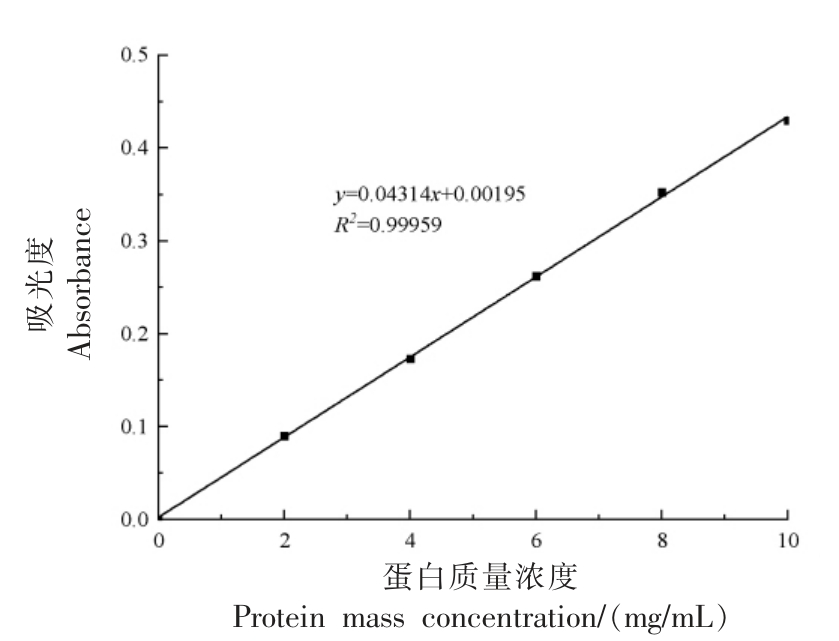
图1 蛋白质溶解度标准曲线
Fig.1 Standard curve of protein solubility
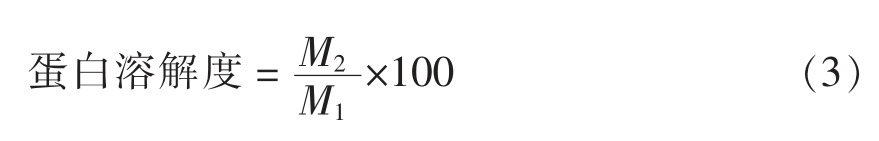
式中:M1 为离心前溶液中蛋白质含量,mg;M2为离心后上清液中蛋白质含量,mg。
1.3.9 持水性的测定 分别称取0.1 g 待测蛋白样品,分散于10 mL 蒸馏水中,磁力搅拌1 h,移入离心管中,10 000 r/min 离心15 min,弃去上清液,称量离心管的质量[11]。蛋白样品的持水性(Water holding capacity,WHC)的计算方法见公式(4)。
式中:m0 为样品质量,g;m1 为空离心管质量,g;m2 为沉淀样品和离心管的总质量,g。
1.3.10 泡沫性和起泡稳定性的测定 分别将蛋白样品配成1%(0.15 mg 样品;15 mL 0.4%的NaOH)的溶液,用均质机将提取的蛋白质在12 000 r/min 搅拌2 min,将分散后的溶液马上倾倒于量筒中,记录此时泡沫和液体的体积,静置30 min 后,再次记录泡沫和液体的体积[12]。蛋白起泡性(Foaming capacity,FC)和泡沫稳定性(Foam stability,FS)分别按如下公式计算。
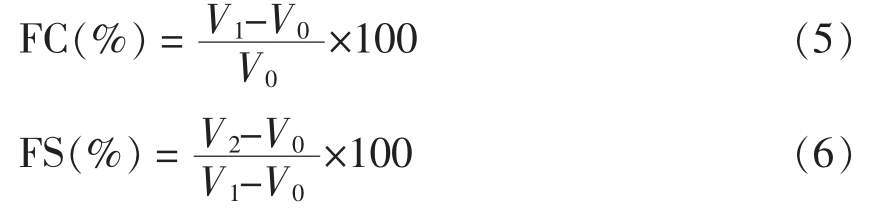
式中:V0 为溶解样品水溶液的体积,mL;V1 为均质停止时泡沫和液体的总体积,mL;V2 为30 min 后泡沫和液体的总体积,mL。
1.3.11 乳化性和乳化稳定性的测定 将待测样品分别配制成20 mg/mL(0.5 g 样品;25 mL 水)的蛋白溶液。取25 mL 蛋白溶液,搅拌并加入8 mL大豆油,在10 000 r/min 下均质2 min,用0.1%的十二烷基硫酸钠溶液稀释至10 mL,在波长500 nm 下测定吸光度(A0),按 式(7)计算乳化活性(Emulsifying activity index,EAI)。取测定乳化活性后在室温下放置30 min 的乳浊液,同上述方法测定吸光度(At),按式(8)计算蛋白乳化稳定性(Emulsion stability index,ESI)[13]。
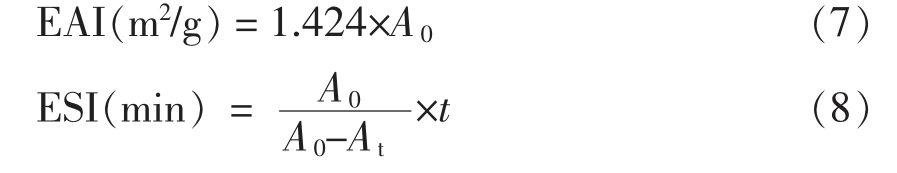
式中:t 为静置时间30 min。
2 结果与分析
2.1 RP、ERP 和SPI-WPI-ERP 巯基及二硫键含量
RP、ERP 和SPI-WPI-ERP 的巯基和二硫键含量见图2。
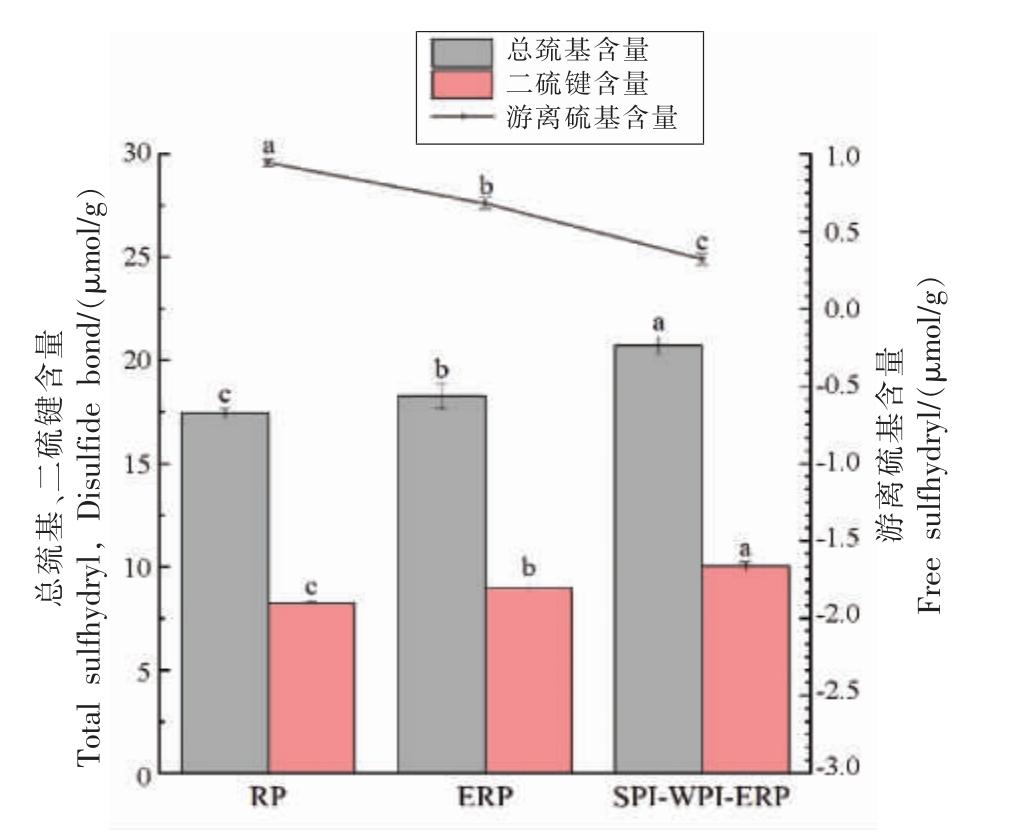
图2 RP、ERP 和SPI-WPI-ERP 巯基及二硫键含量
Fig.2 RP,ERP and SPI-WPI-ERP sulfhydryl group and disulfide bond content
注:不同小写字母表示存在显著差异(P<0.05)。
巯基和二硫键在相对刚性结构的形成中起着重要作用,并显著影响蛋白质的功能性质[14]。与RP 相比,ERP 和SPI-WPI-ERP 的游离巯基含量分别下降27.98%和65.8%,二硫键和总巯基含量略增加,蛋白质分子的巯基在挤压过程中发生氧化或与二硫化物交换形成了新的二硫键,可以在分子内部或分子间产生,这表明在挤压过程中蛋白质分子间相互作用的机会增多,形成了分子聚集体[15]。SPI-WPI-ERP 中新生成的二硫键是因SPI 和WPI 中氨基酸的疏水基团相互作用形成的。在形成SPI-WPI-ERP 的刚性结构时,二硫键的作用大于非共价相互作用,这些结果进一步表明SPI 和WPI 在挤压过程中参与了二硫键的重新形成与排列,在分子内或分子间聚集和交联形成大分子网络结构[16]。正如Cabrera-chávez 等[17]所报道在挤压过程中,具有缓冲作用的可溶性蛋白形成了二硫键,维持无麸质产品中所需的蛋白网络结构。
2.2 RP、ERP 和SPI-WPI-ERP 粒径
RP、ERP 和SPI-WPI-ERP 的粒径分布如图3所示。
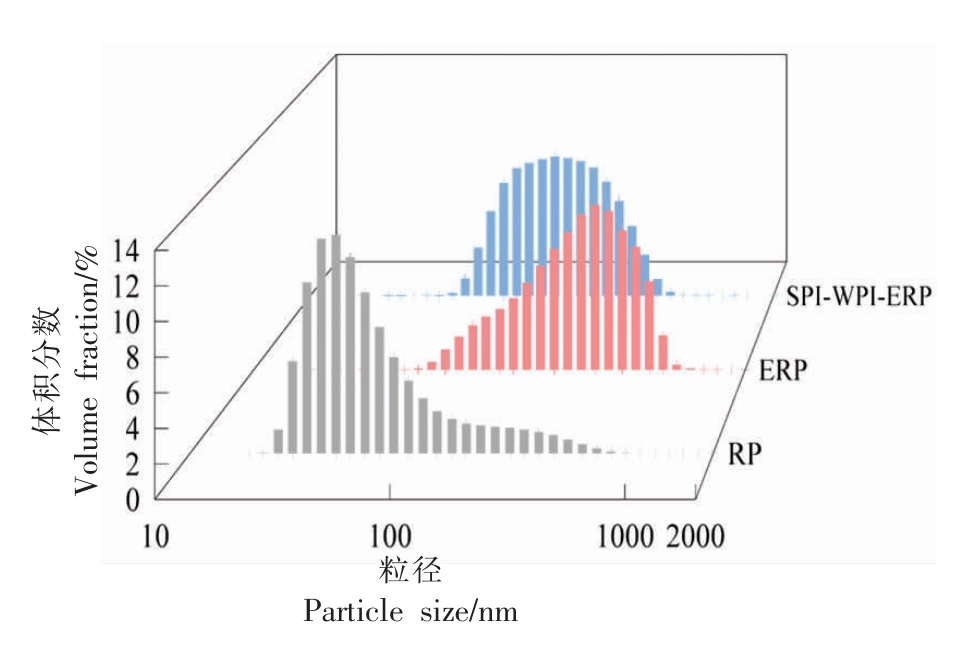
图3 RP、ERP 和SPI-WPI-ERP 的粒径
Fig.3 Particle sizes of RP,ERP and SPI-WPI-ERP
图3 表示蛋白聚集体的粒径变化,可反映挤压后米粉蛋白质的交联和聚集程度。RP 的平均粒径为43.8 nm,ERP 的平均粒径为396 nm,SPIWPI-ERP 平均粒径为164 nm。表明挤压会导致蛋白质的展开,形成较大的热聚集体,使RP 的主峰向更大粒径处转移。ERP 和SPI-WPI-ERP 粒度分布的变化可能是由于挤压导致不稳定蛋白质聚集体的形成和颗粒尺寸的增加[18]。Arzeni 等[19]报道聚集体的形成可能是因为非共价相互作用,如疏水相互作用可能会驱动聚集体。SPI-WPI-ERP 的粒径小于ERP,可能是由于WPI 和SPI 引入了带负电的基团导致蛋白质分子之间产生足够强的静电排斥力,从而减小了蛋白质的粒径[20]。
2.3 RP、ERP 和SPI-WPI-ERP 电位
RP、ERP 和SPI-WPI-ERP 的电位结果如图4所示。
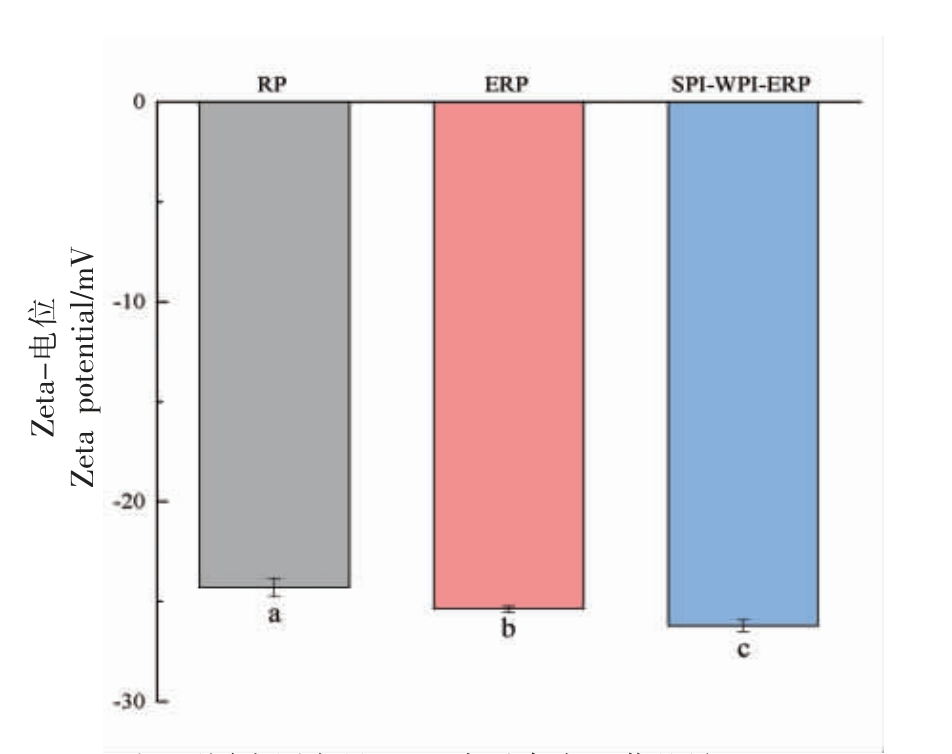
图4 RP、ERP 和SPI-WPI-ERP 的电位
Fig.4 Zeta potential of RP,ERP and SPI-WPI-ERP
注:不同小写字母(a~c)表示存在显著差异(P<0.05)。
RP、ERP 和SPI-WPI-ERP 电位分别为-24.83,-25.24,-26.27 mV,绝对值呈现递增的趋势,说明SPI-WPI-ERP 复合体系呈现较好的稳定性。颗粒的分散和聚集主要取决于它们的有效表面电荷,蛋白质Zeta-电位的绝对值越大,说明样品表面的静电相互作用越强,从而能够抑制蛋白质本身由于疏水性作用而引起的聚集,提高溶液稳定性[21]。通常,如果带正电荷的氨基酸比带负电荷的氨基酸多,则蛋白质溶液的Zeta-电位为正,RP、ERP 和SPI-WPI-ERP 的Zeta-电位均为负,这表明溶液中带负电荷的氨基酸比带正电荷的氨基酸多。这可能是由于挤压处理使蛋白质上的表面负电荷增加,蛋白原有的球状致密结构被破坏,分散为大小不等的球状聚合体,使得各部分的聚合体静电作用更强,使聚合体更稳定[22]。SPI-WPIERP 电位的绝对值进一步增强是因为WPI、SPI与RP 的静电相互吸引作用逐渐增强,阻碍RP 内部聚集,形成了复合凝聚物,因此溶液表现出更小的蛋白质聚集体,使电位进一步增加[23]。这些结果表明,适当的热处理可使RP 分子自身解聚,蛋白三级结构展开,使RP 内部的高度反应性基团暴露出来,阻碍RP 的聚集,有利于溶解性较差的谷蛋白与WPI 和SPI 的静电相互作用形成复合凝聚物,改善RP 的稳定性。
2.4 RP、ERP 和SPI-WPI-ERP 的FT-IR 测定结果
RP、ERP 和SPI-WPI-ERP 的FT-IR 光谱如图5 所示。RP、ERP 和SPI-WPI-ERP 的二级结构如图6 所示。
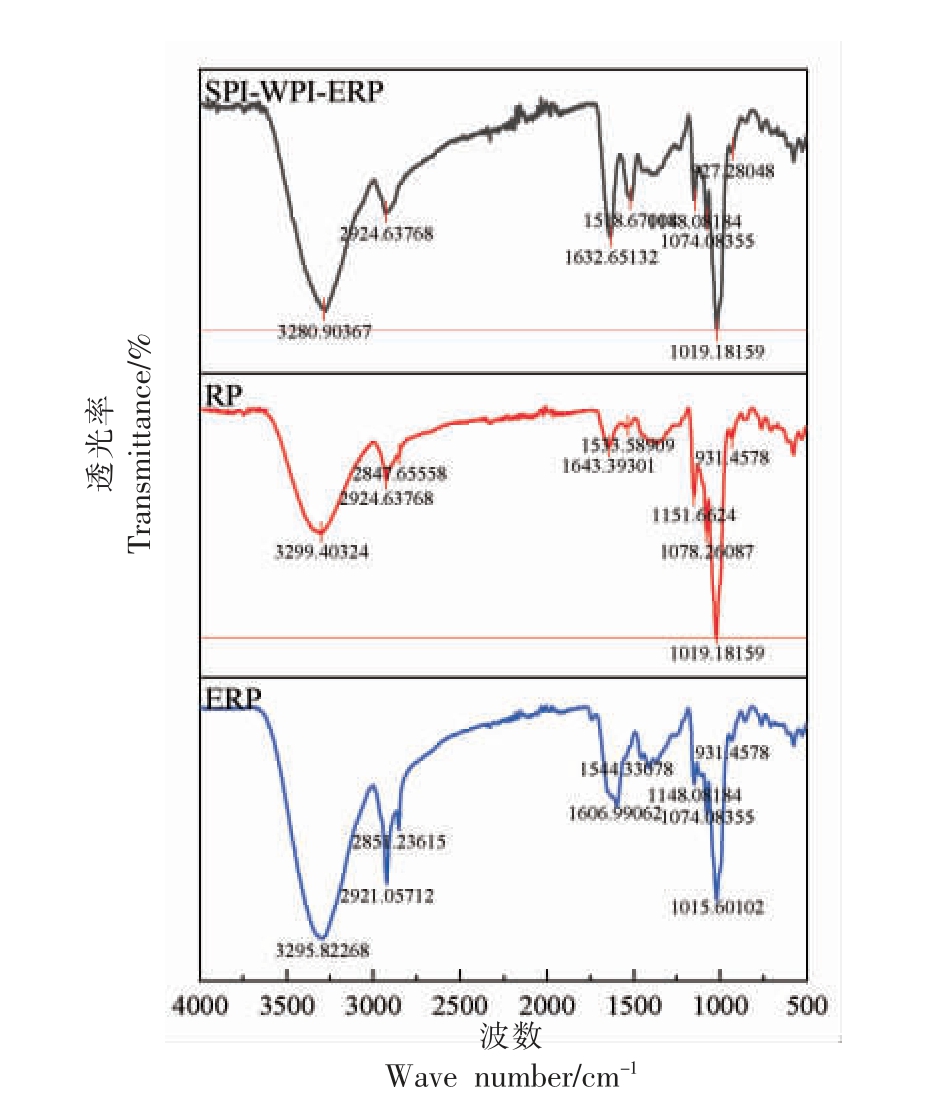
图5 RP、ERP 和SPI-WPI-ERP 的红外光谱图
Fig.5 FT-IR of RP,ERP and SPI-WPI-ERP
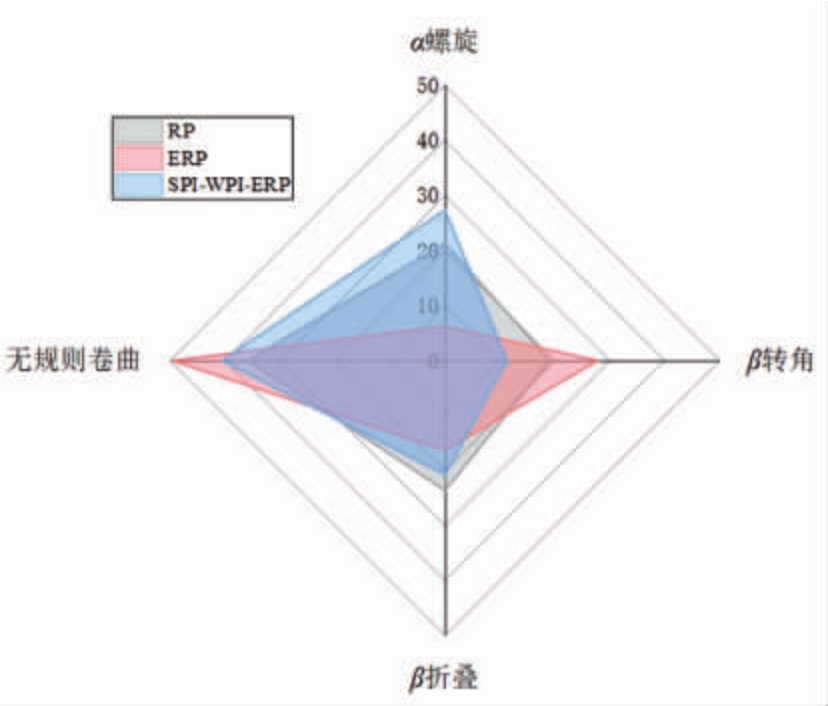
图6 RP、ERP 和SPI-WPI-ERP 的二级结构
Fig.6 Secondary structure of RP,ERP and SPI-WPI-ERP
FT-IR 光谱在2 750~3 600 cm-1 范围内出现的峰主要包含羟基(-OH)、氨基(-NH)、甲基(-CH3)和亚甲基(-CH2)的振动吸收峰,在1 250~1 750 cm-1 范围内出现的峰是酰胺振动区和蛋白质、脂肪酸和多糖的混合区。1 063 cm-1 处的吸收峰是由糖中C-O-C 官能团伸缩振动引起的,930 cm-1 附近出现的吸收峰为糖环骨架的特征吸收峰[24]。500~930 cm-1 范围内存在几个小峰,使其成为指纹区域。RP、ERP、SPI-WPI-ERP 的最大吸收峰波数范围基本相同,特征吸收峰位置、特征指纹和基线趋势相同,然而在同一峰位的吸收强度存在较大差异。这表明化学成分基本不变,振动强度略有不同。挤压导致分子之间的化学键和力发生变化,从而改变了蛋白质的空间结构。
蛋白质二级结构是指蛋白质多肽链中规则重复的构象,由骨架中羰基和酰胺基之间形成的氢键维持。结果表明与RP 相比,ERP 中无序结构的含量增多,可能是由于热和剪切通过蛋白质分子的部分变性,改变了蛋白质的构象,暴露通常隐藏在折叠的天然蛋白质中的基团,导致无序结构增加[25],SPI-WPI-ERP 较ERP 的无序结构含量减少,可能是由于添加SPI 和WPI 的折叠阻力减弱,蛋白质重新聚集形成较稳定的刚性结构。挤压的共混物中淀粉-蛋白质的相互作用涉及氢键,而氢键的数量和强度与系统中蛋白质的数量有关,静电络合物和范德华力也可以在上述观察结果中发挥作用。说明挤压过程中淀粉-蛋白质相互作用导致分子迁移率下降,涉及氢键的-OH 伸缩振动比非氢键对应物具有更低的波数[25]。SPI-WPI-ERP在酰胺I 区、1 063 cm-1 和930 cm-1 附近的峰强度比RP 和ERP 大,表明SPI-WPI-ERP 存在C=O键和糖基化趋势,使蛋白网络结构更加紧密。
2.5 RP、ERP 和SPI-WPI-ERP 荧光光谱测定结果
RP、ERP 和SPI-WPI-ERP 的荧光光谱如图7所示。
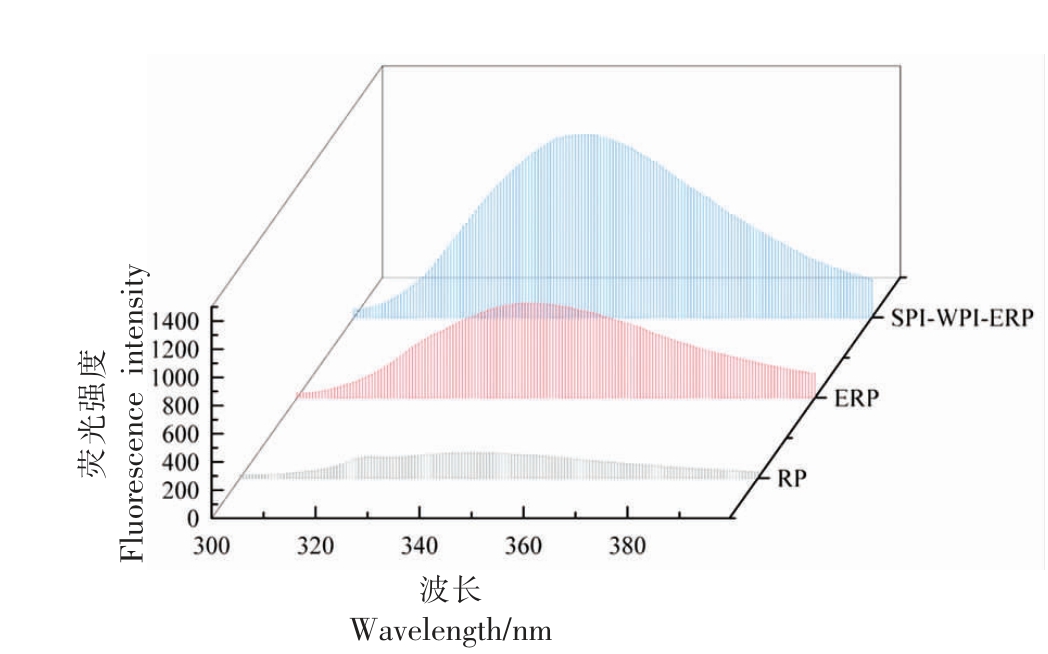
图7 RP、ERP 和SPI-WPI-ERP 的荧光光谱
Fig.7 Fluorescence spectrum of RP,ERP and SPI-WPI-ERP
RP、ERP 和SPI-WPI-ERP 的λmax 分别为342.60,345.00,344.40 nm,荧光强度分别为161.20,179.50,671.00。RP、WPI 和SPI 中蛋白质固有的内源荧光团是色氨酸、酪氨酸和苯丙氨酸的残基,其中色氨酸残基对蛋白质荧光产生主要贡献。在特定波长下会被激发产生荧光以评估氨基酸残基周围的构象变化。这种被激发的荧光属于天然荧光,通过荧光强度和最大发射波长(λmax)可以表示蛋白质三级结构的变化[26]。ERP 和SPIWPI-ERP 的最大荧光发射峰位置发生红移表明挤压使蛋白质部分展开,增加了蛋白质中暴露在分子表面的疏水面积,破坏了蛋白质分子的内部疏水相作用,暴露于极性更大的环境中的生色团数量增加[27]。这些结果表明在挤压加工的高温、高压和高剪切作用下,使最初被掩埋的生色团逐渐暴露,ERP 和SPI-WPI-ERP 的色氨酸残基中的三级结构接触几乎完全丧失。与RP 样品相比,ERP 和SPIWPI-ERP 的荧光强度增加。这是由于在RP 分子内部非极性氨基酸包裹了产生荧光的芳香族氨基酸,而挤压处理后蛋白结构展开,RP 分子内部的芳香族暴露,提高了荧光强度。SPI 和WPI 的加入增加了芳香族氨基酸的含量,使荧光强度进一步增强。
2.6 RP、ERP 和SPI-WPI-ERP 微观结构
RP、ERP 和SPI-WPI-ERP 的SEM 图像如图8所示。

图8 RP、ERP 和SPI-WPI-ERP 的SEM 图像
Fig.8 SEM images of RP,ERP and SPI-WPI-ERP
如图8a、8d 所示,RP 表面呈块状,表现出更多的无序结构和不规则碎片;由图8b、8e 所示,ERP 呈现出整片的薄层结构并夹杂孔状结构;由图8c、8f 所示,SPI-WPI-ERP 展现出交联的网络结构。这说明在挤压过程中RP 发生不同程度的降解及聚合,打破了有序的天然结构,形成片状结构。在米粉中添加SPI 和WPI 并将SPI-WPI-ERF进行挤压,改变了RP 的表面结构,使SPI、WPI 和RP 肽链伸展,分子扩散开来,网络结构重新排列,变得更加规则和密集,导致蛋白质聚集和网络形成。这可能是挤压促进了SPI、WPI 与RP 的相互作用,3 种蛋白发生线性伸展从而导致蛋白质聚集[28],有利于形成更多的三维网络结构。
2.7 RP、ERP 和SPI-WPI-ERP 的溶解度、持水性
RP、ERP 和SPI-WPI-ERP 的溶解度、持水性如图9 所示。
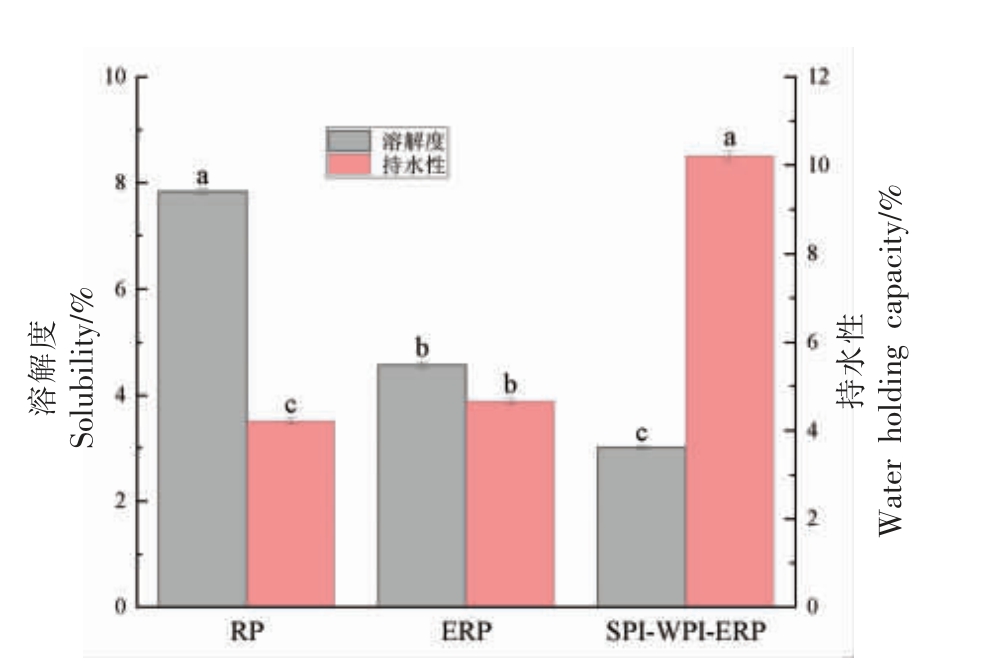
图9 RP、ERP 和SPI-WPI-ERP 的溶解度和持水性
Fig.9 Solubility,water holding capacity of RP,ERP and SPI-WPI-ERP
注:不同小写字母表示存在显著差异(P<0.05)。
如图9 所示,与未挤压的大米蛋白相比,ERP和SPI-WPI-ERP 的溶解度分别降低41.65%和61.57%,持水性分别升高26.29%和142.52%。溶解度的降低可能是由于挤压的高温、高压和高剪切力使蛋白质分子发生受热变性和交联反应,部分展开或聚集,发生不可逆变性分子间二硫键的形成增加,内部部分疏水基团暴露[29];添加SPI 和WPI 后蛋白质分子通过非共价相互作用改变大分子聚集体,导致溶解度进一步降低[30]。Cumming等[31]通过电泳显示,挤压导致了水溶性SPI 的解离和聚集。ERP 和SPI-WPI-ERP 的持水性显著高于RP,可能是由于挤压使WPI 和SPI 与淀粉之间通过二硫键聚集和交联形成了大分子网络结构,可以截留住更多的水分。Alonso 等[32]观察到类似的趋势,挤压导致豌豆蛋白的持水性升高。蛋白分子内部疏水性基团的暴露和表面疏水性变大,导致持水性增强。
2.8 RP、ERP 和SPI-WPI-ERP 的起泡性和乳化性
RP、ERP 和SPI-WPI-ERP 的FC、FS 如图10所示。
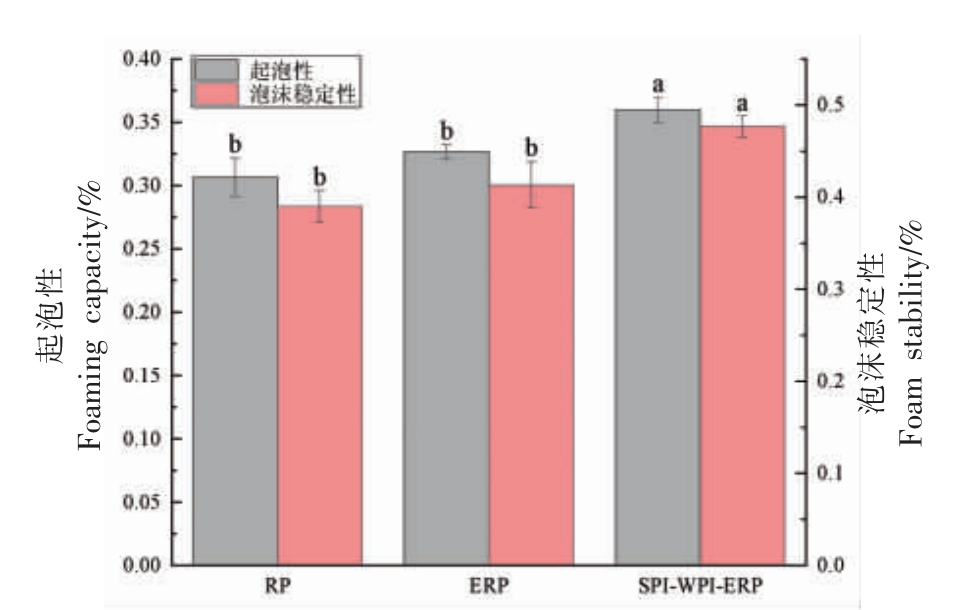
图10 RP、ERP 和SPI-WPI-ERP 的起泡性
Fig.10 Foaming of RP,ERP and SPI-WPI-ERP
注:不同小写字母表示存在显著差异(P<0.05)。
如图10 所示,与RP 相比,ERP 和SPI-WPIERP 的FC 分别提高6.52%和15%,FS 分别提高5.56%和20.51%。这可能是由于挤压后产生了两亲性肽,挤压后蛋白质分子质量变小使它们更加灵活,形成稳定的界面层,并增加了界面的扩散速率,提高了FC。加入的WPI 和SPI 与亲水性水相的相互作用将增强蛋白质的展开,从而产生更好的泡沫形成能力[33]。多肽和聚集体可能通过在泡沫界面的空间位阻对泡沫性能产生抑制作用[34],增强了蛋白质分子对空气颗粒的包封能力,导致ERP 和SPI-WPI-ERP 的FS 增大。SPI-WPI-ERP更高的FS 归因于它具有更高的表面疏水性,这增强了WPI、SPI 和RP 相互作用,并在空气和水形成的界面上形成了强的界面膜。
RP、ERP 和SPI-WPI-ERP 的EAI、ESI 如图11 所示。
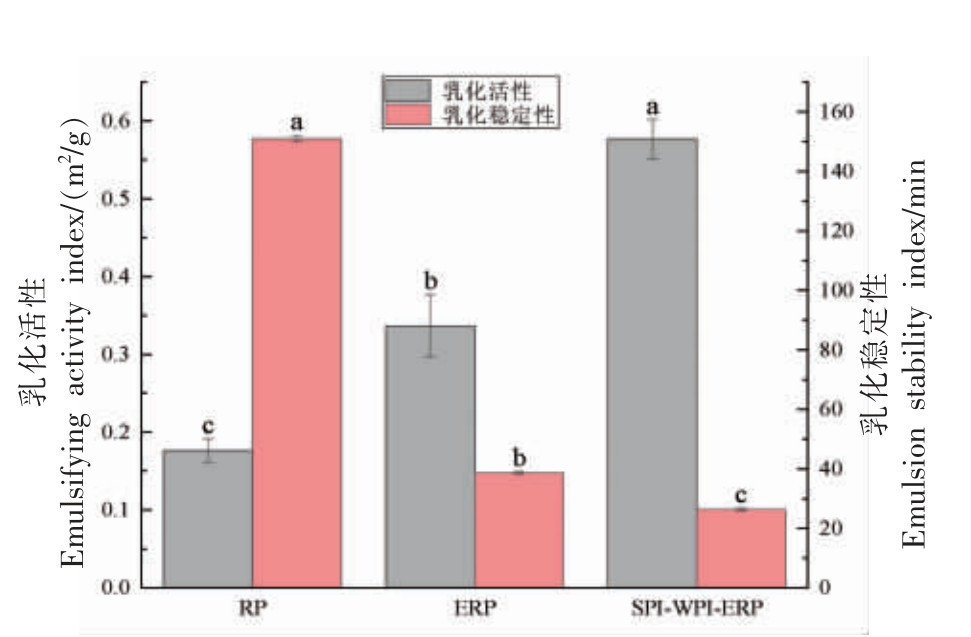
图11 RP、ERP 和SPI-WPI-ERP 的乳化性
Fig.11 Emulsification of RP,ERP and SPI-WPI-ERP
注:不同小写字母表示存在显著差异(P<0.05)。
如图11 所示,与RP 相比,ERP 和SPI-WPIERP 的EAI 分别提高90.91%和227.27%,这归因于挤压后的球蛋白可以更快地迁移到界面,有利于提高RP 的乳化性[35]。SPI-WPI-ERP 的EAI 远高于其它样品,因为挤压后的WPI 和SPI 可以在液滴界面快速扩散和吸附,形成稳定的乳液。Chen等[36]使用组合挤压预处理提高了SPI 的EAI,他们将其归因于蛋白质分子质量降低。样品的EAI 用于评估蛋白质在乳液中防止絮凝和聚结的有效性和在均质过程中形成和稳定小液滴的能力,而EAI 无法描述蛋白质在一定时间内维持稳定乳液的能力,因此测定ESI 来实现。挤压过程中形成的较小肽被认为是ESI 降低的主要原因,因为它们能够通过促进静电排斥或空间位阻来对抗乳液液滴之间的吸引力,使它们不容易团聚产生脂肪球膜。
3 结论
在本研究中首先分析了3 种米粉蛋白的硫基、粒径、二级结构和微观结构,在此基础上,对3种米粉蛋白进行溶解性、持水性、起泡性、乳化性的测定及研究。结果表明:SPI-WPI-ERP 与RP、ERP 相比具有蛋白网络结构,功能特性也有所改善。表明WPI 和SPI 双蛋白协同挤压技术改善了混合米粉蛋白质的网络结构,提高了米粉在无麸质产品开发中的商业价值。为进一步探索大米无麸质食品提供了数据基础,拓宽了大米粉作为产品原料潜在的应用领域,增加了其附加值,对促进我国农业生产的可持续发展具有重要意义。
[1] SAMARD S,RYU G H.A comparison of physicochemical characteristics,texture,and structure of meat analogue and meats[J].Journal of the Science of Food and Agriculture,2019,99(6):2708-2715.
[2] GAO Y X,SUN Y,ZHANG Y,et al.Extrusion modification:Effect of extrusion on the functional properties and structure of rice protein[J].Processes,2022,10(9):1871.
[3] WANG K L,ZHAO X,GANTUMUR M A,et al.Extrusion of casein and whey protein isolate enhances anti-hardening and performance in high-protein nutrition bars[J].Food Chemistry:X,2023,18:100719.
[4] NOGUCHI A,KUGIMIYA W,HAQUE Z,et al.Physical and chemical characteristics of extruded rice flour and rice flour fortified with soybean protein isolate[J].Journal of Food Science,1982,47(1):240-245.
[5] SHIMADA K,CHEFTEL J C.Determination of sulfhydryl groups and disulfide bonds in heat-induced gels of soy protein isolate[J].Journal of the Science of Food and Agriculture,1988,36(1):147-153.
[6] 齐宝坤,李杨,王中江,等.不同品种大豆分离蛋白Zeta 电位和粒径分布与表面疏水性的关系[J].食品科学,2017,38(3):114-118.QI B K,LI Y,WANG Z J,et al.Relationship between surface hydrophobicity and zeta potential as well as particle size distribution of soybean protein isolates from different varieties [J].Food Science,2017,38(3):114-118.
[7] WANG S J,LUO H Y,ZHANG J,et al.Alkaliinduced changes in functional properties and in vitro digestibility of wheat starch:The role of surface proteins and lipids[J].Journal of Agricultural and Food Chemistry,2014,62(16):3636-3643.
[8] HU T,CHEN J,HE X M,et al.Complex plant protein prepared from rice protein and pea protein:Improve the thermal stability of betanin[J].Food Research International,2023,164:112341.
[9] 袁玉洁,张丝琪,王明玥,等.蒸煮米水比对不同直链淀粉含量杂交籼稻米粒微观结构和食味特性的影响[J].作物学报,2022,48(12):3225-3233.YUAN Y J,ZHANG S Q,WANG M Y,et al.Effects of cooking rice-to-water ratio on grain microstructure and eating characteristics of indica hybrid rice with different amylose contents[J].Acta Agronomica Sinica,2022,48(12):3225-3233.
[10] NIELSEN P M,PETERSEN D,DAMBMANN C.Improved method for determining food protein degree of hydrolysis[J].Journal of Food Science,2001,66(5):642-646.
[11] WU J Y,XU S Q,YAN X Y,et al.Effect of homogenization modified rice protein on the pasting properties of rice starch[J].Foods,2022,11(11):1601.
[12] WANG T,WANG L,WANG R,et al.Effects of freeze-milling on the physicochemical properties of rice protein isolates [J].LWT -Food Science and Technology,2016,65:832-839.
[13] MUN S,SHIN M,KIM Y R.Emulsifying properties of proteins isolated from various rice cultivars[J].Food and Bioprocess Technology,2016,9:813-821.
[14] 赵卿宇,林佳慧,沈群.储藏温度对大米蛋白功能特性的影响[J].食品科学,2021,42(13):200-207.ZHAO Q Y,LIN J H,SHEN Q.Effect of storage temperature on functional properties of rice protein[J].Food Science,2021,42(13):200-207.
[15] LIU K S,HSIEH F H.Protein-protein interactions during high-moisture extrusion for fibrous meat analogues and comparison of protein solubility methods using different solvent systems[J].Journal of Agricultural &Food Chemistry,2008,56(8):2681-2687.
[16] ZHENG X Q,WANG J T,LIU X L,et al.Effect of hydrolysis time on the physicochemical and functional properties of corn glutelin by protamex hydrolysis[J].Food Chemistry,2015,172(1):407-415.
[17] CABRERA-CHÁVEZ F,DE LA BARCA A M C,ISLAS-RUBIO A R,et al.Molecular rearrangements in extrusion processes for the production of amaranth-enriched,gluten-free rice pasta[J].LWT,2012,47(2):421-426.
[18] FISCHER T.Effect of extrusion cooking on protein modification in wheat flour[J].European Food Research and Technology,2004,218:128-132.
[19] ARZENI C,MARTINEZ K,ZEMA P,et al.Comparative study of high intensity ultrasound effects on food proteins functionality[J].Journal of Food Engineering,2012,108(3):463-472.
[20] HU Y,SUN-WATERHOUSE D X,LIU P Z,et al.Modification of rice protein with glutaminase for improved structural and sensory properties[J].International Journal of Food Science &Technology,2019,54(7):2458-2467.
[21] YANG J J,MENG D,WU Z J,et al.Modification and solubility enhancement of rice protein and its application in food processing:A review[J].Molecules,2023,28(10):4078.
[22] XIONG W F,WANG Y T,ZHANG C L,et al.High intensity ultrasound modified ovalbumin:Structure,interface and gelation properties[J].Ultrasonics Sonochemistry,2016,31:302-309.
[23] XIONG W F,DENG Q C,LI J,et al.Ovalbumin-carboxymethylcellulose complex coacervates stabilized high internal phase emulsions:Comparison of the effects of pH and polysaccharide charge density[J].Food Hydrocolloids,2019,98:105282-105290.
[24] 闫洁,马晓军.不同干燥方式对大豆蛋白二级结构的影响[J].食品工业科技,2008(5):131-132.YAN J,MA X J.Effect of different desiccant manner on the secondary of soybean protein[J].Science and Technology of Food Industry,2008(5):131-132.
[25] QIN X S,CHEN S S,LI X J,et al.Gelation properties of transglutaminase -induced soy protein isolate and wheat gluten mixture with ultrahigh pressure pretreatment[J].Food &Bioprocess Technology,2017,10(5):866-874.
[26] OHAD N,SHICHRUR K,YALOVSKY S.The analysis of protein-protein interactions in plants by bimolecular fluorescence com plementation[J].Plant Physiology,2007,145(4):1090-1099.
[27] JIANG L Z,WANG J,LI Y,et al.Effects of ultrasound on the structure and physical properties of black bean protein isolates[J].Food Research International,2014,62:595-601.
[28] FANG Y Q,BO Z,WEI Y M.Effects of the specific mechanical energy on the physicochemical properties of texturized soy protein during high -moisture extrusion cooking[J].Journal of Food Engineering,2014,121(1):32-38.
[29] ZHAO G L,YAN L,ZHAO M M,et al.Enzymatic hydrolysis and their effects on conformational and functional properties of peanut protein isolate [J].Food Chemistry,2011,127(4):1438-1443.
[30] GUJSKA E,KHAN K.High temperature extrusion effects on protein solubility and distribution in navy and pinto beans[J].Journal of Food Science,1991,56(4):1013-1016.
[31] GUMMING D B,STANLEY D W,DEMAN J M.Fate of water soluble soy protein during thermoplastic extrusion[J].Journal of Food Science,2010,38(2):320-323.
[32] ALONSO R,OR E E,ZABALZA M J,et al.Effect of extrusion cooking on structure and functional properties of pea and kidney bean proteins[J].Journal of the Science of Food and Agriculture,2000,80(3):397-403.
E E,ZABALZA M J,et al.Effect of extrusion cooking on structure and functional properties of pea and kidney bean proteins[J].Journal of the Science of Food and Agriculture,2000,80(3):397-403.
[33] ZHANG J,LI M Q,LI C R,et al.Effect of wheat bran insoluble dietary fiber with different particle size on the texture properties,protein secondary structure,and microstructure of noodles [J].Grain &Oil,2019,2(4):1-28.
[34] KRISTINSSON H G,RASCO B A.Kinetics of the hydrolysis of Atlantic salmon(Salmo salar)muscle proteins by alkaline proteases and a visceral serine protease mixture[J].Process Biochemistry,2000,36(1/2):131-139.
[35] DAMODARAN S.Protein stabilization of emulsions and foams[J].Journal of Food Science,2010,70(3):305-313.
[36] CHEN L,CHEN J S,REN J Y,et al.Modifications of soy protein isolates using combined extrusion pre-treatment and controlled enzymatic hydrolysis for improved emulsifying properties[J].Food Hydrocolloids,2011,25(5):887-897.