灵芝为多孔菌科真菌赤芝 [Ganoderma lucidum(Leyss.ex Fr.)Karst]或紫芝(Ganoderma sinense Zhao,Xu et Zhang)的干燥子实体[1],含有多糖、三萜类化合物、核苷、微量元素等活性物质[2-3],具有补气安神、止咳平喘的功效。现代药理研究表明,灵芝多糖具有抗炎[4]、抗糖尿病[5]、抗肿瘤[6]和调节免疫等功能[7]。研究发现灵芝多糖能降低促炎细胞因子(TNF-α、IL-6、iNOS)、COX-2、ROS 等炎症介质的表达,提高抗炎因子IL-10 的表达[8-9],从而抵抗LPS 诱导的RAW264.7 细胞炎症反应[10-11],其机理与下调RAW264.7 细胞MAPK通路ERK1/2、JNK 和p38 3 个亚基的磷酸化水平有关[12]。
目前多糖的提取方法主要有溶剂提取法、酶提取法、微波提取法和微生物发酵法等。酶法提取能使灵芝中的多糖与细胞中的果胶、半纤维素等分离,从而提高多糖提取率[13-14]。微生物发酵法具有促进活性物质释放,提高有效成分含量及对环境友好等优点[15]。微生物发酵菌种主要包括真菌和细菌,其中使用较广泛的菌种为植物乳杆菌。研究发现与未发酵相比,植物乳杆菌发酵可显著提高黄精多糖抗氧化活性[16]及苦瓜多糖的降血糖功能[17]。植物乳杆菌发酵后的芦笋多糖可显著抑制促炎细胞因子(TNF-α 和IL-1β)的表达,发挥抗炎作用[18]。灵芝发酵后可提高多糖、三萜类化合物的含量,加强对肝癌细胞HepG2 的抑制作用[19-20]。
近年来对灵芝多糖的研究多集中在提纯、药理作用等方面,而以微生物为发酵菌种,灵芝为发酵底物的固体发酵相关研究较少,研究发酵灵芝多糖抗炎活性的报道更少。本试验以灵芝子实体为原料,对比研究回流提取、复合酶法提取、植物乳杆菌发酵+回流提取、植物乳杆菌发酵+复合酶法提取4 种方法提取的GLP 对LPS 诱导的RAW264.7 细胞炎症的抗炎作用以及对JNK/P38 MAPK 信号通路的影响,以期为灵芝高附加值产品的开发应用提供参考。
1 材料与方法
1.1 材料与仪器
灵芝子实体:赤芝[Ganoderma lucidum(Leyss.ex Fr.)Karst.],重庆市合信农业科技有限公司;破壁酶(5 万U/g)、木瓜蛋白酶(80 万U/g)、果胶酶(3 万U/g)、纤维素酶(2 万U/g),南宁庞博生物工程公司;植物乳杆菌(Lactobacillus plantarum)、MRS 琼脂即用型平板、细菌计数器,重庆波尔生物科技有限公司;透析袋,上海源叶生物科技有限公司;RAW264.7 细胞,上海富衡生物科技有限公司;CCK-8 试剂盒,美国APExBIO 公司;LPS,美国Sigma 公司;胎牛血清、RPMI1640 培养基,美国Gibco 公司;SYBR Master Mix(A25742)、Trizol(15596018)、Primerscript RT reagent kit(M1631)、DEPC treated water(10977-015)、RNA 提取试剂盒、反转录试剂盒、鼠二抗、兔二抗,美国Thermo公司;细胞蛋白抽提试剂盒、二喹啉甲酸(Bicinchoninic acid,BCA)蛋白定量试剂盒,长春鼎国生物科技公司;β-actin(AP0060)单克隆抗体,美国Bioworld 公司;P-P38(4631S)单克隆抗体,美国CST 公司;P38(ab31828)、P-JNK(ab124956)、JNK(ab179461)单克隆抗体,英国Abcam 公司;鲁米诺化学发光试剂盒,美国CE 公司;其它试剂均为国产分析纯级。
RE-201 旋转蒸发仪,郑州凯祥仪器设备有限公司;DZF-6020 真空干燥箱,上海琅玕实验设备有限公司;DXFT-12 型精研混炼机,山东鼎信超微粉碎技术有限公司;SCIENTZ-10N 冷冻干燥机,宁波新芝冻干设备有限公司;GI80DWS 立式压力蒸汽灭菌器,至微(厦门)仪器有限公司;SWCJ-2FD 洁净工作台,苏净集团苏州安泰空气技术有限公司;稳压电泳仪,美国Bio-Rad 公司;7500 Real-time PCR 仪,美国ABI 公司;酶标仪、高速离心机,美国Thermo 公司;核酸浓度测量仪,美国GE 公司;Trans-Blot SD 型转印槽,美国Bio-Rad公司;AlphaImager HP 高端凝胶成像系统,美国Alpha Lnnotech 公司。
1.2 方法
1.2.1 灵芝子实体的预处理[21] 采收后的灵芝子实体40 ℃干燥至恒重,粉碎,过60 目筛,按料液比1∶15 加入95%乙醇30 ℃静置处理24 h,除去脂类及小分子杂质色素,抽滤后重复以上操作至滤液澄清;40 ℃干燥至恒重,水分含量为14.7%,密封保存待用。
1.2.2 灵芝多糖的提取 分别采用回流提取、复合酶法提取、发酵+回流提取、发酵+复合酶法提取4 种方法提取灵芝中的多糖类成分。
1.2.2.1 回流提取 取预处理后的灵芝子实体,按料液比1∶16 加入蒸馏水,搅拌,静置1 h。98 ℃回流提取4 h,过滤,分别收集滤液、滤渣。滤渣再回流提取1 次,提取时间3 h,其余同第一次提取,收集滤液,弃滤渣。合并2 次滤液,旋转蒸发浓缩(温度57 ℃,压力0.085 MPa),得到灵芝子实体回流提取液。
1.2.2.2 复合酶法提取 参照朱玲等[22]的方法,称取预处理后的灵芝子实体,按料液比1∶16 加入蒸馏水,搅拌,静置1 h。按照木瓜蛋白酶1.6%、破壁酶2.1%、纤维素酶1.6%、果胶酶2.3%加入复合酶,60 ℃搅拌提取2 h,酶解结束后90 ℃以上热水灭酶10 min,过滤,取滤液,旋转蒸发浓缩(温度57 ℃,压力0.085 MPa),得到灵芝子实体复合酶法提取液。
1.2.2.3 发酵+回流提取 预处理后的灵芝子实体,先进行植物乳杆菌发酵,然后干燥至恒重得到发酵灵芝子实体干粉,再以此为原料进行回流提取,回流提取操作同1.2.2.1 节,发酵提取参考邱皓璞等[23]的方法,具体操作为:取预处理后的灵芝子实体,按料液比1∶100 加入蒸馏水,搅拌,静置1 h。121 ℃,20 min 灭菌,冷却后按1‰的体积分数接种植物乳杆菌(菌体浓度为2.0×108 CFU/mL),37 ℃培养48 h,对发酵结束的灵芝子实体再次进行121 ℃,20 min 灭菌,并于40 ℃干燥至恒重,得到发酵灵芝子实体干粉。
1.2.2.4 发酵+复合酶法提取 预处理后的灵芝子实体,先进行植物乳杆菌发酵,然后干燥至恒重得到发酵灵芝子实体干粉,再以此为原料进行复合酶法提取,发酵提取操作同1.2.2.3 节,酶法提取操作同1.2.2.2 节。
1.2.3 灵芝多糖的醇沉和纯化[24] 4 种提取液中分别加入95%的乙醇,使其最终乙醇体积分数达到90%,醇沉时间18 h,弃上清液,4 000 r/min 离心30 min,收集沉淀,加水复溶,得灵芝子实体粗多糖溶液。配制Savage 试剂(V氯仿∶V正丁醇=4∶1)并加入到粗多糖溶液中,振荡后静置分层,收集上层液体,重复操作直至蛋白除尽,除蛋白后的产物旋转蒸发浓缩,经3 500 u 分子质量透析袋流水透析,去除小分子杂质,截留透析液并冷冻干燥得到灵芝子实体多糖(GLP),对应4 种提取方法,分别记为GLP-1、GLP-2、GLP-3、GLP-4。
1.2.4 灵芝多糖含量测定 蒽酮-硫酸法,参照《中国药典》2020 年版灵芝项下含量测定:按照紫外-可见分光光度法,在波长625 nm 处测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线为Y=32.718X+0.0584,R2=0.9995。取灵芝子实体多糖约30.0 mg,溶解并定容至50.0 mL,离心(4 000 r/min,10 min),量取上清液3.0 mL,置25.0 mL 量瓶中,加水至刻度,摇匀,即得。量取供试品溶液2.0 mL,同法测定吸光度值,带入标准曲线,计算多糖含量。
1.2.5 细胞培养 RAW264.7 细胞在含8%胎牛血清的RPMI1640 培养基中,于37 ℃、5% CO2 恒温培养箱中常规培养。
1.2.6 CCK-8 法测定GLP 对RAW264.7 细胞活性的影响 取细胞悬液,按2×105 个/mL 细胞密度接种在96 孔板中,待细胞完全贴壁后,分别加入0,25,50,100,200 μg/mL 的GLP-1、2、3、4 溶液,孵育24 h 后,加入10 μL CCK-8 试剂溶液,于37℃细胞培养箱中继续孵育30 min。孵育结束后,使用酶标仪在波长450 nm 处检测吸光度。
1.2.7 实时荧光定量PCR(qRT-PCR)法检测炎症因子表达水平 取对数生长期的RAW264.7 细胞(5×105 个/mL),接种于6 孔板,于37 ℃、5% CO2培养箱中培养过夜。试验分为空白对照组、LPS组、GLP-1 组、GLP-2 组、GLP-3 组、GLP-4 组,空白对照组加入1 mL 培养基,LPS 组加入等体积1 μg/mL LPS 溶液,多糖组同时加入多糖和LPS,其中LPS 终质量浓度为1 μg/mL,多糖质量浓度为200 μg/mL,恒温培养24 h,每组设置3 个重复,收集细胞,进行后续试验。
Trizol 法抽提细胞中的总RNA 后按说明书反转录为cDNA。利用Real-time PCR 仪检测每孔的Ct 值,分析炎症相关基因TNF-α、IL-6、IL-10、iNOS 的mRNA 相对表达水平,采用△△Ct 的方法进行相对定量。PCR 反应体系见表1,基因引物序列见表2。
表1 PCR 体系中各组分的体积
Table 1 Volume of reagents in the PCR reaction system

表2 目的基因引物序列
Table 2 Primer sequences of target genes

1.2.8 免疫印迹检测 参照夏炎等[25]的方法,取对数生长期的细胞RAW264.7(5×106 个/mL)接种于6 孔板,37 ℃、5% CO2 培养箱中培养过夜。分组同1.2.6 节,培养4 h 后收集细胞,提取总蛋白。采用免疫印迹法测定蛋白含量。采用Image J 软件对蛋白条带的灰度值进行分析,计算P-P38、PJNK 的相对表达量。
1.3 数据处理
所有数据采用SPSS 统计软件进行处理,Origin 绘图,图中的竖线代表标准偏差。以P<0.05 为差异有统计学意义。
2 结果与分析
2.1 灵芝多糖对RAW264.7 细胞活性的影响
采用LPS 诱导RAW264.7 细胞炎症模型评价不同提取方法GLP 的体外抗炎活性。利用CCK-8检测不同质量浓度的GLP-1、2、3、4(0,25,50,100,200 μg/mL)对RAW264.7 细胞生存率的影响。结果如图1 所示,发现200 μg/mL GLP 以下质量浓度作用于RAW264.7 细胞,细胞存活率均在93%以上,与对照组相比无显著性差异,证明GLP质量浓度在200 μg/mL 及以下对RAW264.7 细胞无细胞毒性,因此选择200 μg/mL 作为试验质量浓度。

图1 GLP 对RAW264.7 细胞活性的影响
Fig.1 Effects of GLP on the viability of RAW264.7 cells
2.2 灵芝多糖对RAW264.7 细胞TNF-α mRNA 表达的影响
由图2 可知,LPS 刺激RAW264.7 细胞后,与空白对照组相比,其TNF-α mRNA 的相对表达水平显著提高(P<0.01)。与LPS 组相比,GLP-2、3、4组均能极显著的抑制TNF-α mRNA 的表达(P<0.01),GLP-1 组的抑制作用显著(P<0.05)。GLP-1组与GLP-2 组相比,TNF-α mRNA 的表达差异显著(P<0.05),GLP-1 组与GLP-3 组、GLP-2 组与GLP-4 组相比,差异显著(P<0.05),说明GLP 对LPS 刺激RAW264.7 细胞的TNF-α mRNA 的表达有抑制作用,提取方法会影响GLP 对TNF-α mRNA 表达的抑制作用,发酵提取的GLP 抑制效果较好。
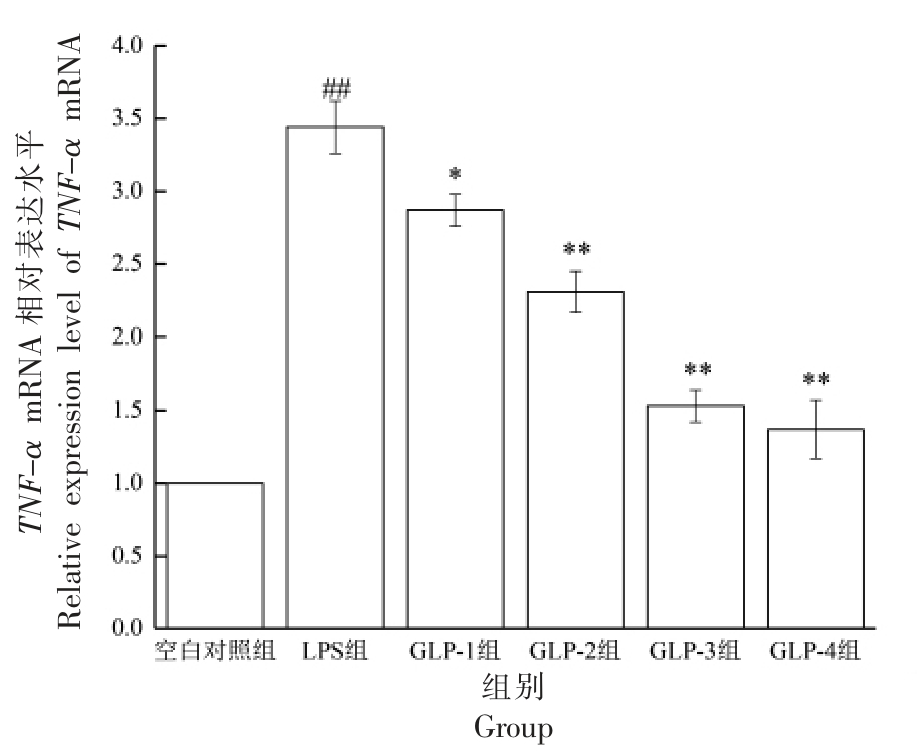
图2 GLP 对RAW264.7 细胞TNF-α 的mRNA表达的影响
Fig.2 Effects of GLP on TNF-α mRNA expression in RAW264.7 cells stimulated by LPS
注:与空白对照组比较,#.P<0.05,##.P<0.01;与LPS 组比较,*.P<0.05,**.P<0.01,下同。
2.3 灵芝多糖对RAW264.7 细胞IL-6 mRNA表达的影响
由图3 可知,LPS 刺激RAW264.7 细胞后,与空白对照组相比,其IL-6 的表达水平显著提高(P<0.01)。与LPS 组相比,GLP-2、3、4 组均能极显著的抑制IL-6 的表达(P<0.01),GLP-1 组的抑制作用显著(P<0.05)。GLP-1 组与GLP-2 组、GLP-3组与GLP-4 组相比,IL-6 的表达差异显著(P<0.05),GLP-1 组与GLP-3 组、GLP-2 组与GLP-4组相比,差异显著(P<0.05),说明GLP 对LPS 刺激RAW264.7 细胞的IL-6 mRNA 的表达有抑制作用,提取方法会影响GLP 对IL-6 表达的抑制作用,复合酶法提取的抑制效果优于回流提取,发酵后2 种提取方法GLP 的抑制效果均增强。
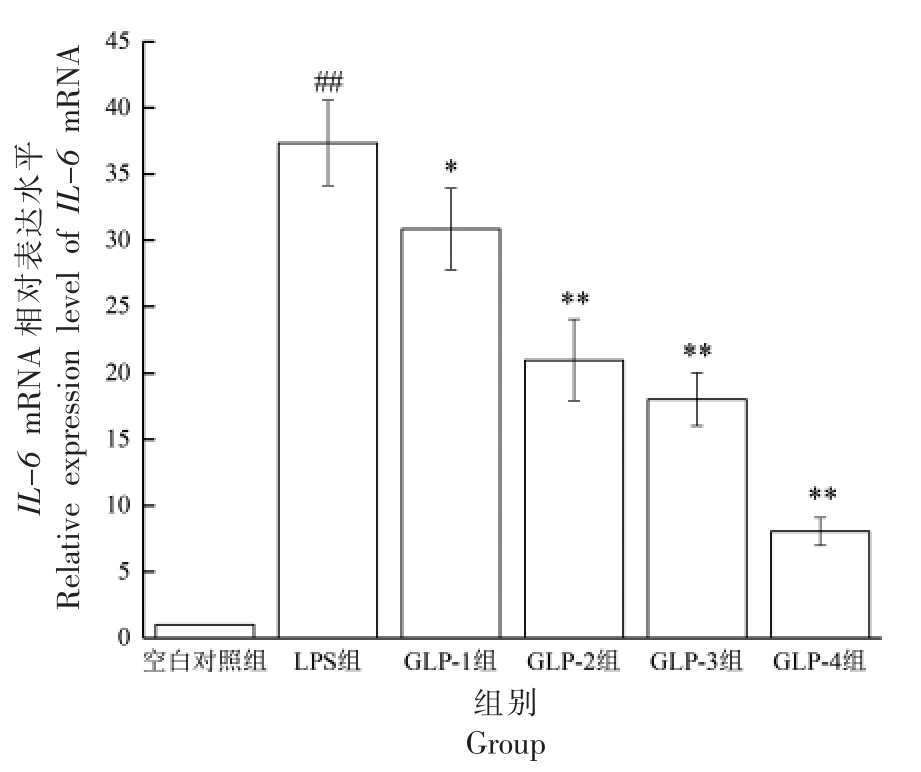
图3 GLP 对RAW264.7 细胞IL-6 的mRNA 表达的影响
Fig.3 Effects of GLP on IL-6 mRNA expression in RAW264.7 cells stimulated by LPS
2.4 灵芝多糖对RAW264.7 细胞IL-10 mRNA表达的影响
根据图4 可知,与LPS 组相比,分别加入多糖和LPS 培养24 h 后,RAW264.7 细胞IL-10 mRNA 表达水平均有不同程度的升高。GLP-1 组与GLP-2 组、GLP-3 组与GLP-4 组相比,IL-10 的表达差异显著(P<0.05),GLP-1 组与GLP-3 组、GLP-2 组与GLP-4 组相比,差异显著(P<0.05),说明GLP 对LPS 刺激RAW264.7 细胞的IL-10 mRNA 的表达有促进作用,提取方法会影响GLP对IL-10 表达的促进作用,复合酶法提取的促进效果优于回流提取。
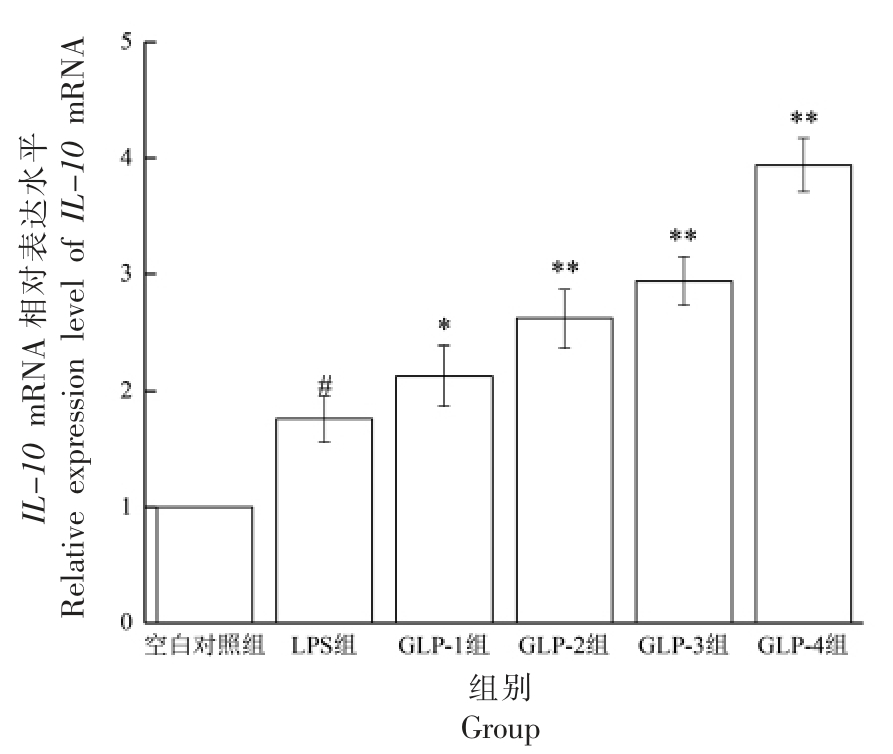
图4 GLP 对RAW264.7 细胞IL-10 mRNA 表达的影响
Fig.4 Effects of GLP on IL-10 mRNA expression in RAW264.7 cells stimulated by LPS
2.5 灵芝多糖对RAW264.7 细胞iNOS mRNA表达的影响
由图5 可知,LPS 刺激RAW264.7 细胞后,与空白对照组相比,其iNOS mRNA 的表达水平显著提高(P<0.01)。与LPS 组相比,GLP-1、2、3 组均能显著的抑制iNOS 的表达(P<0.01),GLP-4 组的抑制作用极显著(P<0.01)。GLP-2 组与GLP-4 组相比,差异显著(P<0.05),说明GLP 对LPS 刺激RAW264.7 细胞的iNOS mRNA 的表达有抑制作用,发酵+复合酶法提取GLP 的抑制效果较强。
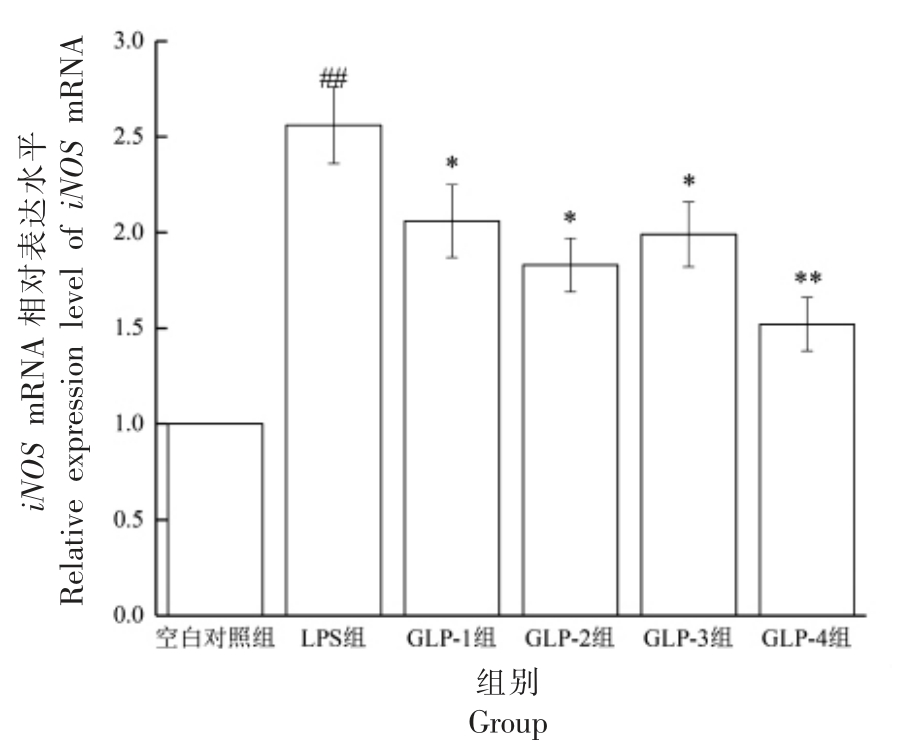
图5 GLP 对RAW264.7 细胞iNOS mRNA 表达的影响
Fig.5 Effects of GLP on iNOS mRNA expression in RAW264.7 cells stimulated by LPS
2.6 灵芝多糖对RAW264.7 细胞JNK/P38 MAPK 信号通路蛋白表达的影响
根据图6a、6b 可知,与空白对照组相比,LPS组中P-JNK、P-P38 蛋白表达水平极显著上升(P<0.01);与LPS 组相比,GLP-1、2、3 组中P-JNK、PP38 蛋白表达水平显著降低(P<0.05),GLP-4 组蛋白表达水平极显著降低(P<0.01)。GLP-1 组与GLP-3 组、GLP-2 组与GLP-4 组、GLP-3 组与GLP-4 组相比,差异显著(P<0.05)。结果说明GLP可抑制P-JNK、P-P38 蛋白表达,发酵后2 种提取方法GLP 的抑制效果均增强,其中发酵+复合酶法提取GLP 的抑制效果较强。
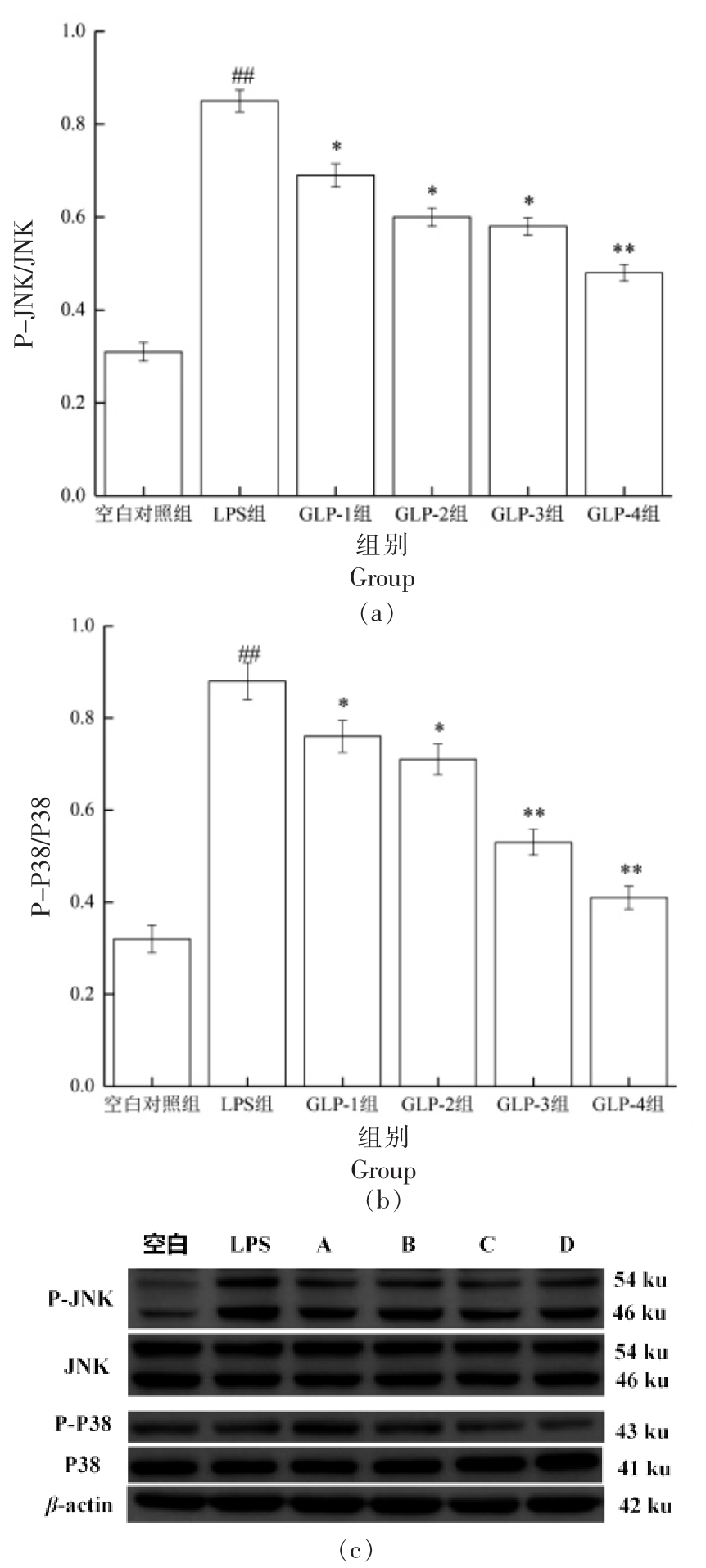
图6 GLP 对RAW264.7 细胞JNK/P38 MAPK 信号通路蛋白表达的影响
Fig.6 Effects of GLP on the expression of JNK/P38 MAPK signal pathway relatived proteins in RAW264.7 cells
注:a、b 为P-JNK、P-P38 蛋白表达统计图,c 为蛋白条带。
3 讨论与结论
据报道,LPS 能刺激RAW264.7 细胞引起促炎因子表达显著增加,抗炎因子表达显著降低,进而诱导炎症的发生[26]。GLP 对LPS 诱导释放的促炎细胞因子TNF-a、IL-6、iNOS 具有明显的抑制作用,对抗炎因子IL-10 的表达具有明显的促进作用[27-28]。本文采用4 种不同方法提取GLP,对比研究其对LPS 诱导的RAW264.7 细胞炎症模型的体外抗炎活性。结果表明GLP 具有较好的体外抗炎活性,且不同提取方式对体外抗炎活性的影响较大,其中植物乳杆菌发酵提取GLP 抑制TNFα、IL-6 mRNA 表达及促进IL-10 mRNA 表达的效果比未发酵的复合酶法、回流提取好;发酵+复合酶法提取GLP 对iNOS mRNA 表达的抑制效果较强,即植物乳杆菌发酵提取会增强GLP 对RAW264.7 细胞炎症因子的调控,这可能与发酵使GLP 分解为小分子多糖有关。研究表明多糖通过不同方法降解为小分子多糖可保留甚至提高多糖原有生物活性[19-20,29]。赵洋[30]发现植物乳杆菌发酵后灵芝多糖分子质量由1.12×105 u 减小为8.89×104 u,部分糖苷键断裂,糖醛酸含量升高,从而导致其抗氧化能力显著提高。当采用超声波[31]、微波[32-33]对GLP 进行降解,并评价其抗炎活性,发现分子质量影响GLP 抗炎活性,降低分子质量可提高其抗炎活性,可更强的抑制促炎因子(TNF-α、IL-1β、IL-6 等)分泌,这与本文qRT-PCR 的研究结果相似。
研究表明,GLP 可通过下调或阻断TLR4/NFκB、MAPK 信号通路来改善炎症反应[34-35]。MAPK是一族在真核生物中高度保守的丝氨酸-苏氨酸蛋白激酶,包括ERK1/2、JNK 和P38 3 个亚基,参与细胞的生长增殖、对环境的应激适应以及炎症反应等多种重要的生理病理过程,是信号从细胞表面传递到细胞核内部的关键,阻断该信号通路可以有效阻止炎症因子TNF-a、IL-6、iNOS 等的合成与分泌,进而阻止炎症反应的发生[36]。LPS 刺激能提高MAPK 通路ERK1/2、JNK 和P38 3 个亚基的磷酸化水平,进而诱导炎症的发生。本文对比研究4 种不同方法提取GLP 处理对RAW264.7细胞MAPK 通路P-JNK、P-P38 蛋白表达的影响,结果发现发酵后复合酶法、回流提取这2 种提取方法GLP 对P-JNK、P-P38 蛋白表达的抑制效果均增强,说明植物乳杆菌发酵会增强GLP 对MAPK 信号通路的调控,从而增强对炎症因子的调控,免疫印迹的检测结果也间接证明了qRTPCR 的研究结果,即植物乳杆菌发酵GLP 会通过增强对MAPK 信号通路调控而有更加显著的抗炎活性。
本文研究不同提取方式GLP 对LPS 诱导的RAW264.7 细胞炎症模型的体外抗炎活性。以回流提取、复合酶法提取、植物乳杆菌发酵+回流提取、植物乳杆菌发酵+复合酶法提取4 种方法提取GLP,分析其对炎症因子TNF-α、IL-6、IL-10、iNOS mRNA 表达水平及对JNK/P38 MAPK 信号通路的影响。结果不同提取方法对GLP 体外抗炎活性的影响较大,植物乳杆菌发酵提取GLP 会通过增强对MAPK 信号通路调控而有更加显著的抗炎活性。
[1] 国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2020:195.Chinese Pharmacopoeia Commission.Pharmacopoeia of the People's Republic of China[M].Beijing:China Medical Science and Technology Press,2020:195.
[2] 罗虹建,林冬梅,王联福,等.灵芝活性成分分析与质量评价研究进展[J].药物分析杂志,2023,43(1):51-60.LUO H J,LIN D M,WANG L F,et al.Research progress on active ingredient analysis andquality e valuation of Ganoderma lucidum[J].Chinese Journal of Pharmaceutical Analysis,2023,43(1):51-60.
[3] 潘少香,赵岑,闫新焕,等.不同品种灵芝子实体及孢子粉元素成分分析及重金属安全性评价[J].现代食品科技,2023,39(2):319-324.PAN S X,ZHAO C,YAN X H,et al.Element composition analysis and heavy metal safety evaluation of different varieties of Ganoderma lucidum fruit bodies and their spore powders[J].Modern Food Science and Technology,2023,39(2):319-324.
[4] ZHANG X L,WU D S,TIAN Y,et al.Ganoderma lucidum polysaccharides ameliorate lipopolysaccharide -induced acute pneumonia via inhibiting NRP1-mediated inflammation[J].Pharmaceutical biology,2022,60(1):2201-2209.
[5] 吴睿婷,付王威,万敏,等.黑灵芝多糖对糖尿病大鼠血糖血脂调节及肠道菌群的影响[J].食品科学,2022,43(5):91-102.WU R T,FU W W,WAN M,et al.Effect of polysaccharide from Ganoderma atrum on hyperglycemia,blood lipid and gut microbiota of diabetic rats[J].Food Science,2022,43(5):91-102.
[6] 刘洋,陈会英,范雪枫,等.灵芝多糖辅助DNA 疫苗对小鼠肿瘤免疫治疗的影响[J].中国食品学报,2022,22(5):84-91.LIU Y,XU H Y,FAN X F,et al.Effects of Ganoderma lucidum polysaccharide on immunotherapeutic performance of DNA vaccine in tumor bearing mice[J].Journal of Chinese Institute of Food Science and Technology,2022,22(5):84-91.
[7] 谢溢坤,张静,余茜,等.灵芝多糖类成分及其生物活性研究进展[J].中草药,2021,52(17):5414-5429.XIE Y K,ZHANG J,YU Q,et al.Advances in studies on polysaccharides from Ganoderma and their biological activities[J].Chinese Traditional and Herbal Drugs,2021,52(17):5414-5429.
[8] LI K K,ZHUO C,TENG C Y,et al.Effects of Ganoderma lucidum polysaccharides on chronic pancreatitis and intestinal microbiota in mice[J].International Journal of Biological Macromolecules,2016,93(PA):904-912.
[9] 李露,付王威,吴睿婷,等.基于UPLC-Q-TOF/MS的黑灵芝多糖对大鼠急性肠道炎症作用机制研究[J].食品工业科技,2021,42(6):310-317.LI L,FU W W,WU R T,et al.Effect of Ganoderma lucidum polysaccharides on intestinal inflammation in rats based on UPLC-Q-TOF/MS[J].Science and Technology of Food Industry,2021,42(6):310-317.
[10] 陈慧珊.长白山灵芝多糖对Pg-LPS 刺激的巨噬细胞炎症介质表达的影响[D].长春:吉林大学,2023.CHEN H S.Effect of Ganoderma Lucidum polysaccharides from Changbai Mountain on the expression of inflammatory mediators in macrophages stimulated by Pg-LPS[D].Changchun:Jilin University,2023.
[11] GUO C L,GUO D D,FANG L,et al.Ganoderma lucidum polysaccharide modulates gut microbiota and immune cell function to inhibit inflammation and tumorigenesis in colon [J].Carbohydrate Polymers,2021,267:118231.
[12] HU X Y,YU Q,HOU K Y,et al.Regulatory effects of Ganoderma atrum polysaccharides on LPSinduced inflammatory macrophages model and intestinal-likeCaco-2/macrophages co-culture inflammation model [J].Food and Chemical Toxicology,2020,140:111321,
[13] 董宇,林翰清,缪松,等.酶法提取多糖的研究进展[J].食品工业科技,2021,42(3):351-358.DONG Y,LIN H Q,LIAO S,et al.Advances in enzymatic extraction of polysaccharides[J].Science and Technology of Food Industry,2021,42(3):351-358.
[14] NADAR S S,RAO P,RATHOD V K.Enzyme assisted extraction of biomolecules as an approach to novel extraction technology:A review[J].Food Research Intermational,2018,108:309-330.
[15] HONG H F,XIAO J,GUO Q Q,et al.Cycloastragenol and astragaloside IV activate telomerase and protect nucleus pulposus cells against high glucoseinduced senescence and apoptosis[J].Experimental and Therapeutic Medicine,2021,22(5):1326.
[16] 杨壮,刘怡琳,李隆熙,等.固态发酵制备黄精多糖的工艺优化、理化特性及抗氧化活性[J].食品与发酵工业,2024,50(7):92-98.YANG Z,LIU Y L,LI L X,et al.Process optimization,physicochemical properties and antioxidant activity of Polygonatum sibiricum polysaccharide prepared by solid-state fermentation[J].Food and Fermentation Industries,2024,50(7):92-98.
[17] WEN J J,LI M Z,GAO H,et al.Polysaccharides from fermented Momordica charantia L.with Lactobacillus plantarum NCU116 ameliorate metabolic disorders and gut microbiota change in obese rats[J].Food &Function,2021,12(6):2617-2630.
[18] ZHANG Z H,FAN S T,HUAN D F,et al.Polysaccharides from fermented Asparagus officinalis with Lactobacillus plantarum NCU116 alleviated liver injury via modulation of glutathione homeostasis,bile acid metabolism,and SCFA production[J].Food&Function,2020,11(9):7681-7695.
[19] 武铭,李梅,周中凯.发酵灵芝主要活性物质变化及对HepG2 细胞的抑制作用[J].中国食品学报,2023,23(4):12-21.WU M,LI M,ZHOU Z K.The changes of main active substances of Ganoderma lucidum fermented by Lactobacillus rhamnosus and the inhibitory effect of alcohol extracts on HepG2 cells[J].Journal of Chinese Institute of Food Science and Technology,2023,23(4):12-21.
[20] 谢晓阳,李晓,王伟,等.灵芝子实体多糖发酵工艺条件优化及抗氧化活性[J].食品研究与开发,2023,44(10):107-115.XIE X Y,LI X,WANG W,et al.Optimization of fermentation conditions and antioxidant activity of polysaccharides from the fruiting body of Ganoderma lucidum[J].Food Research and Development,2023,44(10):107-115.
[21] 谢苗,亓小妮,张鑫,等.低共熔溶剂提取灵芝多糖的工艺优化及抗氧化活性研究[J].食品研究与开发,2022,43(5):123-129.XIE M,QI X N,ZHANG X,et al.Study on process optimization and antioxidant activity of polysaccharide from Ganoderma lucidum extracted by deep eutectic solvents[J].Food Research and Development,2022,43(5):123-129.
[22] 朱玲,史吉平,王晨光,等.响应面法优化灵芝多糖的酶法提取工艺研究[J].食品工业科技,2016,37(24):238-244.ZHU L,SHI J P,WANG C G,et al.Optimization of enzymatic extraction of polysaccharides from Ganoderma lucidum using response surface methodology[J].Science and Technology of Food Industry,2016,37(24):238-244.
[23] 邱皓璞,李卓航,潘洁尘,等.不同发酵菌种对白及多糖提取率及发育毒性的影响[J].中国野生植物资源,2021,40(12):26-30.QIU H P,LI Z H,PAN J C,et al.Effects of different fermentation strains on extraction rate and reproductive toxicity of Bletilla striata polysaccharide[J].Chinese Wild Plant Resources,2021,40(12):26-30.
[24] 赵婷婷,戴映笛,舒昉,等.灵芝菌丝体多糖提取工艺优化及其对慢性酒精肝损伤的保护作用[J].食品工业科技,2023,44(5):388-396.ZHAO T T,DAI Y D,SHU F,et al.Optimization of extraction technology of polysaccharides from Ganoderma lingzhi mycelium and its protective effect on alcoholic liver injury[J].Science and Technology of Food Industry,2023,44(5):388-396.
[25] 夏炎,管晓辉,崔艳艳,等.蒲公英糖蛋白体外抗炎作用及对NF-κB 信号通路的调控[J].食品科学,2017,38(19):182-188.XIA Y,GUAN X H,CUI Y Y,et al.Inhibitory effect of Taraxacum glycoprotein on lipopolysaccharide-induced inflammation via regulating NF -κB pathway[J].Food Science,2017,38(19):182-188.
[26] JIA X W,MA B J,XUE F,et al.Structure characterization and anti -inflammatory activity of polysaccharides from Lingzhi or Reishi medicinal mushroom Ganoderma lucidum(Agaricomycetes)by microwave-assisted freeze minus;thaw extraction[J].International Journal of Medicinal Mushrooms,2022,24(11):49-61.
[27] WENG L R,SHENG Z L,WANG J P,et al.Structure of water-soluble polysaccharides in spore of Ganoderma lucidum and their anti-inflammatory activity[J].Food Chemistry,2022,373(PA):131374.
[28] LI T,ZHANG Y S,WAN M,et al.Ganoderma atrum polysaccharide modulates the M1/M2 polarization of macrophages linked to the Notch signaling pathway[J].Food &Function,2022,13(7):4216-4228.
[29] YAN J K,WANG Y Y,MA H L,et al.Ultrasonic effects on the degradation kinetics,preliminary characterization antioxidant activities of polysaccharides from Phellinus linteus mycelia[J].Ultrasonics Sonochemistry,2016,29:251-257.
[30] 赵洋.植物乳杆菌ATCC-14917 发酵对灵芝孢子粉多糖结构及抗氧化活性的影响[D].长春:吉林农业大学,2023.ZHAO Y.Effects of Lactiplantibacillus plantarum ATCC-14917 fermentation on polysaccharide structure and antioxidant activity of Ganoderma lucidum spore powder[D].Changchun:Jilin Agricultural University,2023.
[31] LIU Y F,TANG Q J,FENG J,et al.Effects of molecular weight on intestinal anti-inflammatory activities of β-D-glucan from Ganoderma lucidum[J].Frontiers in Nutrition,2022,9:1028727.
[32] LIU L P,FENG J,JIANG S Q,et al.Anti-inflammatory and intestinal microbiota modulation properties of Ganoderma lucidum β-D-glucans with different molecular weight in an ulcerative colitis model[J].International Journal of Biological Macromolecules,2023,251:126351.
[33] 马冠骅,秦秀,张劲松,等.灵芝β-葡寡糖的分离纯化和体外抗炎活性[J].菌物学报,2023,42(6):1360-1369.MA G H,QIN X,ZHANG J S,et al.β-Glucooligosaccharide separated and purified from Ganoderma lingzhi and its in vitro anti-inflammation activities[J].Mycosystema,2023,42(6):1360-1369.
[34] FAN Y,WANG W,WANG X F,et al.Ganoderma lucidum polysaccharide inhibits LPS-induced inflammatory injury to mammary epithelial cells [J].Journal of Future Foods,2023,3(1):49-54.
[35] HILLIARD A,MENDONCA P,SOLIMAN F A.Involvement of NF-κB and MAPK signaling pathways in the preventive effects of Ganoderma lucidum on the inflammation of BV-2 microglial cells induced by LPS[J].Journal of Neuroimmunology,2020,345:577269.
[36] YANG G Y,YANG L,ZHUANG Y,et al.Ganoderma lucidum polysaccharide exerts anti-tumor activity via MAPK pathways in HL-60 acute leukemia cells[J].Journal of Receptor and Signal Transduction Research,2016,36(1):6-13.